Al margen de sus funciones principales como dispositivos antiarrítmicos, los marcapasos y desfibriladores implantables nos ofrecen un amplio abanico de aplicaciones útiles en el manejo de diversas situaciones de interés clínico, entre las que se incluyen la detección de arritmias, herramientas dedicadas a la optimización en el tratamiento de la insuficiencia cardiaca y el diagnóstico del síndrome de apneas-hipopneas del sueño.
Por su parte, la monitorización remota potencia estas aplicaciones, al favorecer la disponibilidad inmediata de información relevante en la toma de decisiones.
Detección de fibrilación auricular silente mediante marcapasos y desfibriladores: ¿cuál es su relevancia clínica?La fibrilación auricular (FA) es la arritmia cardiaca sostenida más frecuente, y se asocia a un incremento en la mortalidad y en el riesgo de insuficiencia cardiaca, ictus y embolismo sistémico.
Algunos dispositivos cardiacos electrónicos implantables (DCEI), como marcapasos y desfibriladores bicamerales y dispositivos de resincronización cardiaca, tienen la capacidad de detectar taquiarritmias auriculares (TA) asintomáticas. Varios estudios observacionales han correlacionado la carga arrítmica con el riesgo embólico (tabla 1), y el único ensayo clínico publicado hasta la fecha, con una estrategia guiada por los eventos detectados, no ha aportado resultados relevantes con respecto al manejo específico de las TA detectadas por los DCEI1.
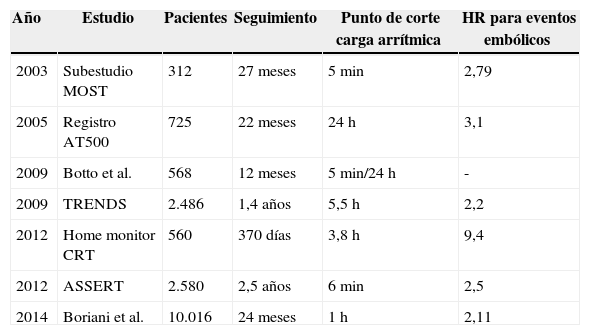
Estudios observacionales que han evaluado el riesgo embólico en función de la duración de los episodios de frecuencia rápida auricular detectados por dispositivos antiarrítmicos
| Año | Estudio | Pacientes | Seguimiento | Punto de corte carga arrítmica | HR para eventos embólicos |
|---|---|---|---|---|---|
| 2003 | Subestudio MOST | 312 | 27 meses | 5min | 2,79 |
| 2005 | Registro AT500 | 725 | 22 meses | 24h | 3,1 |
| 2009 | Botto et al. | 568 | 12 meses | 5min/24h | - |
| 2009 | TRENDS | 2.486 | 1,4 años | 5,5h | 2,2 |
| 2012 | Home monitor CRT | 560 | 370 días | 3,8h | 9,4 |
| 2012 | ASSERT | 2.580 | 2,5 años | 6min | 2,5 |
| 2014 | Boriani et al. | 10.016 | 24 meses | 1h | 2,11 |
Los dispositivos bicamerales pueden detectar TA mediante los algoritmos de cambio de modo, que únicamente tienen en cuenta la frecuencia auricular, o mediante otros algoritmos más complejos.
Los algoritmos de cambio de modo tienen por objeto evitar la estimulación a frecuencias altas en el caso de TA paroxísticas, de tal forma que pasan de un modo de seguimiento auricular (DDD o VDD) a un modo de no seguimiento (habitualmente DDI). Mientras que algunos autores han comunicado una sensibilidad y especificidad próximas al 100%, la mayoría han observado una mayor tasa de falsos positivos, aunque en general con una aceptable precisión diagnóstica para episodios con una duración superior a 5min.
Otros dispositivos incorporan la modificación automática de la sensibilidad y el análisis del patrón de las señales registradas por el electrodo auricular, con la finalidad de reducir las falsas detecciones. Estos algoritmos han demostrado una mayor precisión diagnóstica, con un valor predictivo positivo del 95%, incluso para episodios inferiores a 6min2.
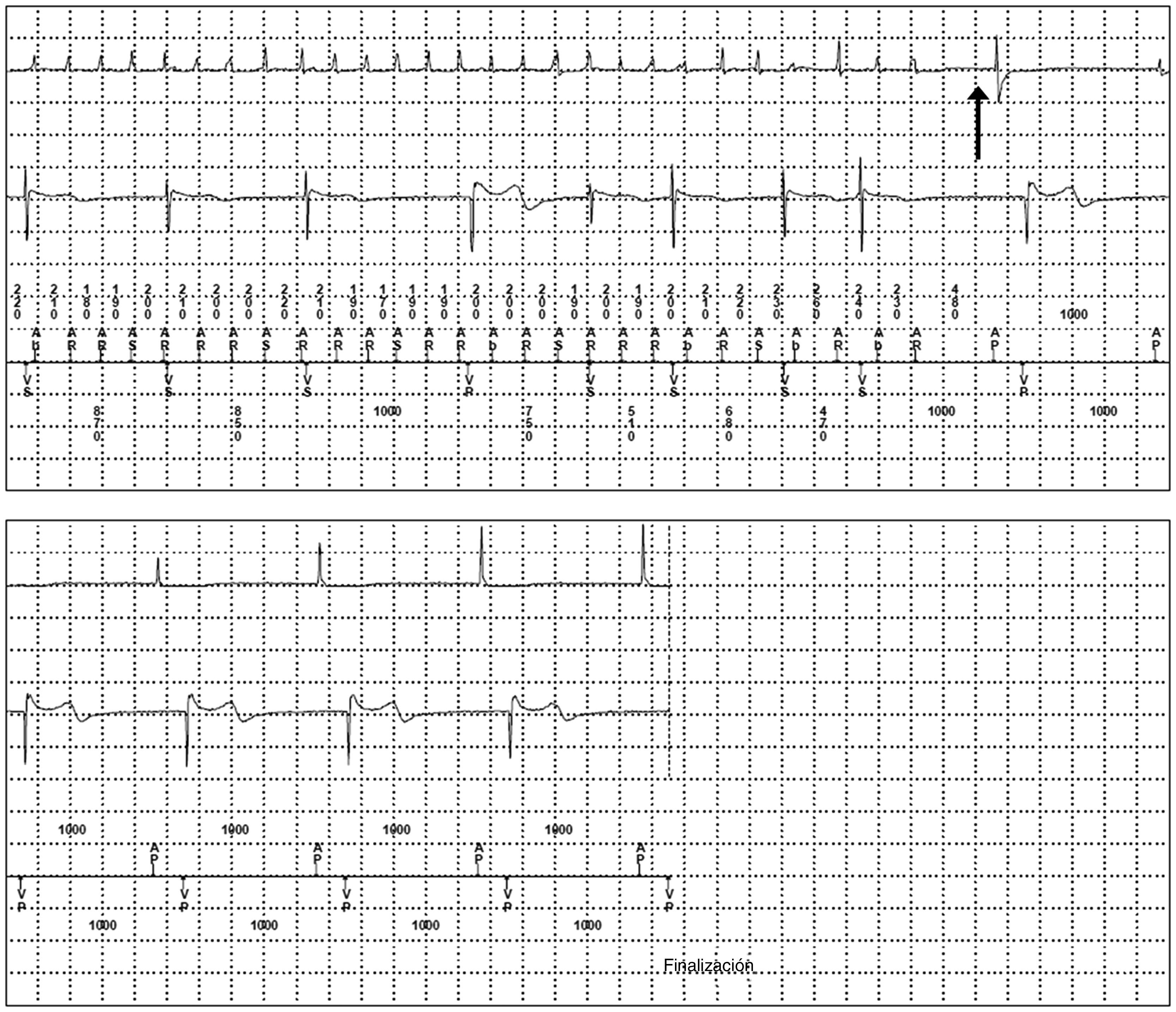
En cualquier caso, es fundamental la revisión de los electrogramas auriculares (señales intracavitarias detectadas por el electrodo auricular) de cada evento concreto, con objeto de confirmar la veracidad del episodio (fig. 1), ya que pueden producirse falsos positivos por detección de campo lejano de la onda R por el electrodo auricular, por salvas de complejos auriculares prematuros o por la presencia de conducción VA. La infradetección transitoria durante un evento puede convertir episodios largos en varios de corta duración, mientras que el tiempo total en FA (carga arrítmica) está menos sujeto a los episodios breves de infrasensado. Por último, es importante considerar que los episodios detectados no siempre se corresponden con FA, sino que pueden deberse a otras TA, como flutter auricular o taquicardia auricular.
Fibrilación auricular detectada por un marcapasos bicameral. Inicialmente actividad auricular característica de fibrilación auricular y marcapasos en modo DDI, con paso espontáneo a ritmo sinusal (flecha) y a modo DDD. Canal superior: electrograma auricular; canal intermedio: electrograma ventricular; canal inferior: canal de marcas.
Varios estudios observacionales (tabla 1) han confirmado la asociación entre los episodios de frecuencia rápida auricular detectados por los dispositivos y los fenómenos embólicos, aunque no ha podido demostrarse hasta la fecha una relación temporal entre ambos1.
Botto et al. (tabla 1) estudiaron la influencia de la carga arrítmica en función del riesgo embólico, de forma que aquellos pacientes con CHADS2 1 requerían episodios de más de 24h para pasar de un grupo de bajo riesgo embólico (0,6% al año) a uno de alto riesgo (4% al año), mientras que aquellos con una puntuación de 2 puntos presentaban ya un riesgo embólico elevado con episodios de más de 5min de duración.
En una publicación reciente, con un importante volumen de pacientes procedentes de 5 estudios prospectivos, Boriani et al. (tabla 1) identificaron la duración de 1h de los episodios de TA como el umbral con una asociación más robusta con los eventos embólicos.
¿Cuándo está indicada la anticoagulación?Los beneficios de la anticoagulación en la FA están definitivamente demostrados, no solo en la prevención del ictus, sino también en la reducción de su gravedad, en caso de producirse, y de la mortalidad.
La indicación de anticoagulación en pacientes con episodios de TA detectadas por DCEI es controvertida, con dudas con respecto a cuánto debe durar el episodio más largo o cuál debe ser la carga arrítmica global.
La detección de FA asintomática en un electrocardiograma, o por cualquier método de monitorización, no plantea ninguna duda con respecto a la necesidad de anticoagulación, que se indica en función de los riesgos embólico y hemorrágico. Por el contrario, cuando la FA se detecta por un dispositivo antiarrítmico, que en este caso ejerce como una forma de monitorización continua más certera en el diagnóstico que otros medios, existe una inexplicable tendencia a adoptar una actitud conservadora, en espera de nuevos episodios para plantear la anticoagulación.
Pese a que el riesgo embólico es proporcional a la carga arrítmica, y ante los resultados irrelevantes del estudio IMPACT1 en el manejo específico de la FA detectada por los DCEI, no debemos considerar la duración del episodio para establecer la indicación de anticoagulación, aunque sí puede tener relevancia diagnóstica. Si disponemos de la visualización directa del electrograma auricular, lo que conlleva un diagnóstico de certeza, es suficiente una duración de 30seg para establecer el diagnóstico de FA, tal como recogen las guías de práctica clínica, e iniciar la anticoagulación en el caso de estar indicada. Por el contrario, si no disponemos del electrograma auricular, lo que es poco frecuente en los dispositivos actuales, es razonable considerar el umbral de los 5min de duración del episodio para establecer el diagnóstico de FA, aunque debe tenerse en consideración que puede haber diferencias significativas en cuanto a la precisión diagnóstica entre distintos fabricantes y dispositivos concretos.
La detección de FA silente por los DCEI nos ofrece la posibilidad de una intervención temprana, y varios estudios han demostrado la eficacia de la monitorización remota en el diagnóstico precoz de la FA y en el inicio temprano de la terapia anticoagulante en el caso de estar indicada3.
Monitorización remota en la insuficiencia cardiaca: ¿una herramienta útil en la optimización del manejo de los pacientes portadores de dispositivos implantables?El manejo de la insuficiencia cardiaca (IC), fundamentalmente en lo relacionado con la prevención de las reagudizaciones y los ingresos hospitalarios, continúa siendo un desafío. Una descompensación aguda es un proceso complejo que aúna alteraciones hemodinámicas, neurohormonales, electrofisiológicas y vasculares, que convergen finalmente en una sobrecarga de fluidos. En la mayoría de las ocasiones estos procesos fisiopatológicos evolucionan de forma progresiva durante días o semanas antes de la aparición de las manifestaciones clínicas.
Un número creciente de pacientes con IC son portadores de desfibriladores y dispositivos de resincronización cardiaca. Muchos de estos dispositivos, de forma adicional a sus efectos terapéuticos directos y a la posibilidad del seguimiento remoto de su funcionamiento y de las arritmias ventriculares, pueden monitorizar parámetros fisiológicos de interés en el manejo de la IC. El registro de dichos parámetros puede ayudarnos a anticiparnos al episodio de descompensación, de tal forma que la capacidad de detectar de forma precoz variaciones clínicamente silentes mediante monitorización remota puede ayudar a lograr un manejo clínico individualizado. Por ejemplo, la detección de fibrilación auricular o de la pérdida de resincronización cardiaca conducen a actuaciones que pueden mejorar el estado clínico del paciente y prevenir hospitalizaciones.
La acumulación de líquido en los pulmones se acompaña de un descenso en la impedancia eléctrica intratorácica, que algunos DCEI miden entre el generador y el electrodo alojado en el ventrículo derecho. Este descenso en la impedancia intratorácica se anticipa en el tiempo a la descompensación clínica, lo que puede ser de utilidad para instaurar modificaciones del tratamiento que la eviten.
La variabilidad de la frecuencia cardiaca, otro parámetro proporcionado por algunos DCEI, nos muestra el balance entre la actividad simpática y la parasimpática, inclinándose hacia la primera en pacientes con peor pronóstico, de modo que un descenso en su valor precede a los ingresos por descompensación, al igual que sucede con una frecuencia cardiaca nocturna elevada o con el descenso en la actividad del paciente.
Los parámetros descritos muestran de forma general una adecuada sensibilidad en la predicción de los episodios de descompensación clínica, aunque a expensas de una especificidad subóptima. Por ello, se han propuesto algoritmos que combinan varios de estos parámetros, con una mejor correlación con el estado clínico real, permitiéndonos clasificar a los pacientes en función del riesgo de descompensación clínica.
El estudio IN-TIME4 evaluó el impacto de la monitorización remota en 664 pacientes con IC y fracción de eyección <35% portadores de un desfibrilador automático implantable. Usando como criterio de valoración principal un objetivo clínico combinado, se registraron mejores resultados en el grupo de telemonitorización frente al grupo control tras 12 meses de seguimiento, fundamentalmente a expensas de una menor mortalidad (3% frente al 8,2%).
Diagnóstico de sospecha del síndrome de apneas-hipopneas del sueñoEl síndrome de apneas-hipopneas del sueño (SAHS) es una entidad muy prevalente y un factor de riesgo reconocido de hipertensión arterial, ictus, enfermedad coronaria, insuficiencia cardiaca y arritmias, y es el resultado de episodios repetidos de obstrucción de la vía aérea superior durante el sueño.
Ante la elevada prevalencia de SAHS en pacientes portadores de DCEI, algunos dispositivos son capaces de establecer un diagnóstico de sospecha para esta entidad, de tal forma que se podría tratar de forma precoz con objeto de evitar sus complicaciones.
Los sensores de ventilación minuto que utilizan algunos marcapasos para adaptar la frecuencia cardiaca a la actividad del paciente tienen la capacidad de detectar variaciones respiratorias mediante la medida de la impedancia intratorácica.
Tras programar el horario de sueño habitual, durante este período se detectan los episodios de apnea (ausencia de actividad respiratoria durante más de 10seg) e hipopnea (reducción de la amplitud respiratoria con respecto a los ciclos previos durante 10seg un porcentaje determinado, y que puede ser 26% o 50% según el algoritmo utilizado). Con estos datos se obtiene el índice de apneas-hipopneas por hora, que ha mostrado una aceptable correlación con la polisomnografía5, patrón oro en el diagnóstico del SAHS.
ConclusionesLos marcapasos y desfibriladores implantables nos ofrecen herramientas diagnósticas de suma utilidad y con implicaciones pronósticas en diversos escenarios clínicos. Es de esperar que estas aplicaciones crezcan de forma exponencial en el futuro, lo que aconseja el implante y seguimiento de los DCEI por personal cualificado para extraer el máximo rendimiento de los mismos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.