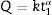Se han preparado 3 vidrios con distinto contenido en SiO2 y de composición similar a los nutrientes necesarios para el crecimiento del alga Spirulina platensis. Se han escogido 2 fracciones con distinto tamaño de partícula para cada uno de los vidrios preparados y la cinética de lixiviación de dichos vidrios ha sido estudiada a través del análisis químico de las aguas de lixiviado, permitiendo obtener las curvas de velocidad para cada uno de los componentes del vidrio. A partir del cálculo de la constante de velocidad y del exponente de la reacción de lixiviado, se ha realizado una aproximación al crecimiento del alga Spirulina platensis en condiciones ambientales normales de luz, pH y temperatura y se ha obtenido que, a través de la modificación de la composición del vidrio de partida o de su tamaño de partícula, es posible ajustar el aporte de nutrientes al medio a la velocidad de crecimiento del alga Spirulina platensis.
Three glasses with an elemental composition similar to the nutrient ratio required for Spirulina platensis growth and with different SiO2 content have been prepared. The glasses were crushed and sieved into 2 different fractions and the effect of the particle size has been studied in terms of the leaching kinetics of each element. The chemical analysis of the leaching water was used for obtaining the dissolution rate curves for each element taking part of the glass composition. From the calculation of the leaching rate constant and the exponential constant of the lixiviation reaction, it has been evaluated the Spirulina platensis growth in ambient normal conditions of light, temperature and pH of the growing media. It has been concluded that, either from the modification of the chemical composition of the glass or its particle size, it is possible to tune the delivery of the nutrients to match the growth rate of Spirulina platensis.
La utilización de vidrios como sistemas fertilizantes se postula cada vez más como una alternativa factible para la mejora de los procesos de abonado de diversas clases de plantas en los más variados tipos de suelos. Aunque los fertilizantes convencionales tipo NPK (nitrógeno, fósforo, potasio) son los que mejores rendimientos aportan al cultivo, su rápida disolución por agua suele dar lugar a pérdidas del abono, ya que no todos los nutrientes pueden ser absorbidos por las plantas en el tiempo en el cual el fertilizante está en contacto con la planta y el suelo circundante. Cuando esto ocurre así, los nutrientes no absorbidos pasan a los niveles freáticos con la consecuente contaminación de sus aguas [1]. Si bien, en general, las concentraciones de los nutrientes NPK en vidrios fertilizantes son inferiores a las que poseen los abonos convencionales, los vidrios tienen la ventaja de que permiten controlar la velocidad de lixiviación de dichos elementos (sobre todo del P y el K) con lo que su absorción por la planta es más elevada (por ser secuencial) y, a la vez, se reduce la contaminación de las aguas subterráneas [2]. En este sentido, la utilización de vidrios fertilizantes no solo implica una mejora tecnológica de los procesos de abonado de los cultivos al conseguir una absorción sostenida de los nutrientes, sino que los hace medioambientalmente más sostenibles, lo que resulta en una forma de mejorar el medio ambiente a través de la reducción de la contaminación de las aguas de regadío.
En los últimos años, uno de los cultivos que ha experimentado un mayor y más amplio desarrollo ha sido el cultivo de algas por poseer un amplio espectro de aplicaciones entre las que destacan la obtención de bioetanol o biodiésel [3], obtención de piensos de alta concentración de nutrientes [4,5], productos de alto valor añadido como son los aceites omega-3, etc. [6]. Si bien la utilización de vidrios como fertilizantes de plantas terrestres es un tema de gran interés científico y social, no existen aún estudios de este tipo de abonado en plantas acuáticas. En el cultivo de algas, aunque los elementos nutrientes fundamentales son del tipo NPK, cada tipo de alga requiere unos elementos específicos para mejorar su crecimiento y, sobre todo, sus propiedades finales en función de la aplicación en la que va a ser empleada.
Los aportes de nutrientes para el cultivo de algas se suelen realizar mediante la adición directa de compuestos químicos puros solubles en agua. Sin embargo, el elevado precio de estos y el relativo poco crecimiento del alga hacen que el coste del proceso final sea elevado y, por lo tanto, el cultivo de algas no sea económicamente viable. Otro aspecto a tener en cuenta en el cultivo de algas es el de los elevados volúmenes de agua necesarios para que las plantas crezcan, lo que supone un mayor coste del proceso, no solo por el propio precio del agua, sino por la infraestructura necesaria para contener tales volúmenes de líquido capaz de disolver todos los nutrientes. Para reducir el coste del agua, en lugar de un agua purificada, lo que se suele emplear es aguas no muy puras y, a ser posible, se busca que la propia agua contenga elementos que puedan servir como nutrientes al alga, minimizando así la adición de compuestos químicos puros al medio de crecimiento. En este sentido y al igual que sirve para plantas terrestres, la utilización de vidrios o partículas de vidrio de disolución controlada puede ser un método válido para aportar nutrientes al medio acuático que contiene algas. Para tal fin, es necesario que el vidrio presente una determinada solubilidad en agua sostenida en el tiempo y que libere los elementos nutrientes de acuerdo con una cinética adecuada para que el alga pueda aprovecharlos sin llegar a saturar el medio ni tampoco a hacerlo deficitario.
El trabajo que aquí se presenta se ha basado en el estudio de la disolución de vidrios en cuya composición química se han incorporado elementos nutrientes para algas, en concreto para el alga Spirulina plantensis (S. platensis). El estudio se ha centrado en la cinética de disolución de vidrios en un medio acuoso y en la realización de una aproximación de la liberación de estos nutrientes para diferentes tiempos de abonado de la S. platensis. La S. platensis es una conocida microalga del género de las cianobacterias y, posiblemente, la cianobacteria más estudiada dada su gran importancia en alimentación y su facilidad de cultivo puesto que solamente requiere agua a pH comprendido entre 9 y 11,5. La S. platensis tiene la capacidad de tomar como única fuente de nitrógeno el nitrógeno molecular (N2) del aire pues contiene la enzima nitrogenasa y es, además, altamente eficaz en la fijación de CO2 del medio ambiente, que puede llegar hasta el 38% [7].
En este sentido, para cultivar S. platensis en agua se requiere solamente la adición de ciertos nutrientes como Na, K, P, Ca, Mg y Fe, entre otros. Para el cultivo de S. platensis se han utilizado como medios fertilizantes los conocidos como medio de Zarrouk, Rao, CFTIR, OFERR, Raof, Bangladesh, así como variaciones del de Zarrouk, o solo agua de mar o, incluso, con adiciones de residuos orgánicos [8,9]. Hay que tener en cuenta que, para que la S. platensis crezca, siempre es necesario que los nutrientes estén en unas concentraciones o intervalos de concentración adecuados, ya que si alguno de ellos falta pueden darse varios inconvenientes como es la inhibición de la actividad del ADN del alga, lo que da lugar a una pérdida de la capacidad de destruir cualquier otro gen que pretenda entrar en su célula [10], o bien puede verse alterada la concentración de proteínas, lípidos, hidratos de carbono, antioxidantes, etc., que se obtienen a partir de ella [11]. En general, se ha observado que los medios sintéticos como los de Zarrouk, CFTIR, etc., son algo mejores que los demás, pero el coste de las materias primas es superior, por lo que para este tipo de alga se pueden utilizar medios más sencillos y baratos con la condición de que existan en el medio los nutrientes adecuados, sin necesidad de utilizar compuestos puros.
Cuando el cultivo se realiza en laboratorio, en matraces de 500-5.000cm−3, se suelen incorporar los nutrientes todos a la vez, seguidamente se inocula la cepa de S. platensis y se la deja crecer. Sin embargo, cuando se utilizan grandes volúmenes (300-500 l) es recomendable adicionar los nutrientes poco a poco, o día a día, en función del crecimiento y recolección del alga [12]. En este sentido, el estudio realizado en este trabajo pretende utilizar vidrios cuyos contenidos en P, K, Ca, etc. sean similares a los de los fertilizantes usados para cultivar S. platensis y cuya velocidad de lixiviación pueda ser controlada mediante 2 procedimientos: a) a partir de la cantidad de SiO2 en el vidrio y b) por el tamaño de partícula del vidrio.
Parte experimentalLos vidrios se han formulado de acuerdo con una base de sílice en la que se han incorporado los elementos nutrientes específicos para el alga S. platensis de acuerdo con el medio Zarrouk [13]. Las concentraciones de elementos de dicho medio son: Na2O (87,70%); K2O (9,31%); MgO (0,37%); CaO (0,17%); P2O3 (2,34%) y Fe2O3 (0,03%). Así se han preparado 3 vidrios denominados SP1, SP2 y SP3 cuyas concentraciones en sílice han sido del 30, 50 y 60% respectivamente. El resto de los elementos son los componentes del medio Zarrouk en las proporciones establecidas para dicho medio. Las materias primas utilizadas han sido arena (99%); Na2CO3 (99%); K2CO3 (99%); MgO (99%); (NH4)2HPO4 (99%) y Fe2O3 (99%). Las fusiones se han realizado en crisol de porcelana a 1.200, 1.300 y 1.500°C para SP1, SP2 y SP3, respectivamente. Los vidrios se colaron en molde de latón y se recocieron a 550°C durante 12 h. Posteriormente fueron molturados a 2 tamaños diferentes, denominándose CF o fracción gruesa a la fracción de tamaño grande (218±25μm), y FF o fracción fina a la de tamaño pequeño (23±6μm). La lixiviación de las partículas de vidrio se realizó en agua desionizada a temperatura de 25°C y agitación de 300rpm. En todos los casos se utilizaron 75cm3 de agua desionizada alcanzando un pH de 11,0-11,2 tras la incorporación del vidrio. Se han estudiado tiempos de lixiviación comprendidos entre 1 y 1.080 min para la fracción FF, y tiempos de lixiviación de 1 a 10.080 min para la CF. Trascurridos estos tiempos los vidrios se filtraron y se recogieron las disoluciones filtradas, las cuales se analizaron mediante espectroscopia de plasma ICP-OES.
ResultadosLa lixiviación de los elementos nutrientes para el cultivo de las algas se produce por la disolución sostenida en el tiempo de los componentes del vidrio. Así pues, el análisis del contenido elemental de las aguas de lixiviación es un indicativo de la disponibilidad de dichos nutrientes para ser consumidos por el alga objeto de estudio, la S. platensis. En el presente estudio, los datos obtenidos del análisis químico han sido convenientemente tratados para el cálculo de los porcentajes lixiviados de cada uno de los elementos en función de la composición química del vidrio de partida.
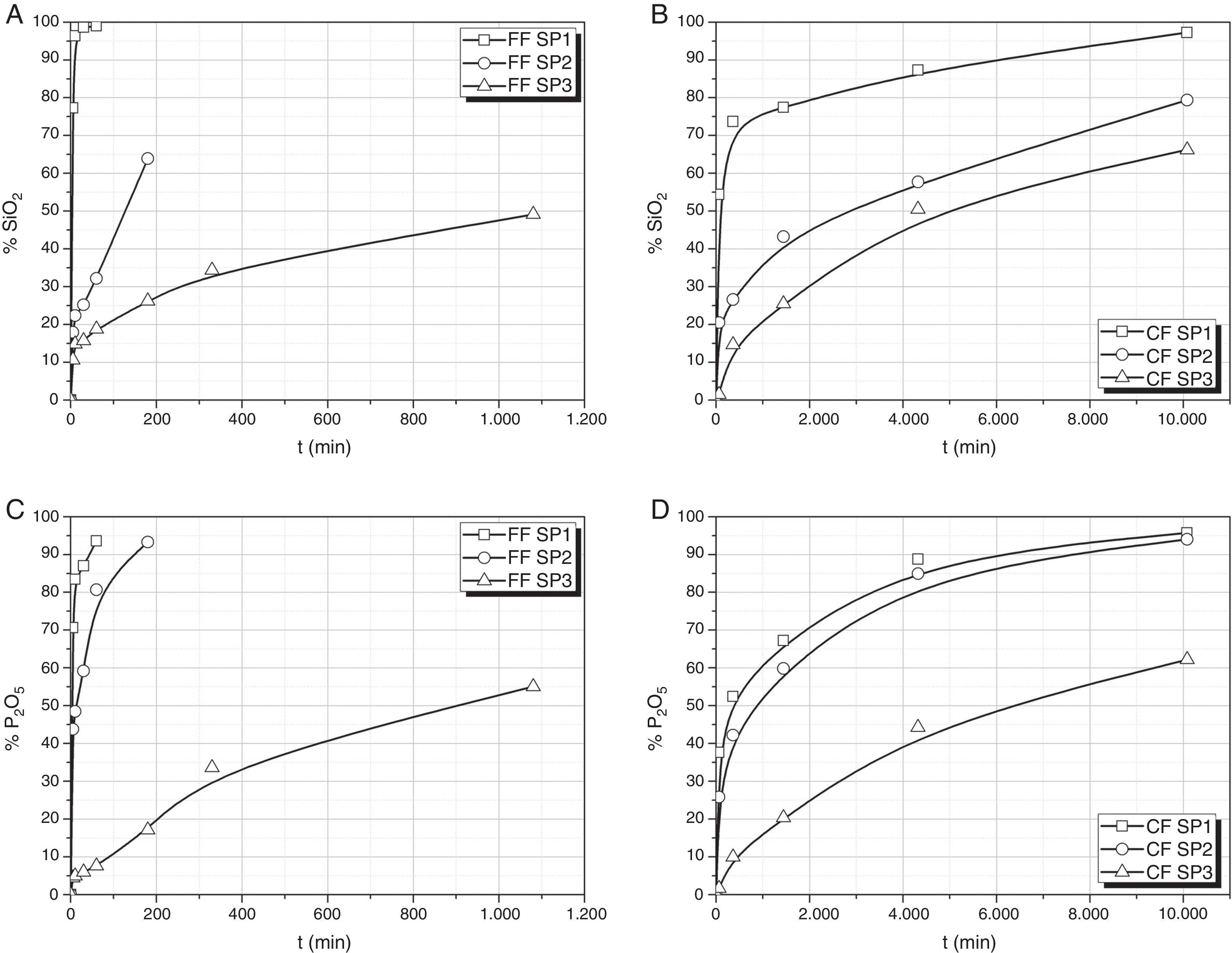
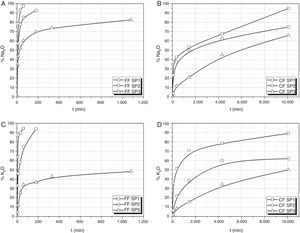
Lixiviación de SiO2 y P2O3Los fosfatos y compuestos de fósforo (particularmente el orto-fosfato) son elementos fundamentales para la evaluación del crecimiento de las algas en los ecosistemas naturales, siendo la forma asimilable del fósforo la del ión fosfato. El P2O5 en disolución permite realizar una estimación directa de la cantidad de fósforo disponible para el cultivo del alga. Por su parte, el SiO2 lixiviado se relaciona con la solubilidad del vidrio en el medio de cultivo.
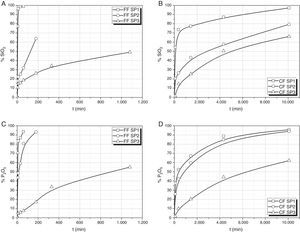
En la figura 1 se muestran los resultados obtenidos de los análisis químicos de las aguas de lixiviación para la determinación de las cantidades de Si o P extraídos en función del tiempo de disolución en agua. Para el vidrio SP1 y fracción fina (FF SP1) prácticamente en los primeros 60 min se ha disuelto todo el vidrio, lo que es debido a su bajo contenido en SiO2 y pequeño tamaño de partícula. Este mismo vidrio, pero en fracción gruesa (CF SP1), requiere alrededor de una semana para su disolución completa. Para el vidrio SP2 con un contenido en SiO2 del 50% la velocidad de disolución es mucho menor tanto en la FF SP2 como en la CF SP2, aunque en la fracción más fina, la menor velocidad de disolución resulta más evidente. Así, el SiO2 llega a extraerse un 65% en los primeros 180 min en la FF SP2 mientras que el P2O5 se lixivia prácticamente en su totalidad en este periodo tiempo. Finalmente, con el vidrio SP3 con el mayor contenido en SiO2 ni la FF SP3 ni la CF SP3 dan lugar a una disolución completa del SiO2 ni del P2O5, alcanzándose valores no superiores al 50% de SiO2 lixiviado para tiempos de lixiviación de 1.080 min (18 h)
En el vidrio SP3, la concentración de P final en la disolución es bastante similar para las 2 fracciones FF SP3 y CF SP3, sin embargo hay que tener en cuenta que para la primera, el tiempo de lixiviación máximo ha sido de 1.080 min, mientras que para CF SP3, para un porcentaje algo superior (62%) el tiempo de lixiviación requerido ha sido de 10.080 min (168 h).
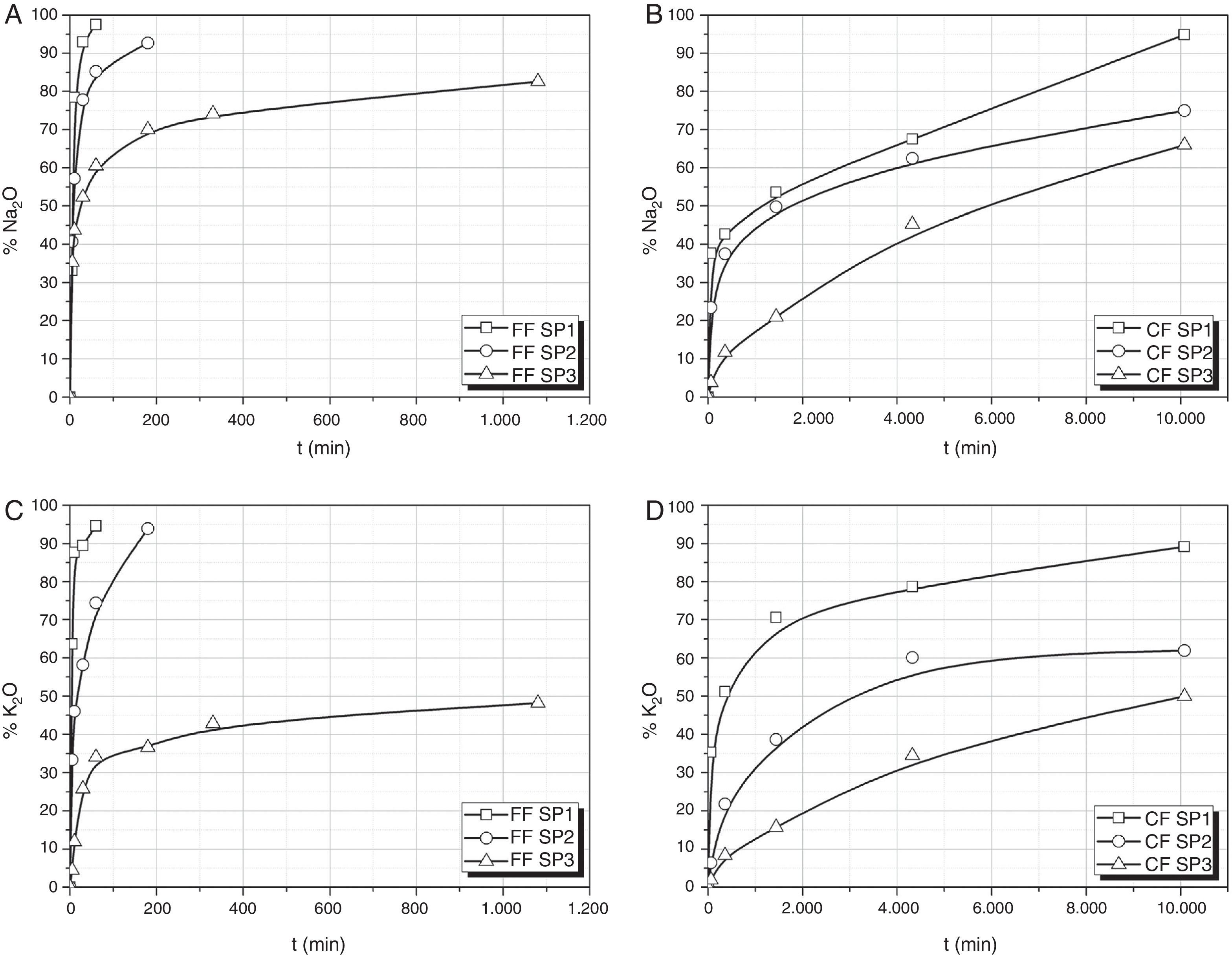
Lixiviación de Na2O, K2OEn la figura 2 se muestran las curvas de lixiviación-disolución de Na y K para los 2 vidrios estudiados. Como en el caso anterior (fig. 1) la lixiviación en los primeros 60 min del vidrio SP1 FF es prácticamente total tanto en iones Na como en K, lo que está de acuerdo con la alta solubilidad en agua de este vidrio de bajo contenido en SiO2. Sin embargo, pare este vidrio en CF se requieren 168 h para llegar a más del 90% de extracción de Na o K. Así mismo, y como en el caso del Si o P, los vidrios SP2 y SP3 por aumentar su contenido en SiO2 dan lugar a una menor lixiviación de Na y K, ya sea en sus fracciones finas ya sea en las gruesas. Igualmente, las extracciones de Na y K para el vidrio SP3 son bastante similares para las fracciones fina y gruesa a tiempos de 18 y 168 h, respectivamente.
La relación Na/K en el medio de cultivo también varía a lo largo del tiempo de lixiviación. En SP1 FF, se encuentra que la relación Na/K en el medio de extracción es menor a bajos tiempos de lixiviación que la inicialmente incorporada en la composición de partida del vidrio, relación que se recupera hasta ser prácticamente igual a la del vidrio de partida a tiempos de lixiviación mayores. En SP1 CF y en SP2 FF, sin embargo, la lixiviación del Na y del K ocurre prácticamente a la misma velocidad y apenas hay variación en dicha relación. En los vidrios SP2 FF y SP3 CF la lixiviación del Na ocurre con mayor eficiencia a tiempos de lixiviación menores, lo que se traduce en una mayor relación Na/K a bajos tiempos de lixiviación, mientras que al aumentar el tiempo de extracción esta relación iónica tiende a alcanzar la del vidrio de partida. Finalmente, en SP3 CF, la lixiviación del Na es ligeramente mayor a la del K durante todo el periodo de lixiviación, aunque al aumentar el tiempo de lixiviación ambas velocidades tienden a igualarse.
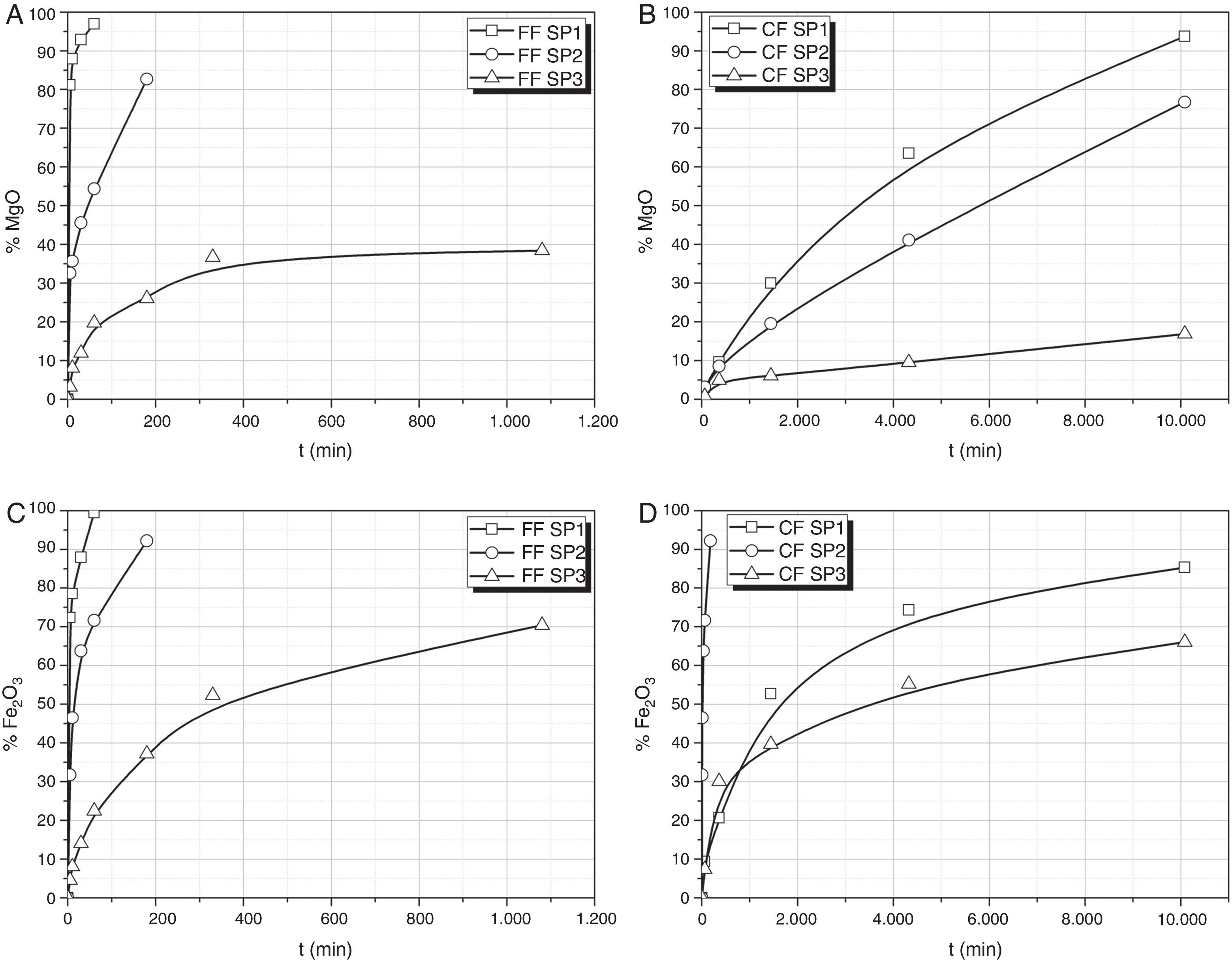
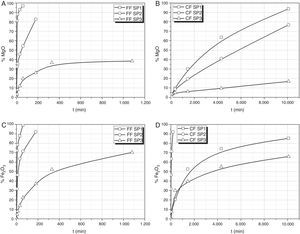
Lixiviación de CaO, MgO y Fe2O3En la figura 3 se muestran las extracciones de Mg y Fe para los 3 vidrios y sus 2 fracciones de tamaño. No se muestra la de Ca ya que es bastante similar a la de Mg. De nuevo se aprecia que FF SP1 se disuelve completamente en la primera hora, sin embargo necesita más de 168 h para que se disuelva CF SP1. Las cantidades disueltas o extraídas de Mg y Fe para cada vidrio son función de la cantidad de SiO2 que contiene, cumpliéndose en todos los casos que a mayor cantidad de SiO2 menor es la disolución de los distintos elementos.
En el caso del Fe, se ha observado que existe también una relación directa con la cantidad de Fe lixiviado y la lixiviación de P. En las FF de los vidrios SP1 y SP2, los porcentajes de Fe y de P son muy similares y la relación entre dichos porcentajes es próxima a uno para todos los tiempos de lixiviación. Esta relación de %Fe/%P varía con el tiempo de extracción encontrándose que para los tiempos inferior y superior, la relación es próxima a uno mientras que para los tiempos intermedios hay un incremento gradual que ocurre hasta los 60 min de tiempo de lixiviación, volviendo a decrecer progresivamente al aumentar el tiempo de lixiviación.
En el caso de la CF de los vidrios SP1 y SP2, el Fe se lixivia más lentamente que el P en los primeros momentos de la extracción y la relación de porcentajes de Fe y P extraídos son muy similares para ambos vidrios. Por el contrario, en SP3 CF el Fe se extrae de manera más eficiente a bajos tiempos de lixiviación mientras que la relación de porcentajes %P/%Fe lixiviado se acerca a la unidad a medida que aumenta el tiempo de lixiviación.
DiscusiónTal y como se explicó en el apartado Introducción, para lograr una velocidad de crecimiento óptima del alga S. platensis es necesario que la cantidad de nutrientes en el medio de crecimiento esté disponible de manera controlada. Un déficit de nutrientes conllevaría un crecimiento menor o más extendido en el tiempo de los cultivos de algas mientras que el exceso de nutrientes implicaría un crecimiento descontrolado y la consecuente eutrofización del medio de cultivo.
La cinética de disolución de los iones nutrientes de las algas permite establecer la disponibilidad de dichos nutrientes en el medio de cultivo y, para ello, se han calculado las velocidades de lixiviación de los diferentes elementos contenidos en los vidrios estudiados, ajustando las curvas de las figuras 1 a 3 a la ecuación general de cinética de lixiviación:
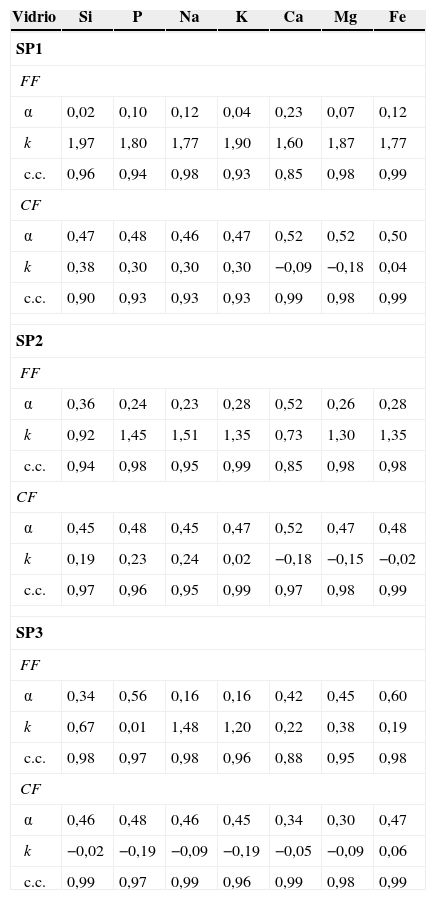
siendo Q la cantidad de iones extraídos en el tiempo t, y k y α son la constante y el exponente de la reacción de extracción, respectivamente. Esta ecuación es válida para la determinación de la velocidad de iones alcalinos en una solución a pH constante [14]. En general, para cortos periodos de tiempo o bien para disoluciones no saturadas α=1 [15] pero experimentos realizados por Rana, Das y Douglas [16–18], atacando vidrios del tipo R2O-SiO2 y R2O-CaO-SiO2 (R=Na, K) con disoluciones acuosas encontraron que a tiempos cortos y temperatura ambiente α es próximo a 0,5, mientras que a altas temperaturas y tiempos largos α se aproxima a la unidad. Por otro lado, El-Shamy et al. [19] encontraron que para un tiempo de lixiviación de 4 h en el medio, α podría alcanzar valores alrededor de 0,35. En resumen, ambos valores de α se pueden encontrar en la lixiviación de un mismo vidrio. Para α=1 el comportamiento es lineal, mientras que para 0,35<α < 0,5 es parabólico y, si ambos tienen lugar durante la lixiviación de un mismo vidrio, quiere decir que existe un periodo intermedio en el que α asciende desde 0,35 a 1. Estudiando vidrios de diferente tamaño de partícula en distintas condiciones, Ethridge [20] concluyó que en realidad siempre existe una mezcla de los 2 mecanismos y que el periodo de transición depende de cada vidrio.La ecuación 1 se ha aplicado a la lixiviación de los vidrios estudiados y los valores obtenidos para k, α y el coeficiente de correlación se recogen en la tabla 1 en función del tipo de vidrio y del tamaño de partícula de este.
Valores de la constante de lixiviación, el exponente de la reacción de lixiviación y el coeficiente de correlación para las fracciones FF y CF de los vidrios preparados
| Vidrio | Si | P | Na | K | Ca | Mg | Fe |
|---|---|---|---|---|---|---|---|
| SP1 | |||||||
| FF | |||||||
| α | 0,02 | 0,10 | 0,12 | 0,04 | 0,23 | 0,07 | 0,12 |
| k | 1,97 | 1,80 | 1,77 | 1,90 | 1,60 | 1,87 | 1,77 |
| c.c. | 0,96 | 0,94 | 0,98 | 0,93 | 0,85 | 0,98 | 0,99 |
| CF | |||||||
| α | 0,47 | 0,48 | 0,46 | 0,47 | 0,52 | 0,52 | 0,50 |
| k | 0,38 | 0,30 | 0,30 | 0,30 | −0,09 | −0,18 | 0,04 |
| c.c. | 0,90 | 0,93 | 0,93 | 0,93 | 0,99 | 0,98 | 0,99 |
| SP2 | |||||||
| FF | |||||||
| α | 0,36 | 0,24 | 0,23 | 0,28 | 0,52 | 0,26 | 0,28 |
| k | 0,92 | 1,45 | 1,51 | 1,35 | 0,73 | 1,30 | 1,35 |
| c.c. | 0,94 | 0,98 | 0,95 | 0,99 | 0,85 | 0,98 | 0,98 |
| CF | |||||||
| α | 0,45 | 0,48 | 0,45 | 0,47 | 0,52 | 0,47 | 0,48 |
| k | 0,19 | 0,23 | 0,24 | 0,02 | −0,18 | −0,15 | −0,02 |
| c.c. | 0,97 | 0,96 | 0,95 | 0,99 | 0,97 | 0,98 | 0,99 |
| SP3 | |||||||
| FF | |||||||
| α | 0,34 | 0,56 | 0,16 | 0,16 | 0,42 | 0,45 | 0,60 |
| k | 0,67 | 0,01 | 1,48 | 1,20 | 0,22 | 0,38 | 0,19 |
| c.c. | 0,98 | 0,97 | 0,98 | 0,96 | 0,88 | 0,95 | 0,98 |
| CF | |||||||
| α | 0,46 | 0,48 | 0,46 | 0,45 | 0,34 | 0,30 | 0,47 |
| k | −0,02 | −0,19 | −0,09 | −0,19 | −0,05 | −0,09 | 0,06 |
| c.c. | 0,99 | 0,97 | 0,99 | 0,96 | 0,99 | 0,98 | 0,99 |
c.c: coeficiente de correlación; k: constante de lixiviación; α: exponente de la reacción de lixiviación.
De acuerdo con estos resultados, α está próximo a 0,5 para las CF en los 3 vidrios estudiados y para la mayoría de los elementos, aunque en algunos casos toma valores inferiores, llegando incluso a 0,3. Los coeficientes de correlación son, en la mayoría de los casos, próximos a 0,98, lo que indica buenos ajustes a la ecuación 1. Por otro lado, la constante k disminuye con el contenido en SiO2 así como con el tamaño de las partículas de vidrio, lo que indica que la velocidad de la reacción de extracción de iones es SP1>SP2>SP3 y FF>CF, es decir, disminuye al aumentar el contenido en SiO2 y el tamaño de partícula. Así, para el vidrio SP1, por ser de bajo contenido en SiO2, los valores de k son muy parecidos para todos los elementos extraídos en la fracción FF, lo que indica que el vidrio es muy soluble, mientras que para la fracción CF los valores de k son similares para Si, Na, K y P, pero varían mucho en Ca, Mg y Fe. El comportamiento de los elementos mayoritarios se ajusta a la misma ecuación de velocidad, pero no ocurre así para los componentes minoritarios. Por el contrario, en el vidrio SP3, por ser el menos lixiviable, y en el caso de la fracción CF, los valores de k son bastante parecidos para todos los elementos extraídos, lo que es de nuevo atribuible a su menor capacidad de lixiviación por el mayor tamaño y por su alto contenido en SiO2.
A partir de los valores de k y α obtenidos para cada vidrio y para cada tamaño respectivo, se ha intentado realizar una evaluación de las necesidades de nutrientes que tendría la S. platensis en condiciones reales. En diferentes trabajos se ha demostrado que, cuando se cultiva S. platensis, los nutrientes del medio se consumen en la primera etapa de crecimiento que ocurre en los 3 primeros días, siendo esta una fase de crecimiento autótrofa caracterizada por una tasa de fotosíntesis neta. Tras esta fase, la velocidad de crecimiento se ve reducida al disminuir las fuentes orgánicas de carbono [21], lo que implica que hay que renovar o incorporar más nutrientes cada cierto periodo de tiempo. A su vez, en otros trabajos se ha demostrado que el cultivo de S. platensis en medios continuos posee un rendimiento mayor que en medios discontinuos [22–24] por lo que cada día es necesario realizar una adición de nutrientes en concentraciones que dependen del tiempo de cultivo, existiendo una concentración inicial característica denominada de crecimiento y otra denominada de mantenimiento. En estos casos los periodos de cosecha de S. platensis se producen a partir de los 10-20 días y llegan hasta los 2-3 meses. En resumen, para cultivar S. platensis se requiere una concentración determinada de nutrientes durante todo el tiempo de cultivo, desde la inoculación hasta la cosecha, y esta concentración debe estar relacionada con la velocidad de crecimiento de la S. platensis en todo ese tiempo, por lo que los diferentes nutrientes necesarios deben ser añadidos a medida que la S. platensis los va consumiendo para su crecimiento.
La velocidad de crecimiento de la S. platensis viene deteminada por numerosos factores que es necesario controlar en el medio de cultivo. Entre ellos, la irradiación ambiental es un factor importante para la viabilidad de estos cultivos por su carácter fotoautótrofo, ya que necesitan la energía lumínica para llevar a cabo los procesos fotosintéticos. Este factor no es determinante en la velocidad de lixiviación de los vidrios, aunque sí lo es la temperatura. La temperatura afecta tanto a las actividades metabólicas como a la disponibilidad de los nutrientes y su absorción. Ajustando los valores de pH (que debe estar entre 9 y 12) y la temperatura, empleando vidrios con elementos nutrientes cuya lixiviación tenga lugar a velocidades adecuadas a las necesidades de crecimiento de la S. platensis, sería posible realizar una sola adición de nutrientes al medio de crecimiento. Esta posibilidad de utilizar vidrios de liberación controlada de nutrientes se ha comprobado para el caso desarrollado por Gami et al. [8], quienes utilizan una concentración de 0,089g/l para el nutriente P.
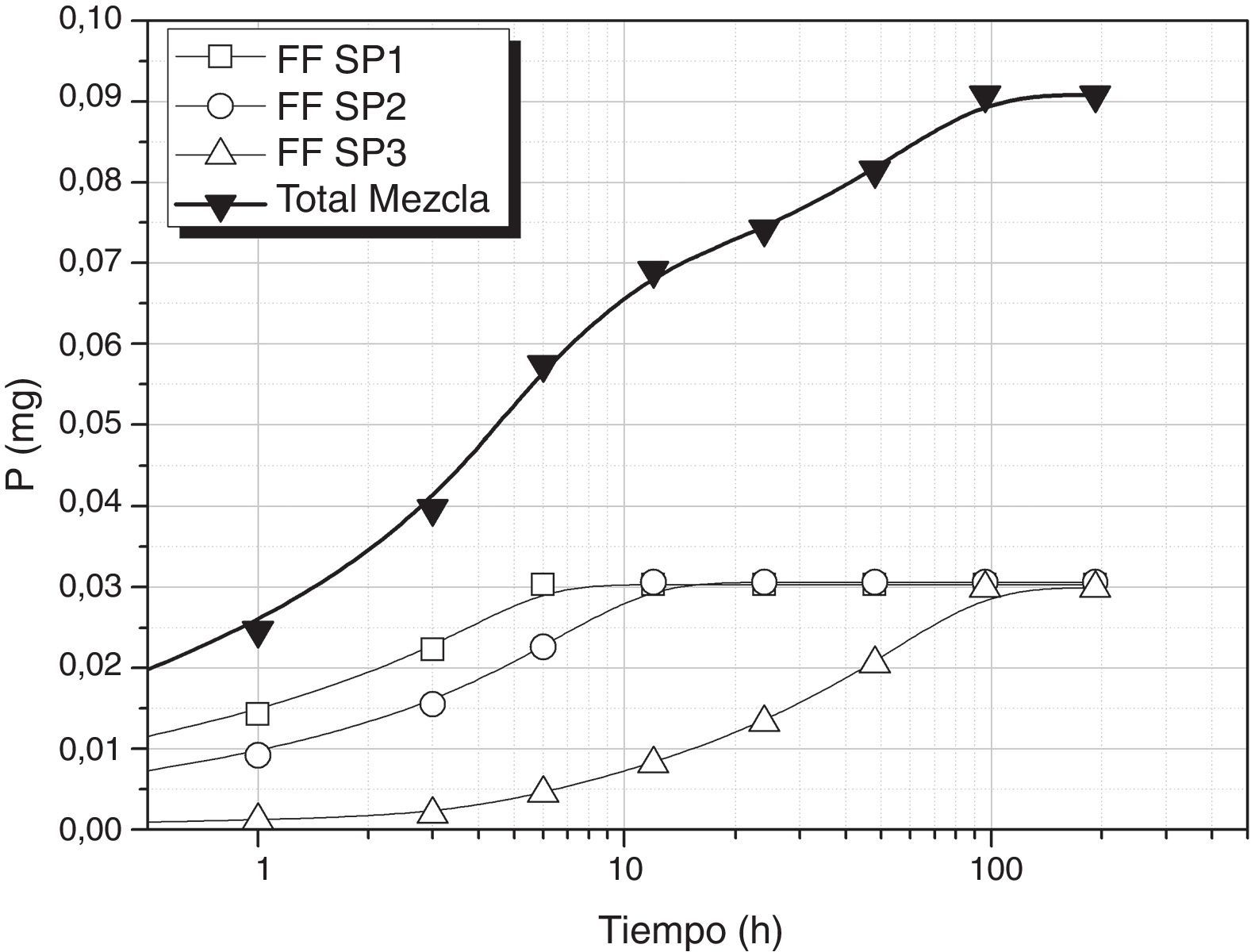
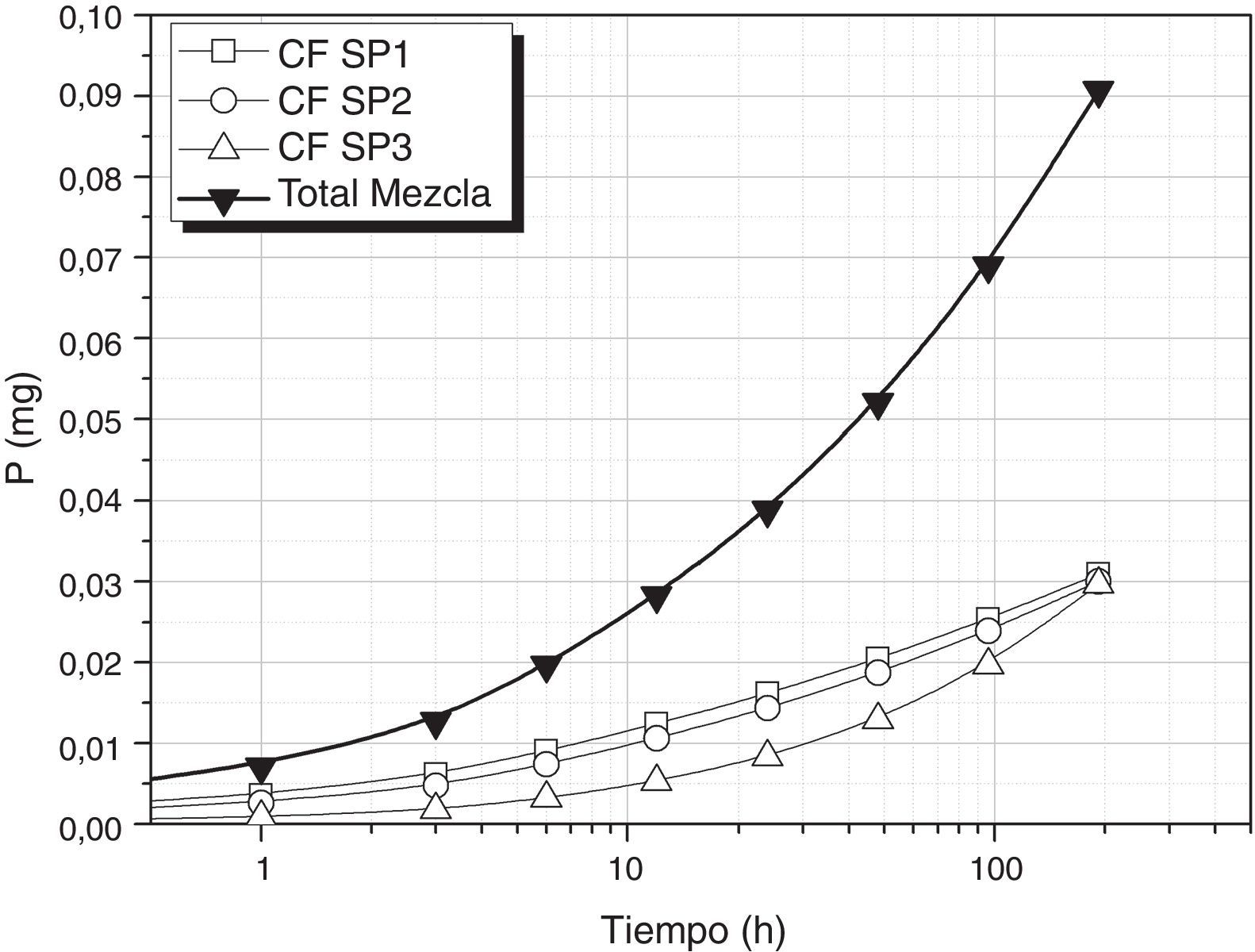
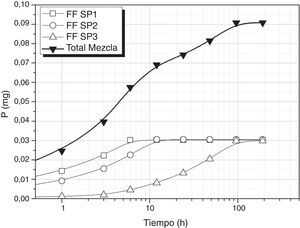
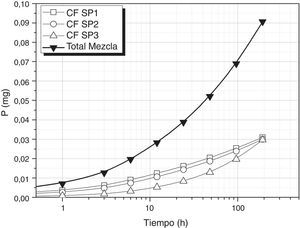
Tomando como referencia uno de los nutrientes necesarios para que se desarrolle el cultivo de S. platensis, en las condiciones de pH (10-12) y temperatura (25°C) de lixiviación de los vidrios, se ha evaluado la viabilidad de empleo de estos vidrios como aportes de nutrientes para el cultivo de dichas algas. En la figura 4 se muestra la liberación de P utilizando los vidrios FF SP1(0,45g), FF SP2 (1,3g) y FF SP3 (0,52g) y se puede comprobar como la concentración requerida de este nutriente se puede conseguir a las 96 h, es decir, que añadiendo estos vidrios la concentración de P sería la requerida para el crecimiento de S. platensis. Por otro lado, en la figura 5 se muestra la liberación de P utilizando una mezcla de vidrios CF SP1 (0,14g), CF SP2 (0,22g) y CF SP3 (0,64g), y se observa en este caso como se requieren 192h para conseguir que entre todos los vidrios liberen 0,089g/l de P, si bien la velocidad es diferente para cada uno de ellos.
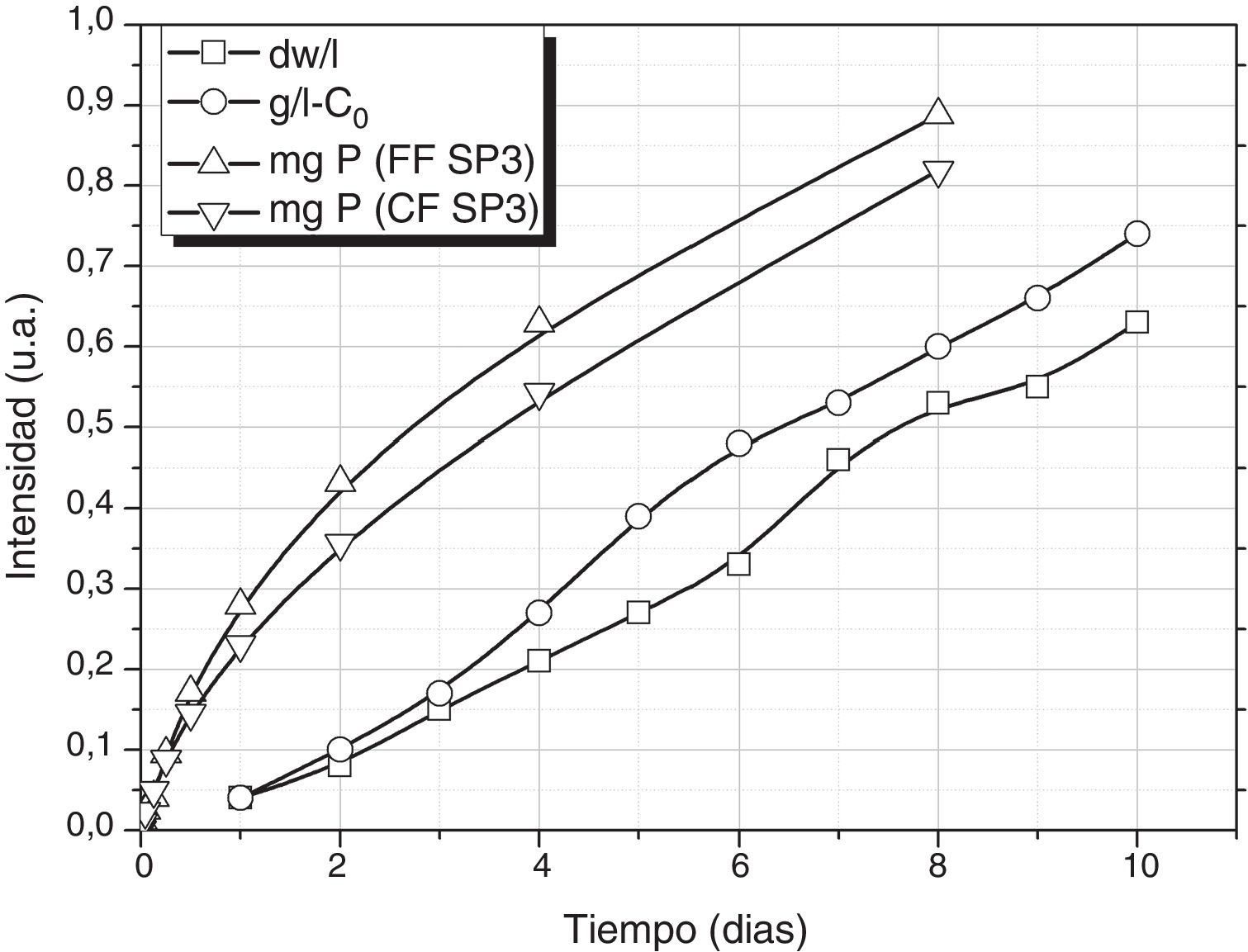
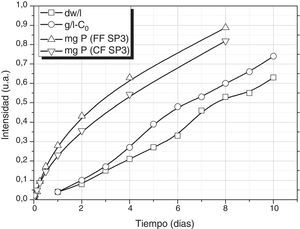
Finalmente, el aporte de nutrientes por el vidrio durante su lixiviación puede ajustarse a las necesidades de crecimiento de la S. platensis. En la figura 6 se muestran los resultados de crecimiento de S. platensis según Oliveira [11] y Gami et al. [8] en condiciones ambientales normales (luz, pH, temperatura), así como el aporte de P mediante los vidrios FF SP3 y CF SP3 a 25°C. En la figura 6 se presenta en la misma escala el peso neto del alga a lo largo del tiempo de crecimiento una vez eliminado su contenido en agua y el resto de líquido por cada litro de medio de cultivo (dw/l), y la cantidad de S. platensis que se reproduce (g/l-C0), que es el peso neto menos la cantidad inicial de alga que se incorpora al medio de crecimiento. Se puede comprobar cómo el aporte de P (así como el del resto de elementos nutrientes como K, Na, Fe, etc., no mostrados aquí) tiene una evolución similar a la variación del crecimiento de S. platensis. El estudio de los mecanismos involucrados en la lixiviación de cada uno de los componentes será objeto de futuros trabajos, de tal manera que, modificando aún más la composición del vidrio o bien su tamaño de partícula, dicha variación se podría ajustar todavía más según el requerimiento de la S. platensis.
ConclusionesEn este trabajo se ha puesto de manifiesto como es posible preparar vidrios cuya composición contenga los nutrientes esenciales que requiere la S. platensis para su crecimiento y cuya lixiviación en medio acuoso aporte dichos nutrientes a una velocidad parecida a la de crecimiento de dicha alga (cianobacteria). Se han preparado 3 vidrios con diferentes contenidos en sílice y el resto de los óxidos que necesita la S. platensis, y se han ensayado 2 fracciones de molienda con 2 tamaños de partícula para cada vidrio. Se ha estudiado la velocidad de lixiviación de los nutrientes en medio acuoso para cada vidrio y cada tamaño de partícula y, a partir de dichas velocidades, se han obtenido las ecuaciones correspondientes, las cuales se han empleado para ajustar la cantidad final de cada nutriente a la requerida por la S. platensis. A partir de estos resultados, se puede seleccionar un sistema de uno o más vidrios, así como uno o 2 tamaños de partícula de tal forma que la velocidad de lixiviación de los nutrientes sea similar a la que requiere el crecimiento de la S. platensis.
Este trabajo ha sido realizado dentro del proyecto INSPIRA1 (Ref. S2013/ABI2783) financiado por la Comunidad de Madrid y cofinanciado con fondos estructurales de la Unión Europea FEDER. Además N. Grabska agradece la estancia realizada en el ICV a una beca LLP Erasmus Programme de Polonia.