Un cemento óseo se sintetizó a partir CaCO3 y CaHPO4, en un tratamiento térmico a 1.400 °C, el material sintetizado fue enfriado rápidamente, con un chorro de aire. El cemento óseo fue mezclado con biovidrio en un 10% en peso (BC-10BG) y luego molido y caracterizado mediante Distribución de Tamaño de Partícula (DTP), Difracción y Fluorescencia de rayos X (DRX y FRX). La mezcla, cemento-biovidrio, y el cemento sólo fueron caracterizados fisicomecánicamente con pruebas de resistencia a la compresión, microdureza, tiempo de cohesión y fraguado. Con el fin de observar tendencias a la precipitación en los estudios in-vitro, se evaluaron adicionalmente otras dos composiciones con biovidrio del 5 y del 15% en peso, por DRX, SEM y FTIR-ATR. Las fases cristalinas encontradas inicialmente corresponden en el cemento óseo al α-TCP, β-TCP, Ca2P2O7 y CaHPO4, por su parte en el biovidrio se detectó, en una parte de su estructura cristalina, la fase whitlockita. En términos físicos, los tiempos de manipulación y las propiedades mecánicas corresponden a un cemento para el relleno de cavidades óseas. Las pruebas in-vitro mostraron un efecto bioactivo progresivo conforme aumenta el tiempo de exposición.
Bone cement is synthesized using CaCO3 and CaHPO4, in a thermal treatment at 1400 °C. The mixture was rapidly cooled with a stream of forced air; bone cement was mixed with 10%wt. Bioglass (BC-10BG) later milled and characterized milled and characterized by Particle Size Distribution (PSD), X-ray diffraction and fluorescence (XRD and XRF). The mixing (Bone cement-Bioglass) and bone cement alone were characterized physicmechamically through testing compressive strength, microhardness, cohesive and setting times; in order to see precipitation trends were carried out in-vitro tests. Additionally, two compositions more of bioglass (5 and 15% wt.) were evaluated by XRD, SEM and FTIR-ATR. The crystalline phases of α-TCP y β-TCP, Ca2P2O7 y CaHPO4 were related to bone cement and whitlockita phase was in agreement with bioglass in one part of its crystalline structure. Physically handling times and the mechanical properties correspond to bone cement for filling cavities. The in-vitro tests showed a progressive bioactive effect with increase the exposition time.
Las fracturas en el sistema óseo ocurren regularmente debido a esfuerzos excesivos, accidentes y al debilitamiento del mismo tejido como consecuencia de enfermedades que comprometen la movilidad y la salud del paciente. Sin embargo, el uso de nuevos materiales biocompatibles promotores de hueso, que contrarresten comportamientos perjudiciales como la desmineralización1, están tomando lugar con mucho más fuerza. Los fosfatos de calcio fueron empleados inicialmente para el mantenimiento de hueso en 1920 por F. Albee, pero sólo hasta 1980 se usaron como material cementante para la osteoregeneración por parte de Brown y Chow, el cual consistía en un material moldeable que se endurecía por sí solo, donde simultáneamente ocurría una reacción de precipitación. Dichos cementos fueron empleados entonces para el relleno de cavidades maxilofaciales, donde la morfología del material sintetizado cambió, pasando de bloques y gránulos a un estado viscoso, con el fin facilitar la implantación del material a las formas heterogéneas de las lesiones2.
Por otro lado, la síntesis del cemento óseo ha sido realizada principalmente por dos procesos, los cuales son el sol-gel y los tratamientos térmicos3. Hay que tener en cuenta que el proceso de obtención del cemento óseo es muy sensible a la formación de dos tipos de fases durante la síntesis, las cuales son la fase αy βde Ca3(PO4)2, aunque ambas fases sean biocompatibles, su solubilidad difiere respecto a su cristalografía, siendo la solubilidad mayor para la estructura monoclínica (fase α, estable > 1.125 ¿C) que para la romboédica (fase β, estable < 1.125 ¿C)4. Por ello, en este trabajo fueron escogidos los tratamientos térmicos con el fin de controlar la fase αy evitar contaminaciones químicas por parte de precursores.
La osteointegración o la integración de compuestos al hueso ocurre a través de un mecanismo de disolución del biomaterial, donde partículas de α-TCP liberan desde su superficie más externa iones de calcio y fosfato hasta los alrededores más próximos. De esta manera, el progreso de la disolución conlleva a la precipitación del compuesto más insoluble en un medio sobresaturado de dichos iones5. De acuerdo a las condiciones de pH y relaciones de calciofósforo, los compuestos pueden ser PHA (hidroxiapatita precipitada; Ca10(PO4)6(OH)2 – pH > 4,2) y brushita DCPD (dihidrato de fosfato dicálcico; CaHPO4.2H2O – pH < 4,2)6, 7.
El estudio de materiales que regulen los fenómenos de la resorción del α-TCP, enfocados a la bioactividad, ha tomado lugar en los últimos años, mostrando no solo interés en determinar las características intrínsecas del material, sino también el efecto de las adiciones sobre el material base8, 9. De esta manera, biocerámicos vítreos han demostrado en diferentes estudios la capacidad de regular la liberación de iones de calcio y contribuir con la formación de tejido óseo nuevo en cementos óseos10, 11. Sin embargo, hasta ahora continúan algunos cuestionamientos, como el efecto sobre las propiedades mecánicas, el efecto de diferentes composiciones de biovidrios y la taza de liberación de iones, etc.
En esta investigación se elaboró un cemento óseo de fosfatos de calcio alfa (α-TCP), siguiendo la tasa de calentamiento de L. Asensio en 200412 y adicionando una cantidad de biovidrio (31SiO2–56CaO–2MgO–11P2O5) en una proporción de 10% en peso, para comprobar el mejoramiento de la bioactividad. Se realizaron pruebas de caracterización como difracción de rayos X (DRX), Fluorescencia de rayos X (FRX), microscopía electrónica de barrido (SEM) y espectroscopía infrarroja (IR). Adicionalmente se hicieron pruebas de caracterización física como evaluación del tiempo de cohesión y de fraguado, resistencia a la compresión y medición de la porosidad. Por último, para determinar el comportamiento bioactivo (tendencia de precipitación de apatitas) del cemento óseo y biovidrio como adición (adiciones de 5, 10, 15% en peso) fueron realizadas pruebas in vitro en una solución SBF (Fluido Corporal Simulado).
MetodologíaSíntesis del cemento óseo de α-TCPLos polvos de hidrógeno fosfato de calcio (CaHPO4; Sigma, ref. C7263) y carbonato de calcio (CaCO3; Merck, ref. 102059) fueron mezclados en un molino centrífugo marca S1000 Restch con 3 cuerpos moledores esféricos de circonia (esferas de 2,5 cm diámetro aprox.) por 5 min a 170 rpm, para garantizar la integración homogénea de los polvos. Luego se realizó un el tratamiento térmico propuesto por L. Asensio en 200412, que consiste en un calentamiento hasta 1.400 ¿C, con un tiempo total de calentamiento de 15 horas y donde se involucra un sobrenfriamiento rápido por medio de un chorro de aire, en aras de obtener la fase metaestable αa temperatura ambiente. Este proceso se hizo por siete veces bajo las mismas condiciones, para garantizar una reproducibilidad en los resultados y obtener suficiente cantidad de material para todos los experimentos y ensayos de caracterización.
Al cemento óseo y al biovidrio se les hizo Distribución de Tamaños de Partículas (DTP) en un equipo marca Master Sizer 2000 E con accesorio Hydro 2000; Difracción de Rayos X (DRX) en un equipo marca PANalytical de referencia EMPYREAN con una fuente de radiación de cobre (Cukα, λ= 1.540598 Å); operando a 45 kV y 40 mA. El espectro del cemento óseo se detectó en un rango 2θentre 0 y 55¿, y un paso de 0, 05¿/min. Para determinar la composición química se empleó un FRX-WD (Fluorescencia de rayos X de Onda Dispersiva) con un espectrómetro de marca Thermo Scientific usando una fuente de rodio.
Síntesis del biovidrio y mezcla del cemento óseo-biovidrioEl biovidrio suministrado se sintetizó siguiendo los métodos planteados por M. Monsalve13, calentando a 1.600 ¿C por 6 horas diferentes mezclas de SiO2, CaO, MgO y P2O5, y vitrificados rápidamente en agua (reactivos de marca Alfa Aesar). El cemento óseo fue mezclado con una proporción de 10% en peso de biovidrio (BC-10BG) para estudiar su comportamiento físico y químico (bioactivo). Adicionalmente, dos composiciones más de biovidrio (5 y 15% en peso) en el cemento óseo fueron evaluadas sólo desde el punto de vista bioactivo, con el fin de determinar una tendencia de precipitación.
La relación Líquido/Polvo (L/P) utilizada para la mezcla del cemento óseo y el biovidrio fue de 0,32, con el fin de obtener una fluidez y consistencia adecuada. La mezcla con la fase líquida tuvo lugar en un mortero a temperatura ambiente durante 1 min. Posteriormente, la pasta cerámica fue moldeada en probetas cilíndricas para evitar su desintegración durante el desmoldeo.
Comportamiento físico del cemento óseo-biovidrioEl tiempo de fraguado fue evaluado usando la norma ASTM 266-08, implementando una adaptación respecto a la cantidad de cemento empleado. Para hallar el tiempo de cohesión, las probetas elaboradas fueron expuestas a la solución SBF (Fluido Fisiológico Simulado) a 37 ¿C hasta su desintegración estructural. En cada prueba fueron empleadas 3 probetas de cada una de las composiciones de 0% y 10% de biovidrio. La nomenclatura empleada: BC-0BG corresponde a la composición sin biovidrio y BC-10BG es la que contiene 10% de biovidrio.
Para evaluar la porosidad, se preparó superficialmente una probeta de cada composición, posteriormente se tomaron 20 imágenes usando un microscopio óptico de luz reflejada marca Olympus BX41 y estas imágenes fueron analizadas utilizando el Software Image J. El porcentaje de porosidad fue tomado siguiendo las indicaciones de la norma ASTM E 2109-01.
La resistencia a la compresión fue medida en una máquina universal de ensayos marca DIGIMESS®, empleando una velocidad de aplicación de carga de 5 mm/min a 4 probetas de dimensiones 12 × 24 mm (ancho × largo). Debido a la ausencia de una norma específica para este tipo de cementos, se emplearon algunos parámetros de la norma ASTM F451-08 para cementos óseos de acrílico, tales como los procedimientos de manipulación, mezcla de los polvos con la fase líquida y la relación de aspecto de las probetas. Por otro lado, la microdureza fue realizada en un microdurómetro marca Zwick/Roell Referencia ZHVμ, con 25gf (0,245 N) de carga, un tiempo de sostenimiento de 15 s y un indentador tipo Vickers. Los ensayos fueron repetidos 20 veces sobre probetas fraguadas de BC-0BG y BC-10BG.
Comportamiento bioactivo del cemento óseo-biovidrioLa bioactividad del cemento óseo y sus adiciones fueron evaluadas exponiendo las probetas a un proceso de incubación en la solución SBF propuesta por Kokubo y otros14, a 37 ¿C durante 1 y 15 días; con movimientos cíclicos translacionales. Luego de finalizar la prueba, las probetas fueron retiradas a un desecador para las posteriores evaluaciones en Microscop-a Electrónica de Barrido (SEM), utilizando un equipo JEOL JSM 6490 LV.
Además para determinar los grupos funcionales, después de la exposición a la solución SBF, fue realizada una prueba de espectrometría infrarroja por transformada de Fourier con reflectancia total atenuada (FTIR-ATR) marca IR Prestige-21/FTIR-8400S. Finalmente, para complementar este resultado fue realizada la valoración del pH en la reacción de fraguado, por medio de un pH-metro Mettler Toledo MP 220, la medición se hizo cada 3 segundos durante 30 min.
Análisis de resultadosCaracterización de la materia primaA los polvos de partida CaCO3 y CaHPO4 se les realizó DTP, para comprobar su estado inicial antes de ser homogenizados y sinterizados. Dichos polvos mostraron una distribución trimodal y bimodal con tamaños entre 10,59-40,18 μm y 2,50-32,88 μm, respectivamente. Lo anterior permitió suponer que dichos rangos de tamaños eran los adecuados para promover la reacción de sinterización, evitando procesos de molienda adicionales. Así mismo, los resultados de las pruebas de Difracción de Rayos X (DRX) para los anteriores compuestos mostraron concordancia con los espectros del CaHPO4 y CaCO3, responsables de la formación de los cementos óseos de α-TCP en el tratamiento térmico.
Caracterización del cemento óseo y biovidrioCemento óseo
El cemento óseo de α-TCP fue sintetizado por reacción en estado sólido, se le realizó un tratamiento térmico y posteriormente una molienda a un tiempo de 10 min a 250 rpm bajo las condiciones expuestas en la sección «Síntesis del cemento óseo de a-TCP». El rango de tamaño de partícula obtenido en la DTP estuvo entre 2,02 μm y 32,88 μm, lo cual indica que el proceso de molienda fina fue eficaz y que las partículas presentan un rango adecuado para la posterior interacción con la fase líquida.
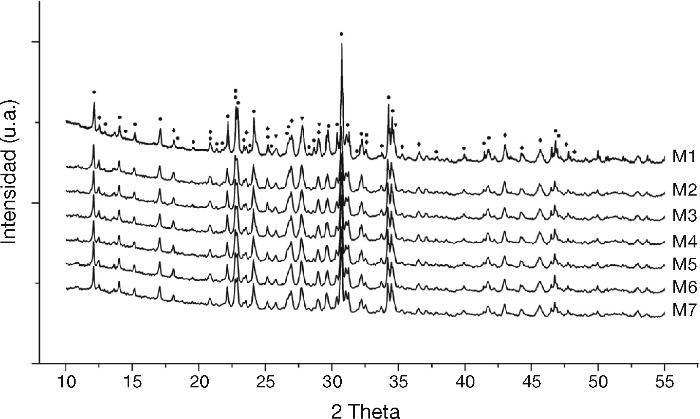
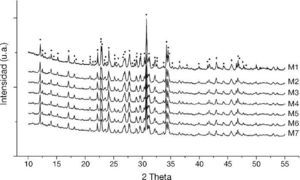
Con el DRX fue posible apreciar la fase alfa en las siete síntesis realizadas (Figura 1). Los espectros obtenidos muestran una similitud en la fase αdel fosfato tricálcico (01-070-0364, X-highScore plus (Xhsp)), los cuales están relacionados al sistema cristalino monoclínico P21/a. Adicionalmente, se han encontrado evaluaciones similares con este tipo de técnicas donde patrones asociados al β-TCP (romboedral-R3C, 00-009-0348(Xhsp)) coinciden o están solapados por la fase αen los ángulos 2θ: 17,13, 21,98, 32,51, 34,54, 36,56, 39,98. Lo anterior ocurre debido principalmente al polimorfismo que guardan las fases de TCP. Así mismo, patrones relaciones al β-TCP también fueron encontrados. Todo lo anterior es atribuido al método de síntesis del cemento óseo, donde los gradientes de temperatura involucrados en el enfriamiento promueven la reversión de la fase α→β, la cual es estable a temperatura ambiente4, 15. Pese a lo anterior, la bioactividad del cemento óseo no se ve afectada, ya que esta fase polimorfa ofrece características similares; a pesar que difieran respecto a la solubilidad, densidad y parámetros de red. Para este estudio en particular, la fase βtoma lugar explícitamente en los ángulos 2θ: 25,85, 27,76, 29,04, 34,68¿.
α-TCP, β-TCP, Ca 2P 2O 7, CaHPO 4)." />Figura 1. Difracción de rayos X de control de las 7 muestras sintetizadas de cemento óseo en un rango de 0 a 55 para el ángulo 2θ (
α-TCP, β-TCP, Ca 2P 2O 7, CaHPO 4).Adicionalmente otras fases remanentes con intensidades menores fueron encontradas (Figura 1) asociados al Ca2P2O7 - Pirofosfato de calcio - (romboedral, 00-009-0345(Xhsp)) [ángulos 2θ: 12,52, 18,15, 20, 85, 23,55, 25,24, 27,05, 29,04, 32,59, 33,75, 35,37, 36,58, 43,01, 44,3, 45,65, 47,59, 49,72] y CaHPO4 - fosfato de calcio dibásico - (01-072-1137 (Xhsp)) [ángulos 2θ: 32,59, 44,86, 44,94¿].
Los cementos óseos de α-TCP presentan nominalmente una relación molar de Ca/P de 1,50, sin embargo este parámetro resulta tener una alta sensibilidad a las condiciones del procesamiento, en consecuencia, el tiempo que tarda el cemento en descomponerse en presencia del SBF y obtenerse la precipitación de la hidroxiapatita, se ven relativamente modificados16. Con respecto a la pureza del compuesto, a través de una prueba de FRX fue posible establecer que el cemento óseo sintetizado muestra un 98,76% de pureza donde el 52,58% es CaO y 46,18% es P2O5 en peso, los cuales son proporciones aproximadas a la composición indicada por el diagrama de fases del sistema CaO-P2O5 para obtener el α-TCP. La relación molar Ca/P obtenida para este biomaterial fue 1,45 (Tabla 1).
Tabla 1. Composición elemental del fosfato tricálcico
| Ca | P | Relacion Ca/P | |
| % peso | 37,77 | 20,15 | 1,45 |
| Moles | 0,94 | 0,65 |
El biovidrio utilizado en este estudio fue suministrado por M. Monsalve, el cual presenta características que difieren a la de los biovidrios tradicionales (CaO–SiO2–P2O5)10, es así como molar de óxido de magnesio y óxido de calcio, respectivamente. Las anteriores proporciones fueron suministradas convenientemente con la intención de propiciar una mayor respuesta osteogénica, pues como ha sido bien documentado el MgO y el CaO en relaciones adecuadas promueven el crecimiento de tejido óseo17. Para determinar la composición química del biovidrio adicionado al cemento óseo de α-TCP, se llevó a cabo una prueba de FRX (Tabla 2). A partir de este resultado se puede deducir que las variaciones en la composición experimental respecto a la composición teórica del biovidrio suministrado son mínimas, lo que lleva a pensar que durante la síntesis no hubo alteraciones estequiométricas.
Tabla 2. Comparación entre la composición teórica y experimental del biovidrio 31SiO2–56CaO–2MgO–11P2O5
| Compuesto | Composicion (%molar) | SiO2 | CaO | MgO | P2O5 | Otros |
| Biovidrio | Teorico | 31 | 56 | 2 | 11 | 0 |
| Experimental | 31,19 | 55,84 | 2,26 | 10,71 | 0 |
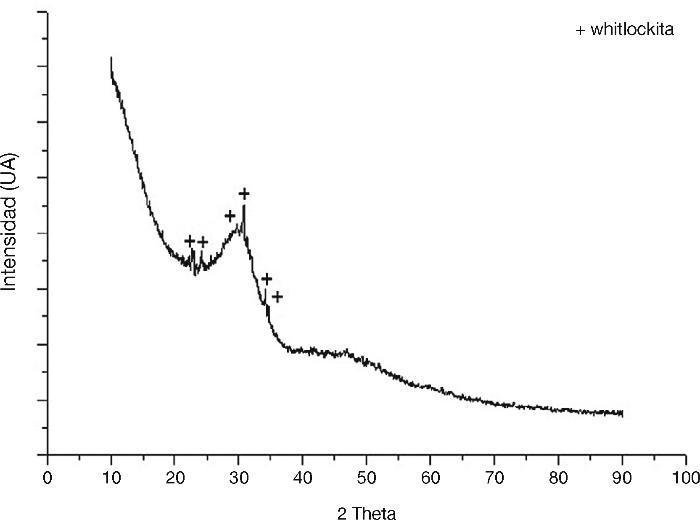
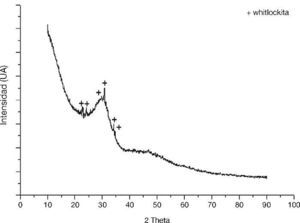
El rango de tamaño en el que se encuentran los cerámicos vítreos suministrados para este trabajo fue determinado por una prueba de DTP, dicho rango estuvo entre 5,13 y 61,63 μm, lo cual indica que no hubo una sobreexposición el proceso de molienda y el efecto del tamaño de las partículas del biovidrio y el cemento óseo en este caso es similar. En la Figura 2 se muestra el difractograma del biovidrio, en el que aparece un espectro típico de compuestos amorfos o semicristalinos. Así, en medio del ruido de fondo una fase cristalina fue encontrada, la cual corresponde a la whitlockita (090348, Xhsp). En contraste a lo anterior, se presume que a pesar de la agresividad del proceso de vitrificación inducido, se presenta un porcentaje de cristalinidad remante del 2,43%, el cual fue determinado por el software X’pert High score plus y debido a la cantidad encontrada no se compromete la estabilidad funcional del biomaterial.
Figura 2. Prueba de difracción de rayos X realizado al biovidrio suministrado.
Caracterización del cemento luego del fraguadoTiempo de cohesión y fraguado
Los tiempos de cohesión (TC) y fraguado (TF), reflejan tiempos en los cuales las partículas interaccionan con la fase líquida. El primer caso consiste en el tiempo que permanece el cemento estructuralmente estable hasta hidrolizarse y en el segundo, es el tiempo requerido para llevarse a cabo la reacción de endurecimiento. Normalmente, el TC resulta menor que el TF inicial, para facilitar la manipulación en el momento de ser implantado7. En la Tabla 3 se ve tanto el TC como el de TF final de las muestras evaluadas. Los anteriores valores reflejan, que las convenciones de manipulación establecidas son respetadas, donde se espera TC y TF final sean inferiores a 5 y 15 minutos, respectivamente18.
Tabla 3. Tiempo de la reacción de cohesión y fraguado para 0% y 10% de biovidrio en el cemento óseo
| Tiempo de cohesion (min) | Tiempo final de fraguado (min) | |
| BC-0BG | 2,08 ± 0,27 | 11,56 |
| BC-10BG | 2,22 ± 0,21 | 11,25 |
Por otro lado, ha ido documentado previamente por M. D. Vlad en 201219, que la relación Ca/P modifica el TF final debido a la presencia de fases alternas como CCP (Pirofosfato de calcio) o TTCP (fosfato tetracálcico). Así, relaciones de Ca/P entre 1,29 y 1,50 muestran TF finales de aproximadamente 80 y 16 min respectivamente. De hecho para la primera relación Ca/P, el endurecimiento no es claro, formándose finalmente un material de textura arenosa. Se observa entonces para esta investigación que el cemento óseo con una relación Ca/P de 1,45 presenta unos tiempos TF determinados (Tabla 3) y que frente a la adición de biovidrio no hay al parecer un efecto notable debido a la similitud de los resultados, confirmando los resultados de M. D Vlad en el efecto de la relación de Ca/P sobre estos tiempos. A pesar que el biovidrio presenta un comportamiento regulador de la disolución en SBF (sección «Pruebas in vitro») en esta etapa de mezcla y endurecimiento la solución empleada no resulta suficientemente efectiva para promover su efecto en la reacción de fraguado.
Porosidad
El efecto de la porosidad sobre las propiedades mecánicas y bioactivas de diferentes biocerámicas ha sido considerado permanentemente. Luego de la reacción de endurecimiento de las cerámicas sinterizadas, se esperaría que alcanzaran propiedades mecánicas comparables a sus homólogos tradicionales que fraguan (por ejemplo cemento portland), sin embargo para los biomateriales tales como los fosfatos de calcio y HA (Hidroxiapatita), la reacción produce el efecto contrario7. Por otro lado, la reducción de las propiedades mecánicas es evidente frente a la porosidad debido al aumento de puntos críticos de tensión, generados en el interior del material ante un esfuerzo experimentado, este comportamiento fue comparado por S. Kwon en 200220, donde probaron en espumas de HA, HA/TCP y β-TCP, encontrando que a medida que aumentaba la porosidad en esos tres compuestos, el esfuerzo a compresión se reducía, mostrando los mejores resultados para HA (∼3 MPa).
Contrario a lo que se presenta en las propiedades mecánicas, las propiedades bioactivas comprenden otro comportamiento respecto a la porosidad interna. Es bien conocido que la presencia de la porosidad aumenta el comportamiento osteogénico, tal como la formación de vasos sanguíneos, el crecimiento y remodelación de hueso21. Sin embargo, lo anterior no se relaciona enteramente a la porosidad (Microporosidad + Macroporosidad), de hecho, la razón por la cual es promovida la bioactividad está asociada con la interconectividad de los poros más que por el tamaño de los mismo, siendo el proceso de fabricación determinante para alcanzar una conveniente interconectividad22.
La porosidad obtenida en este trabajo para el cemento óseo sin biovidrio y para el cemento óseo con 10% de biovidrio (BC-0BG y BC-10BG) fue aproximadamente del 62% en ambos casos. De esta manera, se clarifica que la presencia del biovidrio no involucra un crecimiento o reducción de la porosidad, ya que depende principalmente del método de conformación del biomaterial. Por otro lado, es claro que de acuerdo a este resultado, dicho material sigue un comportamiento mecánico propio de cerámicas frágiles (siguiente sección), y una respuesta bioactiva como se muestra en «Pruebas in vitro».
Resistencia a la compresión
Las cerámicas bioactivas han sido ampliamente usadas como relleno de cavidades maxilofaciales por sus propiedades mecánicas reducidas, donde los esfuerzos a los que están sometidos no comprometen el desempeño del implante. Tal como se vio en el numeral anterior, la porosidad tiene una fuerte influencia en ellas, a pesar de su beneficio bioactivo. Sin embargo, otros parámetros tienen influencia en dichas propiedades, por ejemplo el tamaño de grano, la relación Ca/P y las impurezas remanentes, lo que genera dificultad en la comparación entre dichos biocerámicos a causa de la dispersión estadística de los resultados23.
En cuanto a la resistencia a la compresión, se encontró que para BC-0BG y BC-10BG con un curado a condiciones estándar, el resultado obtenido fue de 0,52 ± 0,09 MPa y 0,27 ± 0,05 MPa, respectivamente. Al parecer, ambos resultados corresponden a un material acorde con una exigencia mecánica reducida. Algunas razones fueron mencionadas anteriormente para explicar este comportamiento, además cabe mencionar que las condiciones de humedad ya sean al interior de la muestra como en el ambiente y la presencia de las fases remanentes pueden tener una influencia directa sobre los valores de la resistencia a la compresión medidos19, 24.
Microdureza
La microdureza realizada a muestras de BC-0BG y BC-10BG fue 57 y 67 HV respectivamente. Este resultado es esperado en este tipo de cerámicas, donde el biovidrio presenta una fragilidad reconocida lo cual limita ampliamente sus aplicaciones mecánicas. En lo que se encuentra en el estado del arte de este tema G. Goller en 1998, usó el biovidrio como un precursor de la síntesis de la HA en aras de genera una posterior estabilidad, resultando en un aumento de sus propiedades mecánicas debido principalmente a la densificación alcanzada por parte del P2O525. Por otra parte, A. Slósarczyk en 1998 mostró que la presencia de cristales de calcita causados por la exposición de CaO al medio ambiente pudo reducir la dureza hasta un 35% de cementos de HA, β-TCP, α-TCP. Pese a esto, la presencia de esos cristales facilitó la aparición de microgrietas que incrementaban la resistencia a la fractura26. De acuerdo a lo anterior, es posible inferir que las durezas obtenidas en este proyecto se presentaron inicialmente debido a la heterogeneidad de las microestructuras, además el incremento que se observa en BC-10BG con respecto a la composición sin biovidrio puede estar asociado a las características vítreas superficiales que guarda dicha adición, y las fases remanentes determinadas previamente.
Pruebas in vitro
Los resultados del análisis realizados mediante microscop-a electrónica de barrido a las muestras que fueron expuestas a SBF indican una aparición creciente de aglomerados asociados a apatita: 3α-Ca3(PO4)2 + H2O →Ca9(HPO4)(PO4)5(OH). En la Figura 3 se observa una fuerte relación entre el comportamiento bioactivo, el contenido de biovidrio en el cemento óseo, y además con el tiempo de exposición en solución SBF; encontrándose que aumenta la deposición de aglomerados a medida que aumenta el contenido de biovidrio y el tiempo de exposición en SBF. Ha sido documentado previamente que la presencia de pequeñas adiciones de Mg y Si en la síntesis estabilizan la fase α-TCP del cemento óseo, lo que conlleva a aumentar los tiempos de fraguado19; sin embargo, la liberación de iones a partir del biovidrio como adición en un material monolítico de α-TCP tiene un efecto diferente.
Figura 3. Microscopía electrónica de barrido de las composiciones de cemento óseo de α-TCP y sus adiciones de biovidrio inmersos en SBF a 1 y 15 días: (A-E) BC-0BG, (B-F) BC-5BG, (C-G) BC-10BG, (D-H) BC-15BG.
F. Barrère en 200827 describió en 5 pasos la forma como reacciona la superficie del biovidrio en contacto con un fluido fisiológico simulado, aunque enfatiza que estos fenómenos dependen directamente del variables como el pH y el tipo solución, además del tamaño de las partículas y tipo de biovidrio, ellos son: (i) formación de silanos, (ii) pérdida de sílice y formación de silanos, (iii) formación de gel de sílice hidratado por una policondensación previa, (iv) formación de capas de fosfato de calcio amorfas, (v) crecimiento de las capas de HA. De esta manera, la formación de apatitas es promovida tanto por la matriz, como por el biovidrio, siendo el último el encargado de regular la resorción de material compuesto.
De esta manera, resulta adecuado asumir que la composición con mayor deposición de precipitados es la relación con 15% de biovidrio en el cemento óseo de α-TCP, y además es la composición con mayor efecto bioactivo. Sin embargo, se ha logrado demostrar26 que composiciones que tienen un efecto estabilizador apreciable, generan la formación rápida de capas de hidroxiapatita deficiente en calcio (DCHA) (amorfa). Entonces usar altas concentraciones de biovidrio, conlleva a una precipitación y saturación excesiva, que desfavorece la osteointegración debido a la limitada disolución en medios acuosos o fisiológicos; razón por la cual se estudió la proporción de 10% de biovidrio.
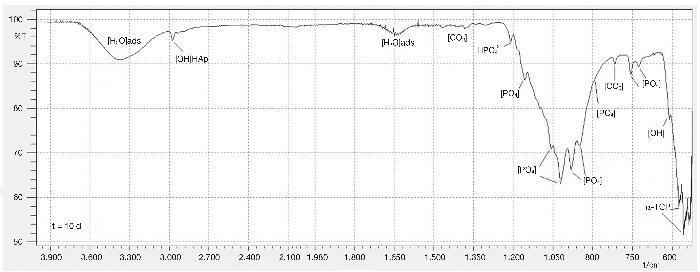
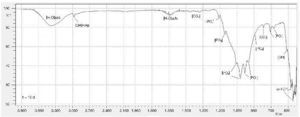
Para comprobar que los aglomerados precipitados corresponden a una composición formada por cemento óseo y de apatitas producto de una exposición a SBF, fue realizada una prueba de espectrometría infrarroja (Figura 4) que exhibió la presencia de los siguientes grupos funcionales:
Figura 4. Espectro infrarrojo de probetas compuestas por BC-10BG a 10 días de inmersión en SBF.
Inicialmente, en el espectro IR se identificaron 3 modos de vibración asociados al P-O: v1) extensión simétrica, v3) extensión triplemente degenerada anti simétrica, v4) flexión doblemente degenera anti simétrica. De esta manera, la banda de absorción débil situada en 815 cm–1 corresponde al modo de vibración v1. Otras bandas de absorción importantes con algunos hombros corresponden a 945, 980, 1.020, 1.060, 1.095, 1.155 cm–1, las cuales están relacionadas al modo de vibración v3. Las bandas situadas en 609, 592, 585, 577 cm–1 aproximadamente se atribuyen al modo de vibración v4. A pesar que en el espectro no fue registrado; de la literatura se documenta que el modo vibracional v2 de flexión doblemente degenerado simétrico se atribuyen a bandas muy débiles en 454, 463, 471 cm–116.
Otras bandas de interés fueron identificadas para los grupos carbonato en 1.380, 1.470 y 810 cm–1. Las bandas ubicadas en 620 y 2.985 cm–1 y 1.210 cm–1 se relacionan a los grupos OH y HPO42– respectivamente. Lo anterior confirma que existe la presencia de hidroxiapatita deficiente en calcio28, luego de 15 días de exposición del cemento óseo con 10% de biovidrio como adición en presencia de SBF. Finalmente, se observan bandas de absorción relacionadas a moléculas de agua en 3.410 y 1.650 cm–1.
Respecto a las composiciones que presentan adiciones de biovidrio, se observó una clara diferencia en las bandas de absorción relacionadas a los grupos OH y HPO42–; con un aumento en la intensidad de estas bandas conforme las proporciones de biovidrio aumentaron, confirmando esta tendencia de precipitación.
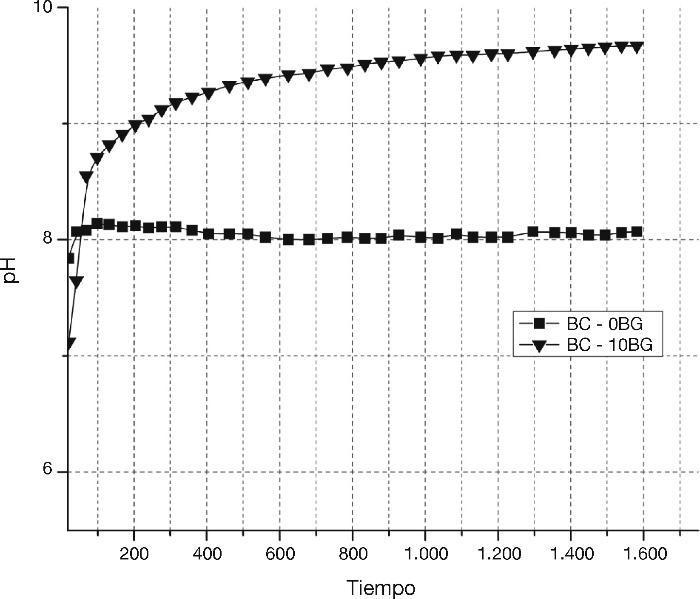
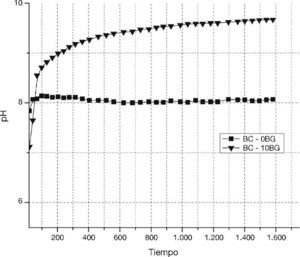
Finalmente, se realizó una evaluación del pH, al cemento óseo con 10% de biovidrio y el patrón de comparación (cemento óseo sin biovidrio), en una solución acuosa durante su reacción de fraguado. En la Figura 5 se observa un aumento de la insolubilidad durante la reacción de fraguado en la solución del compuesto BC-10BG, lo cual da muestra que inmediatamente los polvos sinterizados entran en contacto con una solución acuosa la precipitación de un compuesto más insoluble tiene lugar.
Figura 5. Tendencia de insolubilidad de polvos de α-TCP y biovidrio 31SiO2–56CaO–2MgO–11P2O5 en presencia de un medio acuoso.
ConclusionesSe sintetizó un cemento óseo de fosfato tricálcico alfa a partir de CaHPO4 y CaCO3, en condiciones adecuadas de temperatura de cocción y enfriamiento, en donde también se encontraron tres fases adicionales: β-TCP, Ca2P2O7, CaHPO4. El biovidrio adicionado presentó una composición elemental aproximada a 31SiO2–56CaO–2MgO–11P2O5, con la fase whitlockita y 2,3% de cristalinidad.
Las propiedades mecánicas obtenidas en esta investigación muestran a un material con prestaciones mecánicas reducidas comparadas con otros biomateriales como HA. Para próximos estudios sobre el cemento óseo de α-TCP se recomienda ajustar la relación de Ca/P, con un enfriamiento mucho más severo que evite la descalcificación y la presencia de fases alternas19.
La porosidad registrada en el cemento óseo estuvo alrededor del 62%, lo cual es un valor acertado para biocerámicas de fosfato de calcio usadas como relleno de cavidades. A pesar de la limitada resistencia a la compresión, la bioactividad analizada con la ayuda de pruebas SEM e IR, fue notablemente alta.
La bioactividad de las muestras de cemento óseo con adiciones de 10 y 15% de biovidrio fue superior a la del cemento óseo sin biovidrio ya que presentaron una mayor tendencia a la formación de precipitados de Hidroxiapatita. Adicionalmente, luego de la reacción de fraguado la insolubilidad del cemento con 10% de biovidrio aumentó, y como ha sido documentado en investigaciones previas, dicho compuesto está relacionado con la DCHA (hidroxiapatita deficiente en calcio).
Agradecimientos
Al Comité para el Desarrollo de la Investigación (CODI), que financió la este proyecto PR12-2-03. Por otra parte a M. Monsalve por suministrar el biovidrio empleado en este proyecto y al Grupo de Investigación en Materiales y Recubrimientos Cerámicos, GIMACYR. (Grupo de Investigación) por el préstamo de sus espacios y equipos.
Recibido 19 Septiembre 2014
Aceptado 3 Marzo 2015
Autor para correspondencia. erwinciro@gmail.com