Adolescente de sexo femenino de 13 años con síndrome doloroso abdominal, intolerancia a la vía oral, pérdida de peso y tumor abdominal.
1.1AntecedentesMadre de 32 años de edad, escolaridad secundaria, comerciante, con obesidad, negó toxicomanías. Padre aparentemente sano, fuera del núcleo familiar. Hermana de 3 años de edad, referida sana. Rama materna con carga genética para diabetes mellitus; resto negado.
Originarios y residentes de la Ciudad de México, vivienda rentada que cuenta con todos los servicios básicos de urbanización. Zoonosis negada; hábitos higiénicos adecuados, con baño y cambio de ropa diario.
Alimentación. Se integró a la dieta familiar al año de edad. Refirió alimentación actual completa y balanceada.
Desarrollo psicomotor. Sin alteraciones para la edad.
Inmunizaciones. Referidas completas, no muestra cartilla.
Producto de la G I que cursó con embarazo normoevolutivo con mal control prenatal; negó consumo de ácido fólico o fumarato ferroso. Ultrasonido a los 4 meses de gestación. El producto fue obtenido por vía vaginal a las 40 SDG sin complicaciones, respiró y lloró al nacer, pesó 2800g, talla se desconoce, Apgar 9/9. Egresó sin complicaciones.
Refirió alergia a la penicilina, con antecedente de amputación traumática del cuarto dedo de la mano derecha a los 3 años de edad y antecedentes quirúrgicos para colocación de injerto. Antecedentes traumáticos positivos para fractura de miembros torácicos a los 6 años de edad en distintos momentos.
Acudió al hospital pediátrico por ascitis y permaneció 8 días hospitalizada. Se realizó paracentesis. El líquido peritoneal con reporte de BAAR negativo y antígeno carcinoembrionario de 7.71 UI.
Se envió al Hospital Infantil de México Federico Gómez (HIMFG) para el estudio de tumor abdominal.
1.2Padecimiento finalPresentó dolor abdominal de 9 meses de evolución, de tipo insidioso, progresivo, tipo cólico, localizado en mesogastrio e irradiado a la región dorsal, manejado como infección de vías urinarias y gastritis, sin mejoría. Pérdida de peso de 8kg de un mes de evolución.
Vómito de 2 meses de evolución, intermitente, en escasa cantidad, precedido de náuseas y arqueo, de contenido gastroalimentario. Una semana antes se volvió biliar.
Diarrea de 2 meses de evolución, intermitente, con evacuaciones líquidas en cantidad escasa, hasta tres veces al día, alternando con periodos de estreñimiento.
Fiebre de 39°C de menos de 2h de duración en una sola ocasión, 7 días antes de su hospitalización.
Aumento del perímetro abdominal de aproximadamente 10cm, de una semana de evolución.
A la exploración física se encontraron los siguientes datos: peso de 62kg, talla 161cm, frecuencia cardiaca de 100/min, frecuencia respiratoria 29/min, tensión arterial 100/63mmHg, temperatura 36.5°C, perímetro abdominal 96cm.
Paciente de sexo femenino, de edad aparente menor a la cronológica, activa, orientada, cooperadora, adecuado estado de hidratación, palidez de tegumentos, normocéfala, sin hundimientos ni exostosis. Apertura ocular espontánea, isocoria y normorreflexia. Pabellones auriculares de adecuada implantación, canales auditivos permeables. Membranas normales. Narinas permeables sin secreciones, septum íntegro, puente nasal amplio, mucosa oral hidratada. Cuello cilíndrico corto sin adenopatías, tráquea central, desplazable, tórax simétrico con precordio normodinámico, ruidos cardiacos rítmicos de buen tono e intensidad sin soplos agregados, patrón respiratorio polipneico, murmullo vesicular presente sin agregados. Abdomen blando, depresible, doloroso a la palpación superficial y profunda, sin datos de irritación peritoneal, peristalsis ausente, borde hepático palpable a 2cm por debajo del reborde costal, signo de la ola positivo. Genitales femeninos sin alteraciones, tacto rectal diferido, extremidades hipotróficas.
Exámenes de laboratorio. Biometría hemática: hemoglobina 14.4g/dl, hematocrito 43.3%; leucocitos 7.8 x 103/μl, plaquetas 200 x 103/μl. Química sanguínea: creatinina 0.6mg/dl, sodio 141 mEq/l, potasio 5 mEq/l, cloro 103 mEq/l, bilirrubinas totales 0.86mg/dl, bilirrubina directa 0.37mg/dl; bilirrubina indirecta 0.49mg/dl, proteínas totales 7.4g/dl, albúmina 3.9g/dl, alanina aminotransferasa 26 U/l, aspartato aminotransferasa 15 U/l, deshidrogenasa láctica 156U/l, amilasa 33 U/l, lipasa 199 U/l.
Se realizó tomografía toraco-abdomino-pélvica con doble contraste y ventana pulmonar. Se encontró lesión en topografía de cuerpo y cola del páncreas, a descartar proceso neoplásico. Nódulos pulmonares y hepáticos en relación con enfermedad por depósito secundario, probables implantes peritoneales. Líquido intrabdominal libre, hepatoesplenomegalia.
Se realizó laparoscopia diagnóstica, con los siguientes hallazgos: abundante liquido color café rojizo con puntilleo discreto blanquecino; peritoneo parietal con apariencia de infiltrado algodonoso; hígado con múltiples lesiones de 1cm y menores, duras, en ambos lóbulos; epiplón con aspecto empedrado; todas las estructuras friables.
Presentó distermias en el posquirúrgico, con fiebre de alto grado, y datos de hipoperfusión. Se integró cuadro de sepsis con probable foco abdominal. Se dio cobertura antibiótica empírica contra bacilos Gram negativos anaerobios y enterococos, piperacilina-tazobactam 300mg/kg/día I.V. c/8h.
En sesión clínico-patológica se presentó como lesión probablemente dependiente de páncreas, con infiltración extensa a peritoneo e hígado, y probable infiltración a pared del intestino y antro gástrico, con evidencia de lesiones pulmonares múltiples. Se sugirió realizar endoscopia con toma de biopsia y gammagrama con octreotide, para descartar origen en páncreas.
Se realizó una SPECT-TAC con análogos de receptores de somatostatina, que mostró zonas de aumento de captación en antro gástrico que continuaban hacia páncreas y ganglios mesentéricos, así como pequeñas zonas de captación en hígado, pulmón y ganglios mediastinales derechos con derrame pleural izquierdo. También se encontró líquido libre en cavidad abdominal sin captación. Se hizo el diagnóstico de probable tumor neuroendocrino de estómago sin diferenciar si era primario de páncreas o estómago.
Se colocó catéter peridural por algología. Presentó desequilibrio hidroelectrolítico, con K+ de hasta 6.4 mEq/l, y taquicardia ventricular sin pulso. Recibió un ciclo de reanimación avanzada y una dosis de cardioversión a 4J/kg; el evento total con duración de 2 minutos. Salió a ritmo sinusal, con gasometría postparo con acidosis metabólica hiperlactatémica. Clínicamente bien perfundida; se procedió a intubación orotraqueal.
Recibió quimioterapia con doxorrubicina a 60mg/m2SC/día, dexrazoxane, cisplatino a 20mg/m2SC/día, leucovorin 200mg/m2SC y 5-fluorouracilo (5-FU) 600mg m2SC/día.
Evolucionó hemodinámicamente inestable, sin apoyo aminérgico, con disminución del gasto urinario y tendencia a la taquicardia e hipertensión; ventilatorio con apoyo de oxígeno suplementario con mascarilla-bolsa reservorio a 10 l/min, con Silverman de 2 a expensas de tiraje subcostal y retracción xifoidea. El dolor abdominal persistió y se manejó con infusión de morfina por catéter peridural; además requirió bolos de morfina. Presentó vómito en ocho ocasiones.
Presentó bradicardia que progresó a asistolia sin responder a maniobras básicas de reanimación.
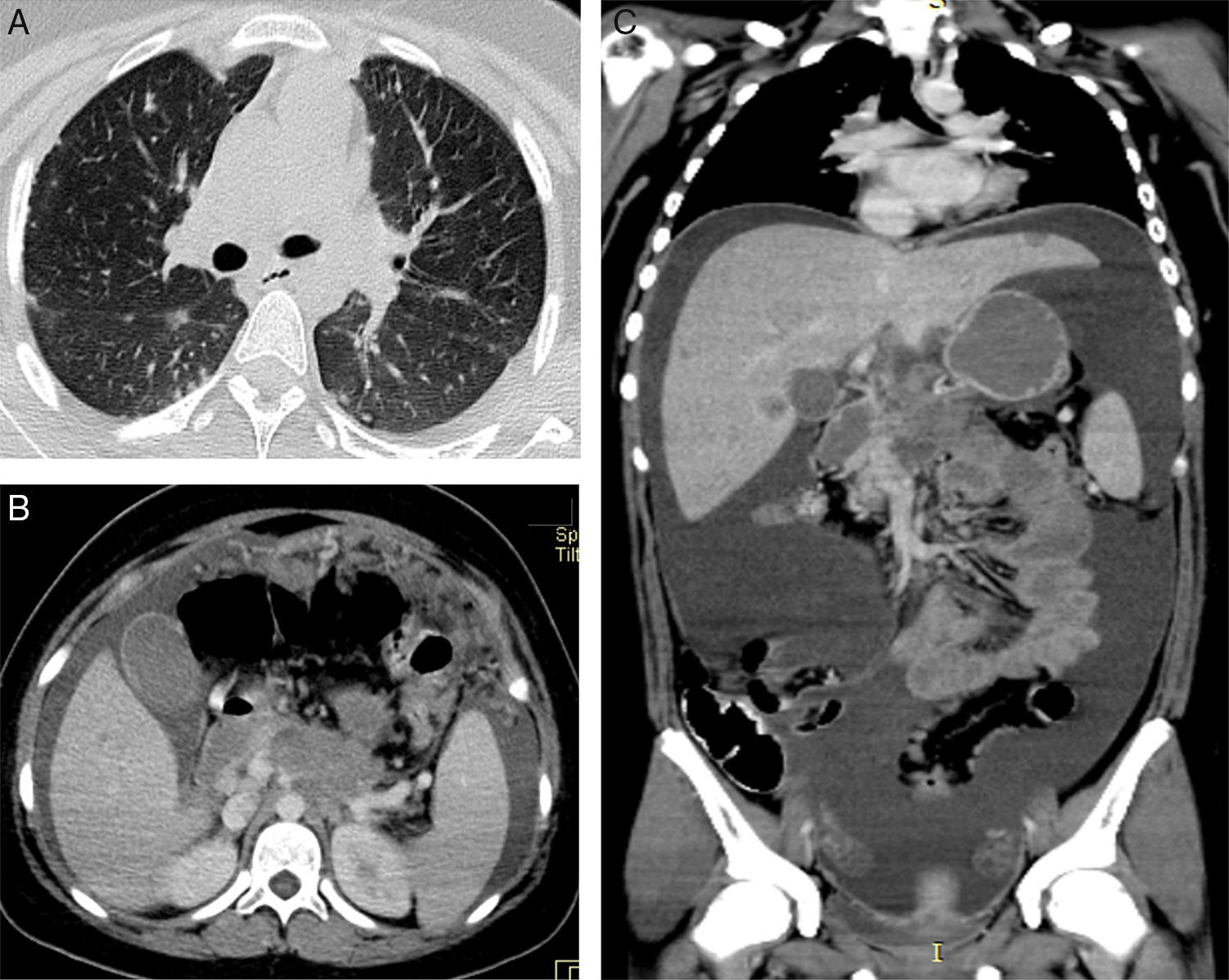
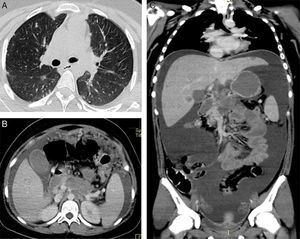
2ImagenologíaSe presentan los estudios de imagen representativos de las lesiones de la paciente. En la tomografía se observa la ventana pulmonar en cortes axiales, donde se identificaron, desde los ápices hasta las bases, múltiples lesiones nodulares subpleurales y pulmonares, pequeñas pero visibles. Además, existe derrame pleural laminar del lado izquierdo (fig. 1A). A nivel de abdomen en fase contrastada con medio de contraste intravenoso, los cortes axiales mostraron una lesión en la transcavidad de los epiplones, de bordes irregulares, parcialmente definidos, que pierde la interfase con la pared del estómago, la pared anterior del páncreas y del duodeno, por lo que no es posible identificar el origen (fig. 1B). Las estructuras vasculares no se observaron de forma adecuada; la vena porta y el tronco celíaco se encuentran afectados. En el epiplón mayor hay múltiples lesiones nodulares. En los siguientes cortes se observa cómo el parénquima hepático tiene múltiples lesiones nodulares que presentaron un discreto realce posterior a la administración de contraste (fig. 1C).
A. Se muestran las lesiones pulmonares periféricas. B. Se observan a nivel del epiplón mayor múltiples lesiones nodulares realzadas con la administración de medio de contraste y la gran cantidad de líquido peritoneal. C. En este corte coronal se muestra mejor la extensión de todo el líquido que existía y que provocaba una centralización de asas.
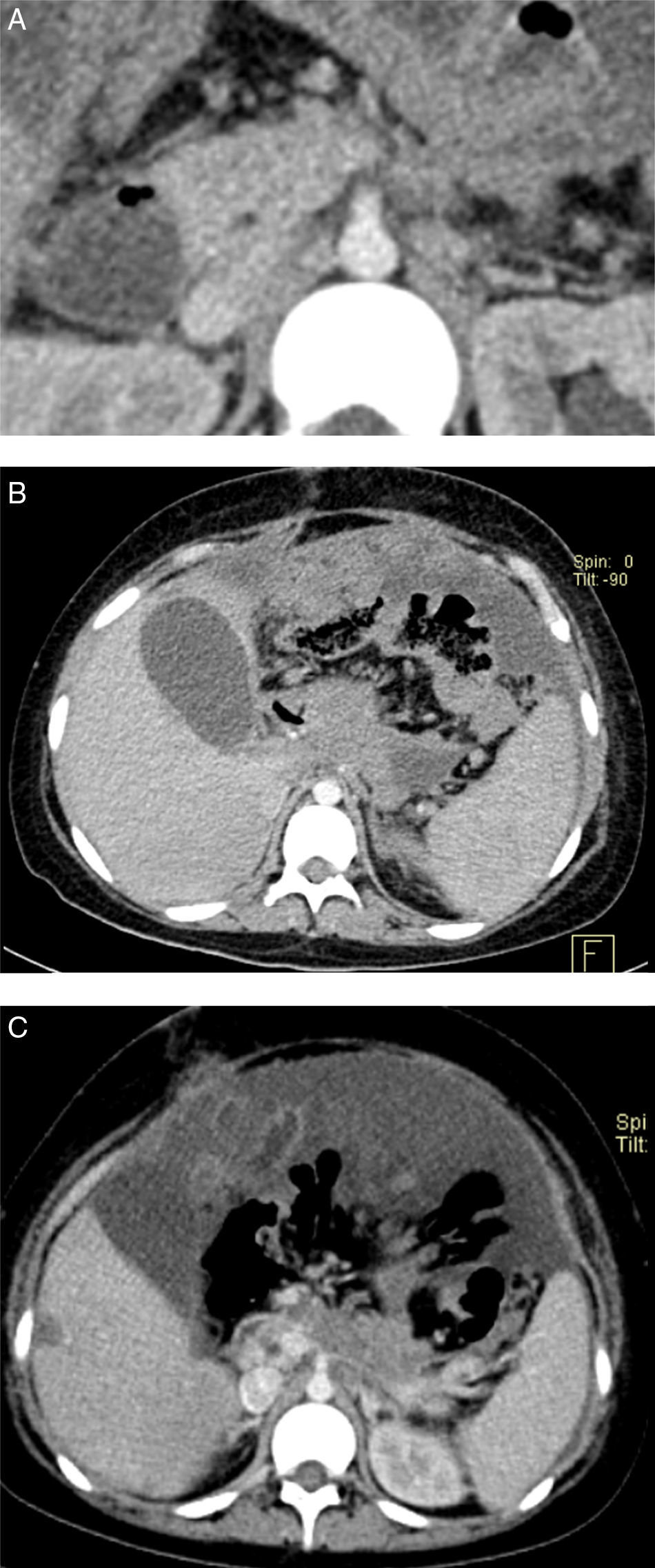
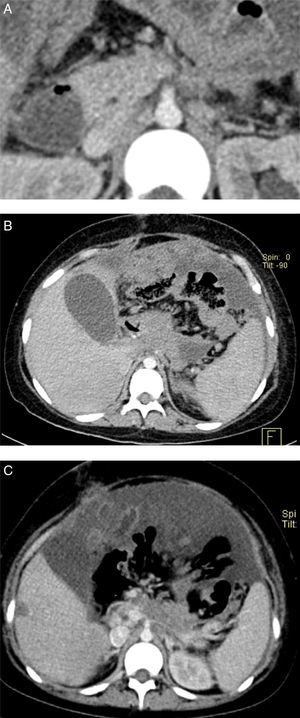
Una tomografía posterior se realizó con fase arterial, venosa y tardía. En la fase venosa se observan múltiples lesiones nodulares adyacentes al páncreas (fig. 2A). Hay aumento difuso del grosor de la pared del estómago y persiste el líquido de ascitis (fig. 2B). En la última tomografía, 7 meses después, las lesiones subpleurales han aumentado de tamaño y de número. Es notable que no se observan lesiones en el parénquima. Las lesiones en hígado persisten (fig. 2C).
A. Las estructuras vasculares conservan su morfología; tanto en la fase venosa como en la arterial se observa que el tronco celíaco no se limita adecuadamente ni la vena porta. B. Persisten las lesiones nodulares en el hígado. C. Las lesiones nodulares peritoneales han aumentado y el líquido de ascitis que se veía anteriormente ha reducido en volumen.
Con las tres tomografías se integró el diagnóstico de lesión tumoral en la transcavidad de los epiplones, de origen probablemente gástrico o pancreático, con depósitos secundarios hepáticos y peritoneales, ascitis y atelectasias pulmonares.
3Presentación del casoSe trató el caso de una paciente adolescente con un adenocarcinoma con diferenciación neuroendocrina de origen primario abdominal.
Se integraron los siguientes diagnósticos sindromáticos:
- •
Dolor abdominal de tipo crónico, difuso, generalizado e intenso, asociado con vómito, diarrea y aumento en el perímetro abdominal.
- •
Síndrome de dificultad respiratoria por incremento en la frecuencia respiratoria, asociado con restricción por distensión abdominal progresiva secundaria a ascitis.
- •
Síndrome de respuesta inflamatoria sistémica con base en fiebre, taquicardia, polipnea, leucopenia y trombocitopenia.
- •
Síndrome infeccioso con base en lo descrito anteriormente e infección por enterobacterias.
- •
Síndrome de disfunción orgánica múltiple ante la falla de los sistemas cardiovascular, hematológico y respiratorio.
- •
Síndrome hemorrágico, por epistaxis asociada con trombocitopenia.
- •
Síndrome anémico, por palidez, taquicardia y cifras de hemoglobina inferiores a las esperadas para la edad.
Se pudieron integrar los siguientes diagnósticos nosológicos:
- •
Adenocarcinoma con metástasis a pulmón, hígado y estómago, probablemente primario de páncreas
- •
Carcinomatosis abdominal con compromiso peritoneal
- •
Ascitis secundaria con líquido peritoneal positivo para la presencia de células neoplásicas
- •
Hipertensión abdominal ante el crecimiento e incremento en el perímetro abdominal por ascitis, con restricción ventilatoria secundaria
El tiempo de evolución del padecimiento representa uno de los factores de pronóstico más importantes para el desenlace de la paciente. El dolor abdominal tenía 9 meses de evolución; no fue abordado de manera adecuada desde su inicio, factor que determinó la referencia pronta a un especialista y que, definitivamente, influyó en el pronóstico final. Fue tratado en múltiples ocasiones con diversos diagnósticos sin mejoría, sin datos clínicos sugerentes de una infección urinaria o de una enfermedad ácido-péptica, como fue manejada, por lo que la semiología completa de dolor abdominal asociada con la historia clínica representa la clave en la revisión de un paciente pediátrico. Cuando se manifiesta pérdida de peso, diarrea, vómito e incremento en el perímetro abdominal, esto traduce cronicidad y ensombrece el pronóstico.
Es crucial la exploración física de un paciente con dolor abdominal crónico. Esta debe ser detallada y minuciosa, con la finalidad de identificar tumores abdominales. Desde la inspección se puede identificar distensión abdominal, y con la palpación se pueden identificar la masa palpable y la ascitis. Incluso, de manera indirecta puede determinarse el origen y la situación del tumor; es decir, si es móvil y se desplaza, se infiere una localización intraperitoneal, mientras que los tumores retroperitoneales no suelen desplazarse y ocupan, por lo general, las fosas renales. No deben olvidarse los principios de la clínica en la revisión diaria de los pacientes. En este caso, con una exploración física adecuada se habría identificado un tumor abdominal y se habrían indicado estudios de imagen de manera temprana, y estudios de extensión para brindar un tratamiento oportuno.
Existen muchas causas de ascitis entre las cuales deben abordarse las de origen hepático, biliar, cardiaco, renal o urinario, gastrointestinal, pancreático, ginecológico, infeccioso, e incluso cromosómico.
En el abordaje del estudio del líquido peritoneal, no se especificó la cuenta celular de proteínas. Se informó un valor anormal de antígeno carcinoembrionario, aunque este resultado es inespecífico por la variedad de diagnósticos que pueden originar este valor.
En el HIMFG se realizó un estudio de tomografía que evidenció un tumor intra-abdominal que invadía el retroperitoneo, localizado en la cabeza y el cuerpo del páncreas, de características heterogéneas, bordes irregulares y con extensión local al antro gástrico. Desde el primer estudio de imagen se evidenció enfermedad metastásica, con la presencia de nódulos en hígado, pleura y pulmones, así como líquido de ascitis.
Se considera que la conducta quirúrgica inicial fue la adecuada, mediante laparotomía exploratoria y toma de biopsias para estadificación. En los hallazgos operatorios se corroboró carcinomatosis peritoneal.
Se debe recordar que los marcadores tumorales son marcadores biológicos, usualmente proteínas asociadas con procesos malignos. Estos pueden determinarse directamente del tumor, de sangre periférica, de ganglios linfáticos, médula ósea, líquido cefalorraquídeo, orina, e incluso heces. La alfa-fetoproteína se sintetiza en el saco vitelino en el feto, en el hígado en edades tempranas y en el tracto gastrointestinal. La cifra disminuye hasta ser menor de 10 ng/ml a los 9 meses de vida. Los niveles se elevan en tumores de células germinales, hepatoblastomas y en algunos hepatocarcinomas. La gonadotrofina coriónica humana se libera en el sincitiotrofoblasto y su rango normal usualmente debe ser menor a 1 ng/ml. De igual modo, se eleva en neoplasias de origen germinal. Finalmente, el antígeno carcinoembrionario es una glucoproteína oncofetal normalmente expresada por células mucosas, y elevada en adenocarcinomas; a pesar de ello, no ha demostrado su utilidad en la población pediátrica y suele ser específica para carcinomas colorrectales.
Idealmente, dentro del abordaje de esta paciente, debió haberse solicitado la determinación del antígeno CA19-9, si la sospecha diagnóstica era pancreática primaria, ya que por lo general este se encuentra muy elevado.
El reporte histopatológico describió adenocarcinoma con diferenciación neuroendocrina. La carcinomatosis peritoneal por tumores neuroendocrinos gastroenteropancreáticos es muy rara, y en la actualidad no existen datos suficientes sobre su prevalencia y tratamiento. Hasta el 80% de los pacientes que son diagnosticados, al inicio ya presentan carcinomatosis peritoneal sincrónica y metástasis hepáticas. En el mundo solamente han sido reportados, en total, 47 pacientes con carcinomatosis peritoneal por tumores neuroendocrinos, todos ellos adultos, la mayor parte de origen en intestino medio.
El abordaje diagnóstico fue adecuado y bien planeado, inicialmente con estudio de imagen, líquido peritoneal y extensión mediante endoscopia y gammagrama con receptores de somatostatina que identificó involucro al antro gástrico, mesenterio y mediastinal.
De acuerdo con los hallazgos operatorios, la estadificación la ubicó en una etapa 4 de Gilly, la más avanzada ante la presencia de masas difusas mayores a 2cm de diámetro. El índice de carcinomatosis peritoneal determina el involucro de la cavidad abdominal por implantes peritoneales: con un puntaje mayor a 20 se considera enfermedad avanzada e irresecable; en este caso particular, el puntaje se aproximaba a tal cifra.
El estudio endoscópico evidenció compresión gástrica extrínseca, sin infiltración de células neoplásicas a la mucosa gástrica. En cuanto al tratamiento quirúrgico, debe estar enfocado en disminuir las comorbilidades secundarias a la obstrucción intestinal.
Lo indicado por consensos internacionales, y lo que debió de haberse ofrecido en este caso, son dos ciclos de quimioterapia, es decir, durante 6 semanas. Posteriormente, dar tratamiento quirúrgico radical mediante pancreato-duodenoctomía tipo Whipple extendida con antrectomía y cirugía desmasificadora, con la intención de resecar todos los implantes peritoneales macroscópicamente visibles. En este tiempo quirúrgico debe administrarse quimioterapia intraperitoneal, que puede ser en dos modalidades, local o intraperitoneal hipertérmica. De acuerdo con el criterio quirúrgico, debe realizarse resección en cuña no anatómica de nódulos hepáticos y toracotomía con metastasectomía en un solo tiempo o diferido para un segundo tiempo quirúrgico. A pesar del tratamiento quirúrgico radical combinado con el médico, el pronóstico de supervivencia apenas alcanza el 30%.
Por síndrome carcinoide se deben considerar e integrar los siguientes síntomas: dolor abdominal crónico, eritema facial y telangiectasias, diarrea crónica, taquicardia, hipotensión arterial y dificultad respiratoria. La base del tratamiento es médica, como se hizo con la administración de análogos de somatostatina, que puede hacerse parenteral en infusión continua, e incluso local intratumoral. Esta tiene como finalidad la disminución de secreciones gastrointestinales y las producidas por mucosas entéricas biliares o pancreáticas, así como por tumores carcinoides.
Finalmente, el tratamiento médico está dirigido a aliviar síntomas por obstrucción intestinal, e incluye dieta baja en residuo, antiespasmódicos, analgésicos, antiheméticos, anticolinérgicos y análogos de somatostatina. En casos de oclusión franca, se requiere sonda nasogástrica para descompresión mediante succión continua, gastrostomía, e incluso yeyunostomía si lo requiere. El tratamiento oncológico tiene como base la mitomicina C, derivados del platino y 5-FU, aunque la experiencia es muy limitada en pacientes pediátricos.
Después del inicio de la quimioterapia, la evolución fue tórpida, aunque esperada, con neutropenia febril, sepsis grave y choque séptico. A pesar de haber recibido adecuada cobertura antibiótica, no presentó mejoría.
Los diagnósticos finales y la causa de muerte son los siguientes:
- •
Carcinomatosis peritoneal secundaria a adenocarcinoma gastroenteropancreático neuroendocrino
- •
Metastásis a hígado, pleura y pulmón
- •
Choque séptico
- •
Disfunción orgánica múltiple secundaria.
El primer contacto que se tuvo con la paciente fue a través de una muestra de líquido de ascitis y dos biopsias, una hepática y una de epiplón. En el líquido de ascitis se observó fondo hemorrágico con células inflamatorias y pequeños grupos de células epiteliales con citoplasma abundante y un nucléolo aparente.
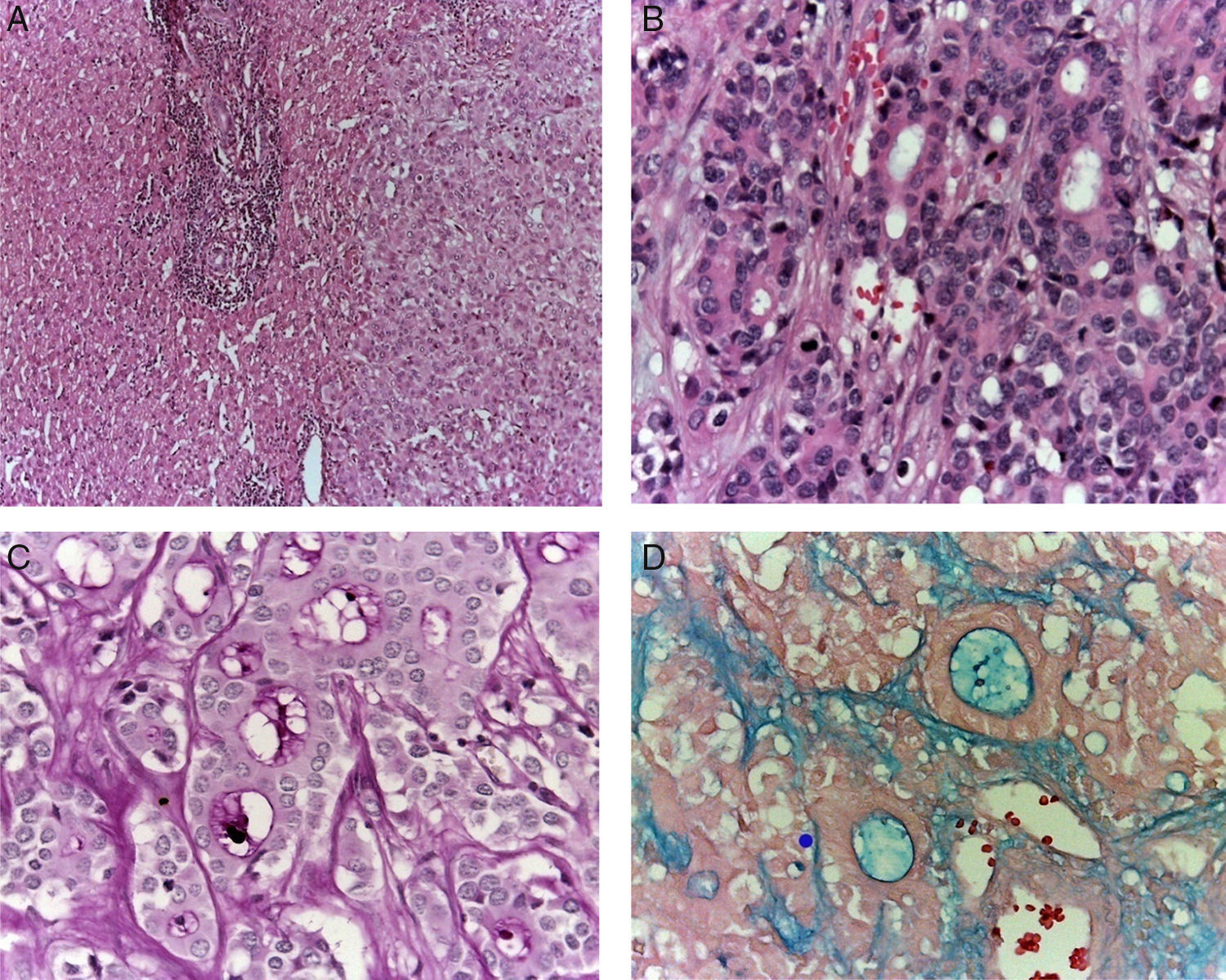
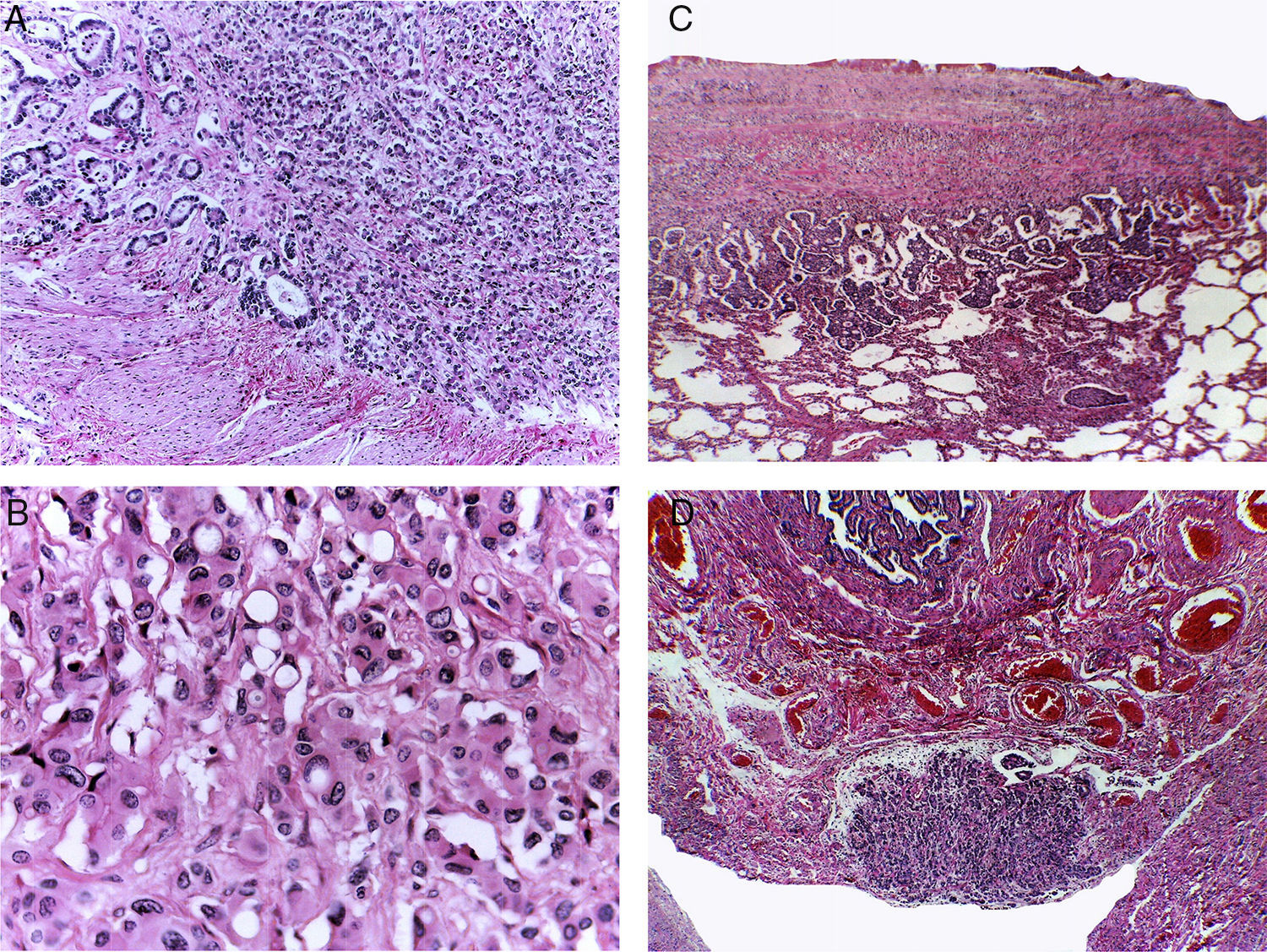
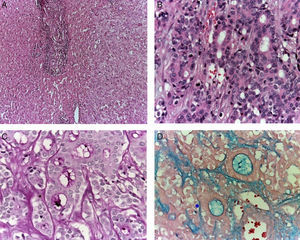
La biopsia de hígado mostró parénquima no neoplásico, un espacio porta con infiltrado inflamatorio moderado que afectaba los sinusoides y una neoplasia de aspecto epitelial. El tumor presentaba dos patrones morfológicos: uno, formando estructuras glandulares de diverso tamaño que producían material basófilo, y otra área constituida por células monótonas que formaban nidos, diferentes a las células que forman las estructuras glandulares (Figuras 3A y 3B). Se realizaron tinciones e inmunohistoquímica para determinar el origen de esta neoplasia. Con la tinción de PAS (ácido peryódico de Schiff) se observó que el producto de las glándulas era positivo (fig. 3C), conservó las características tintoriales después de la diastasa y dio positivo para el azul alcián, lo que se traduce como la presencia de mucosustancias ácidas (fig. 3D). Con la tinción de hematoxilina y eosina y las tinciones especiales se propuso que el origen del tumor podría ser de páncreas, estómago o colon.
La biopsia hepática muestra una neoplasia con dos patrones histológicos. A. En el primero, la morfología muestra nidos de células monótonas. B. En el segundo, se presenta formación de estructuras glandulares, revelando un origen epitelial. Las tinciones de PAS (C) y azul alcián (D) muestran la presencia de mucosustancias ácidas.
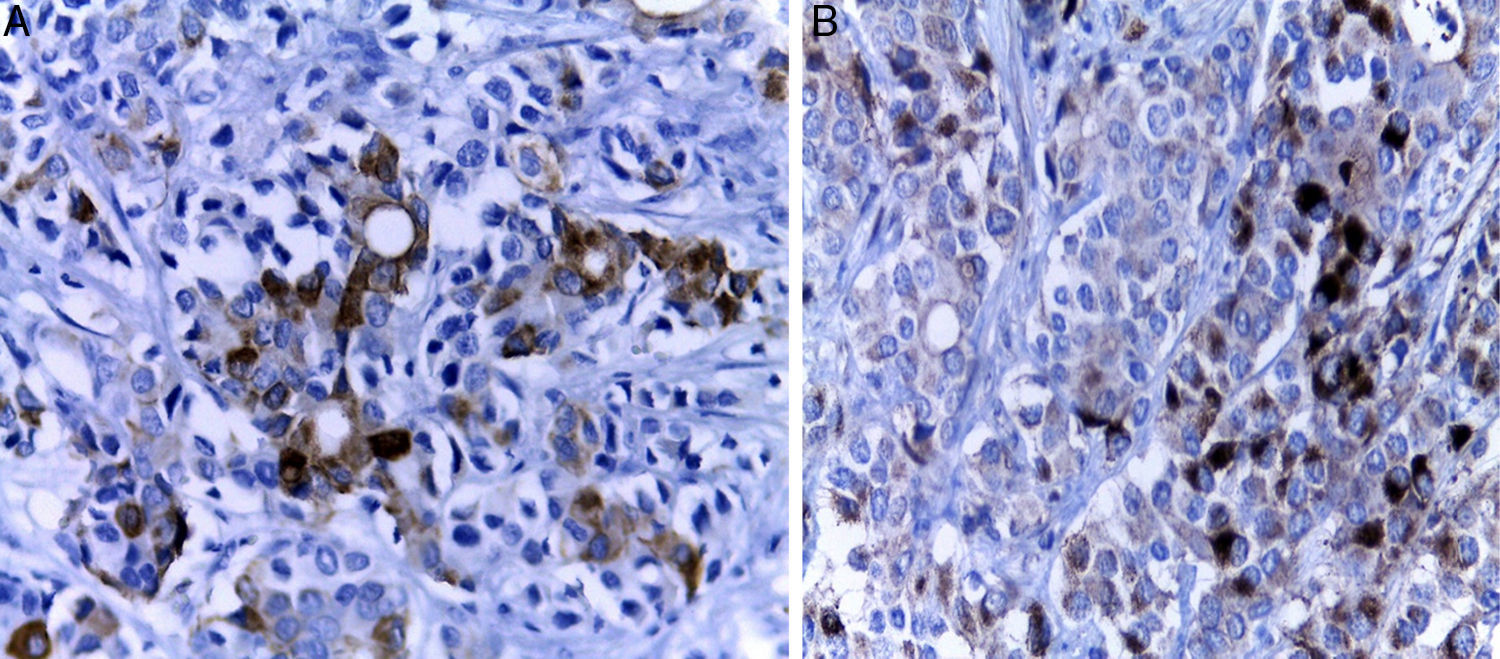
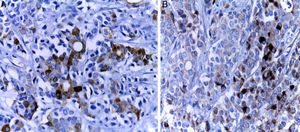
Posteriormente se realizó la inmunohistoquímica. En el panel de marcadores epiteliales se observaron los antígenos carcinoembrionario, de membrana epitelial y citoqueratina positivos en las estructuras glandulares (fig. 4A), y negativos donde el tumor tiene patrón neuroendocrino (fig. 4B). Dos de los anticuerpos más importantes son la citoqueratina 7 y la beta catenina, que resultan positivos en los tumores primarios de estómago y negativos en las neoplasias primarias del colon. El carcinoma de colon es positivo para citoqueratina 20 pero negativo para citoqueratina 7. La citoqueratina 20 fue negativa; con estos resultados se puede descartar el colon como órgano primario. Además, la citoqueratina 7 es muy poco frecuente en los tumores del páncreas. Los marcadores neuroendocrinos, cromogranina, sinaptofisina y somatostatina, fueron positivos en las zonas de aspecto neuroendocrino y negativos en la zona de aspecto epitelial con formación de glándulas (tabla 1).
Perfil de inmunohistoquímica
| Anticuerpo | Resultado |
|---|---|
| CK 20 | Negativo |
| CK A1/A3 | Positivo |
| EMA | Positivo |
| Cromogranina | Positivo |
| Somatostatina | Positivo |
| Insulina | Negativo |
| CK 7 | Positivo |
| ACE | Positivo |
| CD 56 | Positivo |
| Beta catenina | Positivo |
| Sinaptofisina | Positivo |
| Glucagon | Negativo |
DX: Adenocarcinoma con diferenciación neuroendocrina.
CK: citoqueratina; EMA: anticuerpo antiendomisio; ACE: antígeno carcinoembrionario.
Este perfil de inmunohistoquímica sugiere como sitio primario páncreas, estómago y ovario.
El líquido de ascitis fue positivo para células neoplásicas. Posteriormente, se recibieron las biopsias de estómago y esófago, que fueron negativas para células neoplásicas.
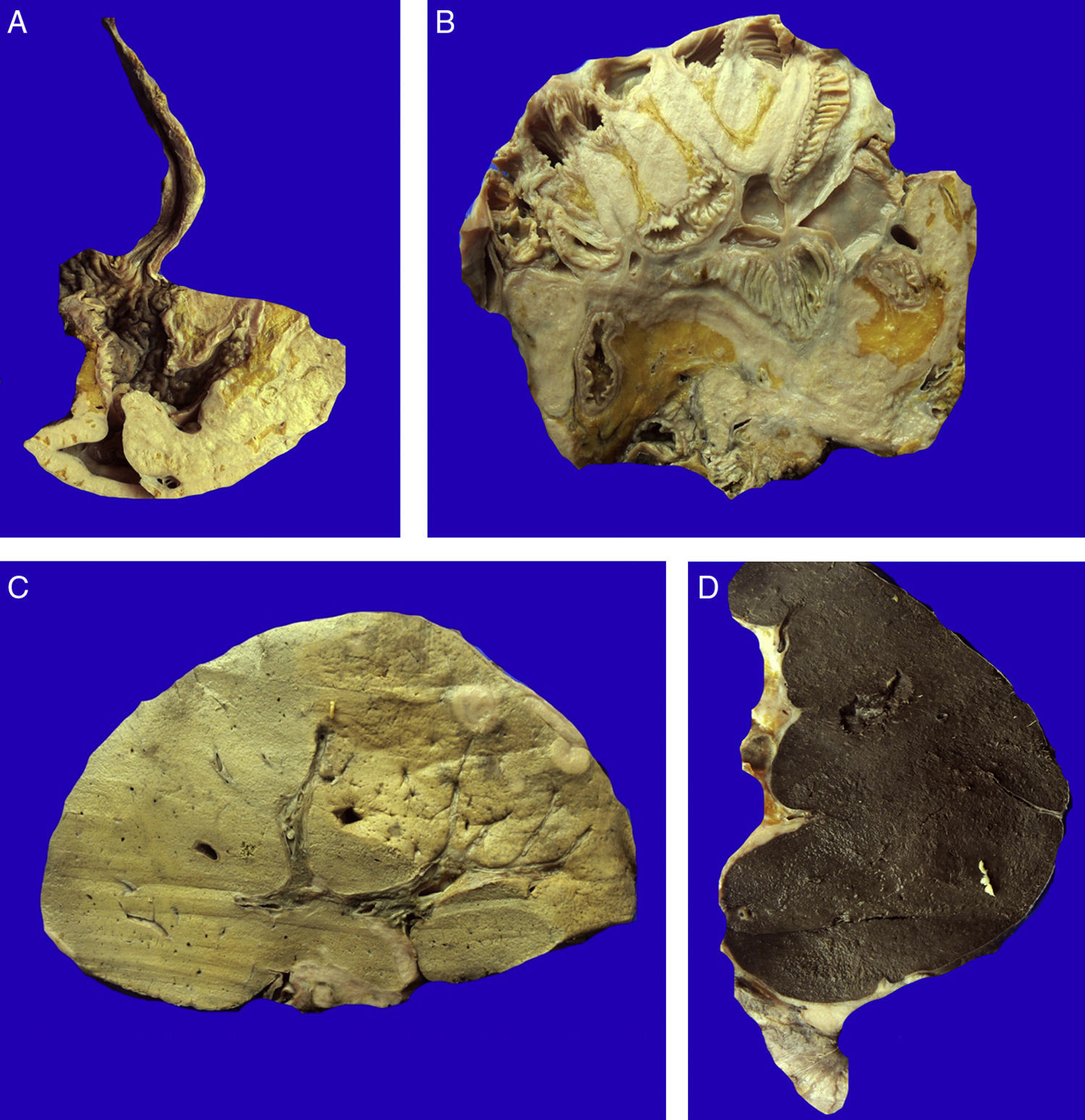
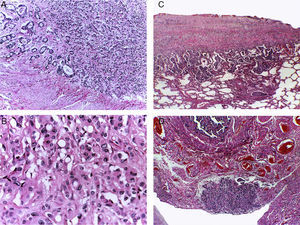
En la autopsia se comprobó que la neoplasia era un carcinoma gástrico del tipo linitis plástica. Este tumor infiltra la pared gástrica y aumenta su grosor, pero respeta las mucosas, lo que explica el aspecto endoscópico de compresión extrínseca sin que se observe un tumor (fig. 5A). Este tumor se extendió a través de las serosas y afectó la cabeza del páncreas.
A. El carcinoma gástrico tipo linitis plástica se diseminó a través de la pared, respetando la mucosa. B. La extensa diseminación linfática y a través de las serosas dio origen a carcinomatosis peritoneal. Las asas intestinales están inmersas en la neoplasia. C. La diseminación hematógena provocó metástasis hepáticas múltiples. D. La neoplasia infiltró la cápsula esplénica, que se ve engrosada, de color amarillo blanquecino, y los ganglios linfáticos.
En la neoplasia del estómago se observaban los dos componentes: el componente glandular y el componente neuroendocrino.
El carcinoma gástrico es una neoplasia muy poco frecuente antes de los 20 años. Representa aproximadamente el 1% de todos los tumores gástricos; los más frecuentes son linfomas y sarcomas.
Otra clave es la presencia de las células llamadas en anillo de sello, donde se observa el citoplasma con una vacuola que rechaza el núcleo y que le da el aspecto de un anillo. Varias de estas células se encuentran a lo largo de toda la neoplasia. Se han descrito carcinomas en anillo de sello en el páncreas, pero no poseen este aspecto.
La neoplasia se extendió prácticamente a todas las serosas, afectó el tejido adiposo que rodea el estómago, y produjo carcinomatosis peritoneal. Hay compresión absoluta de las asas intestinales por la neoplasia (fig. 5B). El tumor presentó diseminación extensa que prácticamente ocluyó todo el abdomen, por lo cual no fue posible resecar ningún segmento.
En el páncreas hay infiltración hacia la cabeza. En el conducto de Wirsung, cuerpo y cola del páncreas no se identificaron alteraciones. En el duodeno y la zona donde desemboca el conducto pancreático tampoco se observaron células neoplásicas.
El hígado mostró metástasis (fig. 5C). El bazo también presentó una infiltración extensa de la cápsula, sin afectar el parénquima (fig. 5D). Ambos riñones se encontraron aumentados de tamaño y de peso.
En los pulmones hay diseminación linfática extensa que afectó la pleura provocando, en algunas zonas, una reacción desmoplásica e invasión focal al parénquima (fig. 6). Los pulmones mostraron zonas de hemorragia y proliferación bacteriana.
A. La pared gástrica esta infiltrada por una neoplasia poco diferenciada. B. La producción de mucosustancias es intracelular, lo que origina las células llamadas en anillo de sello. La diseminación tumoral fue extensa linfática y hematógena. C. La pleura está afectada y focalmente el parénquima pulmonar. D. Los tejidos blandos pélvicos muestran infiltración por la neoplasia; se observa la serosa de una salpinge.
En el útero, salpinges, ovarios, vejiga y los tejidos blandos que rodean el útero hay carcinomatosis. Histológicamente, el útero, la vejiga, las salpinges (fig. 6D) y los ovarios se encuentran infiltrados por la neoplasia.
La médula ósea es acelular, con muy escasos linfocitos y eritrocitos, lo que explica la proliferación bacteriana tan extensa, sin respuesta inflamatoria.
La enfermedad principal fue adenocarcinoma gástrico con células en anillo de sello y diferenciación endocrina.
Los carcinomas gástricos son poco frecuentes en pacientes jóvenes; cuando se presentan con células en anillo de sello, aproximadamente el 25% muestra una diferenciación endocrina, con diseminación extensa a través de las serosas y de los vasos linfáticos a peritoneo, mesenterio, serosas, intestino delgado, colon, recto, útero, páncreas, pulmones, ovarios, y prácticamente a todas las cadenas ganglionares.
Los carcinomas con células en anillo de sello presentan una supervivencia menor a un año, según datos publicados de series en adultos. Son tumores que evolucionan rápidamente. La experiencia en niños es escasa. En el HIMFG, en los últimos 10 años, se han atendido 3 casos de carcinoma gástrico, incluyendo el presente caso.
4.1Diagnósticos finalesAdenocarcinoma gástrico con células en anillo de sello, con diferenciación endocrina y diseminación linfática y hematógena extensa a peritoneo parietal, mesenterio, serosa de intestino delgado, colon, recto, útero, páncreas, pulmones, ovarios, peritubárica, y a cadenas ganglionares mediastinales, mesentéricas, periaórticas, peripancreáticas.
4.2Alteraciones concomitantes- •
Ascitis maligna (500ml)
- •
Red venosa colateral en pared abdominal
- •
Líquido en cavidad pleural izquierda (500ml, serohemático)
- •
Estado post laparatomía con toma de biopsia hepática en cuña y omentectomía parcial
- •
Estado post endoscopia gastritis crónica superficial
- •
Estado post colocación de catéter venoso central subclavio
- •
Estado post colocación de catéter epidural
- •
Edema cerebral (PO 1150g/ PE 1296g)
- •
Hepatomegalia (PO 2600g/ PE 1050g)
- •
Esplenomegalia (PO 400g/ PE 129g)
- •
Nefromegalia bilateral (RD PO 300g/ PE 101g; RI PO 200g/ PE 108g)
Los tumores neuroendocrinos son neoplasias poco frecuentes en edad pediátrica, por lo que se solicitó la opinión de varios especialistas para tener un panorama completo de cómo se abordan estos casos, que presentan manifestaciones diversas, además de que es importante detectarlos oportunamente.
La frecuencia de estos tumores en niños y adolescentes es muy baja; en pacientes adultos, la incidencia es de 2 a 5 casos por 100 000 habitantes por año, habitualmente esporádicos. Algunos se han relacionado con síndromes hereditarios, como neoplasia endocrina simple tipo 1 y 2, síndrome de Von Hippel-Lindau y neurofibromatosis tipo 1.
Esta gran variedad de neoplasias incluye los tumores neuroendocrinos gastroenteropancreáticos, tumores neuroendocrinos sin primario conocido, tumores que producen catecolaminas, tumores neuro-adenohipofisiarios, carcinoma medular de tiroides, carcinoma neuroendocrino y tumor neuroendocrino pulmonar. Dentro de estos, los más comunes son los tumores neuroendocrinos gastroenteropancreáticos, que se dividen en funcionantes y no funcionantes. La sintomatología varía de acuerdo con el tipo de sustancias que se liberan a la circulación, el sitio donde se localiza el tumor y el tamaño del mismo. La mayoría de estos tumores son no funcionantes y la sintomatología que presentan los pacientes es poco específica. Los síntomas más comunes son la presencia de dolor abdominal, que suele ser intermitente, un periodo de evolución muy largo, y se puede añadir la presencia de vómito, náuseas y anemia debida a sangrados en el tubo digestivo1–3. El dolor abdominal puede estar relacionado con la invasión del tumor, obstrucción intestinal o isquemia del mesenterio. Debido a que los síntomas son poco específicos, la sintomatología florida en el caso de los tumores no funcionantes se presenta cuando estos ya ejercen un efecto de tumor sobre alguno de los órganos donde se encuentran localizados, o bien cuando presentan metástasis a hígado. Debido a la poca especificidad, la detección de los mismos es tardía, y en muchas ocasiones se realiza durante alguna exploración quirúrgica o durante la evaluación de un estudio radiológico. En aproximadamente el 20% de los casos de tumores neuroendocrinos se presenta una entidad clínica que se denomina síndrome carcinoide, caracterizado por enrojecimiento facial, del cuello o de la parte superior del tórax, en ausencia de sudoración, y se acompaña de taquicardia, diarrea, rinorrea y lagrimeo.
En el caso de los tumores funcionantes, la sintomatología depende de la sustancia que liberen los mismos. Por ejemplo, en el caso de los insulinomas, los pacientes presentan diaforesis, fatiga y pérdida de la conciencia, habitualmente después de la alimentación. En gastrinomas suelen observarse pacientes con úlceras pépticas y diarrea. Los pacientes con glucagonoma presentan pérdida de peso, diarrea y diabetes. Con somatostinomas, la sintomatología es similar: pérdida de peso, diabetes, colelitiasis, dolor abdominal, diarrea. En los vipomas, los pacientes presentan diarrea acuosa e hipocalemia4–8.
5.2Servicio de Hemato-OncologíaEn este tipo de tumores se da un esquema de quimioterapia en dos ciclos, con la intención de limitar el tumor, disminuir la carga tumoral, la carcinomatosis y tratar de eliminar las lesiones metastásicas. Posteriormente, se aborda quirúrgicamente. Si el diagnóstico no está corroborado, se puede dar tratamiento con un esquema que incluya platino, 5-FU y un antracíclico; este esquema es útil para los carcinomas que se presentan en la edad adulta y en la edad pediátrica.
Por otra parte, el concepto de dar cuidados paliativos comprende la atención de las necesidades del paciente. En este caso, la paciente requería de tratamiento con quimioterapia, con la intención disminuir del tamaño del tumor.
5.3Servicio de Cirugía OncológicaEn poco más de 15 años, este es el tercer caso de carcinoma gástrico que se observa en el HIMFG. En contraste con el presente caso, los otros dos no presentaban esta diferenciación neuroendocrina. En la paciente referida se inició el abordaje diagnóstico con una laparoscopia que se convirtió en una laparotomía, limitada para obtener el tejido para el estudio histopatológico. En la segunda tomografía aparentemente se observó cierto grado de respuesta a la quimioterapia, con disminución de algunos volúmenes y disminución de la cantidad de ascitis. El tratamiento planeado incluía un segundo periodo de quimioterapia, y posteriormente el intento de resecar el primario con cirugía citoreductiva o desmasificadora de la enfermedad peritoneal, de acuerdo con las recomendaciones de la Sociedad Europea de Tumores Neuroendocrinos. En este caso, la paciente no era candidata a resección del tumor primario por la infiltración del mesenterio y del resto de las superficies peritoneales.
Si la paciente hubiera respondido mejor, se podría haber hecho una cirugía resectiva, además de la cirugía citoreductiva, y utilizar la quimioterapia intraperitoneal hipertérmica en el mismo evento quirúrgico.
Se han tenido algunas experiencias con la quimioterapia intraperitoneal hipertérmica en otro tipo de tumores, y en algunos casos se ha logrado extender la supervivencia a pesar de la enfermedad difusa.
Este caso en particular resultaba ya un caso muy avanzado. Apoyados en los hallazgos de autopsia, no era resecable.
5.4Servicio de Medicina Nuclear MolecularEl estudio con SPECT (Single Photon Emission Computed Tomography), un análogo de somatostatina resultó intensamente positivo. A partir de ahí se podría proponer una opción de tratamiento con octreotide, y la posibilidad de hacer seguimiento con ese mismo estudio para su evolución y respuesta al tratamiento.
Es importante que se mencione que en el país se cuenta con la posibilidad de hacer estudios de PET-CT (tomógrafo de emisión de positrones), con 68Ga-dotatate y 68Ga-dotatoc, que es más específico y más sensible. En el Instituto Nacional de Cancerología se está haciendo tratamiento con los mismos análogos, con Lutecio 77, al parecer con buen resultado.
5.5Servicio de Cirugía OncológicaEn el momento de la revisión abdominal, durante la laparotomía, el cirujano puede determinar si es posible llevar a cabo un procedimiento quirúrgico o solo tomar una biopsia o decidir no practicar algún procedimiento, aunque no siempre es posible. Si hay una reacción peritoneal exuberante, los tejidos se inflaman y puede ser muy difícil decidir si el tejido es tumoral o se trata solamente de una reacción peritoneal. La prioridad es no lesionar estructuras importantes, provocar perforaciones o accidentes. Finalmente, el diagnóstico definitivo se realiza con el estudio histopatológico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses de ningún tipo.