El reloj circadiano controla los ciclos de sueño/vigilia y también una serie de procesos metabólicos que incluyen la ingesta, el almacenamiento y la utilización de energía. El aumento de la prevalencia de diabetes tipo2 se ha convertido en uno de los principales problemas de salud pública a nivel internacional. En vista de la pesada carga social causada por la diabetes, es esencial comprender las causas de esta enfermedad y elaborar estrategias más eficaces para su tratamiento. La correlación entre el aumento de diabetes tipo2 y el estilo de vida de la sociedad moderna, caracterizado por la modificación de los patrones de sueño, trabajos por turnos, como también por la exposición a la luz artificial durante las horas de noche, ha llevado a la hipótesis de que la alteración del reloj circadiano puede estar implicada en la etiología de la diabetes tipo2. En este sentido, estudios recientes han propuesto que la corrección de las alteraciones del reloj podría tener un efecto beneficioso en la homeostasis de la glucosa, y de aquí que la cronoterapia, sin intervención farmacéutica, se presente como una opción para tratar pacientes con diabetes tipo2.
The circadian clock controls the sleep-awake cycles, as well as a series of metabolic processes that include the ingestion, storage and use of energy. The increase in the prevalence of type2 diabetes has become one of the major public health problems at international level. Due to the heavy social burden caused by diabetes, it essential to understand the causes of this disease and develop more effective strategies for its treatment. The correlation between type2 diabetes and the lifestyle of modern society, characterised by the changes in sleep patterns, shift work, as well as due to the exposure to artificial light during night time hours, has led to the hypothesis that changes in the circadian clock may be involved in the aetiology of type2 diabetes. In this sense, recent studies have proposed that the correction of clock changes could have a beneficial effect on glucose homeostasis and, from this that chronotherapy, without pharmaceutical intervention, presents as an option for treating patients with type2 diabetes.
La diabetes tipo2 se ha convertido en uno de los más importantes problemas de salud de la sociedad moderna. La obesidad y el aumento excesivo de peso juegan un papel importante en la aparición de la diabetes, junto con otros factores de riesgo, incluyendo la genética y la falta de actividad física. En los últimos años, cambios en el reloj biológico también han sido identificados como contribuyentes a esta enfermedad metabólica. Así, alteraciones en el ritmo circadiano derivados de nuestro estilo de vida actual, incluyendo trabajo por turnos, o las comidas en horarios nocturnos, se han relacionado con diabetes tipo2, obesidad y síndrome metabólico1-4. En el caso de la diabetes tipo2, su asociación con las alteraciones circadianas originalmente estaba relacionada con una alteración de la función del reloj central situado en el hipotálamo. Sin embargo, descubrimientos recientes demuestran que los relojes moleculares periféricos existentes en varios órganos, como el hígado, el músculo, el tejido adiposo, y concretamente en el páncreas, juegan un papel importante en la diabetes5-11. Así, el estudio de la biología del reloj pancreático y de los otros relojes periféricos es importante no solo para entender los ritmos circadianos y su relación con el metabolismo, sino también con el objetivo de desarrollar herramientas para la prevención y el tratamiento de enfermedades metabólicas como la diabetes tipo2.
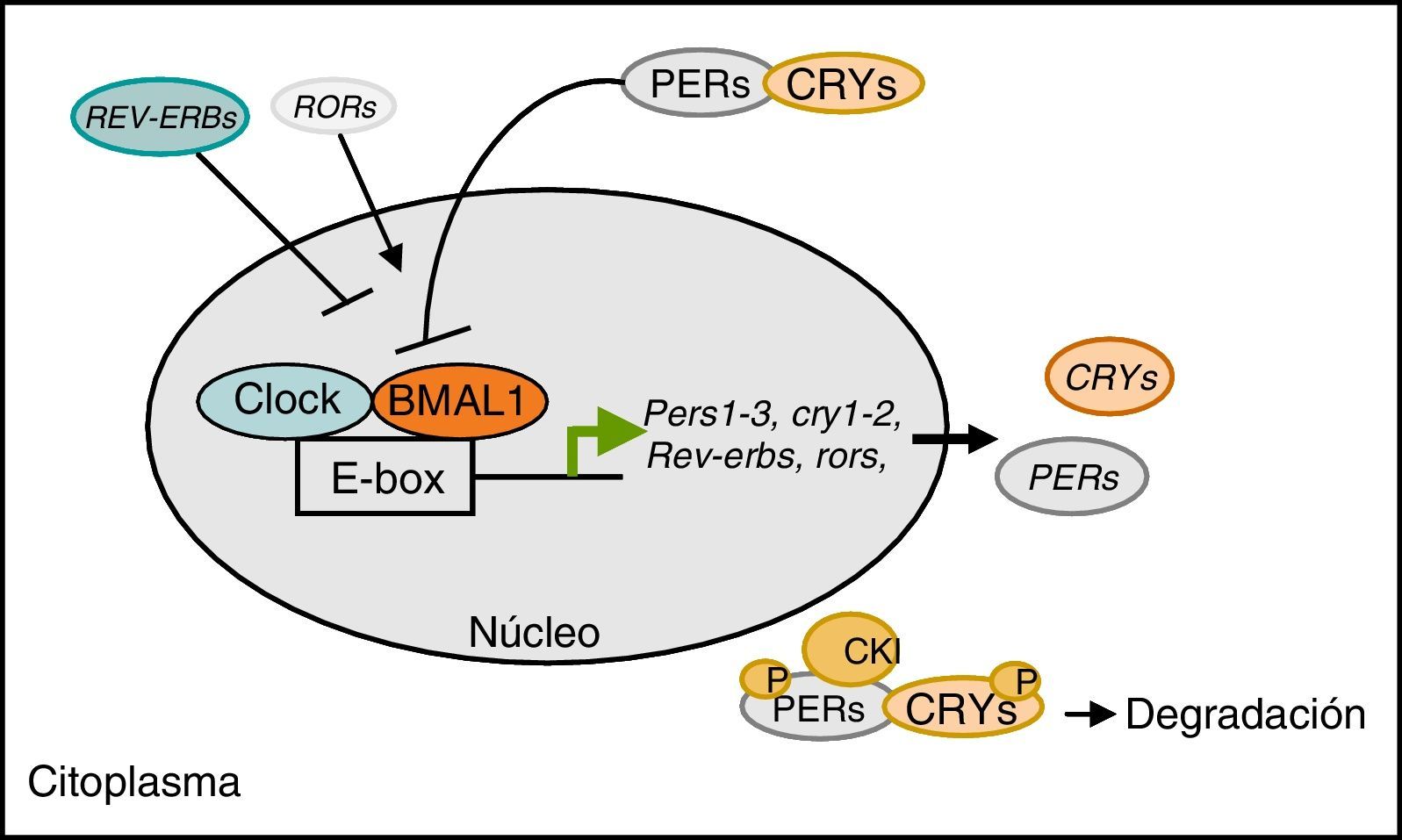
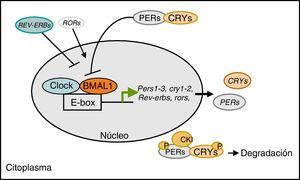
Regulación del reloj biológico a nivel molecularEl reloj biológico central de los mamíferos está localizado en el núcleo supraquiasmático del hipotálamo, y su mecanismo de control es a través de una retroalimentación transcripcional/traslacional que involucra a un conjunto de genes llamados genes reloj (fig. 1). A nivel molecular existen 2 factores de trascripción, conocidos como CLOCK (circadian locomotor output cycles caput) y BMAL1 (brain and muscle ARNT-like protein1), los cuales forman el heterodímero CLOCK/BMAL1 que regula la expresión de varios genes reloj.
Regulación del reloj biológico a nivel molecular. El heterodímero CLOCK/BMAL1 regula la expresión de los genes reloj Pers, Crys, Rev-erbs, Rors. Las proteínas PER y CRY interaccionan con el complejo CLOCK/BMAL1 disminuyendo su propia expresión. CLOCK/BMAL1 activa la transcripción de Rev-Erbs y Rors que activan o inhiben la expresión de Bmal1, respectivamente.
Los genes regulados en su promotor por el heterodímero CLOCK/BMAL1 son principalmente Per1 (period1), Per2 (period2), Per3 (period3), Cry1 (cryptochrome1), Cry2 (cryptochrome2), Rev-erb alpha (reverse erythroblastosis virus alpha), Ror alpha (retinoid-related orphan receptor-alpha). CLOCK/BMAL1 activan la transcripción de los PER y los CRY. Las proteínas PER y CRY forman heterodímeros que se transportan hasta el núcleo para interaccionar con el complejo CLOCK/BMAL1 disminuyendo su propia expresión a modo de retroalimentación negativa. Las proteínas PER y CRY también son reguladas mediante su degradación en el citoplasma bajo el control de la fosforilación de la proteína caseína kinasa1 y así terminando el ciclo de señalización circadiano. Por otro lado, el heterodímero CLOCK/BMAL1 también activa la transcripción de Rev-Erb alpha y Ror alpha, que participan en la regulación de la expresión de Bmal1 inhibiendo o activando su transcripción, respectivamente12. Esta regulación tiene que ser muy efectiva para generar los ciclos de 24h de expresión génica y actividades del metabolismo celular.
Relación entre genes reloj, metabolismo y enfermedades metabólicasLa primera evidencia genética entre ritmos circadianos y metabolismo fue descubierta en ratones portadores de la mutación de ClockΔ19/Δ197,13. Estos ratones exhiben unos ritmos de alimentación atenuados, así como hiperfagia, hiperlipidemia, hiperleptinemia, esteatosis hepática, hiperglucemia e hipoinsulinemia. La alteración observada en la homeostasis glucídica de los ratones ClockΔ19/Δ19 se caracteriza por una alteración en la secreción de insulina y en la proliferación de los islotes pancreáticos7.
La relación entre los genes clock y el control del metabolismo también se ha encontrado al estudiar ratones mutantes en el gen Bmal1. Estos trabajos revelaron que en dichos ratones, además de presentar un comportamiento arrítmico, la pérdida de BMAL1 causaba alteraciones en la adipogénesis, la diferenciación del adipocito y metabolismo hepático14-16. Nuestro grupo demostró que la falta de otro gen reloj, llamado Rev-erb alpha, lleva a una menor secreción de insulina y de glucagón, las principales hormonas involucradas el desarrollo de la diabetes9,10. Además, hemos mostrado que las dietas ricas en grasas también pueden alterar la expresión de los genes reloj. De hecho, ratones alimentados con dieta rica en grasa durante 6 semanas mostraban una alteración de la expresión de los genes reloj en los islotes pancreáticos. Dichos cambios podrían estar involucrados en los defectos observados en la función de las células beta en modelos animales de obesidad y diabetes tipo29.
En los seres humanos, los estudios genéticos también han mostrado un vínculo entre los genes reloj, la obesidad y la diabetes tipo2. Por ejemplo, las variantes genéticas de CLOCK se han asociado con mayor susceptibilidad a la ingesta energética total, obesidad y síndrome metabólico17,18. Variantes genéticas de BMAL1 han sido correlacionadas con la susceptibilidad a la hipertensión y a la diabetes tipo219, mientras que los polimorfismos del gen PER2 han sido asociados con altos niveles de glucosa en sangre en ayunas y obesidad abdominal20,21. Variantes de cry2 han sido relacionadas con diabetes tipo2 y con la alteración de la glucemia en ayunas22. Del mismo modo, polimorfismos en los receptores de melatonina, que desempeñan un papel fundamental en la modulación de los ritmos circadianos, también han sido asociados con un deterioro de la secreción de insulina, resistencia a la insulina, diabetes gestacional y diabetes tipo223-25.
Estudios sobre las variaciones genéticas del gen REV-ERB ALFA en personas obesas han demostrado que un polimorfismo en este gen modula la masa grasa corporal en personas tanto jóvenes como adultas26. Otro polimorfismo en el gen REV-ERB ALFA fue asociado con la obesidad en 2 cohortes de población: una mediterránea y la otra de América del Norte27. Más recientemente, nuestro grupo identificó el SNP rs939347 situado en la región promotora del gen REV-ERB ALFA; este polimorfismo se asoció con la obesidad en la población masculina española, lo que indica un papel específico del género en la variación genética de REV-ERB ALFA en el desarrollo de la obesidad28. En tejido adiposo visceral de sujetos obesos mórbidos hemos demostrado que el patrón circadiano de expresión de los genes reloj CRY2 y REV-ERB ALFA está alterado en comparación con sujetos delgados. Así mismo, identificamos el gen REV-ERB ALFA como uno de los genes reloj más importantes asociados con el síndrome metabólico. Estos resultados demuestran el papel desempeñado por REV-ERB ALFA en la obesidad humana. Así, varias observaciones genéticas en seres humanos indican la existencia de una estrecha relación entre disfunción de los genes reloj y condiciones patológicas tales como el síndrome metabólico, la obesidad y la diabetes tipo2.
ConclusionesLa prevalencia y el creciente aumento de la incidencia de la diabetes y sus complicaciones han generado gran interés en diseccionar los mecanismos que regulan el metabolismo de la glucosa y la secreción de insulina. La interacción entre el reloj biológico y los sistemas metabólicos es compleja e involucra el sistema nervioso y los tejidos periféricos para la correcta coordinación de los sistemas metabólicos y de comportamiento.
Así, las conclusiones obtenidas de los distintos estudios científicos realizados hasta la actualidad indican que el funcionamiento correcto de relojes centrales y periféricos es crucial para el bienestar del organismo. La interrupción de los ritmos circadianos se ha implicado en la patogenia de varias enfermedades, incluyendo las enfermedades metabólicas. Por lo tanto, un mejor entendimiento de la función del reloj molecular en la regulación de los procesos fisiológicos diarios permitiría el desarrollo de tratamientos terapéuticos más eficientes y mejores estrategias preventivas para el manejo de la diabetes, la obesidad y otros trastornos metabólicos.
Responsabilidades éticasProtección de personas y animalesLa autora declara que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLa autora declara que ha seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLa autora ha obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.
Me gustaría agradecer la concesión de este premio a la Sociedad Española de Diabetes, así como muchos de mis colegas, compañeros y colaboradores a los que debo también mi agradecimiento no solo por su amistad, sino que ellos también participaron en mi formación científica. También quiero agradecer a mi familia, que aun estando lejos, siempre me apoyaron en todas las etapas de mi vida.
Este artículo fue escrito debido a la concesión del premio José Antonio Hedo de 2014 en el área de Investigación Básica Júnior en Diabetes.