Introducción
El accidente cerebrovascular (ACV) es una de las causas principales de mortalidad, hospitalización, incapacidad y, en buena lógica, de sobrecoste sanitario en la mayoría de países desarrollados. En realidad, su impacto social deriva de las secuelas motrices y cognitivas y de la comorbilidad asociada. Pese a que se dispone de estrategias preventivas válidas, su aplicación en la práctica clínica sistemática es muy irregular1,2.
En la actualidad está plenamente demostrado que la diabetes tipo 2 y el síndrome metabólico (SM) aumentan el riesgo cardiovascular, pero no es tan evidente que se produzca un aumento paralelo del riesgo de ACV3. De hecho, en España aún no se ha evaluado en detalle ese riesgo contrastando las diversas fuentes informativas aplicadas al campo concreto de la diabetes, en el contexto del SM o fuera de él. Además de la dificultad que comporta el seguimiento prolongado de una cohorte y el establecimiento de criterios diagnósticos mínimos de un ACV, la ausencia de información se explica por 3 razones fundamentales. En primer lugar, no hay una escala estandarizada para medir el riesgo de ACV. Pese a disponer de modelos matemáticos, el riesgo que confiere la diabetes varía según cuál sea la modalidad lesiva cerebrovascular (infarto lacunar, aterotrombosis, cardioembólica, hemorrágica), lo que dificulta su estimación4. Por otra parte, no suelen aplicarse fórmulas de cálculo provenientes de otras sociedades por su falta de ajuste con el estilo de vida mediterráneo, aunque podrían utilizarse en ausencia de otras fuentes más apropiadas de información. En segundo término, influyen las conjeturas clasificatorias que han propiciado al menos 4 definiciones de SM durante los últimos años5-10. Por último, la confirmación de un ACV, sobre todo si es transitorio o asintomático, es compleja en personas de edad avanzada, y más en el entorno de la atención primaria.
Habitualmente se asume que la diabetes es un factor de riesgo de ACV, pero se desconoce si su integración en el SM amplifica ese riesgo o bien actúa con independencia del síndrome. Con todas las limitaciones mencionadas, el propósito de este primer trabajo es aportar una estimación preliminar del riesgo de ACV global asociado con la diabetes tipo 2, en presencia o ausencia de SM, mediante la escala de Framingham. En segundo término, contrastar los índices de riesgo teórico así obtenidos con la incidencia real de ACV durante 5 años de seguimiento de una cohorte (1998-2003) en atención primaria de salud.
Pacientes y métodos
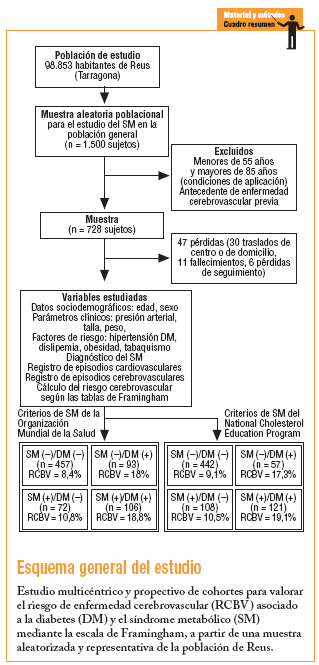
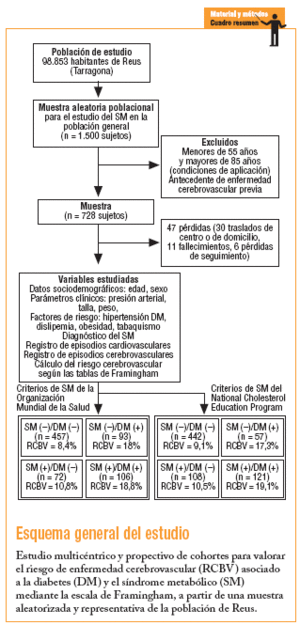
En 1998 se inició un estudio multicéntrico y prospectivo de cohortes en un área urbana con cerca de 100.000 habitantes (censo poblacional superponible a la pirámide de la población general de Cataluña), a partir de una muestra aleatoria y representativa de la población > 14 años. La finalidad fue estimar la prevalencia del SM, el riesgo asociado y la incidencia de ACV investigando los factores más influyentes, susceptibles de prevención. Se estimó que para una prevalencia teórica del 17% de SM, contando con una precisión de ± 2% y un riesgo alfa de 0,05 se precisaba una muestra poblacional aproximada de 1.500 individuos, aceptando un 20% de pérdidas.
El estudio contó con la aprobación ética institucional y el consentimiento informado de los participantes, conocedores de la apertura de una base con sus datos de filiación, examen básico de salud (anamnesia familiar, personal, hábitos tóxicos y antropometría), analíticos en sangre (perfil bioquímico, hematológico y lipídico, prueba de tolerancia oral a la glucosa ante al menos un factor de riesgo para la diabetes, glucohemoglobina A1c e insulinemia basal) y en orina (detección de microalbuminuria y, en su caso, cuantificación en muestra de 24 h), en conexión con la historia clínica informática de atención primaria. La base de datos contiene diagnósticos de los factores de riesgo cardiovascular (hipertensión, diabetes, dislipemia, obesidad), los datos electrocardiográficos más relevantes (fibrilación auricular, hipertrofia ventricular izquierda y cardiopatía isquémica) y un registro asociado de episodios vasculares presentes y futuros así como de los tratamientos recomendados.
Se diagnosticó diabetes, según las últimas recomendaciones del grupo de expertos de la Organización Mundial de la Salud (OMS), a partir de una glucemia basal en sangre venosa >= 7 mmol/l (126 mg/dl) o una glucemia a las 2 h de una sobrecarga oral con 75 g de glucosa >= 11,1 mmol/l (200 mg/dl), y se promovió su confirmación en ausencia de síntomas11. Los criterios seguidos en este estudio para el diagnóstico de SM se esquematizan en la tabla 1, tanto las normas de la OMS5 como del National Cholesterol Education Program de 2001 (NCEP)6.
En cuanto a la definición de diagnósticos, se asumió la presencia de una cardiopatía ante una historia clínica demostrativa de cardiopatía isquémica y/o insuficiencia cardíaca tras valorar los exámenes complementarios disponibles en cada caso (electrocardiograma, prueba de esfuerzo y gammagrafías). Se consideró que había una vasculopatía cerebral ante una historia clínica sugestiva de accidente isquémico transitorio, ACV y/o pruebas de imagen que los evidenciasen. A todos los sujetos sin registro de complicaciones cerebrovasculares se les practicó un examen neurológico básico en un intento de descartar los procesos silentes. En caso de sospecha razonable, se propuso la cumplimentación de un cuestionario (Mini-Mental) y la realización de una prueba de imagen (tomografía computarizada). Se consideró el diagnóstico de vasculopatía periférica ante una ausencia de pulsos periféricos o bien ante su demostración mediante eco-Doppler. La hipertrofia ventricular izquierda se valoró mediante criterios electrocardiográficos convencionales (Sokolow-Lyon y Cornell) y, en caso de disponerse, mediante ecocardiografía.
A efectos de esta evaluación se seleccionó a los sujetos de 55-85 años (margen aplicable para el cálculo del riesgo, según las tablas de Framingham) sin antecedentes previos de ACV. Se usó la escala desarrollada por D'Agostino et al, basada en la referencia de Framingham, revisada recientemente por Straus et al12-14. Esta escala concede especial relevancia a la edad, el sexo y la medida de la presión arterial sistólica (discriminando el consumo de fármacos antihipertensivos). Tras establecer una primera puntuación, ésta se modula y amplifica si concurre alguno de los siguientes factores de riesgo cerebrovascular: tabaquismo activo, diabetes, enfermedad cardiovascular establecida (insuficiencia cardíaca congestiva, infarto de miocardio u otras formas de isquemia coronaria, claudicación intermitente o isquemia arterial periférica), fibrilación auricular e hipertrofia ventricular izquierda. Los baremos posibles de riesgo cerebrovascular a 10 años oscilan entre el 1 y el 80%. Todos los datos sobre riesgo cerebrovascular se trataron de forma automática con un algoritmo informático de cálculo específico para este estudio.
El análisis estadístico se realizó mediante paquetes convencionales (SPSS® versión 11.0), efectuando primero un examen descriptivo. Se llevó a cabo un análisis factorial de los datos por diagnósticos (SM/diabetes * sí/no), para lo que se configuraron 4 grupos que iban desde la ausencia de las 2 condiciones hasta la presencia de ambas, pasando por la presencia de una de las dos. Los parámetros cualitativos se han indicado en el texto como frecuencia y porcentaje entre paréntesis. Para los datos cuantitativos se ha expresado la media aritmética ± desviación estándar (DE). En la estadística inferencial bivariable cualitativa se usó la prueba de la *2. En la cuantitativa se aplicó la prueba de la t de Student o el análisis de varianza, previa comparación con la normal (Kolmogorov-Smirnov). Para estimar el riesgo cerebrovascular de cada grupo se calculó la probabilidad media y su intervalo de confianza (IC) del 95%.
Resultados
En la muestra se incluyó a 728 sujetos, con 412 (56,6%) mujeres. La edad media fue de 66,4 ± 7,3 años, el índice de masa corporal (IMC) de 29,3 ± 4,9 y la presión arterial sistólica (PAS) de 140,1 ± 18,5 mmHg. En 335 casos (46%) medió un tratamiento con fármacos antihipertensivos. Con las normas de la OMS, 199 individuos (27,3%) tenían criterios de SM y 178 (24,4%) de diabetes tipo 2, en 103 casos (57,9%) a partir de la glucemia basal y en 75 (42,1%) a partir de la glucemia a las 2 h de la sobrecarga oral.
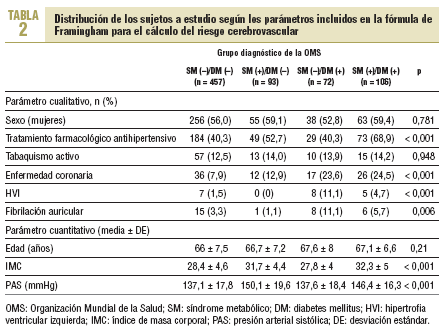
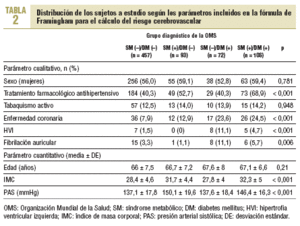
En la muestra, 457 sujetos (62,8%) no tenían diabetes y SM, 93 (12,8%) tenían SM sin diabetes, 72 (9,9%) diabetes sin SM y 106 (14,5%) asociaban ambas entidades (normas de la OMS). Respecto a la clasificación del NCEP, las proporciones fueron: 60,7; 14,8; 7,8 y 16,7%. A título orientativo, en la tabla 2 se detalla la distribución de los sujetos, categorizados según las normas de la OMS (diabetes y SM), en función de los parámetros necesarios para el cálculo del riesgo cerebrovascular. No se detectaron diferencias estadísticamente significativas entre los 4 grupos respecto a la edad, el sexo o el tabaquismo activo, pero sí en el resto de las variables analizadas. Los portadores del SM en ausencia de diabetes también eran comparables con los diabéticos sin SM en cuanto a la edad, el sexo, el tabaquismo y, adicionalmente, el consumo de antihipertensivos y el número de acontecimientos cardiovasculares previos determinado por una mayor proporción de trazados electrocardiográficos de fibrilación auricular (11 frente a 1%) e hipertrofia ventricular (8 frente a 0%). Entre los sujetos con SM pero sin diabetes hubo más obesos (72 frente a 26% con IMC > 30), dislipémicos (55 frente a 17%) e hipertensos (82 frente a 57%), con una cifra de PAS media estadísticamente más elevada.
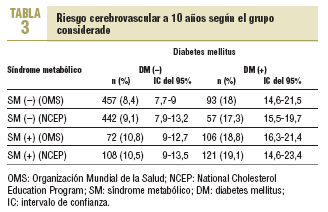
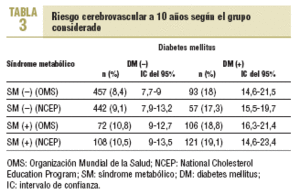
El riesgo cerebrovascular global estimado a 10 años para los individuos de la muestra completa fue 11,2 (10,2%) (IC del 95%, 10,4-11,9). Según los criterios del NCEP, el riesgo cerebrovascular global a 10 años fue 10,2 (9,7%) (IC del 95%, 9,8-11,3). La distribución del riesgo por grupos atendiendo a ambas normativas se refleja en la tabla 3. Si tomamos como referencia un riesgo cerebrovascular del 8,4% para los sujetos sin SM ni diabetes, añadir tan sólo el SM supuso un incremento del riesgo del 28,6%. Sin embargo, añadir tan sólo la diabetes supuso un incremento del 114,3% y añadir ambos, SM y diabetes, conllevó un aumento del 123,8% en el riesgo cerebrovascular medio estimado. En el análisis de estos incrementos aplicando los criterios del NCEP estas proporciones apenas se modificaron.
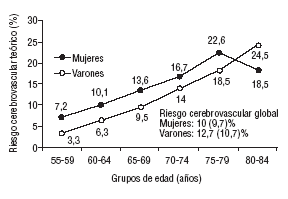
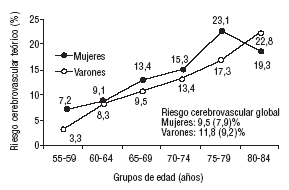
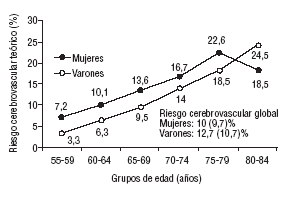
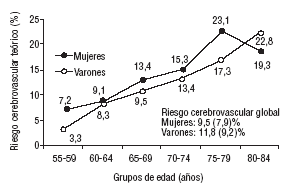
En la figura 1 se expresan las diferencias en el riesgo cerebrovascular calculado en función del sexo para cada franja de edad a tenor de los criterios de la OMS. En la figura 2 se hace lo propio teniendo en cuenta los criterios diagnósticos del NCEP. La máxima probabilidad de enfermedad cerebrovascular entre los varones correspondió al grupo de 75-79 años y entre las mujeres al de 80-84 años, siendo la única que superó el riesgo calculado para los varones. Por su parte, la figura 2 es prácticamente superponible.
Riesgo cerebrovascular medio teórico a 10 años estimado por la ecuación de Framingham en función de la edad y el sexo en la muestra evaluada (criterios de la Organización Mundial de la Salud).
Riesgo cerebrovascular medio teórico a 10 años estimado por la ecuación de Framingham en función de la edad y el sexo en la muestra evaluada (criterios del National Cholesterol Education Program).
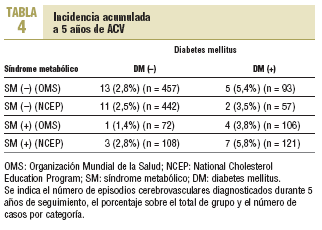
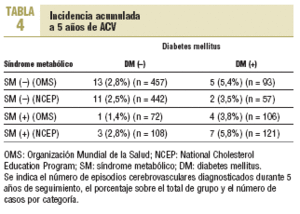
Durante el seguimiento se produjeron 47 pérdidas (6,4%) debidas a traslado de centro o domicilio (n = 30), no aclaradas (n = 6) y 11 fallecimientos, 6 de causa cardiovascular. En la tabla 4 se esquematiza la distribución de los ACV registrados en los 4 grupos establecidos durante el seguimiento efectuado durante los 5 primeros años del estudio (según la OMS y el NCEP). En total se registraron 23 episodios (3,2%), ninguno de ellos fue fatal y tan sólo 2 produjeron secuelas motrices o cognitivas importantes. La distribución de los acontecimientos en los 4 grupos considerados por la OMS (2,8; 1,4; 5,4 y 3,8%) y por el NCEP (2,5; 2,8; 3,5 y 5,8%) expresó índices de incidencia acumulada significativamente inferiores que la incidencia esperada a tenor del riesgo cerebrovascular calculado mediante la ecuación de Framingham, particularmente en los grupos sin el diagnóstico de diabetes.
Discusión
La diabetes tipo 2, la hipertensión arterial, particularmente la sistólica, la obesidad, la dislipemia y la microalbuminuria se asocian con frecuencia con un aumento del riesgo cerebrovascular, preferentemente de carácter isquémico15,16. Esta fusión de riesgos dificulta la individualización del riesgo propio de la diabetes con respecto a la globalidad del SM. Debido a que los datos epidemiológicos disponibles son escasos, el estudio que se presenta pretende aportar una estimación preliminar en la población española.
Pese a la modestia de esta muestra, los resultados indican que el riesgo cerebrovascular global estimado es más elevado entre los sujetos con diabetes o SM que en la población sin ambas entidades. La escala utilizada procede de la población norteamericana de Framingham y todavía no ha sido validada en España y en otros países de nuestro entorno. Aunque es cierto que su estimación del riesgo cerebrovascular podría estar alejada de la realidad, también es probable que los factores ambientales y genéticos que influyen en él se hayan distribuido aleatoriamente entre los 4 grupos revisados y, por tanto, las diferencias relativas informarían acerca de las tendencias intergrupos.
El grupo de investigación se ha especializado en la prevención de la diabetes y del SM. Por esta razón, el uso sistemático de la prueba de tolerancia oral a la glucosa permitió anticipar el diagnóstico de la situación glucémica. En una reciente y completa revisión de la evidencia científica disponible se esquematizaron los principales factores de riesgo cerebral y se otorgó un papel muy relevante a la hipertensión, que incrementaría de 3 a 5 veces el riesgo relativo de enfermedad cerebrovascular14. Por el contrario, en esta misma revisión se redujo el riesgo propio de la diabetes, lo que suscitó un debate todavía abierto, ya que la evidencia científica es de menor categoría. De hecho, la función de la hiperglucemia como factor de riesgo cerebrovascular modificable siempre ha sido controvertida y han coexistido estudios que lo apoyan abiertamente con otros que le restan relevancia17,18. Incluso en la bibliografía autóctona, los resultados observados son dispares. Por ejemplo, en un estudio llevado a cabo en la demarcación de Manresa se observó que había una asociación entre ACV e hiperglucemia tras 28 años de seguimiento19. En esta misma línea, en otro estudio prospectivo efectuado en el área urbana de Barcelona se asoció la diabetes con un peor pronóstico de la hemorragia intracerebral20,21. En contraste, otras informaciones señalan diferencias en la incidencia según la edad y el sexo, con independencia de los valores de glucemia22. Los resultados aquí aportados no pueden responder a estos interrogantes ni pretenden realizar comparaciones a favor de una posición glucocentrista. Tan sólo insinúan que el riesgo cerebrovascular propio de la diabetes podría ser independiente de su integración en el SM, al menos si éste se define con los criterios de la OMS o del NCEP y el riesgo cerebrovascular se valora usando la escala de Framingham. En efecto, la diabetes sola aumentó notablemente el riesgo cerebrovascular basal y la adición del SM a la diabetes sólo implicó un incremento discreto. Para explicar estos valores se debe considerar que, por definición de la escala, la diabetes recibe una notable puntuación directa y aumenta el baremo de riesgo cerebrovascular de todos los casos así diagnosticados. Por otra parte, la mayor incidencia de hallazgos electrocardiográficos en estos pacientes, aunque podría ser anecdótica, también confiere mayor puntuación.
Por el contrario, la elevación del riesgo cerebrovascular no puede atribuirse a una evolución prolongada de la diabetes porque prácticamente la mitad de los sujetos fueron diagnosticados mediante prueba de tolerancia oral a la glucosa, es decir, en etapas iniciales de la enfermedad. Por descontado, la prevalencia de diabetes que se deduce es similar a la comunicada por otros estudios epidemiológicos en los que se emplea de manera sistemática la sobrecarga oral23. Sin embargo, el porcentaje de obesos, dislipémicos, hipertensos y su PAS fue inferior en este grupo y, aun así, el riesgo cerebrovascular medio superó al de los portadores de un SM en ausencia de diabetes. Este dato reforzaría la idea de una sobrevaloración del factor diabetes en la ecuación de Framingham, por lo menos cuando se aplica en nuestra población mediterránea.
La interpretación global de los resultados aportados apunta en 3 direcciones: a) o los datos resaltan el riesgo cerebrovascular propio de la diabetes; b) o son fruto de una escala de medida que lo sobredimensiona claramente, y c) o bien se dan ambas circunstancias. El análisis de los ACV observados durante 5 años de seguimiento también apunta más hacia la segunda interpretación. La incidencia acumulada durante este período fue del 3,2%, frente al 8,4% teórico estimado a 10 años por la fórmula. La aplicación de los criterios diagnósticos de SM del NCEP, mucho más clínicos que los de la OMS, proporciona una incidencia más acorde con la lógica si consideramos que tanto la diabetes como el SM son factores predictivos de riesgo para la enfermedad cerebrovascular (5,8% al conjuntarse ambos). Un resultado parecido se observó en el seguimiento efectuado en la factoría Pirelli de Manresa (el 7,14 frente al 1,2%), aunque en el estudio se incluyó únicamente a varones19. Sus autores registraron 72 episodios en 28 años y en la muestra de Reus documentamos 23 en 5 años. Obviamente, las características de ambas poblaciones son distintas, pero sus hallazgos refuerzan la idea de una sobrestimación. Las diferencias en la incidencia de ACV entre los 4 grupos diagnósticos parecen marginales si consideramos su reducido impacto e intentar explicarlas rozaría la más pura conjetura. No obstante, sugieren que aplicar la definición NCEP del SM aproxima más las proporciones de riesgo a la incidencia real, siempre en un tono de menor impacto que el inferible mediante la escala cerebrovascular de Framingham.
Tradicionalmente se ha puesto el énfasis en que la bibliografía disponible en la población española es escasa, limitación aún más evidente en los pacientes ancianos24. Aunque su estudio no parece tener excesivo sentido desde el prisma de la prevención, muchos pacientes de esas características no son ingresados o no son evaluados aun a sabiendas de que el pronóstico vital y cerebrovascular en esta franja etaria es claramente peor25. Por otra parte, se han constatado ciertas diferencias en la atención sanitaria recibida según el sexo26,27, la etnia y otros factores22. Es ilustrativo que la incidencia de episodios tromboembólicos en los varones de Framingham fuese un 40% superior que en los de Honolulu, mientras que la de episodios hemorrágicos fuera prácticamente idéntica. Todos estos datos epidemiológicos subrayan que la escala de riesgo cerebrovascular de Framingham se presta a múltiples opciones de sobrevaloración en función de la variable considerada.
El aspecto más polémico para la atención primaria es la consideración de la diabetes (o del propio SM) como equivalente de riesgo o tan sólo como un factor de riesgo28. Para discernirlo se precisan estudios prospectivos a mayor plazo en los que se registren de manera adecuada los ACV en sujetos con un SM bien documentado. Se debe considerar que las estrategias preventivas para la enfermedad cerebrovascular son múltiples (terapia intensiva de la hipertensión y la diabetes, hipolipemiantes, antiagregantes, anticoagulación, tratamientos quirúrgicos). Por lo general, son medidas efectivas pero tienen un coste importante y conviene individualizarlas29. En tal caso, sería muy útil disponer de una escala para medir el riesgo cerebrovascular adaptada a la idiosincrasia mediterránea, similar a la desarrollada recientemente para estimar el riesgo cardiovascular30. Por el momento, y siempre con las debidas precauciones, se puede emplear las tablas de Framingham, aunque los datos aportados por este estudio sugieren importantes reservas para recomendar su aplicación sistemática en el cribado de la población atendida.
Agradecimientos
La línea de investigación sobre la intolerancia a la glucosa y el síndrome metabólico en Reus obtuvo los primeros premios de la Sociedad Catalana (2002) y la Sociedad Española (2003) de Hipertensión Arterial, así como el VI premio de l'Acadèmia de Ciències Mèdiques de Catalunya i Balears (Terres de l'Ebre). Dos de los autores (JJC y FM) consiguieron sendas becas predoctorales de la Fundació Jordi Gol i Gurina (Atención Primaria, Institut Català de la Salut) con motivo de esa línea de investigación. Al cuadro directivo de nuestro ámbito le agradecemos su apoyo a la investigación, conscientes de las dificultades que entraña su defensa en atención primaria de salud.