Evaluar el proceso y el impacto económico de un programa integrado de cuidados paliativos.
DiseñoEstudio transversal comparativo.
EmplazamientoOrganizaciones Sanitarias Integradas Alto Deba y Goierri Alto-Urola, País Vasco.
ParticipantesPacientes fallecidos (oncológicos y no oncológicos) en 2012 (grupo control) y 2015 (grupo intervención) susceptibles de necesitar cuidados paliativos según la estimación mínima de McNamara.
IntervencionesIdentificación de pacientes con el código de cuidados paliativos en atención primaria, uso de rutas asistenciales conjuntas en atención primaria y hospitalaria e impartición de cursos formativos.
Mediciones principalesCambio en el perfil de uso de recursos del paciente durante sus últimos 3 meses de vida. Se utilizó el genetic matching para evitar sesgos. Mediante análisis univariante se compararon los grupos y mediante regresiones logísticas y modelos lineales generalizados se analizaron las relaciones entre variables.
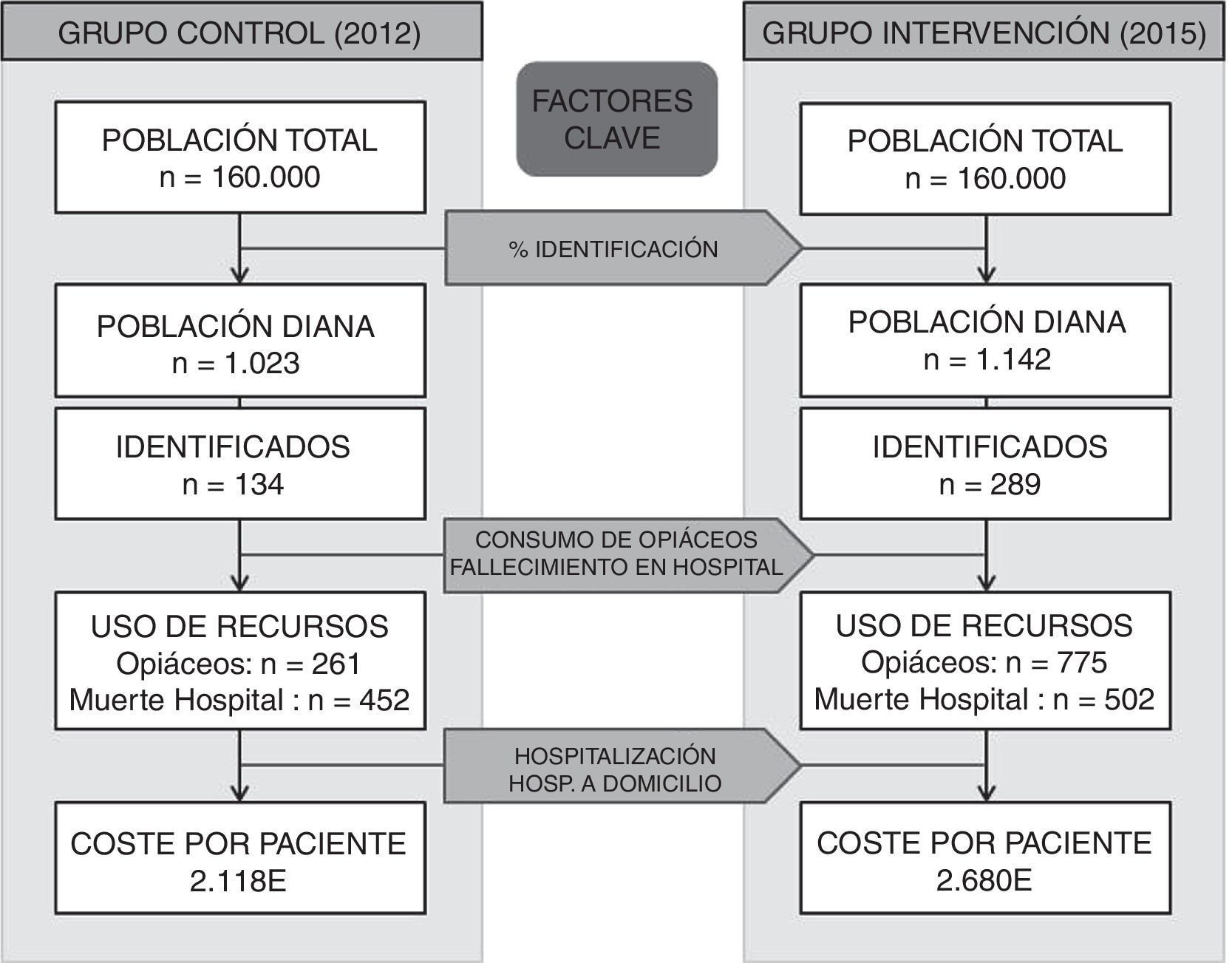
ResultadosSe identificaron 1.023 pacientes en 2012 y 1.142 en 2015. En 2015 aumentó al doble la probabilidad de ser identificado como paliativo en pacientes oncológicos (19-33%) y no oncológicos (7-16%). La prescripción de opiáceos subió (25-68%) y el fallecimiento en hospital se mantuvo estable. Los contactos por paciente con atención primaria y hospitalización a domicilio aumentaron, mientras que las hospitalizaciones tradicionales disminuyeron. El coste por paciente aumentó un 26%.
ConclusionesEl modelo integrado incrementó la identificación de la población diana. La relación entre variables mostró que la identificación repercutió positivamente en la prescripción de opiáceos, fallecimiento fuera del hospital y extensión a enfermedades no oncológicas. Aunque también disminuyeron los ingresos, el coste aumentó debido al uso de hospitalización a domicilio.
Evaluate the process and the economic impact of an integrated palliative care program.
DesignComparative cross-sectional study.
LocationIntegrated Healthcare Organizations of Alto Deba and Goierri Alto-Urola, Basque Country.
ParticipantsPatients dead due to oncologic and non-oncologic causes in 2012 (control group) and 2015 (intervention group) liable to need palliative care according to McNamara criteria.
InterventionsIdentification as palliative patients in primary care, use of common clinical pathways in primary and secondary care and arrange training courses for health professionals.
Main measuresChange in the resource use profile of patients in their last 3 months. Propensity score by genetic matching method was used to avoid non-randomization bias. The groups were compared by univariate analysis and the relationships between variables were analysed by logistic regressions and generalized linear models.
ResultsOne thousand and twenty-three patients were identified in 2012 and 1,142 patients in 2015. In 2015 doubled the probability of being identify as palliative patient in deaths due to oncologic (19-33%) and non-oncologic causes (7-16%). Prescriptions of opiates rise (25-68%) and deaths in hospital remained stable. Contacts per patient with primary care and home hospitalization increased, while contacts with hospital admissions decreased. Cost per patient rise 26%.
ConclusionsThe integrated palliative care model increased the identification of the target population. Relationships between variables showed that the identification had a positive impact on prescription of opiates, death outside the hospital and extension to non-oncologic diseases. Although the identification decreased admissions in hospital, costs per patient had a slight increase due to home hospitalizations.
En las organizaciones sanitarias integradas (OSI) Alto Deba y Goierri-Alto Urola de Guipúzcoa se valoró en 2013 que la población susceptible de recibir cuidados paliativos (CP) no estaba adecuadamente atendida1, ya que sus múltiples necesidades no eran reconocidas y se atendían de forma dispersa. Entre los problemas detectados estaban la escasa formación en el abordaje de los CP2, la falta de identificación de los pacientes en atención primaria (AP) mediante el código de «Admisión para tratamiento paliativo» (V66.7) de la Clasificación Internacional de Enfermedades 9.a Revisión Modificación Clínica (CIE-9), la infrautilización de opiáceos y un uso mayoritario de la muerte en el hospital de hasta un 70%3. Los familiares echaban en falta atención paliativa domiciliaria, al mismo tiempo que percibían dificultades en la toma de decisiones compartida y un déficit de coordinación y criterios unificados4,5. Por su parte, los profesionales sanitarios consideraban que no se trabajaba en equipo, informaban de dificultades de coordinación y mostraban el deseo de recibir formación2,4. La escasa identificación de los pacientes con el código de CP tuvo como explicación que su uso era interpretado como una pérdida de esperanza. En este contexto, se decidió implantar un programa integrado basado en rutas asistenciales comunes de AP y atención hospitalaria (AH)6–8, definiendo los roles de cada uno e impulsando la comunicación y la coordinación entre diferentes niveles9,10.
En 2016 se planteó de forma conjunta evaluar su impacto en la población diana. Como intervención compleja, su implantación poblacional supuso un reto por la necesidad de cambiar las conductas de los profesionales en el conjunto de los 15 centros de salud11, 2 servicios de medicina interna y 2 servicios de hospitalización a domicilio12,13. Aunque en las rutas se describieron los CP en términos genéricos a partir de la definición de la OMS14,15, la población diana incluyó pacientes que se encontraban en situación de enfermedad avanzada-terminal, recomendando utilizar como criterio las 10 condiciones propuestas por McNamara16. El objetivo pretendido fue que ningún paciente con necesidades paliativas quedara desatendido en la fase final de su vida, estimando que el consumo de recursos aumentarían en caso de lograrlo. Debido a la complejidad de la intervención y a los diversos actores involucrados, se consideró necesario evaluar el programa integrado con datos del mundo real para conocer su verdadero impacto.
Por lo tanto, el objetivo del estudio fue evaluar en términos de mejora del proceso e impacto económico la implementación en las 2 OSI del programa integrado de CP centrado en la identificación de los pacientes.
Material y métodosDiseñoSe aplicó un diseño transversal comparativo en la población diana para comparar los periodos previo y posterior a la intervención. La información necesaria para realizar el estudio se obtuvo de la base de datos Oracle Business Intelligence, la cual contiene de forma anonimizada los registros administrativos y clínicos del Servicio Vasco de Salud17.
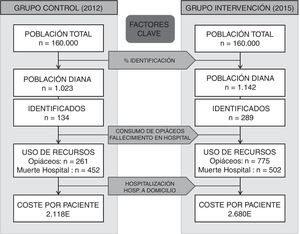
El conjunto formado por las OSI de Alto Deba y Goierri-Alto Urola está compuesto por 2 hospitales comarcales y 15 centros de salud que, en total, atienden a una población de 160.000 habitantes. La población diana del estudio fueron los pacientes fallecidos (oncológicos y no oncológicos) en ambas OSI en 2012 (grupo control) y en 2015 (grupo intervención) susceptibles de necesitar CP de acuerdo con la estimación mínima de McNamara. Este enfoque es específico según la condición causante de la muerte e incluye cáncer, insuficiencia cardíaca, insuficiencia hepática, insuficiencia renal, EPOC, ELA y enfermedades de motoneurona, Parkinson, Huntington, Alzheimer y sida16.
IntervenciónEl despliegue de la intervención integrada comenzó en 2013 y se basó en la identificación de los pacientes con el código CIE-9 adecuado para pacientes paliativos por parte de los médicos de AP, es decir, la identificación mediante el código V66.7. Como criterio de identificación se utilizó la estimación mínima de McNamara. La intervención también abarcó el uso de rutas asistenciales conjuntas para actuar con criterios homogéneos en AP y AH (hospitalización a domicilio y medicina interna) y la impartición de cursos de formación en CP8,18,19. Se definió la ruta óptima a seguir según las necesidades del paciente, al mismo tiempo que se impulsó la comunicación entre diferentes niveles de atención para evitar desplazamientos innecesarios20,21. La historia clínica electrónica compartida y la receta electrónica actuaron como facilitadores en la transmisión de información entre niveles y la conciliación de la medicación. A nivel formativo se impartieron talleres generales de CP, control de síntomas, uso de opiáceos y vía subcutánea, sedación paliativa y comunicación al final de la vida tanto para medicina como para enfermería. Como órgano de coordinación, evaluación y seguimiento del programa se constituyó la Comisión de Cuidados Paliativos.
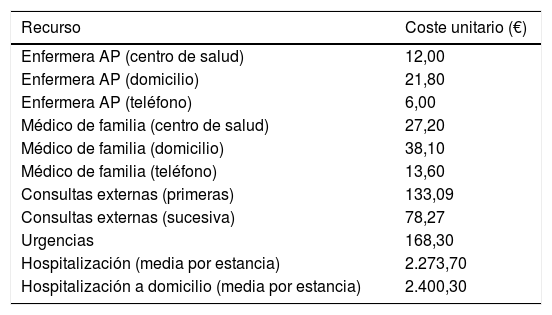
Variables del estudioLa evaluación de la implementación del programa integrado se llevó a cabo analizando el cambio en el perfil de uso de recursos de los pacientes durante sus últimos 3 meses de vida22. Se estimó que este seguimiento era el adecuado para poder evaluar el impacto final del despliegue del programa3,23. Respecto a las consideraciones éticas, como no fue necesario identificar al paciente ni acceder a su historia clínica, no se precisó su aprobación para llevar adelante el estudio.La información necesaria para realizar el estudio referente a los datos del paciente y al consumo de recursos de 2012 a 2015 de los últimos 3 meses de vida del paciente se extrajo de las bases de datos administrativas y clínicas de las OSI e incluyó la edad, el sexo, la causa de la muerte, la marca V66.7 en la historia clínica, la prescripción de opiáceos, el lugar de fallecimiento y el índice de Charlson24. En AP se incluyeron los diferentes contactos con médicos y enfermeras, en el centro sanitario, en el domicilio o por teléfono. Para AH se tuvieron en cuenta todas las consultas externas, urgencias, hospitalizaciones y hospitalizaciones a domicilio. Los costes unitarios en euros (€) en el año 2012 fueron obtenidos del sistema de contabilidad del Servicio Vasco de Salud y se muestran en la tabla 1. Por otra parte, en el anexo se encuentra accesible material adicional complementario que amplía más detalladamente la información proporcionada en el artículo.
Coste unitario de cada recurso en el año 2012
| Recurso | Coste unitario (€) |
|---|---|
| Enfermera AP (centro de salud) | 12,00 |
| Enfermera AP (domicilio) | 21,80 |
| Enfermera AP (teléfono) | 6,00 |
| Médico de familia (centro de salud) | 27,20 |
| Médico de familia (domicilio) | 38,10 |
| Médico de familia (teléfono) | 13,60 |
| Consultas externas (primeras) | 133,09 |
| Consultas externas (sucesiva) | 78,27 |
| Urgencias | 168,30 |
| Hospitalización (media por estancia) | 2.273,70 |
| Hospitalización a domicilio (media por estancia) | 2.400,30 |
El análisis estadístico se llevó a cabo utilizando los programas estadísticos SPSS® (versión 23) y R (versión 3.3.2) con un nivel de confianza del 95%. Primero se realizó un análisis descriptivo de los indicadores de proceso del paciente para ver la evolución que tuvieron entre 2012 y 2015.
Posteriormente se llevó a cabo un análisis univariante para comparar los datos observados en 2012 y 2015. Se buscaron diferencias sociodemográficas y clínicas estadísticamente significativas en los indicadores. Se aplicó el test exacto de Fisher para las variables categóricas de 2 categorías y valor esperado menor o igual a 5, mientras que para los demás casos se utilizó el test chi-cuadrado. En el caso de las variables continuas con distribución normal la comparación de medias se efectuó mediante la prueba t-Student. Para analizar las tasas de uso de recursos se realizó una categorización debido a que no seguían una distribución normal y contenían una masa sustancial de probabilidad en el punto cero. Sin embargo, en los resultados se muestran las medias para facilitar la interpretación. La comparación de la distribución de la variable categorizada en los años 2012 y 2015 se llevó a cabo mediante el test chi-cuadrado. También se estimó el coste medio por paciente en AP y AH. Puesto que los costes no siguen una distribución normal se aplicó la prueba no paramétrica de Mann-Whitney para la comparación de medianas.
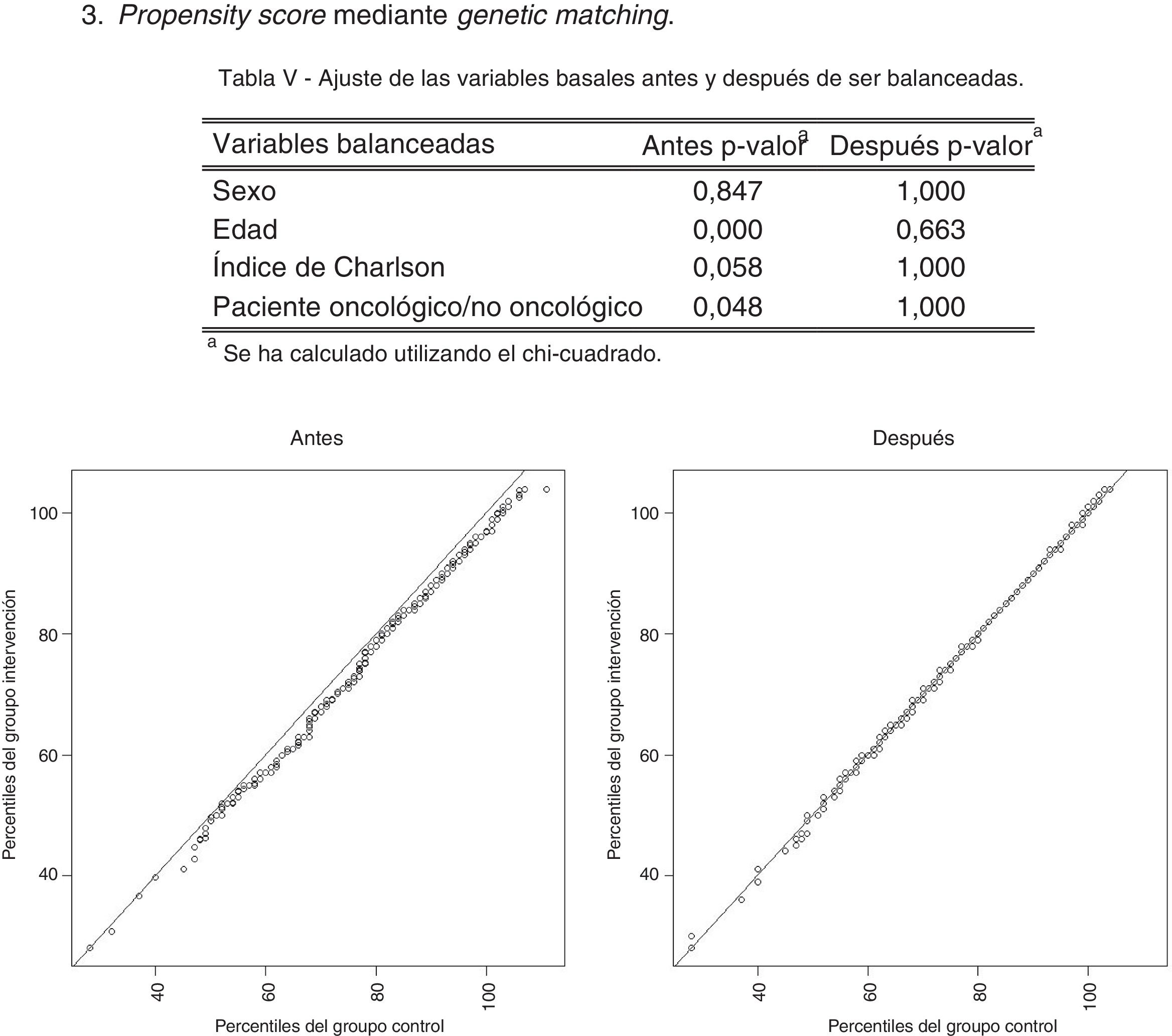
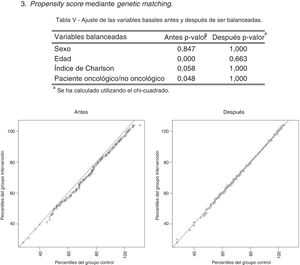
Antes del análisis estadístico multivariante, y dado que los estudios con datos del mundo real y grupo de comparación no aleatorizado pueden estar sujetos a sesgos, se usó el propensity score mediante genetic matching para ponderar las poblaciones de forma que coincidieran en las variables basales de los grupos. Se trata de una técnica que consiste en elegir individuos de ambos grupos con las mismas características en función de las variables seleccionadas con la finalidad de crear grupos homogéneos25,26. En estas poblaciones emparejadas se analizó mediante regresiones logísticas la probabilidad que tenían los individuos de ser marcados con el código V66.7, recibir opiáceos, fallecer en el hospital, ser ingresados en el hospital y ser ingresados en hospitalización a domicilio. Además, se utilizaron los modelos lineales generalizados o generalized linear models para analizar el coste total, una generalización de la regresión lineal de mínimos cuadrados ordinarios que permite que la variable respuesta siga distribuciones con forma distinta a la normal27,28. Como variables independientes se incluyeron las relativas a la información sociodemográfica y clínica.
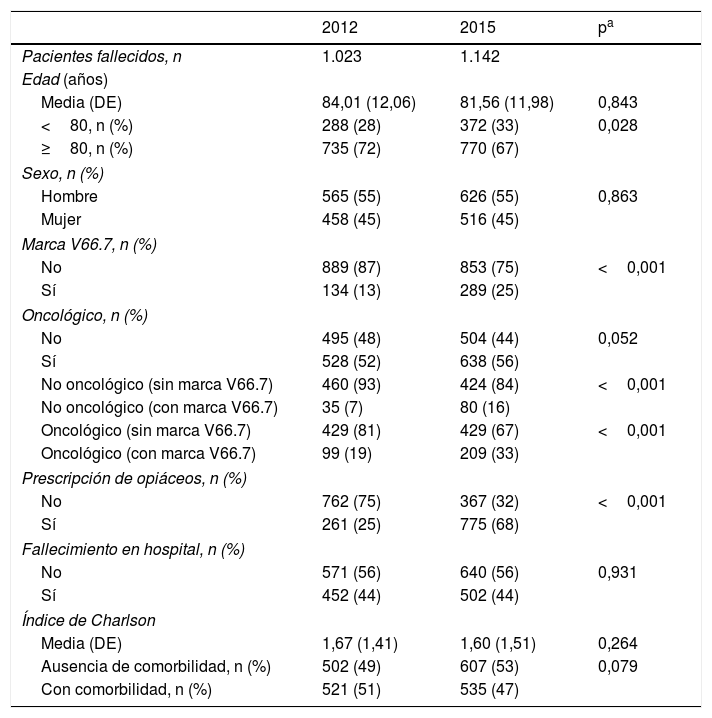
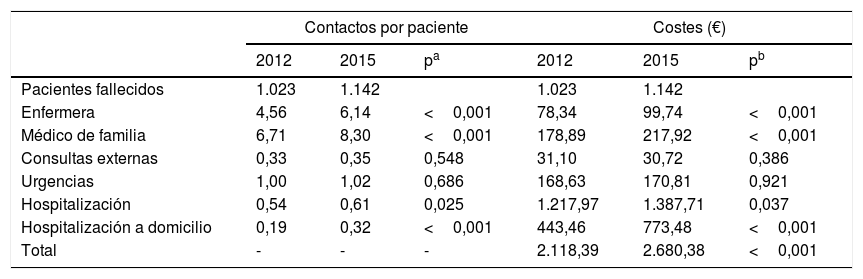
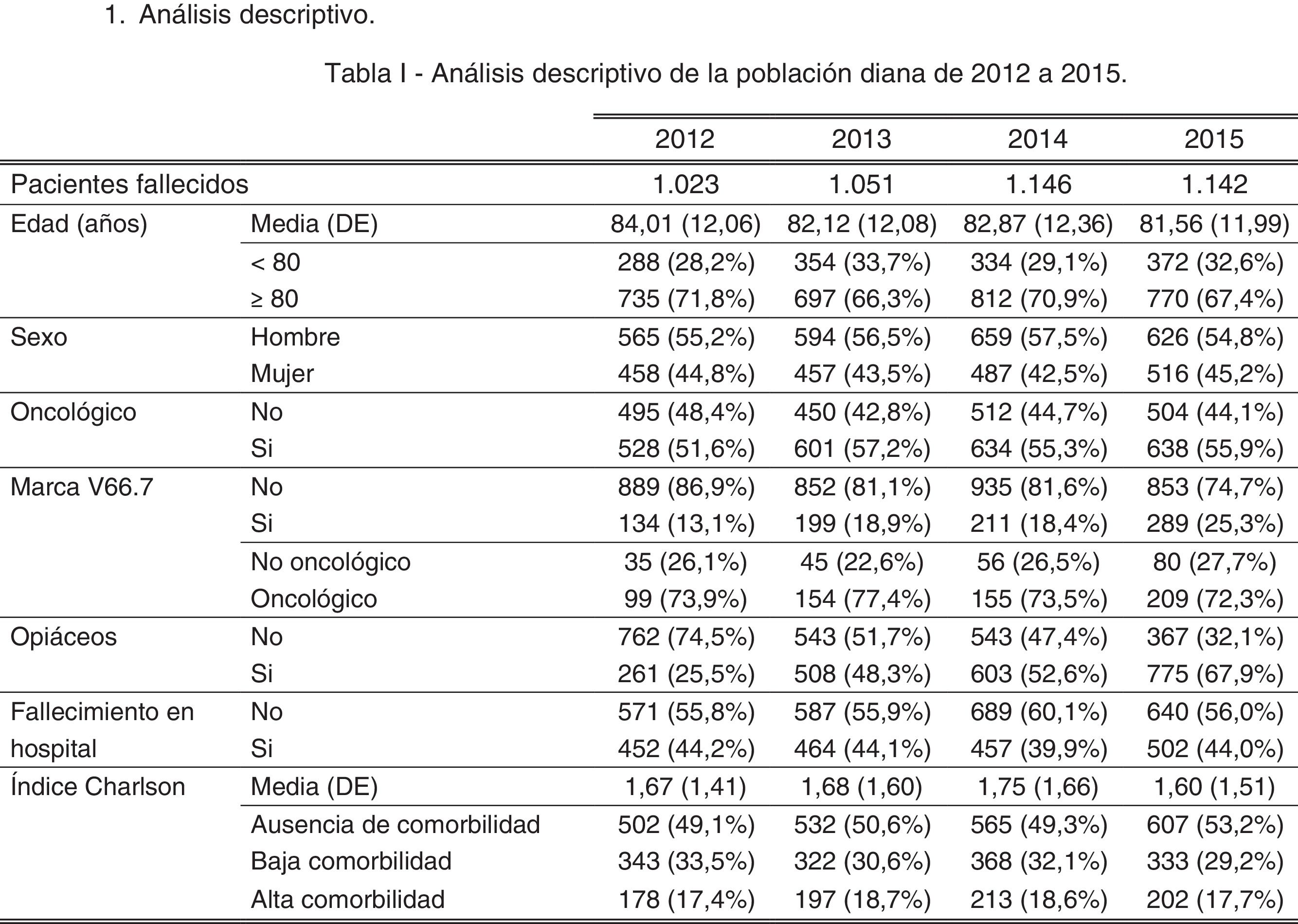
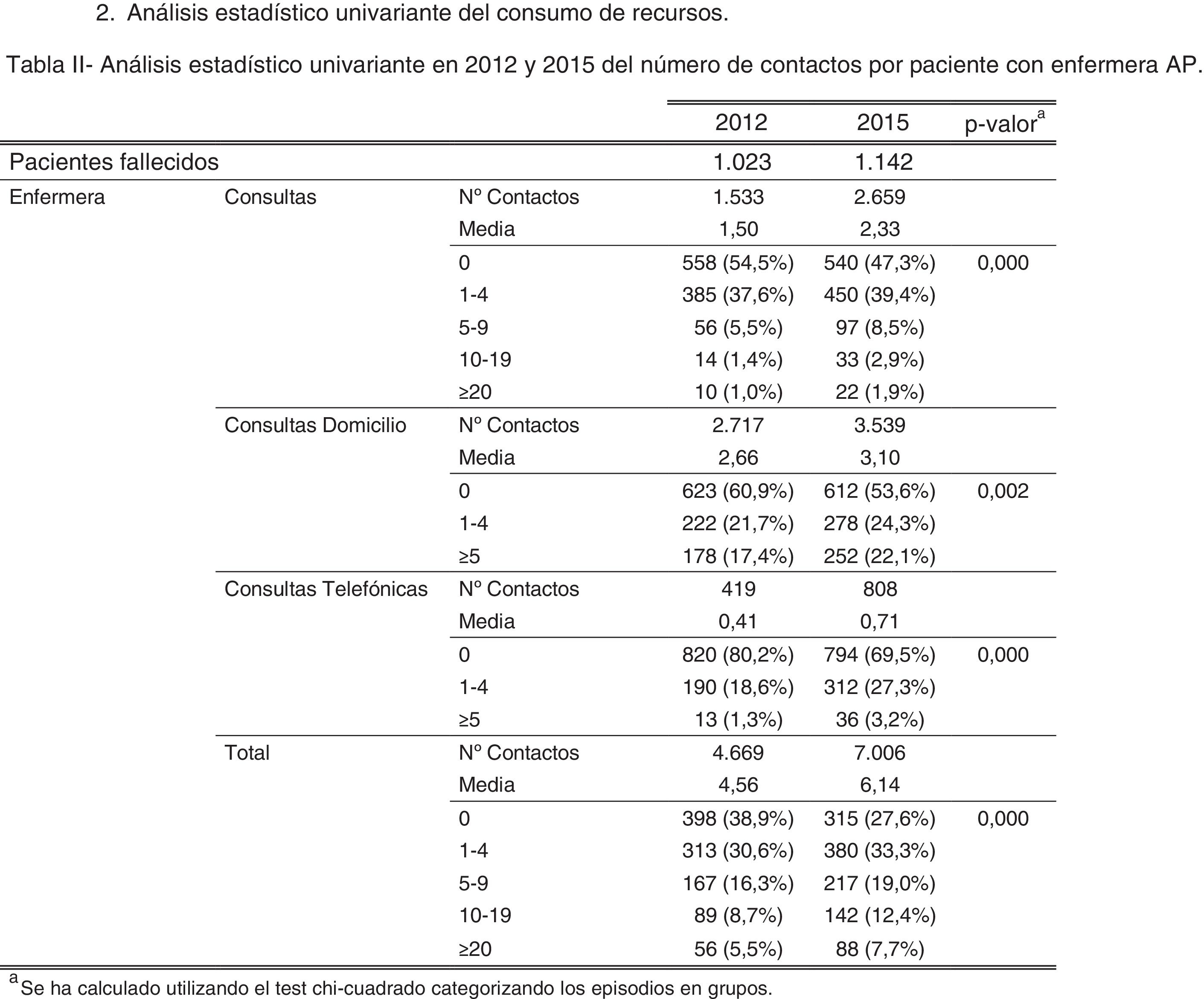
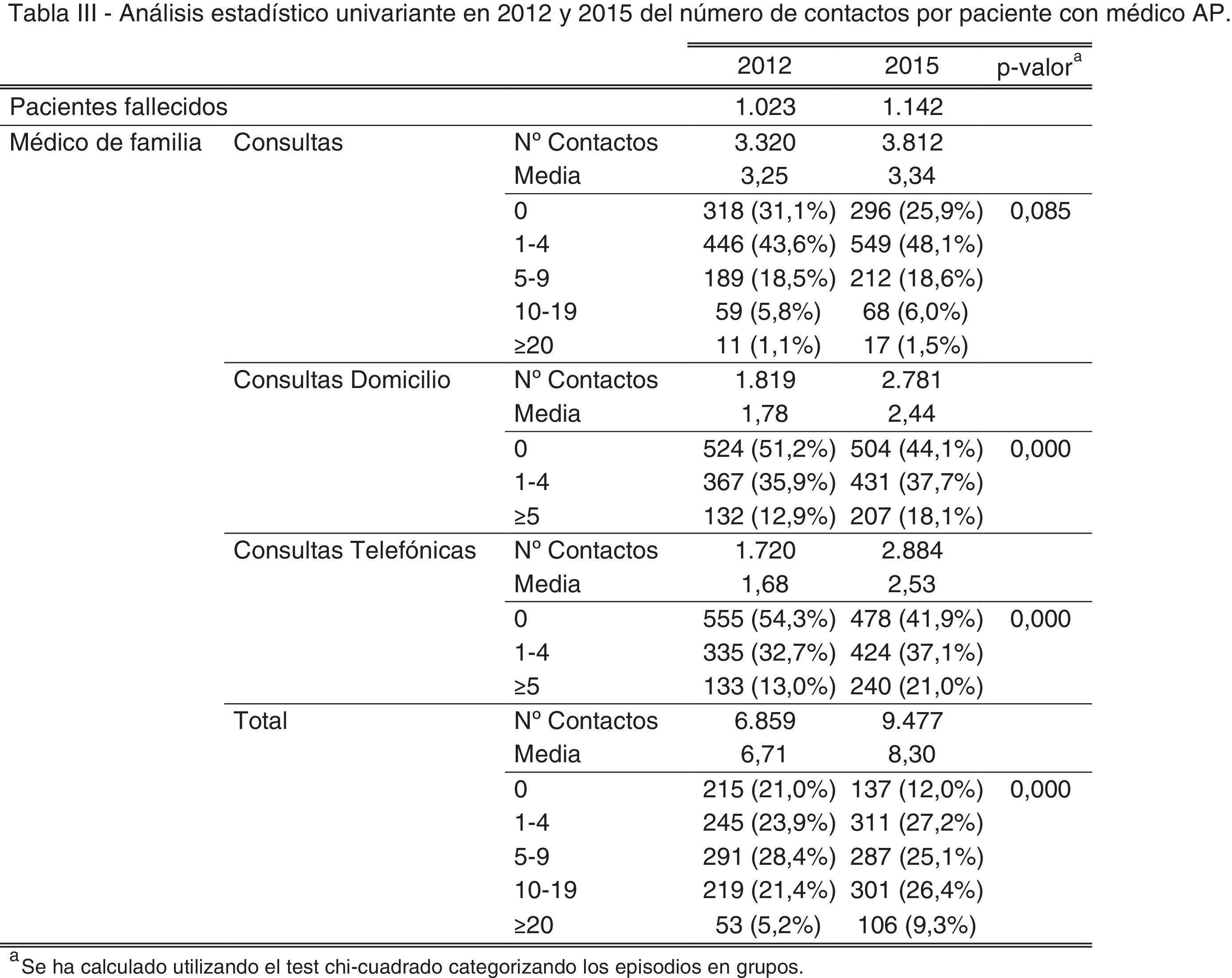
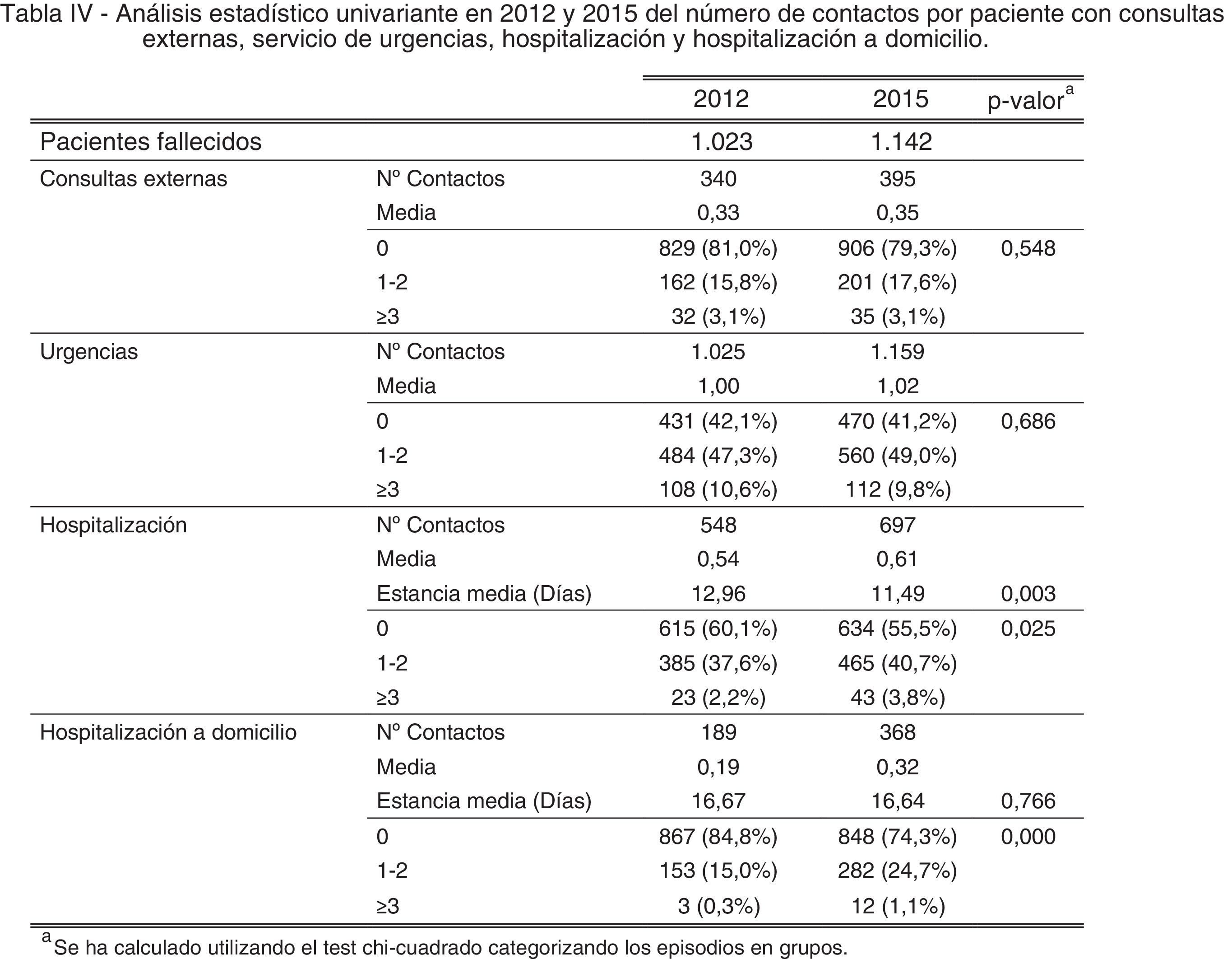
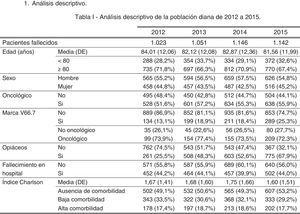
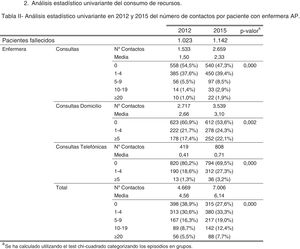
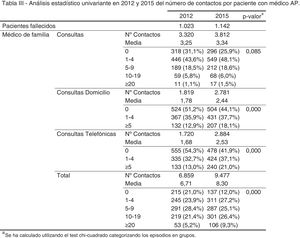
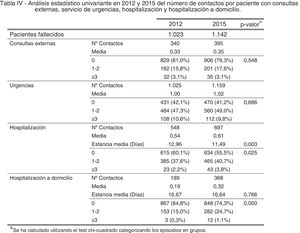
ResultadosAl realizar el análisis univariante se identificaron 1.023 pacientes en 2012 como grupo control y 1.142 en 2015 como grupo intervención. Los pacientes identificados con el código V66.7 y la prescripción de opiáceos tuvieron incrementos estadísticamente significativos, mientras que el fallecimiento en hospital no cambió (tabla 2). El porcentaje de identificados respecto al total de pacientes pasó del 7 al 16% en los no oncológicos y del 19 al 33% en los oncológicos. En cuanto al consumo de recursos, en la tabla 3 se aprecia que en AP aumentaron significativamente los contactos por paciente tanto con la enfermera como con el médico de familia. Sucedió lo mismo en AH para los casos de hospitalización y hospitalización a domicilio. Los valores p de esta tabla surgen del análisis realizado con los episodios categorizados por número de contactos, información que se amplía más detalladamente en el anexo. El coste también aumentó significativamente un 26%.
Análisis estadístico univariante en 2012 y 2015 de las características basales de los pacientes
| 2012 | 2015 | pa | |
|---|---|---|---|
| Pacientes fallecidos, n | 1.023 | 1.142 | |
| Edad (años) | |||
| Media (DE) | 84,01 (12,06) | 81,56 (11,98) | 0,843 |
| <80, n (%) | 288 (28) | 372 (33) | 0,028 |
| ≥80, n (%) | 735 (72) | 770 (67) | |
| Sexo, n (%) | |||
| Hombre | 565 (55) | 626 (55) | 0,863 |
| Mujer | 458 (45) | 516 (45) | |
| Marca V66.7, n (%) | |||
| No | 889 (87) | 853 (75) | <0,001 |
| Sí | 134 (13) | 289 (25) | |
| Oncológico, n (%) | |||
| No | 495 (48) | 504 (44) | 0,052 |
| Sí | 528 (52) | 638 (56) | |
| No oncológico (sin marca V66.7) | 460 (93) | 424 (84) | <0,001 |
| No oncológico (con marca V66.7) | 35 (7) | 80 (16) | |
| Oncológico (sin marca V66.7) | 429 (81) | 429 (67) | <0,001 |
| Oncológico (con marca V66.7) | 99 (19) | 209 (33) | |
| Prescripción de opiáceos, n (%) | |||
| No | 762 (75) | 367 (32) | <0,001 |
| Sí | 261 (25) | 775 (68) | |
| Fallecimiento en hospital, n (%) | |||
| No | 571 (56) | 640 (56) | 0,931 |
| Sí | 452 (44) | 502 (44) | |
| Índice de Charlson | |||
| Media (DE) | 1,67 (1,41) | 1,60 (1,51) | 0,264 |
| Ausencia de comorbilidad, n (%) | 502 (49) | 607 (53) | 0,079 |
| Con comorbilidad, n (%) | 521 (51) | 535 (47) | |
Análisis estadístico univariante en 2012 y 2015 del consumo de recursos presentado como número de contactos por paciente y costes por paciente en los últimos 3 meses de vida utilizando los costes unitarios referentes al año 2012
| Contactos por paciente | Costes (€) | |||||
|---|---|---|---|---|---|---|
| 2012 | 2015 | pa | 2012 | 2015 | pb | |
| Pacientes fallecidos | 1.023 | 1.142 | 1.023 | 1.142 | ||
| Enfermera | 4,56 | 6,14 | <0,001 | 78,34 | 99,74 | <0,001 |
| Médico de familia | 6,71 | 8,30 | <0,001 | 178,89 | 217,92 | <0,001 |
| Consultas externas | 0,33 | 0,35 | 0,548 | 31,10 | 30,72 | 0,386 |
| Urgencias | 1,00 | 1,02 | 0,686 | 168,63 | 170,81 | 0,921 |
| Hospitalización | 0,54 | 0,61 | 0,025 | 1.217,97 | 1.387,71 | 0,037 |
| Hospitalización a domicilio | 0,19 | 0,32 | <0,001 | 443,46 | 773,48 | <0,001 |
| Total | - | - | - | 2.118,39 | 2.680,38 | <0,001 |
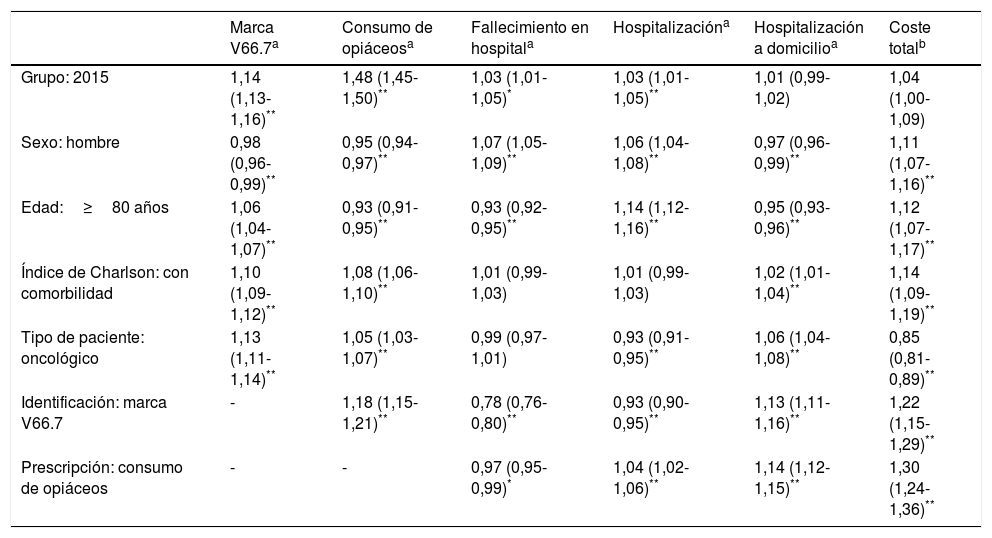
En el análisis multivariante se pudo ver que todas las covariables influyeron significativamente en la probabilidad de marcar a los pacientes con el código V66.7 y de prescribir opiáceos. Estos indicadores fueron mayores en 2015, en mujeres, en los pacientes oncológicos y en los que padecían mayor comorbilidad. Identificar a los pacientes con el código V66.7 también aumentó la probabilidad de prescribir opiáceos. La identificación, en cambio, determinó una reducción de los ingresos hospitalarios y del fallecimiento en el hospital, a pesar de que la probabilidad de hospitalización fue mayor en 2015. En la tabla 4 se presentan los resultados en forma de odds ratio y la significación estadística, donde los valores mostrados de las variables analizadas hacen referencia a la etiqueta del valor 1.
Análisis estadístico multivariante de la probabilidad de identificación con el código V66.7, la prescripción de opiáceos, el fallecimiento en hospital, la hospitalización, la hospitalización a domicilio y el coste total presentado en forma de odds ratio y significación
| Marca V66.7a | Consumo de opiáceosa | Fallecimiento en hospitala | Hospitalizacióna | Hospitalización a domicilioa | Coste totalb | |
|---|---|---|---|---|---|---|
| Grupo: 2015 | 1,14 (1,13-1,16)** | 1,48 (1,45-1,50)** | 1,03 (1,01-1,05)* | 1,03 (1,01-1,05)** | 1,01 (0,99-1,02) | 1,04 (1,00-1,09) |
| Sexo: hombre | 0,98 (0,96-0,99)** | 0,95 (0,94-0,97)** | 1,07 (1,05-1,09)** | 1,06 (1,04-1,08)** | 0,97 (0,96-0,99)** | 1,11 (1,07-1,16)** |
| Edad:≥80 años | 1,06 (1,04-1,07)** | 0,93 (0,91-0,95)** | 0,93 (0,92-0,95)** | 1,14 (1,12-1,16)** | 0,95 (0,93-0,96)** | 1,12 (1,07-1,17)** |
| Índice de Charlson: con comorbilidad | 1,10 (1,09-1,12)** | 1,08 (1,06-1,10)** | 1,01 (0,99-1,03) | 1,01 (0,99-1,03) | 1,02 (1,01-1,04)** | 1,14 (1,09-1,19)** |
| Tipo de paciente: oncológico | 1,13 (1,11-1,14)** | 1,05 (1,03-1,07)** | 0,99 (0,97-1,01) | 0,93 (0,91-0,95)** | 1,06 (1,04-1,08)** | 0,85 (0,81-0,89)** |
| Identificación: marca V66.7 | - | 1,18 (1,15-1,21)** | 0,78 (0,76-0,80)** | 0,93 (0,90-0,95)** | 1,13 (1,11-1,16)** | 1,22 (1,15-1,29)** |
| Prescripción: consumo de opiáceos | - | - | 0,97 (0,95-0,99)* | 1,04 (1,02-1,06)** | 1,14 (1,12-1,15)** | 1,30 (1,24-1,36)** |
El modelo integrado de CP supuso un cambio significativo en la asistencia prestada a los pacientes, ya que hubo una mejora relevante en los indicadores clave como son la identificación con código V66.7, la prescripción de opiáceos, el fallecimiento fuera del hospital y la extensión a enfermedades no oncológicas. A pesar de que etiquetar al paciente como paliativo podría tener una connotación negativa por la posible pérdida de la esperanza en su recuperación16, la identificación de la población diana, ya sean oncológicos como no oncológicos, aumentó significativamente. La probabilidad de ser identificado fue 2,4 veces mayor en 2015, lo cual significa que las dificultades de los profesionales, como las de cualquier individuo, para formalizar la aceptación de la muerte empiezan a ser superadas. No obstante, cabe la posibilidad de que la baja identificación previa pudiera deberse a la poca demanda por falta de conocimiento de los familiares o a la dificultad de abordar el incremento de la carga de trabajo. Además, los resultados mostraron que aumentó el uso de la AP y la hospitalización a domicilio pero no la hospitalización convencional. En este sentido, el estudio evidenció que identificar a los pacientes se asocia con el perfil de indicadores que permiten ajustar la gestión para mejorar en la práctica la atención a los pacientes con necesidades paliativas29.
Por su parte, el análisis de los costes es relevante para estimar la sostenibilidad del modelo de cuidados. Al llevar a cabo el análisis univariante, el coste por paciente en 2015 fue significativamente más alto. No obstante, cuando en el análisis multivariante se ajustó por las covariables, la implementación del modelo integrado no determinó un aumento significativo, mientras que la identificación sí supuso un incremento. Por tanto, se puede decir que el modelo de cuidados mejoró la atención incurriendo en un aumento de los costes. En un estudio realizado en el sur de California se documentó la sostenibilidad del programa por evitar hospitalizaciones30. A pesar de que la identificación redujo el número de hospitalizaciones, no se ha encontrado en el estudio una reducción de costes asociada a la identificación como paliativo, principalmente debido al aumento del uso de la hospitalización a domicilio.
En cuanto al método utilizado, para estimar la población que requiere CP existen diferentes propuestas16,34–36. Este estudio siguió la propuesta de McNamara porque se basa en el uso de sistemas de información integrados y facilita el abordaje poblacional al definir la población diana a partir de las causas de defunción16. Las otras propuestas tienen un enfoque clínico y se basan en la identificación de la población diana mediante el uso de diferentes cuestionarios, como CARING o NECPAL34–36. Actualmente el cuestionario NECPAL está incorporado en la historia clínica digital del Servicio Vasco de Salud, sin embargo, cuando comenzó el programa no estaba incluido.
La evaluación también mostró las debilidades del programa, siendo un aspecto a mejorar la baja cobertura de los procesos no tumorales39. A pesar de que en 2015 la identificación aumentó al doble en las enfermedades crónicas no oncológicas, su cobertura fue solamente del 16%, cuando en los pacientes oncológicos fue del 33%. Al aplicar los criterios McNamara a nuestra base de datos, la población diana se distribuyó aproximadamente en 2 mitades (oncológica y no oncológica). Sin embargo, otros enfoques determinan que el porcentaje de los pacientes con condiciones crónicas no oncológicas supera ampliamente al de los oncológicos. En un estudio desarrollado en Cataluña el ratio no oncológico/oncológico en los pacientes que requerían CP fue de 7 a 135. La diferencia entre los criterios estriba en la inclusión de la categoría de pacientes frágiles, que no está recogida entre los criterios de McNamara16. Es en este punto donde radica la principal limitación del estudio, ya que, al no estar incluida en la CIE-9 ni en la CIE-10 la condición de fragilidad, no se pueden registrar ni posteriormente buscar en las bases de datos administrativo-clínicas estos pacientes, por lo que no se incluyeron en el estudio. Compartimos la necesidad de tener en cuenta a estos pacientes y, por tanto, del uso de herramientas que permitan identificarlos.
Otra de las debilidades del estudio fue la falta de definición cuantificada de los objetivos poblacionales en su lanzamiento en 2013. Sabemos que mejoró la identificación, pero no sabemos si alcanzó el nivel que se esperaba en la planificación. Esta circunstancia limita la aplicación de herramientas de mejora continua como el ciclo PDCA de Deming, que consta de 4 fases que se repiten: Plan, Do, Check y Act21,37,38. La herramienta ayuda a mejorar la implementación de programas de atención a pacientes en general y con necesidades paliativas en particular. Pero la carencia de la fase de planificación (Plan) hace que la valoración del análisis estadístico (Check) carezca de una referencia para saber si el programa consiguió los objetivos de gestión. En este contexto, el criterio de la significación estadística puede no ser suficiente para realizar una valoración del resultado de la implementación del programa. Una conclusión de la evaluación es la necesidad de establecer objetivos cuantificados en la nueva fase de planificación que seguirá al análisis de la evaluación.
El diseño transversal comparativo a partir de las bases de datos corporativas resultó útil para medir el avance del programa. No obstante, debido al diseño del estudio los grupos no fueron formados mediante un proceso aleatorio, pudiendo aparecer sesgos de selección por falta de homogeneidad entre los grupos. Los posibles sesgos se paliaron con la aplicación de la herramienta estadística propensity score mediante genetic matching25,26. Ahora que la historia clínica digital y los registros administrativos facilitan el acceso a los datos de uso real del sistema sanitario, es necesario resaltar la importancia de procedimientos que mejoren la validez del estudio31–33.
Por último, resulta clara la falta de indicadores que aporten la percepción que tienen del programa los pacientes y familiares5. Tampoco se plantearon en el despliegue del programa, pero resultan necesarios para poder monitorizar su efectividad mejorando la calidad de vida.
- •
Los modelos integrados de atención a las enfermedades crónicas han sido el objeto de mayor atención en la adaptación del sistema sanitario español a los retos del envejecimiento.
- •
En el caso de los cuidados paliativos adquiere una especial relevancia que los pacientes estén debidamente atendidos, siendo necesario para ello que la población susceptible de recibir atención paliativa esté adecuadamente identificada.
- •
El estudio busca dar soporte al modelo integrado que promueven las Organizaciones Sanitarias Integradas evaluando la implementación del programa poblacional integrado de cuidados paliativos y tratando de reconocer factores que pudieran asociarse a una mejor identificación y atención de los pacientes.
- •
Evalúa el proceso y los costes de un modelo de organización integrada para pacientes con necesidades de cuidados paliativos en una población de 160.000 habitantes, aprovechando la disponibilidad de las bases de datos administrativas y clínicas a nivel de paciente.
- •
Muestra la mejora asistencial que conlleva la correcta identificación de la población diana, repercutiendo positivamente en indicadores clave como prescripción de opiáceos, fallecimiento fuera del hospital y extensión a enfermedades no oncológicas. Muestra también como la identificación se asocia con un descenso de los ingresos hospitalarios, mientras que los costes por paciente aumentan debido a un incremento en el uso de la hospitalización a domicilio.
- •
Utiliza métodos innovadores en la literatura española de evaluación económica, como el método estadístico de ponderación propensity score mediante genetic matching. Estas técnicas permiten resolver las dificultades que plantean los posibles sesgos asociados a la falta de aleatorización.
Este estudio se ha llevado a cabo con recursos financieros internos de las OSI de Alto Deba y Goierri-Alto Urola y una beca de la Fundación Española de Calidad Asistencial.
AutoríaTodos los autores cumplen los criterios de autoría y no se excluye a nadie que también los cumpla. IgL, MSG y JaM diseñaron el estudio. JeM, ItL, RSV y MI colaboraron en el diseño y aportaron el modelo conceptual y la obtención de los datos. IgL, MSG y AA llevaron a cabo el análisis estadístico. IgL, MSG y JaM escribieron el borrador de las secciones de introducción y discusión. IgL y AA escribieron las secciones de métodos y resultados. Todos los autores revisaron los datos clínicos y epidemiológicos, aportaron comentarios en la introducción y conclusiones y aprobaron el texto final del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todas las personas que nos han ayudado con el estudio y a los revisores anónimos asignados al manuscrito por su contribución a la mejora de la calidad del reporte.