En esta Guía de práctica clínica analizamos el manejo diagnóstico y terapéutico de pacientes adultos con estreñimiento y molestias abdominales, bajo la confluencia del espectro del síndrome del intestino irritable y el estreñimiento funcional. Ambas patologías están encuadradas en los trastornos funcionales intestinales y tienen una importante repercusión personal, sanitaria y social, afectando a la calidad de vida de los pacientes que las padecen. La primera es el subtipo de síndrome del intestino irritable en el que el estreñimiento es la alteración deposicional predominante junto con dolor abdominal recurrente, hinchazón y distensión abdominal frecuente. El estreñimiento se caracteriza por la dificultad o la escasa frecuencia en relación con las deposiciones, a menudo acompañado por esfuerzo excesivo durante la defecación o sensación de evacuación incompleta. En la mayoría de los casos no tiene una causa orgánica subyacente, siendo considerado un trastorno funcional intestinal. Son muchas las similitudes clínicas y fisiopatológicas entre ambos trastornos, con respuesta similar del estreñimiento a fármacos comunes, siendo la diferencia fundamental la presencia o ausencia de dolor, pero no de un modo evaluable como «todo o nada». La gravedad de estos trastornos depende no solo de la intensidad de los síntomas intestinales sino también de otros factores biopsicosociales: asociación de síntomas gastrointestinales y extraintestinales, grado de afectación, y formas de percepción y comportamiento. Mediante los criterios de Roma, se diagnostican los trastornos funcionales intestinales. Esta Guía de práctica clínica está adaptada a los criterios de Roma IV difundidos a finales de mayo de 2016. En una primera parte (96, 97, 98) se analizaron los aspectos conceptuales y fisiopatológicos, los criterios de alarma, las pruebas diagnósticas y los criterios de derivación entre Atención Primaria y aparato digestivo. En esta segunda parte, se revisan todas las alternativas terapéuticas disponibles (ejercicio, ingesta de líquidos, dieta con alimentos ricos en fibra soluble, suplementos de fibra, otros componentes de la dieta, laxantes osmóticos o estimulantes, probióticos, antibióticos, espasmolíticos, esencia de menta, prucaloprida, linaclotida, lubiprostona, biofeedback, antidepresivos, tratamiento psicológico, acupuntura, enemas, neuroestimulación de raíces sacras o cirugía), efectuando recomendaciones prácticas para cada una de ellas.
In this Clinical practice guide we examine the diagnostic and therapeutic management of adult patients with constipation and abdominal discomfort, at the confluence of the spectrum of irritable bowel syndrome and functional constipation. Both fall within the framework of functional intestinal disorders and have major personal, health and social impact, altering the quality of life of the patients affected. The former is a subtype of irritable bowel syndrome in which constipation and altered bowel habit predominate, often along with recurring abdominal pain, bloating and abdominal distension. Constipation is characterised by infrequent or hard-to-pass bowel movements, often accompanied by straining during defecation or the sensation of incomplete evacuation. There is no underlying organic cause in the majority of cases; it being considered a functional bowel disorder. There are many clinical and pathophysiological similarities between the two conditions, the constipation responds in a similar way to commonly used drugs, the fundamental difference being the presence or absence of pain, but not in an “all or nothing” way. The severity of these disorders depends not only on the intensity of the intestinal symptoms but also on other biopsychosocial factors: association of gastrointestinal and extraintestinal symptoms, degree of involvement, forms of perception and behaviour. Functional bowel disorders are diagnosed using the Rome criteria. This Clinical practice guide adapts to the Rome IV criteria published at the end of May 2016. The first part (96, 97, 98) examined the conceptual and pathophysiological aspects, alarm criteria, diagnostic test and referral criteria between Primary Care and Gastroenterology. This second part reviews all the available treatment alternatives (exercise, fluid ingestion, diet with soluble fibre-rich foods, fibre supplements, other dietary components, osmotic or stimulating laxatives, probiotics, antibiotics, spasmolytics, peppermint essence, prucalopride, linaclotide, lubiprostone, biofeedback, antdepressants, psychological treatment, acupuncture, enemas, sacral root neurostimulation and surgery), and practical recommendations are made for each.
Esta Guía de práctica clínica (GPC) ha sido desarrollada entre enero de 2015 y diciembre de 2015 por un grupo de trabajo formado por expertos seleccionados por la Sociedad Española de Patología Digestiva (SEPD), la Sociedad Española de Medicina de Familia y Comunitaria (semFYC), la Sociedad Española de Médicos de Atención Primaria (SEMERGEN) y la Sociedad Española de Médicos Generales y de Familia (SEMG). Entre diciembre de 2015 y abril de 2016ha sido sometida a revisión, con la última adaptación a Roma IV en mayo de 20161,2.
Para un detalle del proceso metodológico de trabajo mediante el cual se ha elaborado esta GPC ver http://www.sepd.es/file/GPC_SII_E_EF_Metodologia.pdf
Aspectos conceptuales, impacto y fisiopatologíaPara acceder al apartado de Aspectos conceptuales, impacto y fisiopatología (preguntas 1-7; figuras 1A yB y figura 2; tablas 1 y 2 de la Parte 1), ver las publicaciones correspondientes (96–98).
DiagnósticoPara acceder al apartado de Diagnóstico (preguntas 8-12; figuras 3 y 4; tablas 3 a 6 de la Parte 1), ver las publicaciones correspondientes (96–98).
TratamientoImportancia del cumplimiento terapéutico y aspectos prácticos generales para cualquier alternativa terapéuticaComo en cualquier otra patología, el cumplimiento terapéutico estricto es imprescindible para conseguir la eficacia del plan terapéutico prescrito. En el caso de los procesos que nos ocupan, incluye no solo la toma de fármacos sino el seguimiento de los consejos higiénico-dietéticos pautados (tabla 1) y la modificación de los estilos de vida cuando ello procede.
Medidas higiénico-dietéticas en el SII-E/EF
| • Ingesta de 25-30 g de fibra soluble con la dieta al día |
| • Ingesta adecuada de líquido (1,5-2 l al día) |
| • Ejercicio aeróbico regular (ajustado a las condiciones físicas de cada individuo y a sus preferencias) |
| • Dieta equilibrada |
| • Patrón regular de comidas |
| • Evitar comidas copiosas, grasas, fibra insoluble y alimentos flatulentos |
| • En algunos pacientes el sorbitol, las grasas, el alcohol, el trigo, los frutos secos o la leche pueden exacerbar la sintomatología del SII, aunque las dietas con exclusión de estos alimentos no han mostrado resultados concluyentes |
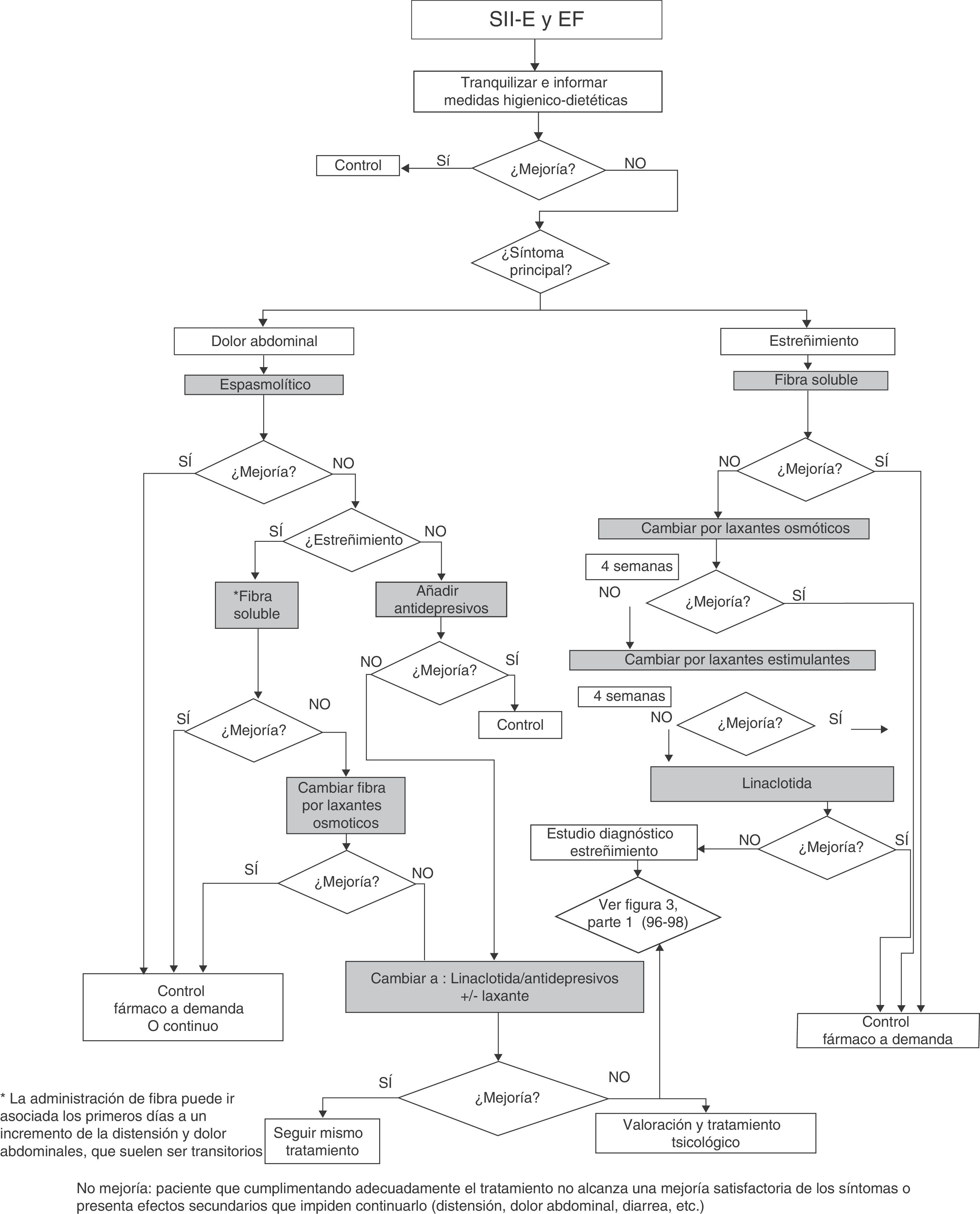
Es cierto que no basta con plantear dicho plan terapéutico (figs. 1 y 2), porque resultará del todo inútil si el paciente no lo asimila, lo admite y acepta ponerlo en práctica. Por tanto, no se trata de que el paciente adopte una conducta de sumisión o de obediencia a la prescripción, sino que se debe conseguir el clima adecuado entre médico y paciente que conlleve la colaboración y la participación activa de este en la toma de decisiones y en la asunción de su propia responsabilidad sobre el cuidado o la mejora de su salud.
Por ello, además de tomar en consideración las mejores opciones terapéuticas desde el punto de vista objetivo, es preciso valorar otras cuestiones que facilitarán el compromiso y con ello el cumplimiento por parte del paciente. Entre ellas son interesantes las siguientes:
- -
Pautar fármacos cuya posología sea simple, con el menor número posible de tomas o empleando formulaciones galénicas que la simplifiquen (tablas 2 y 3).
Tabla 2.Fármacos utilizados en el SII-E y EF
Fibra soluble (formadores de bolo) Nombre comercial Principio activo Dosis Biolid® sobres 3,5 g Ispagula (plantago ovata) Cutícula 3,2 a 10,5 g/24 h Metamucil® sobres 3,26 g Plantaben® sobres 3,5 g Plantago ovata EGF sobres 3,5 g Cenat®envase 250/400 g Ispagula (plantago ovata) Semilla 10 g/24 h Muciplazma® cápsulas 500 mg Metilcelulosa 1,5 g/8 h Laxantes osmóticos Nombre comercial Principio activo Dosis Emportal® polvo para solución oral 10 g Lactitol 10-20 g/24 h Oponaf® polvo para solución oral 10 g Duphalac® sobres 10 g, suspensión Lactulosa 15-30 g/24 h Lactulosa EFG sobres 10 g, suspensión Magnesia cinfa® sobres 2,4 g, suspensión oral 200 mg/ml Hidróxido de magnesio 2,4 g 1 a 3 dosis/24 h Magnesia San Pellegrino polvo ® 2,24 g Magnesia lainco® sobres 2,4 g Casenglicol® gel, polvos Polietilenglicol/macrogol 4000 Casenlax® polvo 10 g Polietilenglicol/macrogol 4000 10-20 g/24h Movicol® sobres 13.8 g Polietilenglicol/macrogol 3350 13,8-41,4g/24h Molaxole® sobres 13,8 g Politetilenglicol/macrogol 3350 13,8-41,4g/24h Laxantes estimulantes (difenilmetanos) Nombre comercial Principio activo Dosis Bisacodilo comp. 5 mg, sup. 10 mg Dulcolaxo 5-10 mg/24 h Evacuol gotas 7,5 mg/ml Picosulfato sódico 5-10 gotas/24 h Espasmolíticos antagonistas de canales del calcio Nombre comercial Principio activo Dosis Spasmoctyl®, grágeas 40 mg Bromuro de otilonio 40 mg/12-8 h Eldicet® comp. 50 mg Bromuro de pinaverio 50 mg/8 h Relajantes directos del músculo liso Nombre comercial Principio activo Dosis Duspatalín®comp. 135 mg Mebeverina 135 mg/8 h Anticolinérgicos/antimuscarínicos Polibutin® comp. 100 mg y suspensión 24mg/5 ml Trimebutina 100-200 mg/8-12 h Buscapina® sup. 10 mg; comp. 10 mg. Metilbromuro de butilescopolamina 10 a 20 mg/8 h Esencia de menta Nombre comercial Principio activo Dosis Menta Gotas® 30 ml Aceite de menta 15-30 gotas/1-3 veces día Iberogast® 20/50/100 ml Menta y otros* 20 gotas/8 h (Alcaravea, Angélica archangélica raíz, Cardo mariano, Celidonia, Iberis amara, Manzanilla, Melissa officinalis hojas, Regaliz)* Antidepresivos (clase IRSS más utilizados) Nombre comercial Principio activo Dosis Citalopram EGF comp. 10 mg y varias marcas Citalopram 10-20 mg/24 h Paroxetina EGF comp. 20 mg y varias marcas Paroxetina 10-40 mg/24 Secretagogos Nombre comercial Principio activo Dosis Constella ® cápsulas 290 mg Linaclotida 290 mg/24 h Amitiza®comp. 24 mcg* Lubiprostona 24 mcg/12 h Procinéticos Nombre comercial Principio activo Dosis Resolor ® comp. 1-2 mg Prucaloprida 2 mg/24 h Antibióticos Nombre comercial Principio activo Dosis Spiraxin® comp. 200 mg Rifaximina 4 0 0 mg/8-12h Tabla 3.Mecanismo de acción de los fármacos utilizados frecuentemente en el SII-E y EF
Tratamiento Reducción dolor Reducción distensión abdominal Aumento frecuencia deposicional Esfuerzo defecatorio Fibra (Psyllium) (2-5 sobres/día) 0 - + + Espasmolíticos (2-4 comp./día) + + 0 0 Laxantes (1 - 3 comp. o sobres/día) 0 0 ++ ++ Procinéticos (Prucaloprida) (1 comp./día) + + ++ 0 Secretagogos (Linaclotide) (1 comp/día) ++ ++ ++ + Antidepresivos (ISRS) (1 comp/día) + 0 nc nc nc: datos no concluyentes.
- -
Facilitar al paciente información y recordatorios escritos, simples y de fácil comprensión.
- -
Elaborar «calendarios» de cumplimiento mediante los cuales monitorizar la toma de medicación o la realización de actividades pautadas.
- -
Proveer al paciente de información acerca de la fisiopatología de su proceso, adaptada a su idiosincrasia y nivel cultural, de manera que se sienta implicado en la evolución de su enfermedad.
- -
Incluir en todas estas estrategias a los familiares y cuidadores de manera que también actúen como refuerzo positivo de la actitud del paciente.
- -
Es muy importante la regularidad en el tratamiento indicado para el estreñimiento. Mientras unos pacientes se automedican permanentemente con laxantes estimulantes, otros los utilizan solo de forma intermitente y puntual ante agravamientos y, con cierta frecuencia, algunos pacientes evitan la toma de cualquier tratamiento con el concepto erróneo de que los laxantes producen dependencia o pueden resultar peligrosos.
Por último, conviene recordar que el personal de enfermería puede desempeñar un papel muy eficaz en la educación sanitaria y en el seguimiento de la evolución de estos pacientes.
En todo caso, es inútil intentar valorar la eficacia del plan terapéutico sin asegurar el óptimo cumplimiento del mismo por parte del paciente. Su falta de eficacia no será mejorada con modificaciones aisladas o globales de la prescripción si no es factible garantizar la mejor disponibilidad del paciente para comprometerse con dicho plan terapéutico.
Utilidad del ejercicio físico aeróbico para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensiónSe suele recomendar la realización de ejercicio físico de forma empírica para mejorar el estreñimiento y la distensión abdominal. El ejercicio físico aeróbico es útil para mantener una adecuada función intestinal y reducir el estrés3.
Eficacia. Un programa regular de actividad física aeróbica (caminar, bicicleta) puede ser eficaz en el estreñimiento, ya que se ha observado una mejoría en el TTC total y en rectosigma4. También se ha señalado su efecto beneficioso en la distensión abdominal y la retención de gas5, aunque en menor grado que en los sujetos sanos6. En otros dos estudios se demostró una mejoría global de los síntomas en el síndrome del intestino irritable (SII) y en la consistencia de las heces7,8. Además, también mejoraron otros aspectos que pueden influir en el SII, como la ansiedad y la depresión7.
Limitaciones. La práctica moderada y regular de ejercicio físico aeróbico ajustada a las condiciones físicas de cada individuo, no tiene grandes limitaciones clínicas, salvo en pacientes con alteración de la movilidad. Sin embargo, está por determinar la intensidad y la duración óptima del mismo.
Recomendaciones prácticas. El ejercicio físico aeróbico practicado de forma regular puede ser útil en la mejoría del estreñimiento, favorece la evacuación del gas intestinal y mejora la distensión, por lo que parece recomendable aconsejar su práctica en los pacientes con síndrome del intestino irritable con (predominio de) estreñimiento (SII-E) y estreñimiento (crónico) funcional (EF).
¿El aumento en la ingesta de líquidos mejora el estreñimiento?La mayoría de las guías clínicas recomiendan realizar modificaciones en el estilo de vida, como la adecuada ingesta de líquidos y de una dieta rica en fibra. En concreto, se suele recomendar beber de 1,5-2 L de líquido al día según algunas guías9–11 y otras revisiones más específicas sobre el EF en ancianos12.
Eficacia y limitaciones. En un estudio aleatorizado, la ingesta de 2 L de agua al día en pacientes con EF, que ya estaban consumiendo una dieta rica en fibra, mejoró la frecuencia defecatoria y la necesidad de laxantes13. Sin embargo, no se dispone de ensayos clínicos que demuestren que la ingestión de líquidos en sí misma, sin otras medidas adicionales, mejore el estreñimiento, salvo en pacientes deshidratados9,14.
Recomendaciones prácticas. Aunque la evidencia para recomendar el aumento de la ingesta de líquidos es insuficiente, esta medida sí que puede ofrecer algún beneficio en casos de estreñimiento leve asociada al adecuado consumo de fibra con la dieta.
Utilidad de fibra en la dieta para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensiónEn la mayoría de las guías se recomienda la dieta rica en fibra como medida inicial para mejorar el estreñimiento. Se suele aconsejar un aumento gradual de la misma para evitar la distensión abdominal; la cantidad de fibra recomendada al día es de unos 25-30g. Sin embargo, aunque esta medida puede mejorar la frecuencia defecatoria y la consistencia de las heces, puede empeorar otros síntomas como el dolor y la distensión abdominal.
Eficacia. En un metanálisis se concluyó que el consumo de ciruelas secas (100g/día) fue beneficioso para mejorar el estreñimiento y que este efecto fue incluso superior al obtenido con psyllium15.
En otro metanálisis la dieta rica en fibra fue útil para mejorar el estreñimiento, pero no para el dolor y la distensión abdominal en pacientes con SII16. En esta misma revisión sistemática, la fibra soluble de los alimentos es la que proporcionó algún beneficio en los pacientes con SII.
Limitaciones. Aunque los alimentos ricos en fibra soluble pueden tener algún beneficio en el estreñimiento, no ocurre lo mismo con la fibra insoluble. En un metanálisis se analizaron 5 estudios, con un total de 221 pacientes. Se llegó a la conclusión de que no existen diferencias en la mejoría sintomática al comparar los que tomaban fibra insoluble frente a los que hacían una dieta baja en fibra o recibían placebo (riesgo relativo [RR] 1,02; 95% intervalo de confianza [IC] 95%: 0,82-1,27)17. Por otra parte, en casos de estreñimiento grave con importante enlentecimiento del tiempo de tránsito colónico (TTC), la dieta con alto contenido en fibra no es eficaz y puede empeorar el dolor y la distensión9.
Recomendaciones prácticas. Una dieta con alimentos de alto contenido en fibra soluble (como las ciruelas secas), ha demostrado beneficio en la mejoría del estreñimiento leve pero no en la del dolor o la distensión abdominal, pudiendo incluso empeorar estos síntomas en pacientes con SII.
Utilidad de las distintas dietas en el síndrome del intestino irritable con estreñimiento y en el estreñimiento funcional para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensiónAproximadamente dos tercios de los pacientes con SII creen que sus síntomas son desencadenados por algún alimento.
En pacientes con SII se ha demostrado la existencia de sensibilidad al trigo en ausencia de enfermedad celiaca. En un ensayo clínico, se investigaron 920 pacientes con síntomas de SII y se evidenció que un tercio de los sujetos empeoró (aumento del dolor abdominal y la distensión) al ingerir trigo pero no placebo18. Sin embargo, está por determinar cuál es el papel de la sensibilidad al gluten no-celiaca, ya que en un estudio realizado en pacientes diagnosticados de esta entidad que cumplían criterios de SII, se comprobó que la administración de gluten en distintas concentraciones de forma aleatorizada y ciega frente a placebo no fue identificada por los pacientes19.
Aunque la malabsorción de lactosa no juega un papel en el estreñimiento, sí se ha relacionado con el dolor y la distensión abdominal en pacientes con SII. En una revisión sistemática se analizaron los resultados de 7 estudios en los que se había realizado test de hidrógeno espirado con lactosa en pacientes con SII; el resultado fue que más de un tercio de los mismos tenían malabsorción de lactosa y que la intolerancia a la misma también era más común en los pacientes que en los controles20; sin embargo, es frecuente que los pacientes con SII presenten síntomas gastrointestinales tras la ingesta de productos lácteos aun cuando no se demuestra malabsorción de lactosa.
Por otra parte, una extensión de la hipótesis de la intolerancia a distintos hidratos de carbono en el SII ha llevado a plantear una dieta exenta de oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP). En un estudio aleatorizado 41 pacientes con SII recibieron dieta baja en FODMAP o su dieta regular. El 68% de los pacientes que recibieron dieta baja en FODMAP refirió control adecuado de los síntomas con respecto al 23% que continuó con su dieta habitual (p = 0,005). La consistencia de las heces no se modificó en ambos grupos21. No obstante, en un estudio reciente, la dieta baja en FODMAP no fue superior al consejo dietético clásico en el SII22.
Limitaciones. Como efectos secundarios de este tipo de dietas hay que señalar la posible malnutrición si se mantienen de forma prolongada.
Recomendaciones prácticas. El papel de algunos componentes de la dieta como desencadenantes de los síntomas o en la patogénesis del SII es objeto de interés creciente. La dieta sin gluten o la dieta baja en FODMAP parecen mejorar los síntomas de dolor y distensión abdominal en el SII pero no el estreñimiento. La dieta FODMAP no ha sido evaluada en pacientes con EF pero es muy poco probable que sea de utilidad. En definitiva, la evidencia actual es limitada para su recomendación rutinaria en la práctica clínica para el SII-E y el EF.
Utilidad de los suplementos de fibra para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. ¿Qué tipo de fibra? ¿Cuál es la tolerabilidad?Mecanismo de acción. Los suplementos de fibra en la dieta engloban un conjunto de hidratos de carbono complejos poco digeribles en el intestino delgado y que alcanzan íntegros el colon, contribuyendo a aumentar el volumen fecal y siendo parcialmente fermentados por la microbiota produciendo ácidos grasos de cadena corta, agua y gases (hidrógeno, metano, dióxido de carbono). Suele clasificarse en fibra soluble e insoluble, según su comportamiento en solución acuosa. Los efectos biológicos de la fibra son la aceleración del TTC, un aumento de la biomasa con cambios en el pH colónico y la microbiota y potencialmente tiene efectos sobre la permeabilidad y la inflamación23.
Eficacia. Varios metanálisis han revisado la evidencia de la fibra sobre el EF y el SII. Todos ellos coinciden en la dificultad para extraer conclusiones conjuntas por la heterogeneidad de diseños y objetivos, y la baja calidad en general de los estudios. En conjunto, la fibra tiene un beneficio sobre los síntomas de estreñimiento (número de deposiciones, esfuerzo defecatorio) o sobre objetivos secundarios (uso de laxantes) superior al placebo, especialmente la fibra soluble (psyllium) tanto en estudios realizados en pacientes con EF como con SII. Los efectos sobre otros síntomas como el dolor o la distensión no están claros24–26.
Efectos adversos. Los principales efectos adversos de la fibra dietética se derivan de su potencial para producir distensión, en general derivado de la producción de gases por la fermentación bacteriana. La mayoría de los ensayos clínicos no lo señalan como efecto adverso relevante, pero la práctica clínica muestra que esto puede ser importante, especialmente en pacientes en los que el estreñimiento se asocia con distensión abdominal y dolor27.
Limitaciones. El uso de suplemento de fibra dietética no tiene grandes limitaciones clínicas; deben utilizarse con precaución y control clínico en pacientes inmovilizados o con trastornos graves conocidos de la motilidad intestinal y colónica, por un mayor riesgo de impactación.
Recomendaciones prácticas. La utilización de fibra dietética o suplemento de fibra como primera medida terapéutica es razonable en cualquier paciente con estreñimiento, asocie o no molestias abdominales, existiendo mayor evidencia con la fibra soluble, pudiendo considerarse que un curso de tratamiento de 6 semanas es suficiente para evaluar su eficacia28. Se debe prestar atención no solo a la eficacia sino también a la tolerancia, por lo que es aconsejable ir aumentando la cantidad de fibra de forma progresiva.
Utilidad de los laxantes osmóticos para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. Los laxantes osmóticos contienen iones no absorbibles o moléculas que retienen agua en la luz intestinal. Los más utilizados son el polietilenglicol (PEG), la lactulosa y las sales de magnesio.
Eficacia. Este tipo de laxantes mejoran el estreñimiento y la consistencia de las heces, pero se obtiene una pobre respuesta en el dolor y la distensión abdominal. La mayor evidencia, por los estudios disponibles, es para el PEG, pero las sales de magnesio se utilizan frecuentemente en la práctica clínica con resultado satisfactorio.
Solo dos ensayos clínicos han estudiado el uso de laxantes osmóticos (PEG) en SII-E. En el primero, no se observó superioridad con respecto al placebo29. En el segundo ensayo, se demostró mejoría en la frecuencia defecatoria pero no en el dolor o la distensión abdominal30.
En cuanto a los estudios específicos para el EF, en 5 ensayos se evaluó el PEG frente a placebo. Se demostró la superioridad del PEG con un número necesario de pacientes a tratar (NNT) de 3 (IC 95%: 2- 4). La lactulosa también fue superior al placebo con un NNT de 4 (IC 95%: 2-7)31.
En otra revisión sistemática en la que se comparan PEG y lactulosa, el PEG fue superior en los resultados: número de deposiciones a la semana, consistencia de las heces, alivio del dolor abdominal y necesidad de otros fármacos32.
Efectos adversos. Los efectos secundarios más frecuentes son dolor y distensión abdominal, diarrea, náuseas y vómitos. Se han descrito muy pocos casos de reacciones de hipersensibilidad (erupción, urticaria o edema). Tienen buen perfil de seguridad y se pueden utilizar en pacientes ancianos, mujeres embarazadas y durante la lactancia. También se pueden utilizar en caso de insuficiencia hepática o renal. El PEG tiene menos efectos secundarios que la lactulosa y su administración es segura durante periodos prolongados (hasta 6 meses). En el caso de las sales de magnesio, el efecto secundario más común es el desequilibrio electrolítico; por ello, se debe utilizar con precaución en pacientes con insuficiencia renal por el riesgo de hipermagnesemia11.
Limitaciones. La principal limitación de este grupo de laxantes es su escasa respuesta para el control del dolor y la distensión abdominal, síntomas importantes, sobre todo en pacientes con SII. El PEG parece algo superior a la lactulosa en este sentido y por ello, esta última no es recomendable en pacientes con SII-E33.
Recomendaciones prácticas. Los laxantes osmóticos son útiles para el tratamiento del estreñimiento pero no para el control del dolor y la distensión abdominal, por lo que son fármacos de primera línea en el EF pero su utilidad es más limitada en el SII-E. El PEG es más eficaz que la lactulosa en el control de los síntomas y produce menos efectos secundarios, por lo que debe considerarse como fármaco de primera elección. Tienen un buen perfil de seguridad, por lo que se pueden utilizar en situaciones específicas, como en ancianos, durante el embarazo y en pacientes con insuficiencia renal y hepática.
Utilidad de los laxantes estimulantes para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. Estos fármacos favorecen la secreción de agua y electrólitos en el colon o inducen la peristalsis del mismo. Entre los laxantes estimulantes se incluyen los difenilmetanos (fenolftaleína, bisacodilo, picosulfato sódico) y las antraquinonas (Senna, cáscara sagrada, aloe vera).
Eficacia. En dos ensayos clínicos se estudió la eficacia del bisacodilo y del picosulfato sódico. En el primero se incluyeron 247 pacientes a los que se trató con 10mg de bisacodilo, frente a 121 pacientes que recibieron placebo una vez al día durante 4 semanas. El bisacodilo fue superior al placebo para mejorar el estreñimiento, otros síntomas asociados al mismo y mejorar la calidad de vida34. En el segundo ensayo se evaluó la eficacia del picosulfato sódico frente a placebo, de forma que 131 pacientes recibieron 10mg de picosulfato sódico y 71 placebo durante 4 semanas. Como en el caso anterior, el picosulfato sódico fue superior al placebo para mejorar el estreñimiento35. Considerando ambos estudios en conjunto, en el 42,1% de los pacientes que recibieron laxantes estimulantes fracasó el tratamiento frente al 78% de los que recibieron placebo, con un NNT de 3 (IC 95%: 2-3,5)31.
Efectos adversos. Los efectos adversos más frecuentes son dolor abdominal, diarrea, náuseas y vómitos. Con menor frecuencia se han descrito reacciones alérgicas. Los tratamientos prolongados pueden provocar pérdida de líquidos y electrólitos, por lo que se deben utilizar con mucha precaución en ancianos, pacientes con insuficiencia cardiaca o en pacientes con tratamiento diurético o con corticoides. No se dispone de suficientes estudios para poder garantizar su seguridad durante el embarazo, por lo que no se recomiendan en esta situación.
Limitaciones. Como ocurre con los laxantes osmóticos, estos fármacos no han demostrado su eficacia en el control del dolor y la distensión abdominal, e incluso pueden empeorar estos síntomas. Por otra parte, en muchos casos los pacientes no pueden conseguir un ritmo intestinal «predecible».
Recomendaciones prácticas. Los laxantes estimulantes son útiles para el tratamiento del estreñimiento, aunque menos eficaces para controlar el dolor y la distensión abdominal, por lo que su utilidad es muy limitada en el SII-E. Su perfil de seguridad es menor que el de los laxantes osmóticos.
Utilidad de los probióticos para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensiónMecanismo de acción. Los probióticos son bacterias vivas que poseen diversas características como son la supervivencia en el tracto gastrointestinal, la adherencia al epitelio intestinal y la modulación de la flora intestinal, inhibiendo las bacterias potencialmente patógenas y produciendo diversos efectos inmunomoduladores e inmunoestimulantes, como el estímulo para la proliferación de células inmunitarias, el aumento en la actividad de las células fagocíticas o el incremento en la producción de IgA. Todo ello, determina su potencial efecto beneficioso en la prevención de infecciones, especialmente por patógenos de origen intestinal, y de la translocación bacteriana36–38.
Eficacia. En base a las revisiones sistemáticas y metanálisis existentes al respecto, el uso de los probióticos para el alivio de los síntomas globales (mejoría de la defecación, de la hinchazón abdominal y el dolor abdominal) de los pacientes con SII, es todavía incierto, existiendo por una parte estudios que arrojan resultados positivos a su uso, como otros que no encuentran diferencias significativas.
Respecto al EF, los datos son más inciertos todavía, dada la heterogeneidad entre los diversos estudios y sesgos existentes en los mismos31,39–41.
Efectos adversos. En ningún estudio se aprecian efectos secundarios respecto del uso de probióticos en este tipo de pacientes.
Limitaciones. No se encuentran actualmente limitaciones al uso de probióticos en ningún estudio.
Recomendaciones prácticas. Dada la falta de evidencia actual a favor por los resultados contradictorios que arrojan los diversos estudios respecto de su eficacia en el alivio de los síntomas de dolor abdominal, distensión y mejora en el ritmo deposicional en los pacientes con SII-E y EF, no podemos recomendar hoy por hoy su uso en estos pacientes.
Utilidad de los antibióticos para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensiónMecanismo de acción. La rifaximina es un antibiótico sintético derivado de la rifamicina, con actividad grampositiva, gramnegativa y frente a microorganismos aerobios y anaerobios, no absorbible a través de la mucosa intestinal (<0,01% tras la administración oral) por lo que actúa intraluminalmente, con nulo efecto sistémico. Impide la adherencia de los patógenos a la mucosa intestinal y la invasión de las células epiteliales por estos, al unirse a la subunidad β de la ácido ribonucleico polimerasa microbiana, inhibiendo de este modo la transcripción y la síntesis de ácido ribonucleico42.
Eficacia. El uso de rifaximina parece reducir según las revisiones de los estudios llevados a cabo, los síntomas de distensión, flatulencia y dolor abdominal en los pacientes con SII sin estreñimiento31,42–44. En un estudio se señala que pudiera ser útil en el subgrupo de pacientes de SII-E45.
No hay actualmente, estudios que evalúen sus efectos en el EF.
Limitaciones. Efectos adversos y contraindicaciones. No se reflejan en los distintos estudios y revisiones, efectos secundarios mayores o más frecuentes que los comparados con placebo46–48.
Recomendaciones prácticas. No existen suficientes datos actualmente para recomendar la utilización de rifaximina en pacientes con EF o SII-E, aunque podría disminuir la hinchazón y la flatulencia.
Utilidad de los espasmolíticos para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. Los espasmolíticos se han utilizado clásicamente en el tratamiento empírico del SII basándose en que la contracción espástica del músculo liso colónico contribuye a los síntomas del SII, especialmente al dolor. Se distinguen 3 clases principales: antagonistas de canales del calcio (otilonio y pinaverium), relajantes directos del músculo liso (mebeverina) y anticolinérgicos/antimuscarínicos (hioscina, cimetropium, hidrocloruro de diciclomina).
Eficacia. Los espasmolíticos son superiores al placebo en la mejoría de los síntomas en el SII, sobre todo el dolor y la distensión abdominal (38% en el grupo placebo y 56% en el grupo tratado con espasmolíticos; odds ratio [OR]: 2,13 [IC 95%: 1,77-2,58])49. El efecto de los distintos espasmolíticos de forma individual es variable y difícil de interpretar, ya que solo hay un reducido número de estudios que evalúen cada uno de los 12 diferentes fármacos disponibles. De todos ellos, el bromuro de otilonio (5 ensayos) y la hioscina (3 ensayos) mostraron evidencia de eficacia17. El bromuro de cimetropium, de pinaverium y el hidrocloruro de diciclomina también han demostrado cierto grado de beneficio31. En cualquier caso, hay que tener en cuenta la heterogeneidad de los estudios. Otros espasmolíticos estudiados no fueron superiores al placebo.
En otro ensayo clínico multicéntrico se demostró además que los pacientes tratados con bromuro de otilonio tuvieron menos probabilidad de recurrencias de los síntomas que los tratados con placebo50.
Efectos adversos. El 14% de los pacientes tratados con espasmolíticos refirieron efectos secundarios, frente al 9% de los tratados con placebo. Los efectos secundarios más frecuentes fueron sequedad bucal, mareo y visión borrosa y no hubo ningún efecto adverso grave. El RR de presentar un efecto adverso frente a placebo fue 1,61 (IC 95%: 1,08-2,39)17,31.
Los espasmolíticos con más acción anticolinérgica pueden provocar alteraciones visuales, retención urinaria, estreñimiento y sequedad de boca. Se deben administrar con precaución en pacientes ancianos, con antecedentes de infarto agudo de miocardio e hipertensión. No se recomienda su utilización en el embarazo y en la lactancia, ya que su seguridad en estas situaciones no ha sido establecida.
Limitaciones. Los espasmolíticos son útiles en el control del dolor y la distensión abdominal pero no tienen acción sobre el estreñimiento.
Recomendaciones prácticas. Los espasmolíticos son eficaces en el tratamiento del dolor y la distensión abdominal en pacientes con SII con buen perfil de seguridad. Los efectos secundarios de estos fármacos son poco frecuentes; no obstante, los que tienen mayor acción anticolinérgica pueden tener efectos adversos a dosis altas.
Utilidad de la esencia de menta para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversosMecanismo de acción. La esencia de menta, con frecuencia también llamado aceite, tiene propiedades espasmolíticas y en la modulación del dolor al atenuar la hipersensibilidad visceral.
Eficacia. En dos revisiones sistemáticas se demuestra un efecto superior al placebo en el control del dolor en pacientes con SII17,31. En la más reciente se incluyeron 5 ensayos con un total de 482 pacientes51–55; se demostró un efecto positivo estadísticamente significativo a favor de la esencia de menta frente a placebo, con un NNT de 3 (IC 95%: 2-4)31. Sin embargo, había heterogeneidad significativa entre los estudios.
Efectos adversos. En los estudios señalados no se describieron efectos secundarios significativos con respecto al placebo. La esencia de menta no suele tener efectos adversos a dosis convencionales, pero se han descrito reacciones alérgicas, pirosis y cefalea. No se conoce su perfil de seguridad a las dosis que se utilizan para el tratamiento en SII en el caso de embarazo y lactancia, por lo que no se recomienda su utilización en estas situaciones.
Limitaciones. Como ocurre con otros espasmolíticos, no tiene acción demostrada sobre el estreñimiento.
Recomendaciones prácticas. La esencia de menta ha demostrado ser eficaz para el control del dolor y la distensión en pacientes con SII con escasos efectos adversos.
Utilidad de la prucaloprida para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. La serotonina (5-HT) juega un papel crucial en el tracto gastrointestinal influyendo en las funciones secretora, motora y sensorial. Existen 7 subtipos de receptores de 5-HT a nivel intestinal. De ellos, el receptor 5-HT4 favorece la secreción intestinal, aumenta el peristaltismo y el tránsito intestinal56. Prucaloprida es un agonista altamente selectivo del receptor 5-HT4 y que por tanto, actúa estimulando la motilidad intestinal57.
Eficacia. En los ensayos fase III prucaloprida fue superior al placebo en mejorar el estreñimiento, el dolor y la distensión abdominal así como la calidad de vida58–60.
En una revisión sistemática en la que se incluyeron 8 ensayos clínicos, la respuesta de prucaloprida para mejorar el estreñimiento fue superior a la obtenida con placebo (fracaso del tratamiento en 71% de los pacientes con prucaloprida y en 87,4% con placebo), aunque se identificó importante heterogeneidad en los estudios31.
En otro metanálisis, en el que se incluyeron 9 ensayos, también se demostró la eficacia de prucaloprida en el estreñimiento consiguiendo una media de al menos 3 deposiciones a la semana (RR=1,63; IC 95%: 1,07-2,49). Además, mejoraron tanto la calidad de vida (RR=1,51; IC 95%: 1,07-2,11) como la consistencia de las heces (diferencia media frente al grupo control 9,16; IC 95%: 7,28-11,03)61. También parece ser un fármaco útil para el estreñimiento refractario en el anciano según los resultados obtenidos en un ensayo clínico fase II62.
Por otra parte, hay que reseñar su potencial utilidad, aunque no hay suficiente evidencia al respecto, en otros trastornos de la motilidad que cursan con estreñimiento, como la seudoobstrucción intestinal crónica. Prucaloprida mejoró los síntomas de distensión y dolor abdominal en pacientes con esta patología63.
Se necesitan estudios para verificar la asociación de prucaloprida con otros fármacos, como linaclotida o lubiprostona, para los casos de estreñimiento grave.
Efectos secundarios. La seguridad y tolerancia del fármaco es buena. Los efectos secundarios más frecuentes son dolor de cabeza, náuseas, dolor abdominal y diarrea. El perfil de seguridad cardiaco es muy bueno debido a su afinidad selectiva por los receptores 5-HT4 intestinales. No obstante, se debe utilizar con precaución en la insuficiencia renal avanzada y en la insuficiencia hepática grave. No se recomienda la utilización de prucaloprida durante el embarazo (fármaco de clase C) ni durante la lactancia.
Limitaciones. El fármaco no ha sido comercializado en España con la indicación de SII-E aunque por lo señalado anteriormente, podría tener un papel en los casos de SII-E grave y sin respuesta a otros tratamientos.
Recomendaciones prácticas. Prucaloprida es un fármaco útil en el tratamiento del EF sin respuesta a otras medidas farmacológicas; en menor medida, también mejora el dolor y la distensión en estos pacientes con un buen perfil de seguridad. Se puede utilizar en pacientes ancianos con estreñimiento refractario, con la recomendación de reducir la dosis a la mitad (1mg).
Utilidad de la linaclotida para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. La linaclotida es una agonista de la guanilato ciclasa C, cuyo estímulo produce un aumento del guanosín monofostafo cíclico intracelular en el enterocito. Este guanosín monofostafo cíclico actúa a nivel intracelular produciendo un aumento de la secreción de bicarbonato y cloro hacia la luz intestinal y se difunde al espacio extracelular ejerciendo una acción sobre las terminaciones sensitivas, disminuyendo su actividad. Desde el punto de vista farmacodinámico, el efecto final es un aumento de la secreción intraluminal con la consiguiente aceleración del tránsito y un efecto analgésico visceral, con disminución de umbrales sensitivos a la distensión mecánica64,65.
Eficacia. Tomando como base los ensayos clínicos y metanálisis comparativos de linaclotida frente a placebo66,67 tanto en pacientes con SSI-E (RR: 1,95 con IC 95%: 1,3-2,9, basado en 7 estudios) como en pacientes con EF (RR 4,26 con IC 95% 2,80-6,47, basado en 3 estudios), linaclotida es claramente eficaz para aliviar los síntomas de estreñimiento con NNT 7 (IC 95% 5–11)66en ambos grupos de pacientes, mostrando unos resultados muy homogéneos a lo largo de todos los estudios. Los efectos de linaclotida no se limitan solo a su acción sobre los síntomas de estreñimiento sino que en ambos grupos (EF, SII-E) se muestra en los ensayos clínicos una mejoría del dolor y la distensión (un beneficio entre un 15-30% sobre el placebo).
Efectos adversos. Desde el punto de vista práctico, el único efecto adverso registrado relevante es la diarrea, cuya importancia ha de ser evaluada con el paciente. De hecho, en los ensayos clínicos se reporta diarrea en aproximadamente un 20% de los pacientes tratados con linaclotida, pero solo un 2% es catalogada como grave y solo motivó la retirada del fármaco en el 4,5% de los pacientes tratados.
Limitaciones. La linaclotida no se absorbe y no pasa a la circulación sistémica, ni actúa sobre el citocromo P450; por ello, aunque no se ha estudiado específicamente en pacientes con insuficiencia hepática o renal, no cabe pensar que exista ninguna limitación para su uso en este tipo de pacientes. Su eficacia y seguridad es similar tanto en el anciano como en el adulto de mediana edad. No existen datos respecto a la posibilidad de efectos teratogénicos, aunque son improbables, y por ello no se aconseja su utilización en el embarazo. El fármaco está comercializado en España para la indicación de SII-E, no para el EF. En otros países europeos o en EE. UU., donde se indica en EF, se utiliza a mitad de dosis.
Recomendaciones prácticas. La linaclotida es el fármaco de elección en pacientes con estreñimiento y molestias abdominales, como dolor y distensión cuando la fibra dietética y los laxantes han fracasado66,67.
Utilidad de la lubiprostona para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. La lubiprostona es un derivado prostaglandínico que activa los canales del cloro tipo 2 (CIC-2) de la membrana luminal del enterocito, produciendo un aumento de la secreción de cloro hacia la luz intestinal, lo que conlleva un aumento del tránsito intestinal. No se han demostrado efectos sobre la sensibilidad visceral.
Eficacia. La lubiprostona ha mostrado su eficacia para mejorar los síntomas de estreñimiento NNT 4 (IC 95% 3-7)68. En ensayos clínicos en pacientes con síndrome de intestino irritable ha mostrado un cierto efecto sobre el dolor (aproximadamente un 7% de ventaja sobre el placebo) que aparece al mes de tratamiento68,69.
Efectos adversos. Los principales efectos adversos son la diarrea y las náuseas, ocurriendo estas últimas hasta en un 15% de los pacientes que reciben tratamiento activo. Aunque raro, se ha descrito disnea en relación con lubiprostona.
La lubiprostona no requiere ajuste en pacientes con insuficiencia renal; aunque no existe evidencia de metabolización hepática, la FDA recomienda reducir la dosis en paciente con hepatopatía con un grado B o C de Child-Pugh. Está contraindicado su uso durante el embarazo, encontrándose clasificada en la categoría C.
Recomendaciones prácticas. La lubiprostona no se encuentra comercializada en Europa.
Utilidad del biofeedback anorrectal para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensiónMecanismo de acción. El biofeedback (BFB) anorrectal es una técnica de reeducación indicada en pacientes con disinergia defecatoria en la que se monitoriza la actividad fisiológica anal y rectal y se muestran las alteraciones al paciente enseñando las maniobras adecuadas para corregirlas.
Eficacia. Los estudios comparando el BFB con el BFB ficticio, tratamiento estándar, laxantes o diazepan70,71, muestran una superioridad del BFB sobre todos ellos, de una magnitud variable, para mejorar los síntomas de estreñimiento. Tan solo un estudio evalúa su efecto sobre el dolor abdominal, observando un beneficio significativo comparado con laxantes. Ningún estudio evalúa su efecto sobre la distensión abdominal.
Efectos adversos. No se han descrito. No existen a priori limitaciones para la aplicación del BFB por las características del paciente, aunque se requiere una adecuada disponibilidad y capacidad para seguir las instrucciones y completar la reeducación.
Recomendación práctica. El BFB es la técnica de elección en pacientes con estreñimiento y disinergia pélvica demostrada72.
Utilidad de los antidepresivos para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. Las vías por las que estos fármacos ejercen sus efectos beneficiosos, varían dependiendo de qué familia de fármacos utilicemos.
Los antidepresivos tricíclicos (ADT) (amitriptilina). Logran sus efectos, mediante la capacidad de modulación de la percepción del dolor a nivel central73.
Los inhibidores de la recaptación de la serotonina (ISRS) (fluoxetina, paroxetina, citalopram, escitalopram): Disminuyen la sensibilidad visceral, mejoran la sensación de bienestar global, poseen propiedades ansiolíticas y potencian los efectos de otros fármacos como los ADT73,74.
Los inhibidores de la recaptación de la serotonina y noradrenalina (ISRSN) (duloxetina, venlafaxina, desvenlafaxina): mejoran el control del dolor mediante el bloqueo dual de los receptores de serotonina y noradrenalina75.
EficaciaSobre la eficacia de los ADT y los ISRS, hay resultados dispares dependiendo del fármaco estudiado. En un metanálisis73, el uso de ADT o ISRS, mejoraron de forma global los síntomas de distensión, dolor abdominal y también la consistencia de las heces en pacientes con SII con una NNT de 4 para ambas terapias (IC 95% 3-6; 4 para ADT con IC 95% 3-8 y 3,5 para ISRS con IC 95%2-14). Sin embargo, en el SII-E no debe utilizarse los ADT por aumentar el estreñimiento.
Por otra parte, en otro estudio74 donde se analizó la terapia durante 16 semanas con fluoxetina (ISRS), se concluye que fluoxetina, a dosis inferiores a las que se utilizan en el tratamiento para las distintas psicopatologías, mejoró de forma global todos los síntomas asociados de SII-E (dolor, distensión abdominal y consistencia de las heces). El análisis con paroxetina frente a placebo, doble ciego y randomizado, no encontró diferencias significativas en la variable principal (dolor abdominal), pero sí en las de memoria global y severidad de los síntomas76. También hay estudios a favor de citalopram en este aspecto75.
Respecto de los ISRSN, solo duloxetina a dosis de 60mg/día ha sido estudiada en pacientes con SII77, mejorando los síntomas de dolor y consistencia de las deposiciones.
Limitaciones. Efectos adversos78ADT. Son lo que tienen un mayor número de efectos secundarios derivados de los múltiples mecanismos de acción (sequedad de boca, estreñimiento, náuseas, vómitos, hipotensión ortostática, etc.). Debido a que favorecen marcadamente el estreñimiento no deben utilizarse en SII-E (ni, obviamente, en EF). Precaución en enfermos cardiacos, neurológicos, urológicos e insuficiencia hepática entre otros.
ISRS. Mejor tolerados que los ADT. Suelen ser leves, pero molestos y en ocasiones obligan a la retirada del fármaco. Entre ellos están la sequedad oral y el adormecimiento, disminución de la libido, anorgasmia, alteraciones gastrointestinales (sensación nauseosa, diarreas o estreñimiento) y ganancia ponderal.
ISRSN. También mejor tolerados que los ADT. Pueden provocar náuseas, somnolencia, mareos, diarrea, fatiga, estreñimiento, hiperhidrosis, boca seca, vómitos, disminución del apetito, astenia y anorexia.
Recomendaciones prácticas. El uso de antidepresivos, a dosis inferiores a las usadas para las alteraciones psiquiátricas, puede estar indicado en el tratamiento de los síntomas persistentes de distensión y dolor abdominal y mejora de la consistencia de las heces en el SII-E. Los antidepresivos recomendados en el SII-E son los ISRS, evitando los ADT. Debería reservarse su uso a pacientes con persistencia de estos síntomas tras otros tratamientos (medidas higiénico-dietéticas, laxantes y linaclotida), así como a aquellos con una psicopatología asociada que indique su uso. Cuando clínicamente sean eficaces, se recomienda prolongar el tratamiento al menos 6 meses.
No hay datos suficientes actualmente, para hacer esta recomendación en los casos de EF, salvo en la existencia de comorbilidad psiquiátrica que tenga indicado su uso.
Utilidad de los tratamientos psicológicos en pacientes con SII para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. Diversos estudios han señalado la asociación entre el estrés psicológico y el empeoramiento de los síntomas gastrointestinales en pacientes con SII79–82. No tienen lugar en tratamiento de EF. Los tratamientos psicológicos pueden disminuir el nivel de estrés, modificar el umbral perceptivo visceral y en consecuencia, conseguir mejorar la clínica de los pacientes3 en cuanto a la mejora del dolor y del hábito intestinal.
Eficacia. En una revisión sistemática sobre los tratamientos psicológicos, en la que se incluyeron 2.189 pacientes, se observó un efecto estadísticamente significativo a favor de las terapias psicológicas, con un NNT de 4 (IC 95%: 3-5); no obstante, se observó importante heterogeneidad en los estudios y la calidad de los mismos es limitada31. Por otra parte, por el tipo de intervención no fue posible seleccionar estudios doble ciego. Con respecto a los 10 diferentes tipos de terapias, las que han demostrado beneficio han sido la terapia cognitiva-conductual, la hipnoterapia, el tratamiento psicológico multicomponente presencial y vía telefónica y la psicoterapia dinámica31.
La hipnosis puede modificar el umbral perceptivo visceral y conseguir una mejoría clínica a corto y largo plazo83,84.
Efectos secundarios. No se han descrito.
Limitaciones. Este tipo de terapias requiere la colaboración del paciente, así como dedicación y tiempo por parte del terapeuta y del paciente. Además, son tratamientos caros y poco accesibles.
Recomendaciones prácticas. Algunos tipos de tratamientos psicológicos, como la terapia cognitivo-conductual y la hipnosis, pueden ser útiles para controlar el dolor abdominal, además de disminuir el nivel de estrés en pacientes con SII.
Utilidad de la acupuntura en pacientes con SII para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversosMecanismo de acción. La acupuntura se basa en el efecto de la estimulación de determinadas zonas o «puntos gatillo» repartidas por todo el cuerpo, que tienen relación con las distintas vísceras y otras partes del organismo (articulaciones, paquetes musculoesqueléticos, etc.) a través de la inserción superficial en la piel, de finas agujas. A este respecto, determinados puntos de estimulación, se relacionan con el dolor abdominal, la diarrea y el estreñimiento, pudiendo actuar sobre estos síntomas tratando de estimular los puntos necesarios mediante esta técnica85.
Eficacia. En un metanálisis en el que se incluyeron 17 estudios controlados y randomizados sobre los probables beneficios de la acupuntura en la mejoría de los síntomas globales y la calidad de vida de pacientes con SII, no se pudieron hallar datos favorables al respecto86.
Otro estudio que evaluó el tratamiento con acupuntura y sus efectos a nivel de mejora global de síntomas como variable principal y como variables secundarias la mejora en la calidad de vida, y en los diversos síntomas por separado, tampoco encontró diferencias a favor de dicha terapia87.
Respecto del probable efecto sobre los síntomas en EF no hay, hoy por hoy, estudios al respecto.
Limitaciones. No se han descrito limitaciones en este tipo de terapia.
Recomendaciones prácticas. No hay evidencia disponible que permita recomendar la acupuntura para mejorar los síntomas y la calidad de vida de los pacientes con SII-E o EF.
Utilidad de los supositorios y los enemas como medicación de rescate para mejorar el estreñimiento. Efectos adversos y precauciones en situaciones especialesLos enemas y supositorios son esenciales en el tratamiento del estreñimiento complicado con impactación fecal, en algunos casos de defecación obstructiva y como complemento de otras medidas terapéuticas en casos de estreñimiento grave con importante alteración del tránsito intestinal para conseguir la limpieza del colon distal.
Mecanismo de acción. Existen diferentes tipos de enemas y supositorios. Todos ellos, producen distensión rectal favoreciendo la defecación. Dependiendo del tipo de enema, pueden existir mecanismos de acción adicionales, por ejemplo, los enemas salinos hacen que el agua drene hacia el colon, los de fosfato estimulan la motilidad colónica y los de aceite mineral o emolientes lubrican y ablandan las heces duras. Como ocurre con los enemas, dependiendo del tipo de supositorios varía su mecanismo de acción. Existen supositorios con efecto estimulante, como los que contienen bisacodilo. Otros, como los supositorios de glicerina, tienen acción local. El efecto mecánico para la inserción del supositorio, puede por sí mismo estimular la defecación.
Eficacia. La evidencia científica respecto al tipo de enema que se debe utilizar es escasa, aunque la utilización de agua templada, suero salino (fisioenema) o algún tipo de sustancia osmótica suele ser lo más frecuente88.
En el caso de pacientes con disfunción neurogénica intestinal secundaria a lesión medular se ha utilizado con éxito el sistema de irrigación anal con Peristeen® mediante el cual se introducen unos 750mL de agua templada en el colon. En un estudio aleatorizado se consiguió reducir el número de procedimientos necesarios para conseguir la limpieza intestinal, además de mejorar la incontinencia y la calidad de vida de los pacientes con respecto al tratamiento conservador89. Estos alentadores resultados se han confirmado posteriormente en un estudio multicéntrico italiano, que concluye que se puede considerar el tratamiento de elección en este tipo de pacientes90. Además esta terapia es coste-efectiva con respecto al tratamiento conservador90,91.
Otros enemas frecuentemente utilizados son los de fosfato de sodio de 250mL que tienen un efecto osmótico y también los enemas de suero salino (fisioenema), que no tienen efectos secundarios ni requieren receta médica, como sí ocurre con los enemas de fostatos, cuyos efectos secundarios se señalan en el siguiente apartado.
En el caso de los supositorios, como se ha señalado anteriormente, hay que diferenciar los que actúan localmente, de forma tópica, para favorecer el vaciado de la ampolla rectal, de los supositorios activos, como por ejemplo los de bisacodilo, que se tratan en el apartado de los laxantes estimulantes.
Efectos secundarios. No se han descrito efectos secundarios importantes de la irrigación de agua con el sistema Peristeen®.
En el caso de los enemas de fosfato, su utilización prolongada puede ocasionar desequilibrios hidroelectrolíticos, como hiperfosfatemia, hipocalcemia e hipernatremia. Por ello, se deben utilizar con precaución en caso de alteraciones electrolíticas previas, como en la insuficiencia renal grave, en pacientes ancianos, en caso de hipertensión no controlada y en la insuficiencia cardiaca. El abuso en la aplicación de enemas también puede provocar fibrosis y estenosis anorrectal por microtrauma de repetición92.
Los efectos adversos más frecuentes de los supositorios son irritación, escozor o picor anal. Debido al tipo de medicamento del que se trata y a su vía de administración, no afecta al uso concomitante de otros fármacos.
Limitaciones. En algunos casos, la correcta aplicación de los supositorios o enemas puede ser difícil en pacientes con problemas de movilidad, como ocurre en los casos de lesión medular. Sin embargo, esta dificultad parece ser menor con la utilización del sistema Peristeen®.
Recomendaciones prácticas. Los enemas son útiles en el caso de estreñimiento complicado con impactación fecal y como medida de rescate asociada a otros tratamientos en casos de estreñimiento grave, aunque no hay evidencia científica al respecto. Sí que hay evidencia de la utilidad de la irrigación transanal de agua con el sistema Peristeen® en pacientes con lesión medular y probablemente pueda tener cierta eficacia en otros casos de estreñimiento grave.
Utilidad de la neuroestimulacón de raíces sacras para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. Consiste en la estimulación de las raíces sacras S3-S4 mediante electrodos implantados, inicialmente de forma temporal durante unas 4 semanas y posteriormente, si se muestra eficaz, implantados de forma permanente. El mecanismo de acción no está claro pero parece mejorar la sensibilidad rectal y la contractilidad colónica, mejorando el TTC.
Eficacia. Los estudios publicados respecto a la eficacia de la neuroestimulación de raíces sacras se centran en pacientes con estreñimiento por tránsito lento refractarios a todo tipo de tratamiento y se carece de estudios controlados, evaluándose la eficacia mediante diseños cruzados. Un metanálisis de la Cochrane Database of Systematic Reviews de 2007 señala un aumento del número de deposiciones de 2 a 5 semanales y una mejoría del dolor y la distensión abdominal93. El estudio más relevante es un estudio multicéntrico europeo con 62 pacientes; se implanta el dispositivo de forma permanente al 73%, obteniéndose una mejoría sostenida en un seguimiento a 28 meses de los síntomas de estreñimiento, dolor y distensión abdominal. No obstante, persisten las dudas respecto al beneficio a más largo plazo94.
Efectos adversos. El procedimiento no está exento de efectos adversos. En el estudio multicéntrico94 se registran 11 efectos adversos graves relacionados con el tratamiento, fundamentalmente por infección, dolor postimplantación, erosión mecánica de tejidos y migración del electrodo.
Entre las precauciones especiales cabe señalar la recomendación de detener la estimulación si ocurre un embarazo. No existe información respecto a su seguridad en pacientes con comorbilidades importantes.
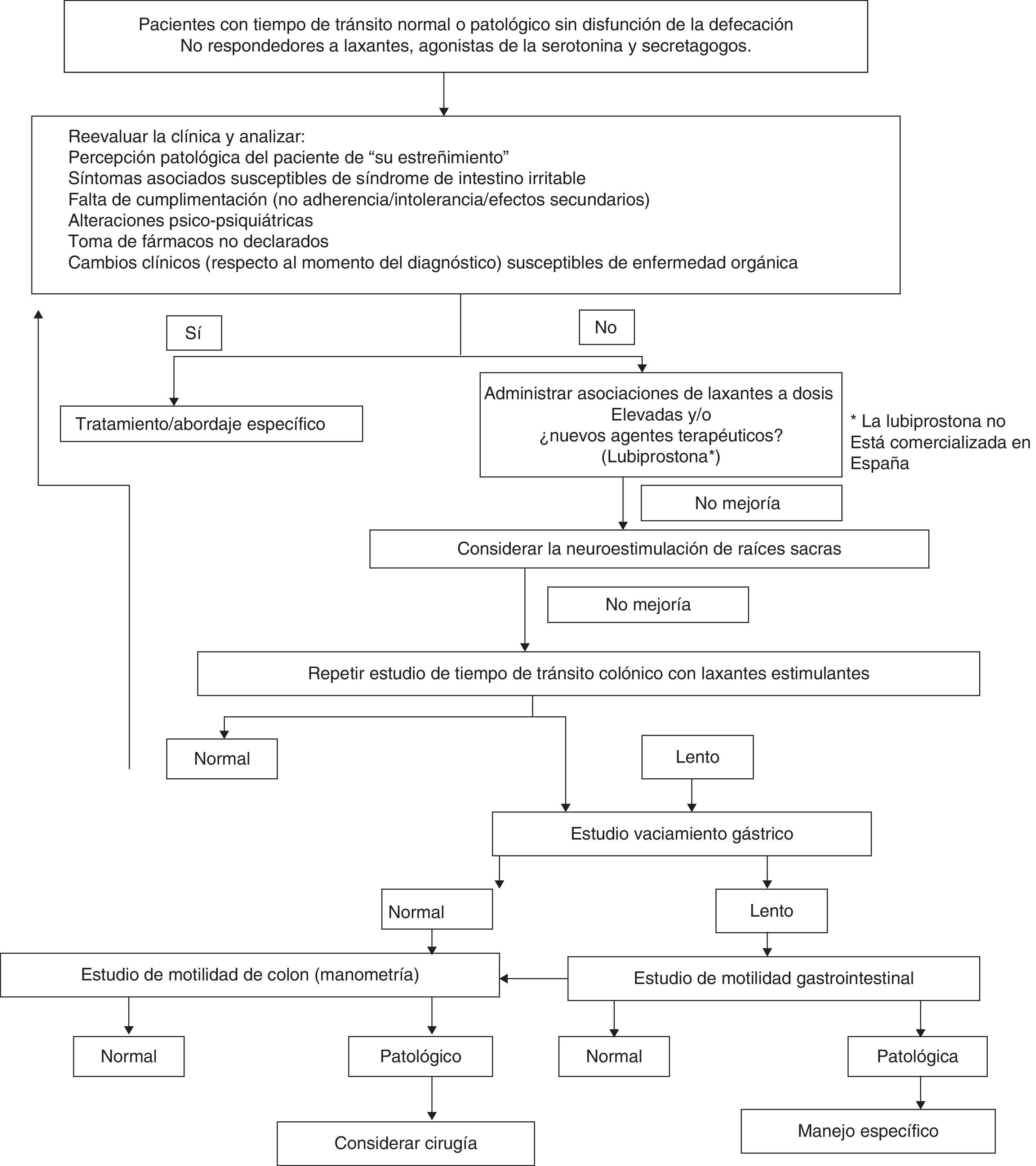
Recomendación práctica. La utilidad de la neuroestimulación de raíces sacras es discutida, por lo que debería considerarse una opción únicamente en pacientes con EF intratable por TCL, en los que se ha descartado una disinergia defecatoria.
Utilidad de la cirugía para mejorar: a) el estreñimiento, b) el dolor abdominal, c) la distensión. Efectos adversos y precauciones en situaciones especialesMecanismo de acción. La cirugía se ha propuesto para el tratamiento del estreñimiento con TCL grave mediante técnicas resectivas (colectomía), siendo el mecanismo de acción una disminución de la capacidad reabsortiva del agua del material fecal.
Eficacia. No existen estudios controlados de cirugía en el EF y la eficacia debe extrapolarse de la revisión de series de casos95. En este análisis de 2011, de 48 estudios con 1.443 pacientes, el 65% mejoró la frecuencia defecatoria y un 88% no requirieron laxantes posteriormente. Su eficacia sobre la distensión abdominal y el dolor no es conocida.
Efectos adversos. De acuerdo con la revisión de series de casos95, la mortalidad se sitúa en el 0,2%. Además de las complicaciones inmediatas (íleo: 0-16%, infección: 0-13%, dehiscencia de anastomosis: 0-22%), se deben considerar importantes complicaciones tardías (obstrucción: 0-74%, incontinencia 0-53%).
Recomendación práctica. La cirugía debe reservarse para casos excepcionales de estreñimiento en los que se ha demostrado un TCL descartando seudoobstrucción intestinal y disinergia defecatoria y tras una evaluación psicológica adecuada. Estos pacientes deben ser atendidos en centros especializados.
Coordinación entre niveles asistencialesPara acceder al apartado de Coordinación entre niveles asistenciales (pregunta 35 y tabla 7 de la Parte 1), ver las publicaciones correspondientes96–98.
Conflicto de interesesLos autores firmantes de esta GPC lo hacen en nombre de la SEPD, la semFYC, la SEMERGEN, la SEMG o como socios de la Asociación Española de Gastroenterología (AEG). Ni estas sociedades científicas ni ninguno de los integrantes del grupo de trabajo tienen vinculación alguna con las compañías que desarrollan los fármacos para las patologías abordadas en esta GPC. La SEPD, la semFYC, la SEMERGEN y la SEMG, así como los componentes del grupo pertenecientes a las mismas, no tienen intereses económicos en las compañías que han realizado la investigación y distribuyen medicamentos para estas patologías del aparato digestivo, si bien mantienen, tanto sociedades como integrantes del grupo, una sostenida relación con las mismas en la promoción de formación, investigación y mejora de la práctica clínica hacia la promoción de la salud digestiva. Finalmente, la SEPD, la semFYC, la SEMERGEN y la SEMG, así como los autores firmantes declaran que este trabajo ha recibido financiación de Almirall y Allergan, que ha carecido de cualquier tipo de influencia externa en el mismo y que ninguna tercera parte ha participado en la deliberación ni desarrollo del mismo ni ha conocido el contenido del texto final, antes de su publicación efectiva en la Revista Española de Enfermedades Digestivas y resto de órganos de expresión de cada sociedad participante.
Los autores agradecen la colaboración de los responsables de las cuatro Sociedades Científicas de las que forman parte, así como el trabajo de apoyo de Marién Castillo Sánchez, de Joaquín León Molina en la gestión bibliográfica y de José María Tenías en el soporte metodológico. También agradecen especialmente las sugerencias y comentarios de los siguientes revisores externos: Agustín Balboa Rodríguez, R. Manuel Devesa Muñiz, Higinio Flores Tirado, Juan Manuel Mendive Arbeloa, Xavier Puigdengolas Armengol, Mercedes Ricote Belinchón, Cecilio Santander Vaquero, Jordi Serra Pueyo, Carlos A. Siljeström Laredo y María José Soria de la Cruz.
Este trabajo se publica conjuntamente por la SEPD, la semFYC, la SEMERGEN y la SEMG. La publicación original íntegra se realizó por la SEPD en (1): Rev Esp Enferm Dig 2016; 108(6): 332-363. semFYC, SEMERGEN y SEMG publican el trabajo en dos partes, para accesibilidad de sus respectivos socios. Tras la publicación de la primera parte (96-98), aquí se publica la segunda.
SEPD: Sociedad Española de Patología Digestiva; semFYC: Sociedad Española de Medicina de Familia y Comunitaria; SEMERGEN: Sociedad Española de Médicos de Atención Primaria; SEMG: Sociedad Española de Médicos Generales y de Familia.