Valorar la prevalencia de comorbilidades, tratamientos concomitantes y episodios adversos asociados a la medicación en una cohorte de pacientes con infección por VIH.
DiseñoEstudio transversal multicéntrico.
EmplazamientoConsultas externas especializadas del servicio de Enfermedades Infecciosas o Medicina Interna de 3 hospitales de la comunidad autónoma del País Vasco.
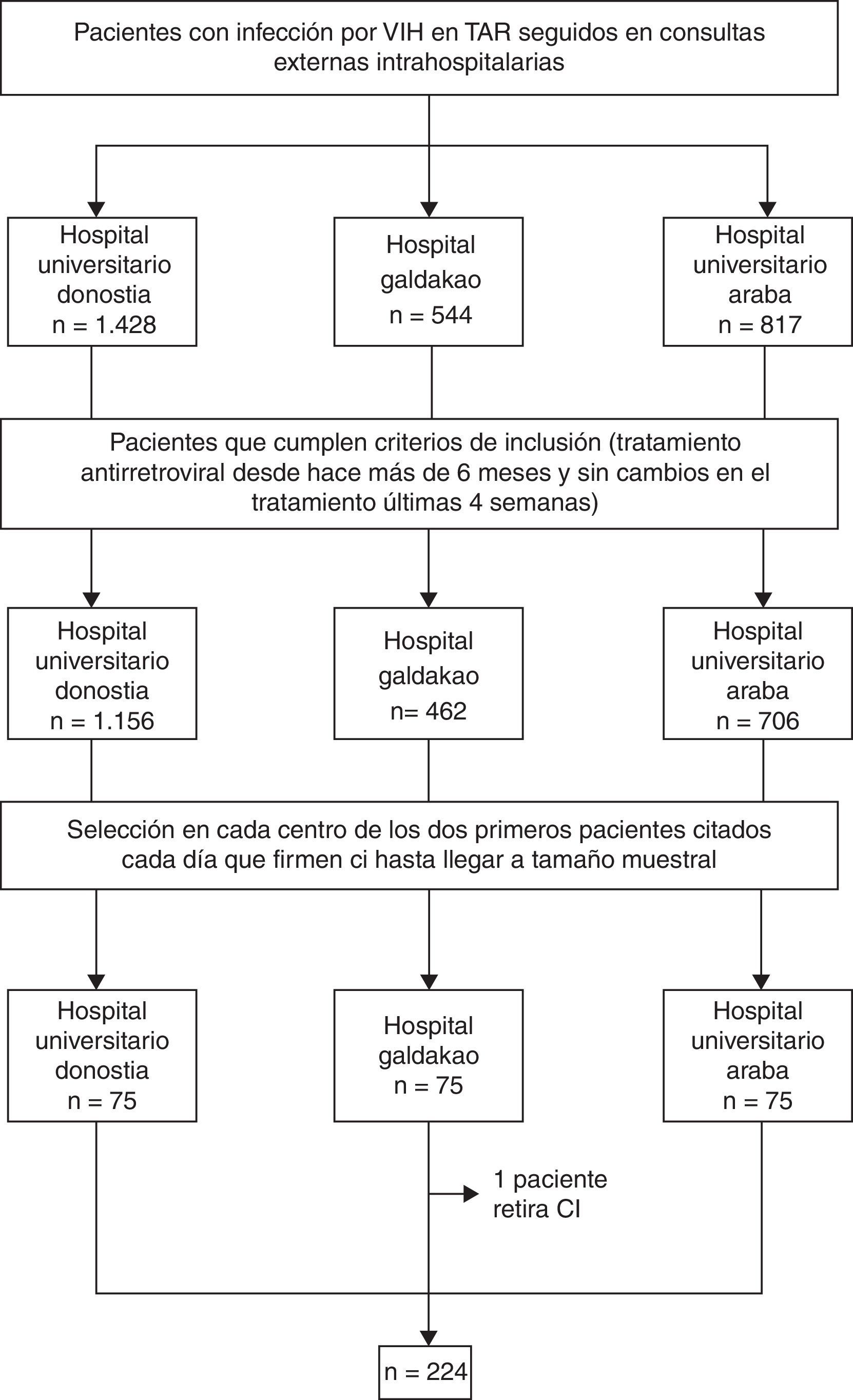
ParticipantesDurante 3meses se seleccionaron de forma aleatoria pacientes con los siguientes criterios de inclusión: infección por VIH, edad superior a 18años, tratamiento antirretroviral (TAR) desde al menos 6meses y pauta de TAR estable las últimas 4semanas. Se incluyeron 224 pacientes del total de 225 previstos.
Mediciones principalesSe recogieron mediante formulario datos epidemiológicos y antropométricos relativos a la infección por VIH, comorbilidades, tratamientos concomitantes y episodios adversos.
ResultadosEl 95,5% de los pacientes presentaban alguna comorbilidad, siendo las más frecuentes: infección por VHC (51,3%), dislipidemias (37,9%), glucemia basal alterada o diabetes mellitus (21,9%) e hipertensión arterial (21,9%). El 69,2% tomaban alguna medicación concomitante al TAR: ansiolíticos (21,4%), antihipertensivos (19,6%), inhibidores de la bomba de protones (17,9%), estatinas (17%) o antidepresivos (16,5%). El 62,9% presentaban algún efecto adverso, los más frecuentes la alteración de la distribución de grasa corporal (32,6%) y digestivos (24,1%).
ConclusionesNuestros pacientes con infección por VIH son cada vez mayores, con mayor número de comorbilidades, con uso muy frecuente de tratamientos concomitantes y elevada prevalencia de episodios adversos. Esto obliga a un abordaje multidisciplinar y a una labor coordinada con atención primaria.
To assess the prevalence of comorbidities, concomitant therapies and adverse effects associated with the medication in a cohort of patients with HIV infection.
DesignMulticentre cross-sectional study.
SettingsInfectious Diseases or Internal Medicine outpatient Clinics of 3 hospitals in the Basque Country.
ParticipantsDuring a 3 month period, patients with the following inclusion criteria were randomly selected: HIV infection, age>18years, antiretroviral treatment (ART) for at least 6months, and no changes in ART in the previous 4weeks. A total of 224 patients (of the 225 expected) were included.
MeasurementsData were collected using a form, and include, epidemiological and anthropometric data, data related to HIV infection, comorbidities, current therapies, and adverse effects.
ResultsOf the 224 patients, 95.5% had at least one comorbidity, the most common being HCV infection (51.3%), dyslipidaemia (37.9%), diabetes mellitus or impaired fasting glucose (21.9%), and hypertension (21.9%). A total of 155 patients (69.2%) were taking concomitant medication: anxiolytics (21.4%), antihypertensives (19.6%), proton pump inhibitors (17.9%), statins (17%), and antidepressants (16.5%). Adverse effects (AE) were observed in 62.9% of subjects, the most common being, changes in body fat distribution (32.6%) and gastrointestinal (24.1%).
ConclusionsPatients with HIV infection are getting older, with more comorbidities, with very frequent use of concomitant treatments, and high number of adverse effects. This requires a multidisciplinary approach and a coordinated effort within the Primary Care setting.
Desde la introducción del tratamiento antirretroviral (TAR) han mejorado tanto la supervivencia como la calidad de vida de los pacientes infectados por el virus de la inmunodeficiencia humana (VIH)1. Este aumento de supervivencia hace que los pacientes con infección por VIH sean cada vez mayores y con mayor comorbilidad. Además, se ha demostrado en esta población una mayor frecuencia de tabaquismo, alcoholismo y adicción a drogas de abuso respecto a la población general2, así como un mayor impacto del tabaquismo sobre la incidencia de determinadas patologías como la cardiopatía isquémica y algunas neoplasias3-5.
Varias cohortes internacionales han estudiado la prevalencia de las principales comorbilidades en población VIH6-8, demostrando que se asemeja a la prevalencia en población general no infectada con rango de edad 10años mayor7. Este envejecimiento «prematuro» se debe probablemente a unos hábitos de vida menos saludables junto con una situación de «inflamación crónica» generada por la propia infección8-11. La dislipidemia, la alteración del metabolismo de la glucosa, la osteopenia, el hipogonadismo, los trastornos renales y hepáticos, las alteraciones psiquiátricas, el deterioro neurocognitivo y las enfermedades coronarias son condiciones que aumentan en los pacientes infectados por el VIH en comparación con los no infectados12-14.
La presencia de comorbilidades conlleva un aumento de medicación concomitante añadida al TAR, que se asocia a un mayor riesgo de interacciones medicamentosas y de episodios adversos15-18. Esto obliga al clínico a una revisión exhaustiva de la medicación para evaluar la necesidad de ajuste de dosis o de cambios de tratamiento.
El objetivo principal de este estudio es el de valorar la proporción de pacientes con comorbilidades y con tratamientos concomitantes en una cohorte de pacientes con infección por VIH de la comunidad autónoma del País Vasco, así como la prevalencia de episodios adversos secundarios a la medicación. Como objetivos secundarios nos planteamos analizar la prevalencia de las diferentes comorbilidades en función del sexo y la edad, y evaluar los episodios adversos en función del tipo de tratamiento recibido.
Material y métodosEstudio observacional transversal llevado a cabo en 3 hospitales de la comunidad autónoma del País Vasco con consulta especializada para pacientes con infección por VIH: Hospital Universitario Donostia (Gipuzkoa), Hospital Galdakao (Bizkaia) y Hospital Universitario de Araba (Álava) con un total de 2.798 pacientes activos en TAR en el momento del estudio. Durante 3meses se seleccionaron de forma aleatoria pacientes que cumplieran todos los siguientes criterios de inclusión: infección documentada por VIH, edad mayor de 18años, estar en TAR desde al menos 6meses, sin cambios en la pauta de TAR las últimas 4semanas y firma de consentimiento informado.
La aleatorización consistió en seleccionar los 2 primeros pacientes citados que acudían a la consulta cada día hasta llegar al tamaño muestral predefinido (75 pacientes en cada centro).
El mismo día en que el paciente acudía a su consulta programada se le proponía la inclusión en el estudio. Tras la firma del consentimiento informado, el facultativo o la enfermera recogían los datos mediante formulario que rellenaban en la misma consulta con ayuda del paciente.
La recogida de datos incluía: fecha de la inclusión, sexo, edad, hábitos tóxicos, parámetros antropométricos, fecha de diagnóstico de la infección por VIH, situación inmunovirológica en el momento de la recogida de datos, pauta de TAR actual, presencia de comorbilidades (coinfección por VHC y/o VHB, diabetes mellitus, glucemia basal alterada, dislipidemia, hipertensión arterial, patología cardiovascular, insuficiencia renal, patología ósea, otras comorbilidades), tratamientos concomitantes al TAR y posibles efectos secundarios de la medicación (sintomatología percibida por el paciente o datos clínicos o analíticos valorados como episodios adversos).
Se realizó un análisis descriptivo general de todas las variables del estudio. Las variables categóricas se describieron mediante frecuencias y porcentajes, las cuantitativas mediante medias y medianas. Se estimó la prevalencia real de las diferentes comorbilidades con un intervalo de confianza del 95% mediante una macro de SPSS statistics. Así mismo, se comparó la prevalencia de las diferentes comorbilidades en función del sexo y de la edad. Por último, se comparó la prevalencia de episodios adversos en función del tipo de TAR, de la toma o no de tratamiento concomitante al TAR y de que el TAR fuera o no monoterapia.
La comparación entre variables cualitativas se realizó mediante el test de Chi cuadrado o el test de Fisher (este último para variables con pocos casos) y la de variables cuantitativas con la prueba t para muestras independientes. Para analizar qué factores podían estar relacionados con la lipodistrofia teniendo en cuenta posibles variables de confusión, se realizó un análisis de regresión logística, en el que se incluyeron todas las variables con un nivel de significación p inferior a 0,1 en el análisis univariante. Se consideró una diferencia estadísticamente significativa cuando la p fue inferior a 0,05. Para el análisis estadístico se utilizó la versión 22 del paquete estadístico SPSS.
El estudio fue aprobado por el comité ético de investigación clínica de Euskadi con fecha del 30 de abril de 2014.
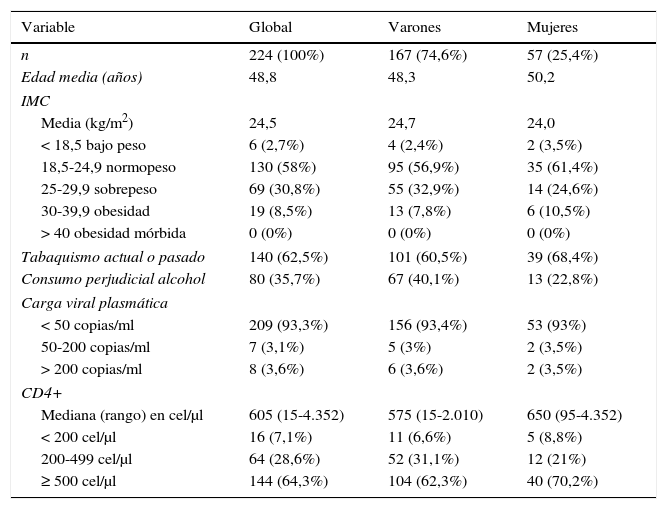
ResultadosCaracterísticas generalesSe incluyeron un total de 224 pacientes, el 74,6% varones, con una media de edad de 48,8años (rango 20-68). La media de antigüedad de la infección por VIH era de 18,6años (rango 1-36) y todos recibían TAR. El 93,3% tenían una carga viral plasmática de VIH inferior a 50copias/ml y el 96,4% inferior a 200copias/ml. En cuanto a la situación inmunológica, la mediana de linfocitos CD4+ era de 605células/μl (rango 15-4.352).
Respecto a los hábitos tóxicos, el 62,5% eran fumadores o ex-fumadores y el 35,7% tenían un consumo excesivo de alcohol (40,1% de los varones y 22,8% de las mujeres). En cuanto al índice de masa corporal (IMC), la media global fue de 24,5 (rango 16,9-36,5), con un 39,3% de los pacientes con sobrepeso (IMC>25) u obesidad (IMC>30), siendo este porcentaje algo mayor en varones (40,7%) que en mujeres (35,1%).
Las características de los pacientes, globales y por sexos, se resumen en la tabla 1.
Resumen de las características epidemiológicas, hábitos tóxicos y situación del VIH de la cohorte, global y por sexos
| Variable | Global | Varones | Mujeres |
|---|---|---|---|
| n | 224 (100%) | 167 (74,6%) | 57 (25,4%) |
| Edad media (años) | 48,8 | 48,3 | 50,2 |
| IMC | |||
| Media (kg/m2) | 24,5 | 24,7 | 24,0 |
| < 18,5 bajo peso | 6 (2,7%) | 4 (2,4%) | 2 (3,5%) |
| 18,5-24,9 normopeso | 130 (58%) | 95 (56,9%) | 35 (61,4%) |
| 25-29,9 sobrepeso | 69 (30,8%) | 55 (32,9%) | 14 (24,6%) |
| 30-39,9 obesidad | 19 (8,5%) | 13 (7,8%) | 6 (10,5%) |
| > 40 obesidad mórbida | 0 (0%) | 0 (0%) | 0 (0%) |
| Tabaquismo actual o pasado | 140 (62,5%) | 101 (60,5%) | 39 (68,4%) |
| Consumo perjudicial alcohol | 80 (35,7%) | 67 (40,1%) | 13 (22,8%) |
| Carga viral plasmática | |||
| < 50 copias/ml | 209 (93,3%) | 156 (93,4%) | 53 (93%) |
| 50-200 copias/ml | 7 (3,1%) | 5 (3%) | 2 (3,5%) |
| > 200 copias/ml | 8 (3,6%) | 6 (3,6%) | 2 (3,5%) |
| CD4+ | |||
| Mediana (rango) en cel/μl | 605 (15-4.352) | 575 (15-2.010) | 650 (95-4.352) |
| < 200 cel/μl | 16 (7,1%) | 11 (6,6%) | 5 (8,8%) |
| 200-499 cel/μl | 64 (28,6%) | 52 (31,1%) | 12 (21%) |
| ≥ 500 cel/μl | 144 (64,3%) | 104 (62,3%) | 40 (70,2%) |
Salvo que se especifique lo contrario, las cifras se expresan en número absoluto y porcentaje.
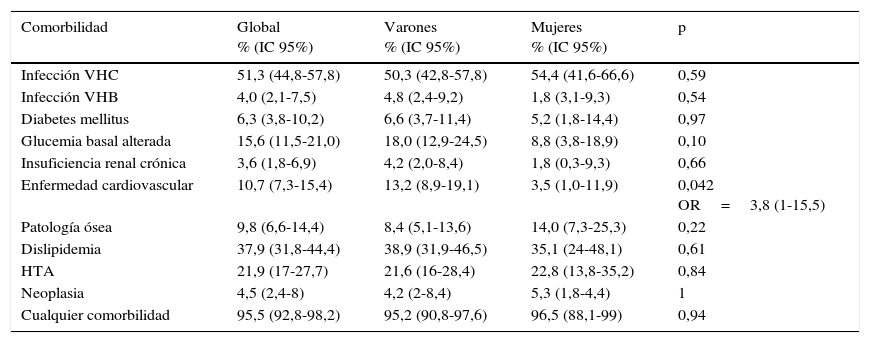
Casi la totalidad de los pacientes incluidos (el 95,5%; IC95: 92,8-98,2%) presentaba alguna comorbilidad, siendo la infección por VHC la comorbilidad más frecuente, afectando al 51,3% de la cohorte, pero sin tenerla en cuenta sigue habiendo un porcentaje del 73,2% de pacientes asociados a otra comorbilidad. En la tabla 2 se resumen las prevalencias de las diferentes comorbilidades.
Prevalencia de las diferentes comorbilidades (y estimación de los IC al 95% de la prevalencia real), tanto global como por sexos, y análisis de la diferencia de prevalencia entre sexos
| Comorbilidad | Global % (IC 95%) | Varones % (IC 95%) | Mujeres % (IC 95%) | p |
|---|---|---|---|---|
| Infección VHC | 51,3 (44,8-57,8) | 50,3 (42,8-57,8) | 54,4 (41,6-66,6) | 0,59 |
| Infección VHB | 4,0 (2,1-7,5) | 4,8 (2,4-9,2) | 1,8 (3,1-9,3) | 0,54 |
| Diabetes mellitus | 6,3 (3,8-10,2) | 6,6 (3,7-11,4) | 5,2 (1,8-14,4) | 0,97 |
| Glucemia basal alterada | 15,6 (11,5-21,0) | 18,0 (12,9-24,5) | 8,8 (3,8-18,9) | 0,10 |
| Insuficiencia renal crónica | 3,6 (1,8-6,9) | 4,2 (2,0-8,4) | 1,8 (0,3-9,3) | 0,66 |
| Enfermedad cardiovascular | 10,7 (7,3-15,4) | 13,2 (8,9-19,1) | 3,5 (1,0-11,9) | 0,042 OR=3,8 (1-15,5) |
| Patología ósea | 9,8 (6,6-14,4) | 8,4 (5,1-13,6) | 14,0 (7,3-25,3) | 0,22 |
| Dislipidemia | 37,9 (31,8-44,4) | 38,9 (31,9-46,5) | 35,1 (24-48,1) | 0,61 |
| HTA | 21,9 (17-27,7) | 21,6 (16-28,4) | 22,8 (13,8-35,2) | 0,84 |
| Neoplasia | 4,5 (2,4-8) | 4,2 (2-8,4) | 5,3 (1,8-4,4) | 1 |
| Cualquier comorbilidad | 95,5 (92,8-98,2) | 95,2 (90,8-97,6) | 96,5 (88,1-99) | 0,94 |
Todas las prevalencias se expresan en porcentajes; en caso de diferencia significativa se da el valor OR o razón de odds, con su correspondiente intervalo de confianza al 95%.
Respecto a los principales factores de riesgo cardiovascular, la dislipidemia fue el más prevalente (37,9% de los pacientes), seguido de la hipertensión arterial (21,9%). La prevalencia de diabetes mellitus fue del 6,3%, pero un 15,6% de los pacientes presentaban una glucemia alterada en ayunas. Todo ello, y recordando que un 39,3% de la población estudiaba presentaba sobrepeso u obesidad, derivó en que el 10,7% de los pacientes habían tenido ya algún episodio cardiovascular.
El resto de comorbilidades fueron menos prevalentes, con un 9,8% de pacientes con patología ósea, un 4,5% con neoplasias y un 3,6% con insuficiencia renal crónica.
Como uno de los objetivos secundarios, habíamos planteado el análisis de las diferentes comorbilidades en función de la edad y el sexo. La única patología en cuya prevalencia encontramos diferencias significativas en función del sexo fue la enfermedad cardiovascular, más frecuente en los varones (13,2%) que en las mujeres (3,5%), p=0,04, siendo el OR de 3,8 (1-15,5). Ajustando el análisis por los principales factores de riesgo (edad, sobrepeso, tabaquismo, dislipidemia, hipertensión, diabetes, glucemia basal alterada), se mantiene la misma tendencia rozando el límite de la significación estadística (OR de enfermedad cardiovascular en hombres respecto a mujeres 4,7; IC95%: 0,98-22,6; p=0,053). También parece haber una mayor prevalencia de patología ósea en las mujeres (14% versus 8,4%) y de glucemia basal alterada en los hombres (18% versus 8,8%), sin que las diferencias alcancen significación estadística.
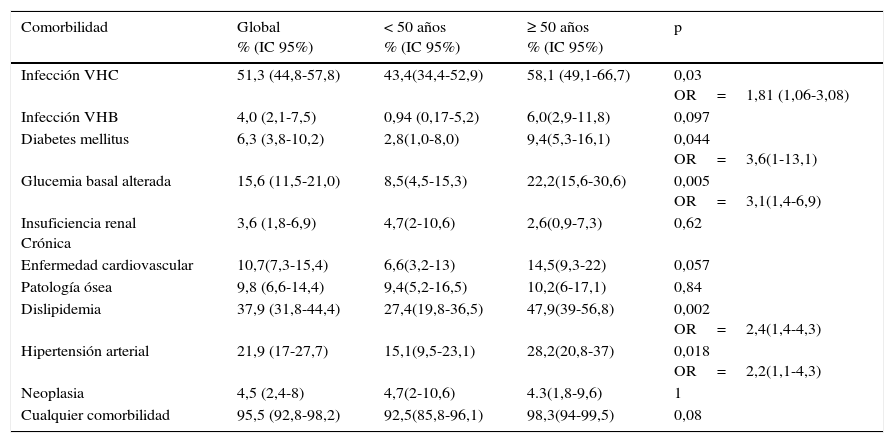
Para analizar las diferentes prevalencias en función de la edad, cogimos como referencia la mediana de edad de la muestra (50años). Tanto la infección por VHC como los factores de riesgo cardiovascular (diabetes mellitus, glucemia basal alterada, dislipidemia e hipertensión arterial) fueron más frecuentes en los pacientes mayores de 50años (p<0,05 para todos ellos). La prevalencia de enfermedad cardiovascular también fue mayor en los pacientes de más de 50años, aunque sin llegar a alcanzar la significación estadística (14,5% en mayores de 50años versus 6,6% en menores de 50; p=0,057). Los datos se resumen en la tabla 3.
Prevalencia de las diferentes comorbilidades (y estimación de los IC al 95% de la prevalencia real), global, en función de la edad (< 50 y ≥ 50 años), y análisis de la diferencia de prevalencia en función de la edad
| Comorbilidad | Global % (IC 95%) | < 50 años % (IC 95%) | ≥ 50 años % (IC 95%) | p |
|---|---|---|---|---|
| Infección VHC | 51,3 (44,8-57,8) | 43,4(34,4-52,9) | 58,1 (49,1-66,7) | 0,03 OR=1,81 (1,06-3,08) |
| Infección VHB | 4,0 (2,1-7,5) | 0,94 (0,17-5,2) | 6,0(2,9-11,8) | 0,097 |
| Diabetes mellitus | 6,3 (3,8-10,2) | 2,8(1,0-8,0) | 9,4(5,3-16,1) | 0,044 OR=3,6(1-13,1) |
| Glucemia basal alterada | 15,6 (11,5-21,0) | 8,5(4,5-15,3) | 22,2(15,6-30,6) | 0,005 OR=3,1(1,4-6,9) |
| Insuficiencia renal Crónica | 3,6 (1,8-6,9) | 4,7(2-10,6) | 2,6(0,9-7,3) | 0,62 |
| Enfermedad cardiovascular | 10,7(7,3-15,4) | 6,6(3,2-13) | 14,5(9,3-22) | 0,057 |
| Patología ósea | 9,8 (6,6-14,4) | 9,4(5,2-16,5) | 10,2(6-17,1) | 0,84 |
| Dislipidemia | 37,9 (31,8-44,4) | 27,4(19,8-36,5) | 47,9(39-56,8) | 0,002 OR=2,4(1,4-4,3) |
| Hipertensión arterial | 21,9 (17-27,7) | 15,1(9,5-23,1) | 28,2(20,8-37) | 0,018 OR=2,2(1,1-4,3) |
| Neoplasia | 4,5 (2,4-8) | 4,7(2-10,6) | 4.3(1,8-9,6) | 1 |
| Cualquier comorbilidad | 95,5 (92,8-98,2) | 92,5(85,8-96,1) | 98,3(94-99,5) | 0,08 |
Todas las prevalencias se expresan en porcentajes; en caso de diferencia significativa se da el valor OR o razón de odds, con su correspondiente intervalo de confianza al 95%.
Todos los pacientes recibían TAR, consistente en la mayoría en triple terapia, en un 5,8% en biterapia y en un 6,3% en monoterapia con un inhibidor de la proteasa (IP) potenciado con ritonavir. El 87,9% de los pacientes llevaban en su pauta un inhibidor de la transcriptasa inversa análogo de los nucleó(t)sidos (ITIAN), el 49,1% un inhibidor de la transcriptasa inversa no análogo de los nucleósidos (ITINN), mientras que el 45,5% de los sujetos llevaba un IP y un 15,2% un inhibidor de la integrasa (INI). Respecto al uso de ITIAN, el 77,7% consistían en una combinación fija o «combo»: en el 52,7% de los casos con tenofovir/emtricitabina (en forma de Truvada® o de Atripla®) y en el 25% abacavir/lamivudina (Kivexa®).
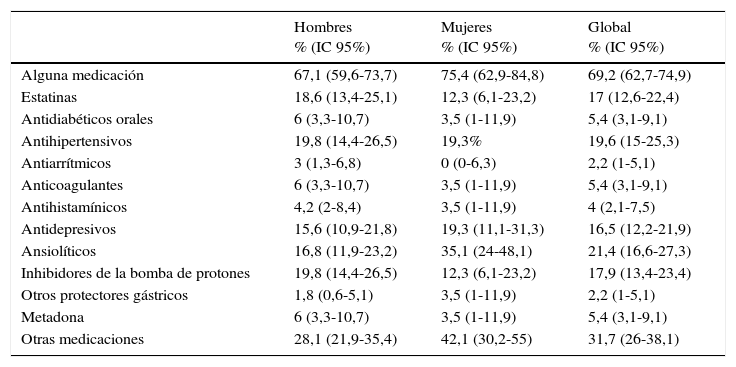
El 69,2% de los pacientes recibían algún otro tratamiento farmacológico además del TAR (tabla 4), por orden de frecuencia: ansiolíticos (21,4%), antihipertensivos (19,6%), inhibidores de la bomba de protones (17,9%), estatinas (17%) y antidepresivos (16,5%). El 5,8% de los sujetos recibían tratamiento sustitutivo con metadona.
Proporción de uso de tratamientos concomitantes por grupos farmacológicos
| Hombres % (IC 95%) | Mujeres % (IC 95%) | Global % (IC 95%) | |
|---|---|---|---|
| Alguna medicación | 67,1 (59,6-73,7) | 75,4 (62,9-84,8) | 69,2 (62,7-74,9) |
| Estatinas | 18,6 (13,4-25,1) | 12,3 (6,1-23,2) | 17 (12,6-22,4) |
| Antidiabéticos orales | 6 (3,3-10,7) | 3,5 (1-11,9) | 5,4 (3,1-9,1) |
| Antihipertensivos | 19,8 (14,4-26,5) | 19,3% | 19,6 (15-25,3) |
| Antiarrítmicos | 3 (1,3-6,8) | 0 (0-6,3) | 2,2 (1-5,1) |
| Anticoagulantes | 6 (3,3-10,7) | 3,5 (1-11,9) | 5,4 (3,1-9,1) |
| Antihistamínicos | 4,2 (2-8,4) | 3,5 (1-11,9) | 4 (2,1-7,5) |
| Antidepresivos | 15,6 (10,9-21,8) | 19,3 (11,1-31,3) | 16,5 (12,2-21,9) |
| Ansiolíticos | 16,8 (11,9-23,2) | 35,1 (24-48,1) | 21,4 (16,6-27,3) |
| Inhibidores de la bomba de protones | 19,8 (14,4-26,5) | 12,3 (6,1-23,2) | 17,9 (13,4-23,4) |
| Otros protectores gástricos | 1,8 (0,6-5,1) | 3,5 (1-11,9) | 2,2 (1-5,1) |
| Metadona | 6 (3,3-10,7) | 3,5 (1-11,9) | 5,4 (3,1-9,1) |
| Otras medicaciones | 28,1 (21,9-35,4) | 42,1 (30,2-55) | 31,7 (26-38,1) |
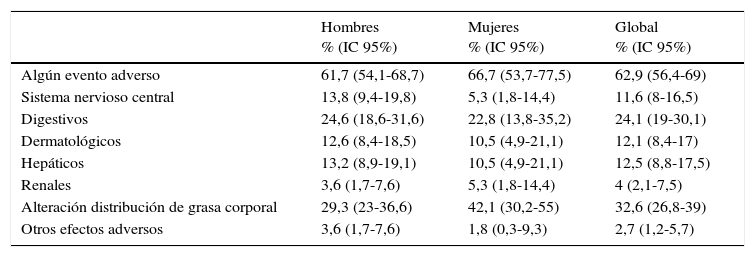
Se valoró la presencia de episodios adversos relacionados con la medicación, y 141 pacientes (62,9%) presentaban algún tipo de efecto secundario (tabla 5). Los más frecuentes fueron los relacionados con la distribución de la grasa corporal (32,6%), seguidos por los síntomas digestivos (24,1%) y, en menor proporción, por los efectos secundarios hepáticos (12,5%), dermatológicos (12,1%) y del sistema nervioso central (11,6%).
Proporción de pacientes con episodios adversos atribuibles a la medicación
| Hombres % (IC 95%) | Mujeres % (IC 95%) | Global % (IC 95%) | |
|---|---|---|---|
| Algún evento adverso | 61,7 (54,1-68,7) | 66,7 (53,7-77,5) | 62,9 (56,4-69) |
| Sistema nervioso central | 13,8 (9,4-19,8) | 5,3 (1,8-14,4) | 11,6 (8-16,5) |
| Digestivos | 24,6 (18,6-31,6) | 22,8 (13,8-35,2) | 24,1 (19-30,1) |
| Dermatológicos | 12,6 (8,4-18,5) | 10,5 (4,9-21,1) | 12,1 (8,4-17) |
| Hepáticos | 13,2 (8,9-19,1) | 10,5 (4,9-21,1) | 12,5 (8,8-17,5) |
| Renales | 3,6 (1,7-7,6) | 5,3 (1,8-14,4) | 4 (2,1-7,5) |
| Alteración distribución de grasa corporal | 29,3 (23-36,6) | 42,1 (30,2-55) | 32,6 (26,8-39) |
| Otros efectos adversos | 3,6 (1,7-7,6) | 1,8 (0,3-9,3) | 2,7 (1,2-5,7) |
Analizamos la prevalencia de los diferentes episodios adversos en función del tipo de TAR. No encontramos diferencias significativas en la aparición de episodios adversos entre los pacientes que tomaban tenofovir/emtricitabina frente a los que tomaban abacavir/lamivudina. Tanto los efectos secundarios digestivos, hepáticos o la aparición de cualquier evento adverso en general fue más frecuente entre los pacientes que recibían un IP frente a los que llevaban un ITINN (p<0,05). De la misma forma, la alteración de la grasa corporal fue más frecuente entre los pacientes que llevaban un IP (39,8% versus 26,7%; p=0,053). No se demostró una mayor frecuencia de episodios adversos a nivel de SNC en los pacientes que llevaban ITINN respecto a los que llevaban tratamiento con un IP.
Analizamos también la prevalencia de episodios adversos en función de si los pacientes tomaban o no algún tratamiento concomitante al TAR, no encontrando diferencias significativas, con la excepción de la alteración en la distribución de la grasa corporal, más frecuente entre los que tomaban algún fármaco asociado al TAR (37,4% versus 21,7%; p=0,021).
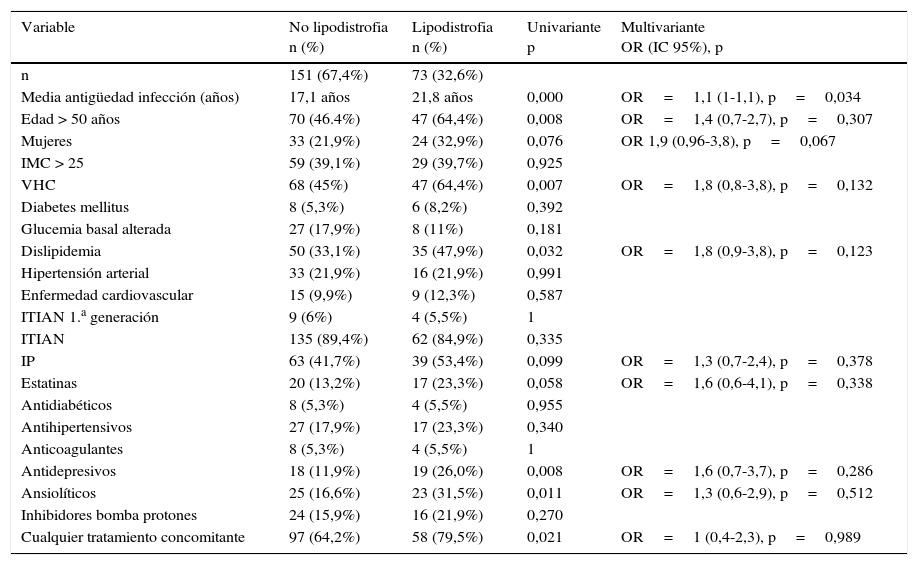
Teniendo en cuenta la alta prevalencia de trastornos en la distribución de la grasa corporal (prevalencia global del 32,6%), analizamos los tratamientos concomitantes y la prevalencia de factores de riesgo cardiovascular en este subgrupo de pacientes. No hubo diferencias en la prevalencia de lipodistrofia entre los pacientes que llevaban en su tratamiento algunos de los ITIAN de primera generación (AZT, ddI, d4T, clásicamente asociados a las alteraciones en la distribución de la grasa corporal) y los que no lo llevaban, con el importante sesgo del desconocimiento de qué pacientes habían llevado estos tratamientos en el pasado. La lipodistrofia fue significativamente más frecuente en pacientes mayores de 50años (64,4% frente a 46,4%) y en los que llevaban más años de evolución con la infección por VIH (media de antigüedad de 21,8años frente a 17,1 en los que no presentaban alteración en la distribución de la grasa). Además, parece haber una mayor tendencia a la lipodistrofia, rozando el límite de la significación estadística entre los pacientes que recibían IP frente a los que recibían ITINN (39,8% versus 26,7%; p=0,053). Respecto al resto de tratamientos concomitantes, se demostró una mayor frecuencia de lipodistrofia en pacientes que recibían tratamiento con ansiolíticos y antidepresivos. De la misma forma, en el análisis univariante tanto la coinfección por VHC como la dislipidemia se relacionaron con la aparición de lipodistrofia.
Sin embargo, realizando un análisis multivariante de todos los posibles factores asociados a la lipodistrofia, encontramos que el único factor que se asoció significativamente con este episodio adverso es la antigüedad de la infección por VIH, que probablemente sea un reflejo indirecto de la toma en el pasado de ITIAN asociados a la lipodistrofia; por ello, interpretamos que el resto de factores (tratamiento psiquiátrico, coinfección por VHC, tratamientos concomitantes…) actúan como factores de confusión más frecuentes en la cohorte de pacientes más antiguos (tabla 6).
Análisis univariante y multivariante sobre la asociación entre diferentes variables y la alteración de la distribución de la grasa corporal
| Variable | No lipodistrofia n (%) | Lipodistrofia n (%) | Univariante p | Multivariante OR (IC 95%), p |
|---|---|---|---|---|
| n | 151 (67,4%) | 73 (32,6%) | ||
| Media antigüedad infección (años) | 17,1 años | 21,8 años | 0,000 | OR=1,1 (1-1,1), p=0,034 |
| Edad > 50 años | 70 (46.4%) | 47 (64,4%) | 0,008 | OR=1,4 (0,7-2,7), p=0,307 |
| Mujeres | 33 (21,9%) | 24 (32,9%) | 0,076 | OR 1,9 (0,96-3,8), p=0,067 |
| IMC > 25 | 59 (39,1%) | 29 (39,7%) | 0,925 | |
| VHC | 68 (45%) | 47 (64,4%) | 0,007 | OR=1,8 (0,8-3,8), p=0,132 |
| Diabetes mellitus | 8 (5,3%) | 6 (8,2%) | 0,392 | |
| Glucemia basal alterada | 27 (17,9%) | 8 (11%) | 0,181 | |
| Dislipidemia | 50 (33,1%) | 35 (47,9%) | 0,032 | OR=1,8 (0,9-3,8), p=0,123 |
| Hipertensión arterial | 33 (21,9%) | 16 (21,9%) | 0,991 | |
| Enfermedad cardiovascular | 15 (9,9%) | 9 (12,3%) | 0,587 | |
| ITIAN 1.a generación | 9 (6%) | 4 (5,5%) | 1 | |
| ITIAN | 135 (89,4%) | 62 (84,9%) | 0,335 | |
| IP | 63 (41,7%) | 39 (53,4%) | 0,099 | OR=1,3 (0,7-2,4), p=0,378 |
| Estatinas | 20 (13,2%) | 17 (23,3%) | 0,058 | OR=1,6 (0,6-4,1), p=0,338 |
| Antidiabéticos | 8 (5,3%) | 4 (5,5%) | 0,955 | |
| Antihipertensivos | 27 (17,9%) | 17 (23,3%) | 0,340 | |
| Anticoagulantes | 8 (5,3%) | 4 (5,5%) | 1 | |
| Antidepresivos | 18 (11,9%) | 19 (26,0%) | 0,008 | OR=1,6 (0,7-3,7), p=0,286 |
| Ansiolíticos | 25 (16,6%) | 23 (31,5%) | 0,011 | OR=1,3 (0,6-2,9), p=0,512 |
| Inhibidores bomba protones | 24 (15,9%) | 16 (21,9%) | 0,270 | |
| Cualquier tratamiento concomitante | 97 (64,2%) | 58 (79,5%) | 0,021 | OR=1 (0,4-2,3), p=0,989 |
IMC: índice de masa corporal; IP: inhibidor de la proteasa; ITIAN: inhibidor de la transcriptasa inversa análogo de los nucleó(t)sidos; ITINN: inhibidor de la transcriptasa inversa no análogo de los nucleósidos.
En el análisis multivariante se incluyeron todas las variables con un nivel de significación p inferior a 0,1 en el análisis univariante.
Debido a la alta eficacia actual de los TAR, los pacientes con infección por VIH son cada vez mayores, y con mayor número de comorbilidades, con uso muy frecuente de tratamientos concomitantes a la terapia antirretroviral11.
Llama la atención en nuestra serie la altísima proporción de comorbilidades, hasta en un 95,5% de los pacientes (si bien es verdad que se trata de una cohorte en la cual más de la mitad de los pacientes presentan coinfección por el VHC, tal y como ocurría en las cohortes históricas de pacientes VIH, con una mayoría de infecciones en pacientes adictos a drogas por vía parenteral); sin embargo, sin contabilizar la infección por VHC, la prevalencia de comorbilidad sigue siendo altísima, hasta un 73,2%, cifra mayor que la descrita en otras series13, probablemente porque se han tenido en cuenta algunas comorbilidades no valoradas en dichos trabajos, como la dislipidemia o la glucosa alterada en ayunas. Esta elevada comorbilidad deriva en un alto porcentaje de pacientes con tratamientos concomitantes al TAR, hasta en 2/3 de los casos. En general la prevalencia de todas las comorbilidades estudiadas es más frecuente que la reportada para pacientes de esta misma edad en población general8.
Como ocurre en pacientes sin infección por VIH, la enfermedad cardiovascular es más prevalente en el sexo masculino y la prevalencia de los diferentes factores de riesgo cardiovascular aumenta con la edad.
Por otra parte, es muy notable la elevada proporción de pacientes con efectos secundarios, la mayoría leves, que relacionan con alguno de sus tratamientos. De entre dichos efectos adversos, predominan los de origen digestivo y la alteración de la grasa corporal. Esta última, presente hasta en el 32,6% de los pacientes seleccionados, probablemente sea reflejo de una cohorte con muchos años de evolución de la infección por VIH (media 18,6; mediana 21años), que ha llevado en el pasado pautas basadas en ITIAN clásicamente relacionados con la lipodistrofia. Parece además que, en nuestra cohorte, el tratamiento con IP se asocia a una mayor prevalencia de episodios adversos globales, y particularmente digestivos y hepáticos.
Todo esto, aun asumiendo la limitación que supone el carácter transversal del estudio, demuestra una vez más el giro radical que ha dado la infección por VIH en las últimas décadas, haciendo hoy en día imprescindible un abordaje multidisciplinar de los pacientes, un estrecho seguimiento por parte de su médico de atención primaria y un riguroso control sobre las posibles interacciones medicamentosas y la aparición de efectos secundarios12.
- •
Los pacientes con infección por VIH son cada vez mayores y presentan cada vez una mayor comorbilidad.
- •
La prevalencia de comorbilidades parece ser mayor que la de la población general de la misma edad.
- •
La presencia de comorbilidades deriva en un aumento de medicación concomitante, con riesgo de episodios adversos e interacciones medicamentosas.
- •
Casi la totalidad de los pacientes de nuestra cohorte presentan alguna comorbilidad asociada a la infección por VIH y 2/3 reciben, además del TAR, algún tratamiento concomitante.
- •
El 62% de los pacientes presentan algún evento adverso que puede estar relacionado con la medicación (TAR o tratamiento concomitante).
- •
Los episodios adversos parecen ser más frecuentes en pacientes que reciben tratamiento con inhibidores de la proteasa.
La colaboración de un escritor médico ha sido financiada por Merck Sharp & Dohme de España, S.A.
Conflicto de interesesMerck Sharp and Dohme de España, S.A, ha colaborado económicamente para la redacción del manuscrito.
Agradecemos a Merck Sharp & Dohme de España, S.A. su colaboración para la elaboración de este manuscrito.