Introducción
La epidemiología del medicamento, o farmacoepidemiología, tiene como objetivo central conocer el impacto que los medicamentos tienen sobre la salud de la población1. Los ensayos clínicos realizados durante la fase previa a la autorización de un medicamento permiten obtener un conocimiento bastante preciso de su eficacia y sus efectos adversos más frecuentes. Sin embargo, los ensayos clínicos tienen limitaciones para proporcionar información sobre los riesgos y beneficios de los medicamentos en un contexto de uso clínico habitual, o sea, su seguridad y su efectividad, cuando su uso se extiende a grupos especiales de riesgo (ancianos, pacientes con varias enfermedades, polimedicados, embarazadas y niños, etc.), o cuando se usan a más largo plazo o con pautas de administración o indicaciones más lábiles.
Farmacoepidemiología y farmacovigilancia
Las aportaciones más notables de la farmacoepidemiología se han producido en el campo de la evaluación de la seguridad de los medicamentos, hasta el punto de que, actualmente, la investigación farmacoepidemiológica se considera un complemento esencial de los sistemas de farmacovigilancia2. El método básico de la farmacovigilancia es la notificación espontánea de sospechas de reacciones adversas a medicamentos. En España, el vehículo habitual para notificar estas sospechas es la conocida «tarjeta amarilla», y los profesionales que más notifican son los médicos de atención primaria, con un 70% del total de notificaciones3. El Sistema Español de Farmacovigilancia está organizado de manera descentralizada: cada comunidad autónoma tiene un centro encargado de estimular la notificación, recibir las enviadas por los profesionales sanitarios, evaluarlas, e introducirlas en la base de datos FEDRA, que es administrada por la Agencia Española del Medicamento3.
Limitaciones de los sistemas de notificación y del trabajo de campo para la investigación farmacoepidemiológica
Los programas de notificación espontánea tienen un valor inestimable para generar señales de alerta sobre nuevas asociaciones fármaco-reacción. Sin embargo, por su propia estructura presentan importantes limitaciones a la hora de cuantificar el riesgo, es decir, la cuantificación del grado de asociación entre el medicamento y la reacción adversa sospechada (paso necesario para la evaluación epidemiológica de la relación de causalidad), la cuantificación del riesgo absoluto (para conocer su impacto sobre la salud pública), su relación con la dosis y la duración del tratamiento, y la identificación de grupos de mayor riesgo (para, en su caso, adoptar medidas tendentes a reducirlo). En la mayor parte de las situaciones, sólo se puede obtener tal información a través de estudios apropiados, básicamente estudios de cohorte, y de casos y controles. Realizar estos estudios según los métodos tradicionales conlleva un lento y laborioso trabajo de campo que, además de consumir muchos recursos, suele ser inadecuado para dar respuestas fundamentadas en un tiempo razonable (en meses, y no en años) ante la generación de una señal de alerta por los sistemas de farmacovigilancia. Por este motivo, las decisiones en este terreno se toman a menudo utilizando únicamente los datos de la notificación espontánea ponderados en función del consumo del medicamento, que se usa como medida indirecta de la exposición4.
Bases de datos informatizadas
En los años setenta se crearon en Estados Unidos las primeras bases de datos sanitarias informatizadas. Su finalidad inicial era puramente administrativa, pero pronto se apreció su gran eficiencia como fuente de información para realizar estudios epidemiológicos5. Con ellas se ha podido estudiar cohortes de cientos de miles de individuos, algo realmente impensable con la metodología «tradicional». Esta ventaja puede resultar particularmente aplicable a la investigación farmacoepidemiológica que, en general, trata de evaluar los efectos de aparición infrecuente que exigen el estudio de cohortes muy amplias, o de extensas series de casos y controles. Además, los estudios realizados con bases de datos informatizadas permiten ofrecer respuestas fundamentadas en unos tiempos más acordes con el proceso de toma de decisiones en farmacovigilancia. Pero las bases de datos informatizadas no sólo simplifican la logística y reducen los costes de la investigación farmacoepidemiológica, sino que además pueden elevar su validez, gracias a otras dos importantes ventajas:
1. La información que contienen sobre exposición a los medicamentos de interés suele ser más completa y fiable que en los estudios tradicionales basados en la entrevista, ya que en ellas se registra prospectivamente su prescripción o su dispensación, en vez de confiar en la memoria del entrevistado.
2. En los estudios de casos y controles, permiten una selección auténticamente poblacional de los controles; cuando se usan otros procedimientos (p. ej., controles hospitalarios) no existe seguridad de que la selección de controles sea independiente de la exposición a los medicamentos de interés.
La base de datos GPRD
Existe ya un buen número de bases de datos en Estados Unidos y Europa con las que poder realizar estudios farmacoepidemiológicos, pero entre ellas destaca la base de datos británica GPRD (General Practice Research Database)6-8, a la que aportan información registrada con ordenador cerca de 2.000 médicos de atención primaria. El rasgo más distintivo de la GPRD es su carácter «integral»: al contener datos de prescripción, enfermedades y problemas clínicos, y resultados de pruebas complementarias, no se precisa ningún enlace con otras bases de datos (record-linkage) para reunir la información requerida en los estudios de farmacoepidemiología, que es el campo en el que indudablemente ha demostrado una mayor utilidad. La GPRD contiene información que corresponde a unos 35 millones de años-persona, y con ella se han podido realizar más de 200 trabajos publicados en revistas científicas, entre los cuales abundan los estudios que evalúan los efectos adversos de los medicamentos9-11, y no faltan los centrados en sus posibles beneficios en la práctica clínica habitual (efectividad)12,13.
Información clínica y atención primaria
La organización del sistema sanitario público en España es similar a la de Gran Bretaña. En nuestro medio, la atención primaria suele ser la puerta de entrada a los servicios sanitarios, y también un destino frecuente de los pacientes que han sido atendidos fuera de ella, además de ser el nivel en el que se resuelven infinidad de problemas de salud. Dentro del equipo de atención primaria, los médicos, tanto los de familia como los pediatras, son los profesionales que tienen más a su alcance llegar a conocer integralmente la información clínica de sus pacientes. La atención longitudinal que prestan, la gran cantidad de diagnósticos y tratamientos que realizan, su función normalizadora del acceso a otras partes del sistema, su visión general de los problemas de salud y la relación de confianza que a menudo entablan con sus pacientes los sitúan en una posición privilegiada para intentar reunir la información que se genera en este y otros niveles o ámbitos de la asistencia. Por otra parte, los médicos de atención primaria son los firmantes de más del 80% de todas las recetas que se extienden en el Sistema Nacional de Salud. El hecho de que una parte de estas recetas corresponda a prescripciones originadas por otros médicos proporciona también una idea del importante flujo de información desde otros niveles asistenciales hacia la atención primaria. En virtud de todo esto, se puede decir, sin temor a equivocarse, que el médico de atención primaria es quien mejor puede efectuar un registro prospectivo completo de los problemas de salud, las intervenciones terapéuticas, las actividades preventivas y los acontecimientos clínicos. En conjunto, la información que maneja de forma habitual se puede considerar especialmente adecuada para la investigación farmacoepidemiológica14, pues contiene todos los ingredientes que ésta requiere a priori: prescripciones, síntomas y diagnósticos, datos demográficos, datos antropométricos, datos exploratorios y resultados de pruebas complementarias.
Informatización de la atención primaria
La informatización de las consultas y las historias clínicas tiene cada vez mayor presencia en atención primaria15-18. Se trata de una herramienta cuya utilidad no tiene por qué quedar limitada a las tareas asistenciales, administrativas o de gestión, sino que cabe intentar extenderla a otras actividades, entre las que por supuesto está la investigación farmacoepidemiológica en grandes poblaciones. Con estas premisas se ha puesto en marcha el Proyecto BIFAP (Base de datos para la Investigación Farmacoepidemiológica en Atención Primaria).
El Proyecto BIFAP
Definición
El Proyecto BIFAP consiste en evaluar si es viable en España establecer una base de datos pública que contenga información clínica anónima (desprovista de datos identificativos personales), facilitada por médicos de atención primaria del Sistema Nacional de Salud que utilicen habitualmente el ordenador para recoger la información de sus pacientes. La base de datos tendrá igualmente el nombre de BIFAP, y se destinará, si es viable, y previa validación como fuente de información, a la realización de estudios farmacoepidemiológicos.
Objetivos
El objetivo del proyecto es crear una herramienta de investigación farmacoepidemiológica de calidad y destinarla esencialmente a dos tipos de estudios:
Estudios de seguridad de los medicamentos que intenten contrastar hipótesis de asociación causal, entre ellos los dirigidos específicamente a evaluar «señales de alerta» relacionadas con medicamentos, especialmente las que genere el Sistema Español de Farmacovigilancia.
Estudios de efectividad de los medicamentos en condiciones habituales de uso (a esto contribuiría la amplia base poblacional de BIFAP).
Es importante señalar que la información de BIFAP sólo podrá ser utilizada con fines de investigación epidemiológica, y nunca para evaluar, individual o colectivamente, cuestiones relativas a la praxis o el gasto de los médicos colaboradores.
Justificación
Aparte de todos los planteamientos que se hacen en el apartado de introducción, existen otras razones para intentar establecer en España una base de datos de atención primaria, habiendo ya otras fuera de nuestras fronteras, y destinarla a la investigación farmacoepidemiológica:
a) siempre es conveniente tener la posibilidad de contrastar una misma hipótesis utilizando varias fuentes de información; b) algunos medicamentos están comercializados sólo en España o sólo se usan de un modo relevante en España; c) los efectos de los medicamentos deben evaluarse en sus condiciones de uso, que pueden no ser las mismas que en otros países, y d) los efectos de los medicamentos varían en función de factores genéticos y ambientales, que pueden diferir según el tipo de población.
Fase piloto
Se inició en enero de 2000 y se prevé que se extienda hasta finales del año 2003. Hasta junio de 2002, los pasos dados han sido los siguientes: a) se ha constituido un equipo formado por farmacoepidemiólogos, médicos de atención primaria e informáticos; b) se ha dotado el Centro de Proceso de Datos (CPD) de BIFAP (que se encuentra en la División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española del Medicamento) con los medios técnicos pertinentes; c) se ha solicitado una autorización para la puesta en marcha del proyecto a las distintas comunidades autónomas; d) se ha comenzado la difusión informativa del proyecto a médicos y centros de salud; e) se han evaluado los programas de mayor implantación en el Sistema Nacional de Salud en cuanto a las posibilidades de desarrollo de un módulo de exportación de datos específico (los programas, como mínimo, deben permitir el registro codificado de los problemas de salud según la Clasificación Internacional de Atención Primaria, la Clasificación Internacional de Enfermedades novena revisión, o versiones posteriores de ambas; de los medicamentos prescritos según los Códigos Nacionales de Especialidad Farmacéutica, así como de las datos complementarios y observaciones de cada proceso); f) se ha desarrollado un módulo de exportación de datos compatible con el programa OMI-AP versiones 4 y 5, y se han efectuado pruebas de éste, con resultados satisfactorios. Las funciones del módulo son (fig. 1): extraer la información de interés (tabla 1), generar códigos de pacientes de carácter no identificativo (disociación), y encriptar los datos; g) se ha creado la estructura de la base de datos, y h) se ha editado una guía de registro para médicos colaboradores usuarios de OMI-AP, cuya función es la de facilitar recomendaciones en distintos aspectos del registro (p. ej., la asignación de fechas, la codificación de procesos y prescripciones, la inactivación de historias duplicadas, la existencia de historias de pacientes imaginarios utilizados muy a menudo para hacer pruebas de registro y entrenarse en el manejo del ordenador, etc.), que aumenten la consistencia y la validez de la información recogida, conservando al máximo la flexibilidad del programa.
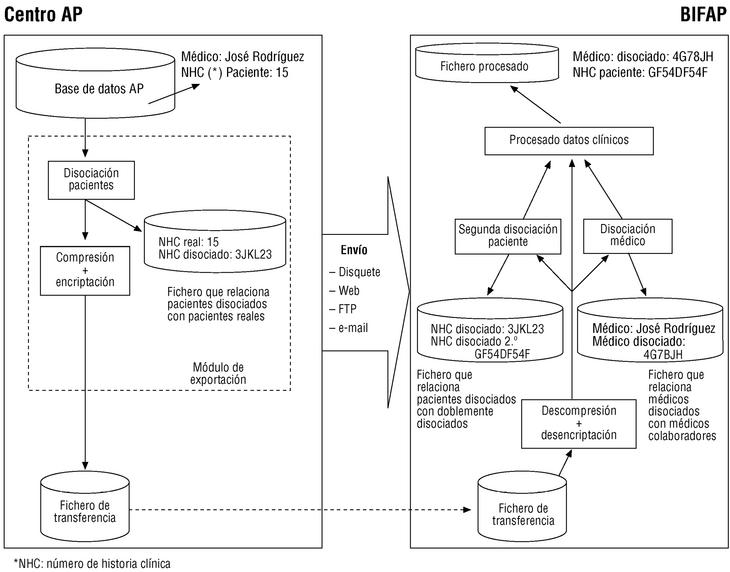
Figura 1. Flujo de información en el Proyecto BIFAP y ejemplo del procedimiento de disociación.
El desarrollo del Proyecto BIFAP es supervisado por un comité científico en el que tienen representación las principales sociedades científicas de atención primaria, y en cuya composición hay médicos de familia, pediatras de atención primaria, especialistas en bioética, especialistas en informatización en atención primaria y farmacoepidemiólogos. Sus cometidos son observar el desarrollo del proyecto, asesorar en aspectos concretos, aportar sugerencias y velar por que se cumplan en todo momento la normativa vigente y las recomendaciones actuales en materia de protección de datos.
Colaboración de los médicos
En el año 2001 se ha comenzado a recabar la colaboración de médicos de familia y pediatras de atención primaria en aquellas comunidades autónomas en las que se dispone de autorización. Se pretende conseguir la colaboración de 300-500 médicos (cifra que se prevé conveniente para los estudios de validación de BIFAP, véase más adelante). La colaboración es de carácter individual y voluntario (con la conformidad previa de la correspondiente dirección o gerencia). Los requisitos esenciales para colaborar en la fase piloto son: a) registrar habitualmente la información de los pacientes a través de OMI-AP , y b) previsión de estabilidad en el puesto de trabajo. Los médicos colaboradores recibirán acreditación como tales.
Ninguna de las actividades que comprende la colaboración va a suponer una carga significativa de trabajo añadido para los médicos que tengan una mínima soltura en el uso del ordenador en consulta. Estas actividades son las siguientes (en negrita se indican las que debe realizar el propio médico colaborador de manera intransferible; en las otras podrían participar, dependiendo del contenido de la actividad, otros médicos del equipo, residentes, informáticos de atención primaria o personal administrativo):
Actividades relacionadas con el envío de datos al CPD:
Instalación del módulo de exportación.
Exportaciones periódicas (cada 2 ó 3 meses). La iniciación de cada exportación requiere el uso de una clave secreta que establece el propio médico colaborador.
Envío al CPD de los ficheros que se generan en el proceso de exportación. Los envíos se podrán hacer por vía telemática o por correo (en disquete u otro soporte adecuado). El flujo de información en el proyecto se representa en la figura 1.
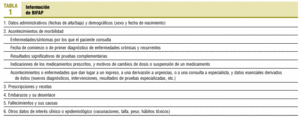
Seguimiento de la guía para médicos colaboradores. El objetivo es alcanzar un nivel suficiente de registro a lo largo de los primeros 6 meses. Es conveniente fomentar el seguimiento de la guía por parte de suplentes y residentes que atiendan al mismo cupo de pacientes. Los distintos tipos de datos a registrar se recogen en la tabla 1.
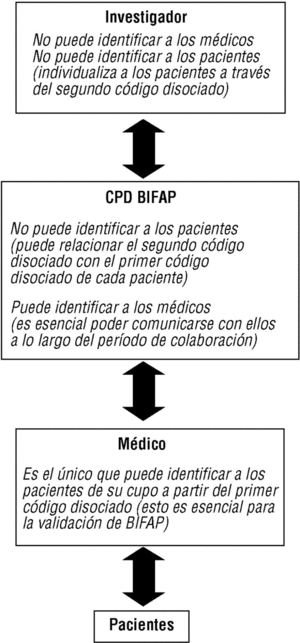
Actividades relacionadas con los estudios de validación de BIFAP, a realizar durante la fase piloto (fig. 2) (v. también el apartado «Validación de BIFAP»):
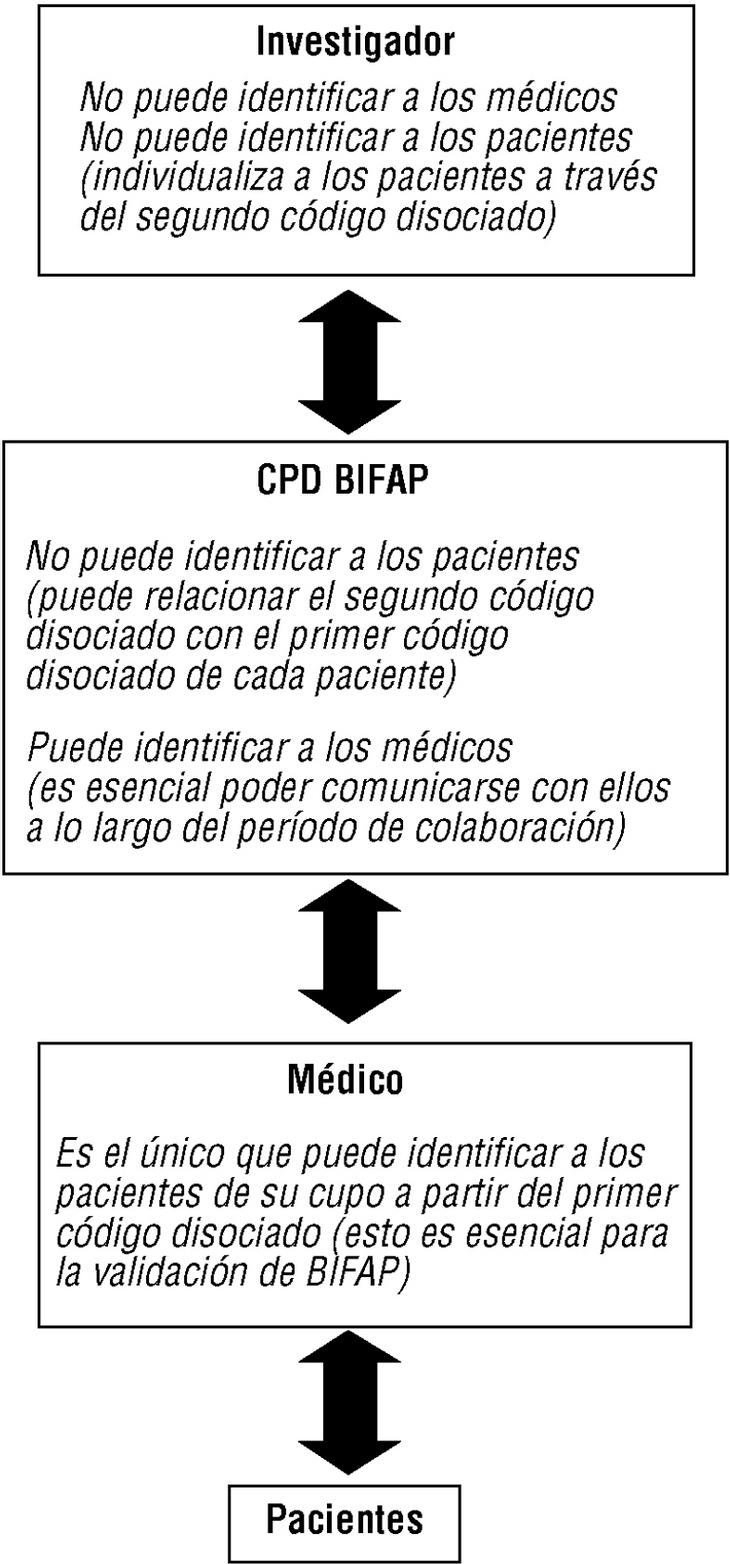
Figura 2. Cadena de comunicación de códigos y protección de identidades en el Proyecto BIFAP.
Fotocopiado o impresión de informes de ingreso, especialistas y pruebas complementarias (archivados en papel o en soporte informático) de pequeñas muestras de pacientes (a tal fin se facilitarán desde el CPD los códigos de disociación individuales de los pacientes seleccionados). A la identidad del paciente sólo puede acceder el propio médico colaborador, pues el módulo le permite al colaborador reasociar este código con su número de historia clínica (para utilizar esta aplicación también hace falta una clave secreta).
Inscripción del código disociado de paciente en las copias de los informes.
Anonimiza de estos documentos fotocopiados o impresos. Esto consiste en eliminar todo dato identificativo directo (nombre y apellidos de los pacientes) o indirecto (nombre de médicos responsables de los informes, hospital, localidad, etc.).
Envío al CPD de los informes anónimos (véase el apartado «Validación»).
Protección de datos en el Proyecto BIFAP
Los mecanismos que garantizan el anonimato y la confidencialidad de los datos son los siguientes: a) la exportación de datos no incluye los datos identificativos personales (fig. 1); b) se efectúa una doble disociación de códigos, en origen y en destino, que asigna a cada paciente un código aleatorio, y se genera en destino un código disociado de cada médico (figs. 1 y 2); c) se efectúa en origen una encriptación de alto nivel que refuerza la seguridad de los datos (fig. 1); d) se siguen en el CPD unas normas de seguridad interna que afectan tanto a la seguridad física y lógica como a los procedimientos de uso de la información, y e) no se comunicará la identidad de los médicos colaboradores a terceras personas (con la obligada excepción de sus correspondientes direcciones/gerencias).
Controles previos a la carga de datos en BIFAP
Los datos que vayan llegando al CPD serán sometidos a controles automatizados, que tienen por objeto comprobar si la información es mínimamente coherente desde el punto de vista cuantitativo y cualitativo, tomando como referencia indicadores poblacionales y valores promedio de la información recibida. Los controles implican, además, la generación de informes que se enviarán personalmente a cada colaborador, y que tienen como fin indicarle las áreas de registro adecuado, las que son susceptibles de mejora y las de registro insuficiente. Naturalmente, estos informes irán dirigidos exclusivamente al correspondiente médico. Se pretende que estos informes supongan un elemento retroalimentador para alcanzar un nivel adecuado de registro, y si ya se está en esta situación, para mantenerlo.
Validación de BIFAP
Los estudios de validación de la base de datos los realizarán los propios investigadores del Proyecto BIFAP durante la fase piloto, cuando la información agregada corresponda como mínimo a un período de 6-12 meses. Los estudios de validación van a consistir en cotejar los registros recogidos en BIFAP con copias anonimizadas de informes clínicos (fig. 2) (véase el apartado «Colaboración de los médicos»), en muestras de pacientes seleccionadas según códigos de enfermedad o de medicación. Se considerará adecuada una concordancia de diagnósticos y medicamentos prescritos superior al 90%. Para los centros que trabajen «sin papeles» se establecerá una estrategia de validación alternativa.
Viabilidad y perspectivas de BIFAP
Únicamente si al final de la fase piloto se cuenta con un número mínimo de médicos colaboradores, y se concluye que BIFAP es válida para la investigación farmacoepidemiológica, tendrá sentido mantenerla como fuente de información permanente. En tal caso, se pedirá a los médicos participantes un compromiso de colaboración estable, y la iniciativa quedará abierta a la incorporación de otros programas informáticos y de nuevos médicos colaboradores, con la finalidad de ir aumentando paulatinamente su población. La cifra de 2.000 médicos colaboradores se antoja conveniente para investigar eficientemente los efectos raros o los efectos de medicamentos de uso infrecuente.
Por otra parte, si en el futuro BIFAP queda establecida como herramienta de investigación, será obligado articular unos procedimientos normalizados de uso y cesión de datos a los investigadores. Estos procedimientos incluirán la revisión científica y ética por un comité independiente de los estudios que se pretenda realizar con ella. Dentro de estas condiciones, se espera que entre los usuarios finales de la base de datos estén los propios médicos colaboradores. En definitiva, ellos son los artífices del Proyecto BIFAP, con el que se pretende poner a la disposición de la salud pública y de la comunidad científica una base de datos que permita realizar estudios farmacoepidemiológicos de calidad con gran economía de tiempo y recursos.
Cómo contactar
Correspondencia: Antonio Salvador. Proyecto BIFAP. División de Farmacoepidemiología y Farmacovigilancia. Agencia Española del Medicamento. Crta. Majadahonda-Pozuelo, Km 2. 28220 Majadahonda (Madrid). España. Correo electrónico: asalvador@bifap.org
El Proyecto BIFAP cuenta con el apoyo de la Sociedad Española de Medicina de Familia y Comunitaria (semFYC), de la Sociedad Española de Medicina Rural y Generalista (SEMERGÉN) y de la Asociación Española de Pediatría de Atención Primaria (AEPAP).
Investigadores principales: Dr. Francisco J. de Abajo Iglesias y Dr. Luis A. García Rodríguez.
Promotores: Agencia Española del Medicamento. Centro Español de Ingestigación Farmacoepidemiológica.
Proyecto BIFAP1. Majadahonda (Madrid). España.
1Comité Científico del Proyecto BIFAP: R. Bravo Toledo (Presidente), F. López Verde, D. Ramírez Puerta, J.A. Carvajal Pascual, D. Montero Corominas, C. Sánchez Carazo, L.A. García Rodríguez, F. de Abajo Iglesias y A. Salvador Rosa (Secretario).