La tripanosomiasis americana o enfermedad de Chagas es una enfermedad infecciosa endémica en América Latina continental, causada por el protozoo Trypanosoma cruzi. En las últimas décadas, debido a los movimientos poblacionales, se ha expandido más allá de las zonas endémicas, siendo España el país europeo con más inmigrantes latinoamericanos.
Durante años puede permanecer asintomática, pero cuando se manifiesta clínicamente puede ser grave (miocardiopatía dilatada, megacolon, megaesófago), así como, debido a su transmisión vertical, la detección en embarazadas es una alta prioridad.
Se han elaborado guías de detección de Trypanosoma cruzi en circunstancias específicas (bancos de sangre, maternidades, coinfección con el VIH, trasplante de órganos); pero detectamos falta de información dirigida a los profesionales de atención primaria. Para facilitar la detección y manejo de esta enfermedad se consideró la necesidad de realizar este documento, redactado y consensuado por médicos de familia, pediatras de atención primaria y especialistas en salud internacional.
Chagas disease is caused by the protozoan Trypanosoma cruzi. Although it is commonly transmitted by an insect vector in continental Latin-America, in recent decades, due migration, has been diagnosed in other countries such Spain, the European country with a largest immigrant population of Latin American. For a long time, the patient remains asymptomatic, but some years after this stage, the symptoms can be serious (dilated cardiomyopathy, megacolon, megaesophagus). In addition, detection in pregnant women has a high priority because of the route of vertical transmission.
Several specific guidelines about Chagas disease has been developed on the Banks of blood, maternal hospitals, HIV co-infection, organ transplant. But due to the detection of lack of information to primary care professionals, we consider to will be useful this document written and agreed to by family phisicians, pediatricians and specialists in International Health.
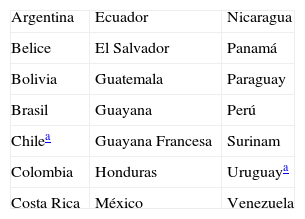
La tripanosomiasis americana o enfermedad de Chagas (EC) es una enfermedad infecciosa endémica en 21 países de América Latina (tabla 1), estrechamente vinculada con aspectos socioeconómico-culturales deficitarios, siendo reconocida por la Organización Mundial de la Salud como una de las 17 enfermedades tropicales desatendidas del mundo.
Está causada por la infección de un parásito protozoario hemoflagelado, Trypanosoma cruzi (T. cruzi).
Su principal vía de transmisión en área endémica es vectorial, a partir de insectos triatominos que tienen su ecosistema natural en el continente americano; estos insectos son conocidos como «vinchuca» en Bolivia, Argentina y Chile, «chipo» en Venezuela, «chiribico» en Colombia, «chinche besucona» en México o «barbeiro» en Brasil, entre otros. Si bien su hábitat natural se extiende desde el sur de Estados Unidos a la región central de Argentina y Chile, su distribución es muy heterogénea, siendo las áreas más afectadas el centro y sur de Bolivia (con prevalencias cercanas al 30% de la población general), norte de Argentina, sur de Perú y determinadas áreas de Paraguay, Brasil, Ecuador, Nicaragua, El Salvador y sur de México.
Otras formas de transmisión son: congénita, por transfusión de sangre, por trasplante de órganos, vía oral (por la ingesta de alimentos contaminados con parásitos) o por accidente de laboratorio.
En las últimas décadas, debido a los flujos migratorios, se han producido importantes cambios epidemiológicos en la EC, diagnosticándose un número creciente de personas en áreas no endémicas, principalmente en Europa y Norteamérica. En Europa el Estado español es el país más afectado y se estima que puede haber entre 50 y 70.000 personas con EC1.
Son numerosas las publicaciones que han detectado casos individuales o que han evaluado la prevalencia de la EC en nuestro país, tanto en la población inmigrante2–4 como en los bancos de sangre5, en los programas de trasplante6 y maternidades7–9.
En España estos resultados, junto a estudios de evaluación económica10, sirvieron para mostrar la conveniencia de implementar protocolos de actuación para el control de las vías de transmisión del T. cruzi posibles en área no endémica.
El Real Decreto 1088/2005 establece la obligatoriedad de cribar en los bancos de sangre a los potenciales donantes con riesgo epidemiológico de EC. El Plan nacional de sangre de cordón (14 de marzo de 2008) recoge las mismas recomendaciones que las relacionadas con la transfusión de sangre.
La transmisión vertical se controla por el cribado sistemático de gestantes. En Valencia11, Cataluña12 y Galicia existen protocolos específicos para el cribado y diagnóstico de EC en mujeres embarazadas latinoamericanas y en sus recién nacidos.
En el año 2005 la Sociedad Española de Medicina Tropical y Salud Internacional inició la elaboración de documentos de consenso para el diagnóstico y tratamiento de la EC importada, que abarcan diversos aspectos de la problemática y complicaciones de esta enfermedad13–17.
JustificaciónA pesar de los avances descritos, se estima que el porcentaje de población infectada por T. cruzi diagnosticada en Europa no alcanza el 10% del total18.
Existen aún importantes retos para el sistema sanitario en el abordaje de la EC, como son: extender la implementación del programa de control de transmisión vertical a todas las comunidades y el diagnóstico, tratamiento y seguimiento adecuado de los infectados.
La atención primaria de salud (APS) constituye el marco habitual de acceso al sistema de salud, y es el ámbito idóneo para detectar de forma precoz aquellas personas afectadas por la EC que pudieran beneficiarse de un tratamiento.
Objetivos del documentoDefinir las características demográficas, epidemiológicas y clínicas de las personas susceptibles de estar infectadas por T. cruzi, para facilitar su detección y manejo por el médico de familia o pediatra, integrando el cuidado de los afectados por la EC en los servicios de APS.
MetodologíaPara la elaboración del documento se realizó una revisión exhaustiva de la evidencia científica disponible utilizando el motor de búsqueda PubMed de libre acceso a la base de datos Medline (última revisión de marzo de 2014).
El documento ha sido sometido a la revisión externa de un grupo multidisciplinar de profesionales expertos, miembros de diversas sociedades científicas, que han participado de forma voluntaria y altruista.
Aspectos clínicos de la enfermedad de ChagasFases de la enfermedad de Chagas y manifestaciones clínicasLa EC evoluciona en 2 fases, aguda y crónica, cada una de ellas con características clínicas, criterios diagnósticos y terapéuticos diferentes.
Fase agudaSe inicia al adquirir la infección por cualquiera de sus vías y dura entre 30 y 90 días. Se caracteriza por la presencia de una alta parasitemia detectable por métodos parasitológicos directos. Generalmente es asintomática o presenta síntomas inespecíficos como fiebre, adenomegalias, hepatoesplenomegalia, anemia, anorexia o diarrea.
En áreas endémicas, cuando la vía de transmisión es vectorial, en un 8% de los casos pueden aparecer síntomas específicos como el chagoma de inoculación. Las manifestaciones clínicas graves y poco frecuentes de esta fase son miocarditis y meningoencefalitis.
En países no endémicos la fase aguda solo se puede observar en neonatos (transmisión congénita), personas transfundidas o trasplantadas.
La mayoría de los recién nacidos con EC adquirida por transmisión congénita permanecen asintomáticos. Cuando aparecen, las manifestaciones y cuadros clínicos más importantes son hepatoesplenomegalia, hepatitis, sepsis, meningitis, miocarditis o anemia hemolítica, pudiendo ser ocasionalmente causa de muerte.
Habitualmente, las manifestaciones agudas de la EC remiten de forma espontánea, dando paso a la fase crónica indeterminada o asintomática.
Fase crónicaLa parasitemia periférica es escasa e intermitente y el diagnóstico se realiza por medio de técnicas serológicas.
- ∘
EC en fase crónica, forma indeterminada, asintomática, consiste en la positividad de las pruebas serológicas con ausencia de afectación orgánica demostrable y puede persistir toda la vida del paciente.
Aproximadamente un 20-30% de estos pacientes, entre 10 y 20 años después de la primoinfección, evolucionan lentamente hacia una fase crónica sintomática que cursa con disfunción autonómica, micro-inflamaciones y fibrosis, produciendo lesiones irreversibles en los órganos diana (corazón, esófago, colon y sistema nervioso periférico).
- ∘
EC en fase crónica con afectación cardiaca. Cursa con miocardiopatía dilatada y trastornos de la conducción, que producirá insuficiencia cardiaca, tromboembolismos y arritmias.
Las alteraciones electrocardiográficas y ecocardiográficas más frecuentes en la cardiopatía chagásica16,19 se detallan en la tabla 2.
- ∘
EC en fase crónica con afectación digestiva. Puede llegar a afectar al 15-20% de los pacientes con EC. Se producen dilataciones del tracto digestivo (megaesófago, megacolon) y trastornos motores gastrointestinales como acalasia esofágica, alteración del vaciado gástrico, alteración del tránsito intestinal y estasis biliar.
Alteraciones electrocardiográficas y ecocardiográficas más frecuentes en la cardiopatía chagásica
| Alteraciones electrocardiográficas | Bloqueo completo de la rama derecha aislado o asociado a hemibloqueo anterior de rama izquierdaExtrasístoles ventriculares, aisladas o repetitivasAlteración primaria de la repolarización ventricular, que puede simular cardiopatía isquémicaZonas eléctricamente inactivas (ondas q)Bloqueos auriculoventricularesOtras alteraciones menos frecuentes: bloqueo de rama izquierda, disfunción sinusal, taquiarritmia supraventricular (fibrilación auricular) |
| Alteraciones ecocardiográficas | Alteraciones segmentarias de la contractilidad miocárdica, sobre todo pared posteroinferior y ápex del ventrículo izquierdoAneurismas en el ápex del ventrículo izquierdo (de cuello estrecho y frecuentemente con trombos murales)Hipocinesia o acinesia de la pared posteroinferiorAfección de la porción basal del septo anterior, con acinesia o formación de aneurismas subaórticosMiocardiopatía dilatadaDilatación y disfunción del ventrículo derecho |
Los síntomas principales son: disfagia, odinofagia, regurgitación, estreñimiento crónico y/o dolor abdominal.
- ∘
EC en fase crónica con afectación mixta cardiodigestiva.
- ∘
EC en fase crónica con afectación neurológica. La enfermedad cerebrovascular puede ser secundaria a la cardiopatía chagásica (insuficiencia cardiaca, trombosis mural y/o arritmias) pero también puede ser el primer signo de la EC en pacientes asintomáticos o con disfunción sistólica leve, por lo que los pacientes con enfermedad cerebrovascular que provienen de regiones endémicas deben ser examinados para la infección por T. cruzi20.
- ∘
EC crónica reactivada21. Los pacientes con inmunosupresión pueden presentar una reactivación de la EC. En pacientes con infección por el VIH las alteraciones del sistema nervioso central pasan a ser predominantes y a veces exclusivas. En pacientes inmunodeprimidos por leucemias y terapias inmunosupresoras destacan los cuadros de miocarditis y de meningoencefalitis. En los pacientes trasplantados son frecuentes los nódulos subcutáneos.
Solo es posible detectar la forma circulante del T. cruzi durante la fase aguda de la infección, por lo que los métodos diagnósticos más idóneos son los directos (parasitológicos) y los moleculares (PCR). Estas pruebas también son útiles en los casos de reactivación.
En la fase crónica de la enfermedad la parasitemia es de baja intensidad e intermitente, por lo que el diagnóstico se realiza mediante la detección de anticuerpos IgG anti-T. cruzi (diagnóstico serológico).
De acuerdo con los criterios internacionales, se consideran positivos para EC aquellos sueros que son reactivos mediante 2 técnicas serológicas que utilizan antígenos distintos, y cuando los resultados son discordantes o dudosos es necesario realizar una tercera prueba confirmatoria.
En los recién nacidos de madres con EC las pruebas serológicas no son útiles para llegar a un diagnóstico precoz de la EC congénita, ya que las IgG anti-T.cruzi halladas en el recién nacido hasta los 9 meses de vida pueden ser de origen materno, y la detección de IgM no ofrece resultados satisfactorios, por lo que, siempre que sea posible, deben realizarse pruebas parasitológicas directas (microhematocrito o PCR) durante el primer mes de vida para detectar el parásito o el ADN del mismo22 y reservar las pruebas serológicas a partir de los 9 meses de edad.
TratamientoEn la fase aguda de la EC y en niños menores de 12 meses se establecen cifras serológicas de curación cercanas al 100% tras el tratamiento con benznidazol (BNZ)23. En la fase crónica de la enfermedad las tasas de curación disminuyen. Aunque la patogénesis de la EC crónica es multifactorial, la persistencia del parásito es el hecho clave para su desarrollo24. Por ello, la eliminación o la disminución de la carga parasitaria modifican la evolución natural de la enfermedad25.
Actualmente los únicos fármacos disponibles para tratar la EC son nifurtimox (NF) y BNZ. Ambos fármacos están contraindicados en mujeres embarazadas y en pacientes con insuficiencia renal o hepática severa. Durante el tratamiento debe evitarse el consumo de alcohol.
La pauta terapéutica consiste en:
- -
BNZ: en adultos 5mg/kg de peso/día (máximo 300mg/24h), repartidos en 2-3 dosis orales diarias, durante 60 días. En niños menores de 12 años la dosis recomendada es de 10mg/kg de peso/día.
BNZ puede producir efectos secundarios gastrointestinales al inicio del tratamiento, pero suelen ser leves y bien tolerados. Las reacciones adversas que más frecuentemente inducen al abandono del tratamiento son las derivadas de hipersensibilidad cutánea, con aparición de exantema eritematoso y pruriginoso que en ocasiones puede ser grave.
- -
NF (no disponible en España): en adultos 8-10mg/kg/día, administrado oralmente en 3 o 4 tomas diarias, durante 60 días. En niños de 11 a 16 años la dosis recomendada es de 12,5-15mg/kg/día y en niños menores de 11 años la dosis será de 15-20mg/kg/día.
Las reacciones adversas más frecuentes son la anorexia, las náuseas, los vómitos y, en menor medida, dolor abdominal, diarrea, pérdida de peso, irritabilidad, somnolencia y alteraciones psiquiátricas. La neuropatía periférica es un efecto dosis dependiente que ocurre más frecuentemente durante el 2.° mes de tratamiento y que requiere la discontinuidad del mismo.
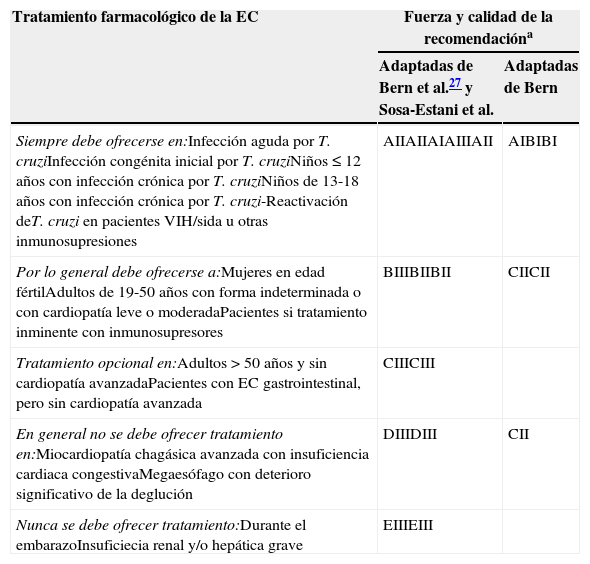
En la tabla 3 se exponen las recomendaciones para el tratamiento antiparasitario de la EC, según el nivel de evidencia.
Recomendaciones para el tratamiento antiparasitario de la enfermedad de Chagas, según el nivel de evidencia
| Tratamiento farmacológico de la EC | Fuerza y calidad de la recomendacióna | |
|---|---|---|
| Adaptadas de Bern et al.27 y Sosa-Estani et al. | Adaptadas de Bern | |
| Siempre debe ofrecerse en:Infección aguda por T. cruziInfección congénita inicial por T. cruziNiños≤12 años con infección crónica por T. cruziNiños de 13-18 años con infección crónica por T. cruzi-Reactivación deT. cruzi en pacientes VIH/sida u otras inmunosupresiones | AIIAIIAIAIIIAII | AIBIBI |
| Por lo general debe ofrecerse a:Mujeres en edad fértilAdultos de 19-50 años con forma indeterminada o con cardiopatía leve o moderadaPacientes si tratamiento inminente con inmunosupresores | BIIIBIIBII | CIICII |
| Tratamiento opcional en:Adultos>50 años y sin cardiopatía avanzadaPacientes con EC gastrointestinal, pero sin cardiopatía avanzada | CIIICIII | |
| En general no se debe ofrecer tratamiento en:Miocardiopatía chagásica avanzada con insuficiencia cardiaca congestivaMegaesófago con deterioro significativo de la deglución | DIIIDIII | CII |
| Nunca se debe ofrecer tratamiento:Durante el embarazoInsuficiecia renal y/o hepática grave | EIIIEIII | |
aLa clasificación de la fuerza y la calidad de las recomendaciones se ha realizado aplicando una adaptación del sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA), tal y como se refleja a continuación:
Fuerza de la recomendación:
A: evidencias muy sólidas para apoyar el uso de una recomendación; sería ofrecida siempre.
B: moderada evidencia para apoyar el uso de una recomendación; generalmente sería ofrecida.
C: escasa evidencia para apoyar una recomendación; opcional.
D: moderada evidencia en contra de una recomendación; generalmente no sería ofrecida.
E: evidencia muy sólida en contra de una recomendación; nunca sería ofrecida.
Calidad de la recomendación:
I: evidencia procedente de al menos un ensayo clínico aleatorizado.
II: evidencia procedente de al menos un ensayo no aleatorizado, bien diseñado, bien de estudios de cohortes, de estudios analíticos de casos y controles (preferiblemente de más de un centro), de series temporales o de resultados concluyentes obtenidos en estudios experimentales no controlados.
III: evidencia de opiniones de expertos basadas en la experiencia clínica o en estudios descriptivos.
Fuentes: Sosa-Estani S, Colantonio L, Segura EL. Therapy of Chagas disease: Implications fr levels of prevention. J Trop Med. 2012;2012:292138. DOI: 10.1155/2012/292138.
Bern C. Chagas disease: Management of acute disease, early chronic disease, and disease in immunocompromised hosts. UpToDate, Feb 2014. Disponible en: http://www.uptodate.com/contents/chagas-disease-management-of-acute-disease-early-chronic-disease-and-disease-in-immunocompromised-hosts?source=search_result&search=chagas&selectedTitle=4∼57
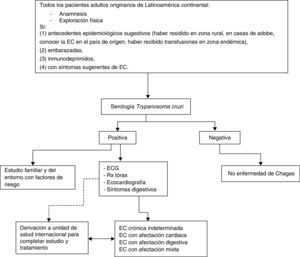
Al ser una enfermedad parasitaria crónica que puede permanecer asintomática, el diagnóstico requiere de un alto grado de sospecha clínica, basado en los antecedentes epidemiológicos del paciente.
El objetivo de la anamnesis será doble:
- 1.
Evaluar el riesgo epidemiológico de la infección por T.cruzi.
Valorar el origen del paciente o la estancia prolongada (más de un mes) en áreas endémicas y recoger información sobre:
- -
País de origen, departamento o región y/o municipio.
- -
Residencia en zonas rurales o urbanas, haber habitado en casas de adobe.
- -
Conocimiento de la existencia de la EC en el área o las áreas donde ha vivido26, o de algún familiar con EC, preguntando específicamente por el antecedente materno.
- -
Si ha recibido transfusiones de sangre o ha sido receptor de trasplantes en el país endémico.
- -
En la consulta pediátrica, aparte de saber si el niño/a es originario de zona endémica (considerar los niños adoptados), es importante detectar a los nacidos en España, hijos de madre originaria de zona endémica y comprobar si se ha realizado el cribado de la EC durante el embarazo y el resultado del mismo.
- -
- 2.
Detectar síntomas de probable afectación orgánica.
Debe tenerse en cuenta que la mayor parte de los pacientes con EC se encontrarán en fase crónica indeterminada y por consiguiente asintomáticos.
- -
Para detectar cardiopatía subyacente se interrogará sobre la presencia de síntomas secundarios a alteraciones del ritmo cardiaco (palpitaciones, síncopes), insuficiencia cardiaca, fenómenos tromboembólicos venosos y sistémicos (embolias pulmonares o sistémicas, enfermedad vascular cerebral generalmente isquémica) o alteraciones microvasculares (dolor precordial).
- -
Para detectar afectación digestiva se interrogará sobre17 síntomas relacionados con alteración esofágica (disfagia, regurgitación, odinofagia, tos nocturna, sialorrea, hipertrofia parotídea), con alteración gastroduodenal (dispepsia, pirosis, distensión abdominal, epigastralgia) y con alteración colónica (estreñimiento, cambio del ritmo deposicional, sensación de evacuación incompleta).
- -
Peso, talla (o longitud en menores de 2 años) e índice de masa corporal (IMC en kg/m2).
- -
Presión arterial, frecuencia cardiaca.
- -
Exploración cardiovascular detallada. Auscultación cardíaca durante 1min.
- -
Exploración abdominal exhaustiva.
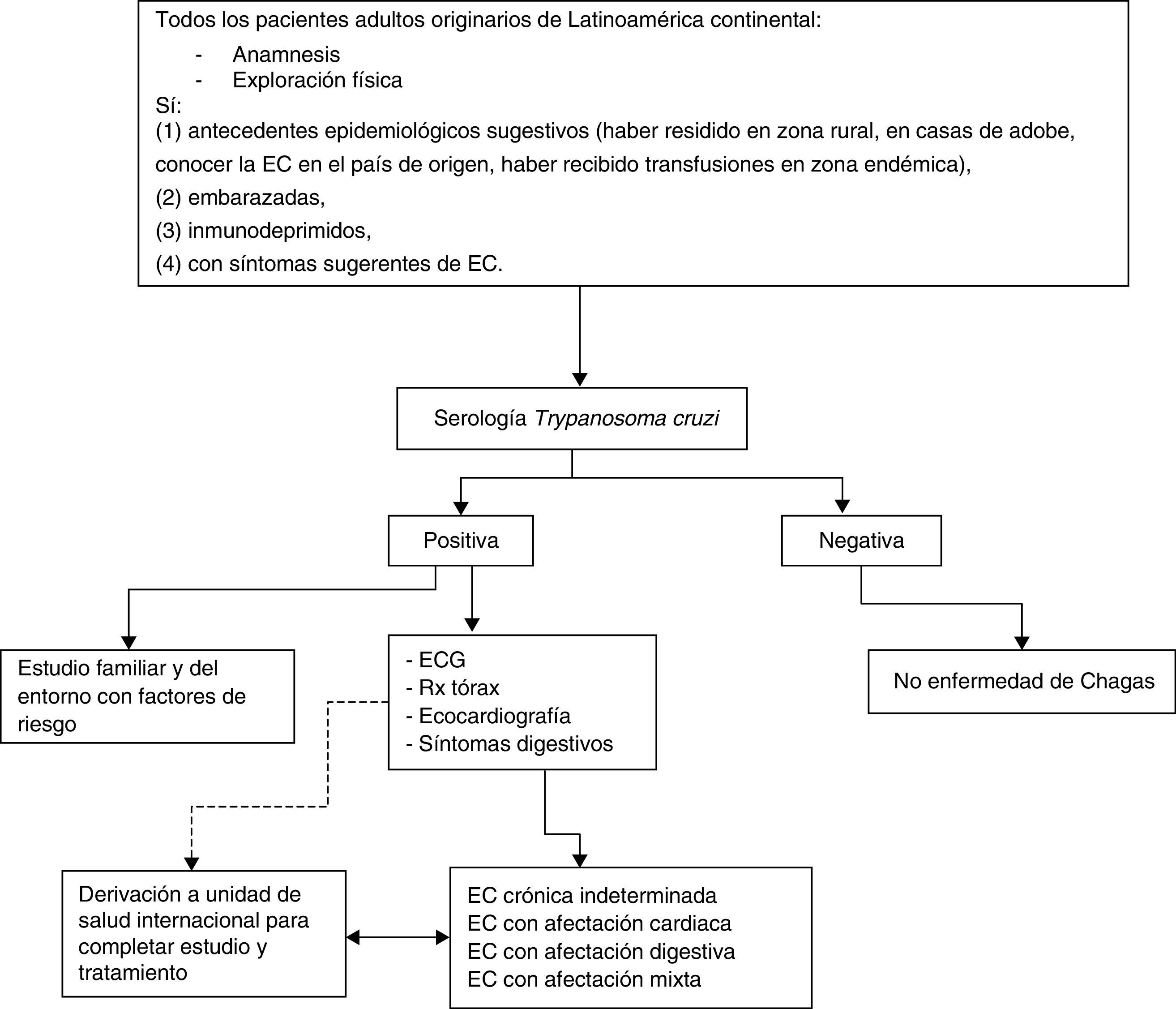
En los países no endémicos para EC, tras los resultados obtenidos en diversos estudios4,27, se recomienda la detección de la infección por T. cruzi a los adultos originarios de Latinoamérica continental, o que hayan realizado largas estancias (más de un mes) en estos países, que hayan sido informados correctamente y accedan a ser estudiados y que presenten:
a) Antecedentes epidemiológicos sugestivos.
b) Embarazo.
c) Inmunodepresión.
d) Síntomas/signos sugerentes de EC.
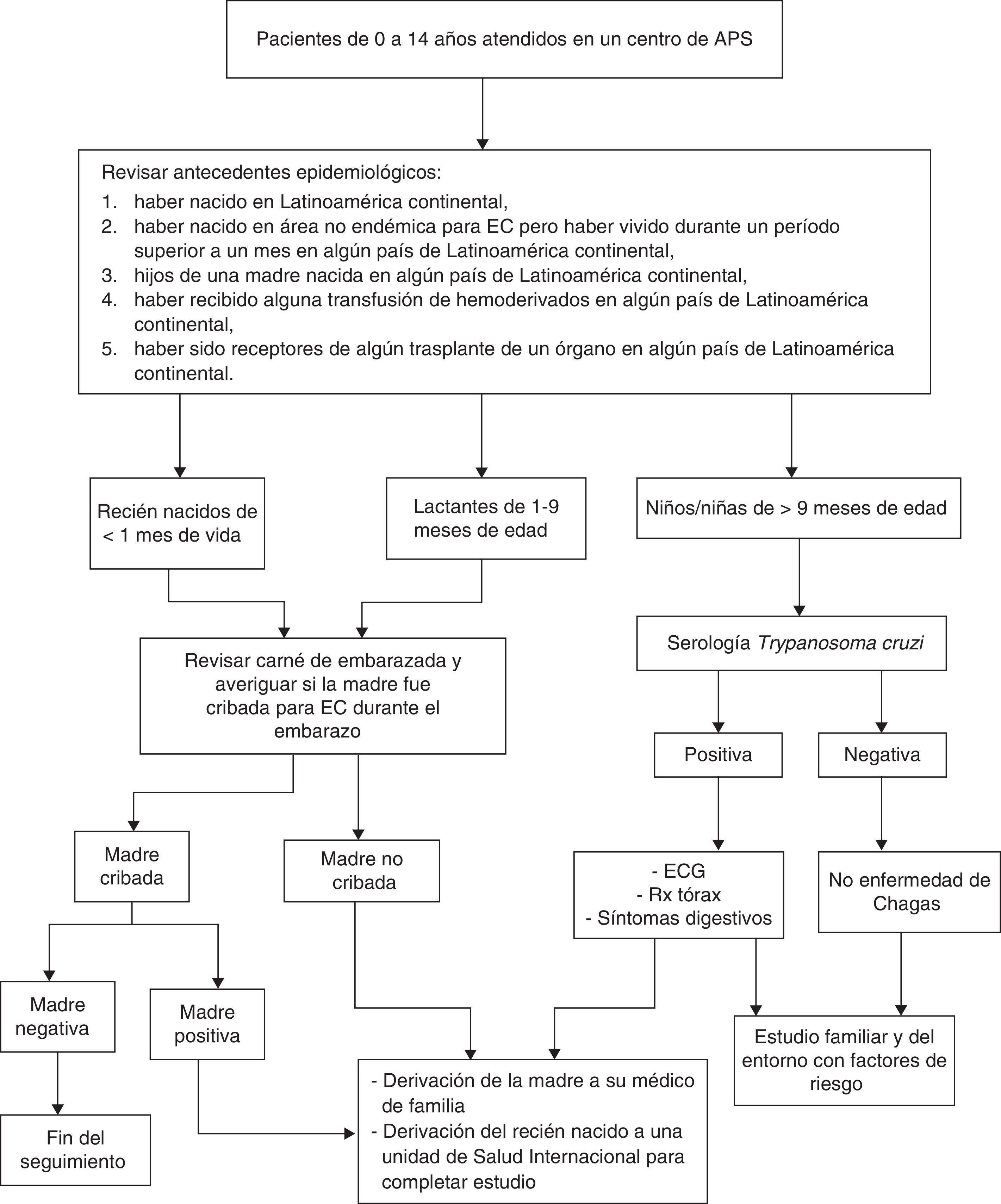
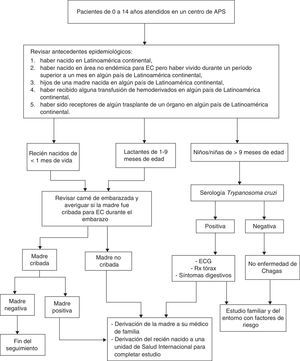
Los pediatras de APS tienen una responsabilidad fundamental para la detección y abordaje de la EC en la población que atienden28. Todo niño/a que es atendido en una primera visita al centro es tributario de ser interrogado por su origen biográfico y familiar.
Serán susceptibles de ser estudiados los niños/niñas en edad pediátrica (de 0 a 14 años), previa información y consentimiento de los padres o tutores, con los siguientes antecedentes epidemiológicos:
a) Haber nacido o haber realizado largas estancias (más de un mes) en Latinoamérica continental.
b) Ser hijos de madre nacida en país endémico.
c) Haber recibido alguna transfusión de hemoderivados o haber sido receptores de algún trasplante de un órgano en país endémico.
Para descartar la EC en fase crónica desde la APS deben solicitarse anticuerpos IgG anti-T. cruzi.
Exploraciones complementariasCon el objetivo de determinar si un paciente con infección por T. cruzi presenta enfermedad orgánica se recomienda practicar:
a) Electrocardiograma (ECG) convencional de 12 derivaciones, con un registro largo de 30seg, en DII.
b) Radiografía de tórax (posteroanterior y lateral): la evidencia de cardiomegalia podría ser un factor predictivo de riesgo de muerte súbita en pacientes con EC crónica. También puede detectar alteraciones del mediastino secundarias a megaesófago.
c) Ecocardiografía: valorar la función ventricular y descartar aneurismas.
En la tabla 4 se detallan otras exploraciones complementarias optativas en función de la disponibilidad y de la clínica.
Exploraciones complementarias optativas
| Para completar el estudio cardiológico (dependiendo de la clínica que presente el paciente) | Estudio Holter de 24h: permitirá establecer la posible relación de los síntomas con una arritmia, identificar a los pacientes en riesgo de muerte súbita y evaluar la presencia de disfunción autonómicaEstudio electrofisiológicoPrueba de esfuerzoCoronariografíaBiopsia miocárdica |
| Para completar el estudio digestivo (dependiendo de la clínica que presente el paciente) | Estudio radiológico con enema opaco, teniendo en cuenta las técnicas de Ximenes para la realización de estudio radiológico baritado en pacientes con sospecha de afectación digestiva chagásicaEsofagograma, teniendo en cuenta las técnicas de Rezende para la realización de estudio radiológico baritado en pacientes con sospecha de afectación digestiva chagásicaDiagnóstico de la infección por Helicobacter pylori: a todos los pacientes que presenten dispepsia, pirosis o signos de distensión abdominal posprandial. En los pacientes >50años el estudio debe ser endoscópico mientras que en <50años puede realizarse mediante técnicas no invasivas (habitualmente test del aliento: estrategia test and treat)En caso de Helicobacter pylori positivo se recomienda el tratamiento erradicador y posteriormente confirmar su erradicaciónEstudio de parásitos en heces: síntomas digestivos atribuidos a la EC pueden estar producidos por parasitosis intestinales. Se recomienda estudio seriado de parásitos en heces mediante 3 muestras de diferentes días, incluyendo un análisis en frescoManometría esofágica: a todos los pacientes que aun con esofagograma normal presenten sintomatología esofágicaEstudios endoscópicos: siempre que se constate megaesófago para valorar el estado de la mucosa esofágica, y siempre que se sospeche de otra enfermedad digestiva por el cuadro clínico o los antecedentes familiares que refiera el paciente |
A pesar de que BNZ es el único fármaco autorizado en España para el tratamiento de la EC, no está disponible en el circuito habitual de las farmacias, y solo puede dispensarse como medicamento extranjero.
Durante el tratamiento es aconsejable realizar visitas de seguimiento y control analítico (hemograma, la función hepática y renal) cada 2-3 semanas para controlar la aparición de reacciones adversas y el cumplimiento terapéutico. La coordinación entre el servicio especializado y la APS puede ofrecer grandes ventajas.
En mujeres en edad fértil descartar la posibilidad de embarazo previo al inicio del tratamiento e indicar la anticoncepción durante el mismo.
SeguimientoEnfermedad de Chagas en fase crónica indeterminadaPara detectar precozmente la afectación orgánica se aconseja practicar anualmente un ECG y realizar anamnesis sobre síntomas y signos de afectación cardiaca o digestiva.
Enfermedad de Chagas con afectación cardiaca o digestiva o mixtaEl seguimiento de la enfermedad cardiaca y/o digestiva chagásica por el médico de familia será la habitual que realizará en estas mismas enfermedades debidas a otras etiologías.
Recién nacidos hijos de madres positivasAunque el resultado de la parasitemia haya sido negativo en el periodo neonatal es obligatorio realizar un seguimiento del niño/a y una serología a los 9-12 meses de edad, cuando es esperable que los anticuerpos maternos hayan sido eliminados. Una serología negativa a esta edad descarta la transmisión vertical de la EC. Si es claramente positiva con un título serológico elevado se iniciará el tratamiento del lactante, pero si el título está cercano al punto de corte deberá confirmarse el diagnóstico con una nueva determinación serológica un mes después.
No se ha demostrado la presencia de T. cruzi en la leche de las madres con EC, por lo que la lactancia materna no se desaconseja, a no ser que existan heridas sangrantes en el pezón23.
Aspectos preventivos en viajerosLa APS ocupa una situación clave para la prevención primaria de la EC, aconsejando medidas antivector a los viajeros a zonas endémicas (especialmente el altiplano andino y Bolivia).
La población de mayor riesgo la constituyen los inmigrantes que viajan a zonas endémicas para visitar a familiares y amigos.
El riesgo de contraer la EC durante el viaje es bajo, aunque hay que considerar factores como el tipo de viaje, la duración, la estancia en zonas rurales y el tipo de alojamiento.
Debe aconsejarse a toda persona que haya estado en zona endémica de EC y que al regreso de su viaje presente síntomas de malestar, fiebre, erupción cutánea, dolor abdominal o cualquier otro síntoma que acuda a su médico.
Otras consideracionesLa APS será responsable del estudio de los familiares u otras personas del entorno del paciente con EC que hayan sido expuestas a los mismos riesgos epidemiológicos.
- Mariola Espejo Surós
Centre de Vacunacions Internacionals Eixample. Institut Català de la Salut, Lleida.
Comissió de Cooperació i Salut Internacional (Cocoopsi)–Societat Catalana de Medicina Familiar i Comunitària (CAMFiC).
Medicus Mundi Catalunya.
-Ana Fullana Montoro
Centro de Salud Salvador Pau, Valencia.
Asociación Española de Pediatría de Atención Primaria.
-Jordi Gómez i Prat
Unitat de Salut Internacional Drassanes-Vall Hebron, PROSICS, Barcelona.
-José Luis Martíncano
Consultorio de Jabugo, UGC de Cortegana, AGC Norte de Huelva, Servicio Andaluz de Salud, Grupo de trabajo de Atención al Inmigrante. SEMERGEN.
-Fernando Parreño Rodríguez
Centro de Atención Primaria Florida Nord, L‘Hospitalet de Llobregat, Barcelona.
-Sílvia Roure Díez
Unitat de Salut Internacional Metropolitana Nord, Universitat Autònoma de Barcelona, Institut Català de la Salut.
-María Eugenia Socías
Fundación Mundo Sano.
-Lluís Valerio Sallent
Unitat de Salut Internacional Metropolitana Nord, Universitat Autònoma de Barcelona, Institut Català de la Salut.
Ninguno de los autores declara conflicto de intereses.
Documento publicado simultáneamente en la revista Pediatría de Atención Primaria (revista oficial de la Asociación Española de Pediatría de Atención Primaria).
Más información sobre los componentes del Grupo de consenso Chagas-APS está disponible en el anexo 1.