Introducción
Las enfermedades del aparato respiratorio representan un importante problema de salud pública, pues conllevan una elevada morbimortalidad. Las dos enfermedades más prevalentes y con mayores implicaciones sociosanitarias y económicas son el asma y la enfermedad pulmonar obstructiva crónica (EPOC). Al ser enfermedades que producen una obstrucción de la vía aérea bronquial, no es difícil observar cómo en algunos documentos de atención primaria ambas se protocolizan y se registran sin distinción1. Este comportamiento es entendible cuando comprobamos la similitud existente entre ambas enfermedades en algunos aspectos (tabla 1), lo que ha llevado a crear cierta confusión entre los médicos y el personal de enfermería, y posiblemente aboque a conductas equívocas en la práctica clínica.
Si la relación de algunos parámetros entre el asma y la EPOC es estrecha, no es menor la diferencia existente entre ambas enfermedades (tabla 2), sobre todo en su fisiopatología, factores de riesgo, respuesta al tratamiento, pronóstico, etc.
Diagnosticar correctamente a un paciente con asma o EPOC es necesario para la administración de las medidas terapéuticas y preventivas correctas y mejorar de esta manera el pronóstico de la enfermedad. En fumadores con obstrucción crónica al flujo aéreo, con la prueba broncodilatadora positiva o con rasgos de atopia, es difícil, en ocasiones, establecer un diagnóstico preciso. También hay pacientes en los que no se llega a un diagnóstico en el momento de la consulta y será la observación objetiva de su evolución y la respuesta al tratamiento lo que nos ayudará en el diagnóstico diferencial. A pesar de todo, existen algunos casos que plantean dudas diagnósticas ya que presentan características propias de ambas enfermedades.
Datos epidemiológicos
Los diferentes estudios publicados sobre la prevalencia del asma presentan una metodología muy diversa y los resultados son difícilmente comparables, en parte debido a la ambigüedad existente sobre la definición de la enfermedad.
La prevalencia del asma se caracteriza por una gran variabilidad geográfica, incluso entre zonas rurales y urbanas, y es más frecuente en la infancia y en personas mayores. Esta variabilidad no es tan importante en la EPOC.
En un estudio de base poblacional de la prevalencia de asma en España (en 5 áreas), con muestras representativas de la población de 20 a 44 años de edad, al combinar las respuestas al cuestionario de síntomas con un test de hiperreactividad bronquial (test de metacolina) se observó una tasa del 4,7% en Albacete, el 3,5% en Barcelona, el 1,1% en Galdakao, el 1% en Huelva y el 1,7% en Oviedo2.
Otro estudio realizado en niños de 6-7 y 13-14 años de edad en más de 150 áreas geográficas de todo el mundo, y en el que participaba España (Almería, Barcelona, Bilbao, Cádiz, Cartagena, Castellón, Pamplona, Valencia y Valladolid), a la pregunta de si habían tenido asma alguna vez las respuestas fueron muy variables y oscilaban entre el 6,2 y el 16,3%. Valladolid, Almería, Castellón y Pamplona presentaron una prevalencia menor que otras áreas, como Barcelona y Cádiz, y en Bilbao se encontró la mayor prevalencia de todas las áreas estudiadas.
Respecto a la presencia de sibilancias durante el último año, la prevalencia se distribuía de la siguiente manera: 5,5% en Pamplona, 6,1% en Valladolid, 7,1% en Castellón, 7,4% en Almería, 10,5% en Cartagena, 11% en Valencia, 11,9% en Bilbao, 14,3% en Barcelona y 15,4% en Cádiz3.
En Huelva, la prevalencia de sibilancias en niños de 10 y 14 años de edad fue del 16 y el 13,4%, respectivamente, y el 8% de los niños presentó un test de metacolina positivo4.
La relación entre tabaco y EPOC es muy notable, por lo que la prevalencia de la enfermedad dependerá del consumo de tabaco. De todas maneras, no se sabe por qué sólo un 15-20% de los fumadores desarrollará la enfermedad. Actualmente, el 36% de los españoles mayores de 16 años es fumador, un 13% es ex fumador y un 51% no ha fumado nunca. En 1999 han sido publicados los resultados de un estudio poblacional (IBERPOC), realizado en 7 áreas geográficas de nuestro país. En este estudio se establece una prevalencia de EPOC del 9,1% en edades comprendidas entre 40 y 69 años, y del 23% en varones entre 60 y 69 años de edad, representando aproximadamente el 12% de todas las consultas realizadas al médico de atención primaria en personas mayores de 65 años5.
El asma es más frecuente entre los niños, situación que se invierte en la edad adulta, y vuelve a ser más prevalente entre los varones mayores de 70 años6, por lo que no es raro observar pacientes cuya primera manifestación de asma aparece a estas edades.
La EPOC tiene una prevalencia mayor en la edad adulta, y ésta se incrementa a medida que aumenta la edad. Un pequeño grupo de enfermos con déficit de α-antitripsina pueden desarrollar la enfermedad en edades tempranas, pero únicamente representan el 1% de todas las EPOC.
Se sospecha que aproximadamente un 10% de los pacientes con EPOC padece asma de forma concomitante.
Como observamos, las prevalencias de ambas enfermedades no son nada despreciables y son uno de los primeros motivos de consulta, tanto en atención primaria como en neumología.
Factores de riesgo y etiología
Tanto en el asma como en la EPOC se conocen, aunque no en su totalidad, los factores de riesgo y los desencadenantes, pero en ninguna de las dos enfermedades se ha establecido su etiología, excepto en un pequeño grupo de pacientes con EPOC.
El hábito tabáquico es el factor de riesgo más importante para la EPOC7,8, pero no todos los fumadores desarrollan la enfermedad10,11. El hábito tabáquico es «necesario pero no suficiente» para causar EPOC («susceptibilidad»). Los factores adicionales son todavía desconocidos, aunque seguramente la genética, la raza, la polución atmosférica, la dieta, el sexo, la hiperreactividad bronquial, etc., tienen un papel importante al respecto.
A diferencia de la EPOC, cuya prevalencia va ligada a la del tabaquismo, el asma es una enfermedad que en los últimos años va en aumento, sobre todo en los países industrializados. Por ello, tiene que estar relacionada no tan sólo con la carga genética, sino con factores externos, que a su vez pueden dar lugar a cambios genéticos. El asma, a diferencia de la EPOC (excepto en los déficit de α-antitripsina), es predominantemente familiar, como la atopia, que representa el factor de riesgo más importante para el asma. Se ha demostrado que la predisposición a tener atopia y/o asma es poligenética12.
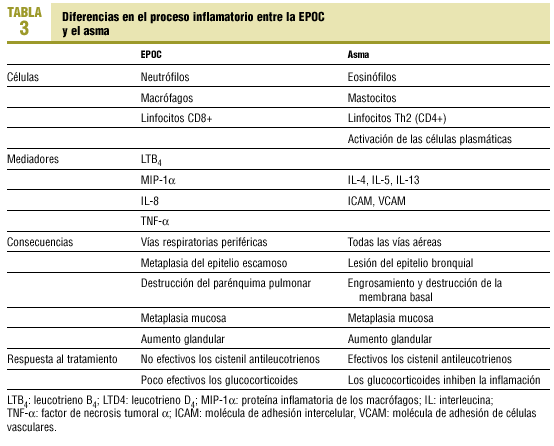
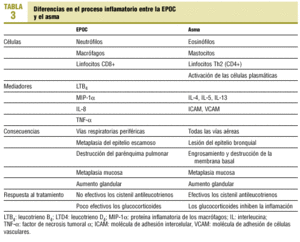
Diferencias entre la inflamación de la EPOC y el asma
El proceso de la inflamación es una característica constante en la fisiopatología del asma y la EPOC, pero la respuesta inflamatoria de la EPOC es claramente diferente de la del asma.
La inflamación en el asma se caracteriza por ser eosinofílica, dirigida por los linfocitos Th2; los mastocitos intervienen en una primera fase y los eosinófilos actúan en una segunda fase13. La inflamación afecta a todas las vías aéreas y no compromete al parénquima pulmonar. La lesión característica producida por los eosinófilos es la descamación del epitelio de las vías aéreas.
Por el contrario, en la EPOC existe una inflamación predominantemente neutrofílica; hay un claro aumento de macrófagos activados en el parénquima pulmonar y los linfocitos predominantes son del tipo CD8+, y no CD4+ como en el asma14.
En la EPOC las vías aéreas periféricas están afectadas y en éstas se desarrolla una fibrosis persistente. Tampoco existe una descamación epitelial, pero la destrucción del parénquima es característica, y es la que determina, por la compresión dinámica, la obstrucción al flujo aéreo.
Mediadores inflamatorios
Los mediadores inflamatorios que intervienen en ambas enfermedades difieren ostensiblemente (tabla 3).
En el asma las citocinas predominantes son las interleucinas IL-4 e IL-5, que son esenciales para la síntesis de las IgE y la activación del eosinófilo y el mastocito15, mientras que en la EPOC es la IL-8, que es selectiva para la quimiotaxis de los neutrófilos y es secretada por los macrófagos y neutrófilos, principalmente. La IL-8 puede desempeñar un papel primario importante en la EPOC y nos puede servir como marcador de gravedad de la inflamación de la vía aérea16.
En el asma intervienen los cistenil leucotrienos (LTC4, LTD4 y LTE4) y en la EPOC el leucotrieno LTB4. Por ello, los antagonistas de los cistenil leucotrienos (montelukast y zafirlukast) no sirven para el tratamiento de la EPOC. El LTB4 es un potente quimiotáctico de los neutrófilos y se han encontrado valores elevados en el esputo de los EPOC, probablemente procedentes de los macrófagos alveolares17.
Se han descubierto varios receptores para los LTB4, y ésta es una línea de investigación para sintetizar fármacos que bloqueen estos receptores impidiendo la acción de los LTB4.
El estrés oxidativo o actividad oxidativa es una característica tanto del asma como de la EPOC, aunque es más importante en esta última. La actividad oxidativa en la EPOC es más notable que la antioxidativa, por lo que existe un aumento del hidrógeno peróxido y del ácido nítrico, entre otras sustancias, contribuyendo al aumento de la secreción de moco, la extravasación del plasma, la broncoconstricción, etc. Todo ello interviene en la obstrucción bronquial y la destrucción del parénquima pulmonar18.
En el asma una de las enzimas predominantes es la triptasa del mastocito, relacionada con la hiperreactividad bronquial y con la remodelación de la vía aérea. También las enzimas proteínicas del eosinófilo (MBP, ECP, EPO, EPX, etc.) pueden dañar a los antígenos, pero a su vez a las células del epitelio bronquial.
En la EPOC son diversas las proteasas que intervienen en la destrucción de la elastina y el tejido conjuntivo del parénquima pulmonar. La elastasa secretada por el neutrófilo y el macrófago es de las más importantes, pero no lo son menos, por su grado de destrucción del pulmón, las catepsinas y las metaloproteasas19. Las proteasas son contrarrestadas por las antiproteasas como la α1-antitripsina.
En los fumadores susceptibles de contraer una EPOC, la producción de antiproteasas puede ser inadecuada para neutralizar los efectos de las múltiples proteasas, quizá porque el polimorfismo genético hace disminuir la función o producción de estas proteínas. Por el contrario, estas enzimas desempeñan un papel secundario en el asma.
La respuesta al tratamiento es diferente entre el asma y la EPOC. La inflamación que caracteriza el asma es suprimida notablemente por los corticoides, que inhiben casi todas las fases o aspectos de la inflamación. Sin embargo, los corticoides tienen un papel limitado en el tratamiento de la EPOC. No actúan sobre la inflamación neutrofílica, ni reducen los mediadores inflamatorios ni las proteasas.
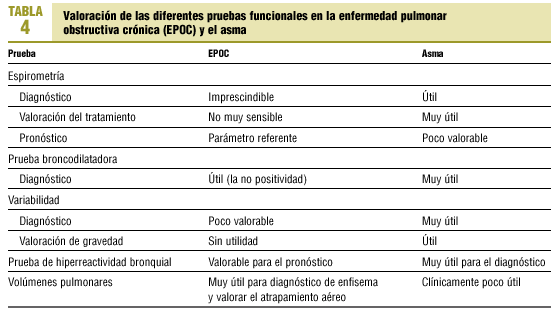
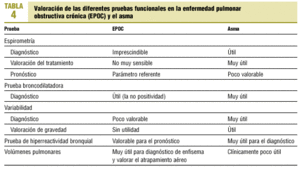
Estudio de la función pulmonar del asma y la EPOC
Las pruebas del estudio de la función pulmonar son esenciales para el diagnóstico, el control, la valoración e incluso el pronóstico del asma y la EPOC. Pero la importancia de cada una de estas pruebas no es igual para estas enfermedades (tabla 4). La espirometría forzada constituye la prueba funcional imprescindible para el diagnóstico de la EPOC; de hecho, su definición viene dada por la disminución del FEV1 y de la relación FEV1/CVF. Asimismo, la gravedad y el pronóstico de la EPOC se objetivan, principalmente, por la evolución y el valor del FEV1.
En el asma los parámetros de la espirometría forzada pueden ser normales aunque, al igual que los pacientes con EPOC, es obstructiva. En los asmáticos la reversibilidad de la obstrucción bronquial con broncodilatadores o con tratamiento antiinflamatorio es completa o casi completa, no siendo así en la EPOC. La espirometría también nos ayuda a valorar la respuesta al tratamiento en ambas enfermedades, aunque en el asma la información de los valores es más útil. Aunque la hiperreactividad bronquial está presente en la EPOC y su presencia es de mal pronóstico, en el asma nos sirve junto con la clínica para el diagnóstico, sobre todo cuando la espirometría, la prueba broncodilatadora y el estudio de la variabilidad son negativos. Una característica del asma es la amplia variabilidad en la resistencia de las vías aéreas, incluso
en un solo día, que puede ser objetivada por la medida seriada del flujo espiratorio máximo (FEM). Una variabilidad positiva es de diagnóstico de asma, pero en la EPOC su estudio no es de utilidad.
Nuevas estrategias en el tratamiento del asma y la EPOC
Asma
El tratamiento actual del asma se basa en las medidas de evitación (generales y específicas) y en la utilización de dos grupos de fármacos: los broncodilatadores (de acción corta como rescate y de acción larga como tratamiento de fondo) y los antiinflamatorios (corticoides y antileucotrienos). Aunque la gran mayoría de los pacientes responde bien al tratamiento, éste no deja de ser paliativo y no curativo.
Como hemos observado anteriormente, los cistenil leucotrienos (CysLT) desempeñan un papel importante en el asma; por tanto, sus antagonistas también, sobre todo para el tratamiento del asma persistente, la desencadenada por el esfuerzo y en la intolerancia al ácido acetilsalicílico. Pero los CysLT no intervienen en el proceso inflamatorio de la EPOC, por lo que los antileucotrienos no son eficaces en esta enfermedad. En España se han comercializado dos cistenil antileucotrienos: el montelukast y zafirlukast. Ambos son igual de eficaces, aunque el primero tiene mejores propiedades farmacocinéticas.
Para el tratamiento del asma y de la EPOC se están investigando nuevos fármacos que mejoren la farmacocinética de los actuales, como los nuevos corticoides inhalados, que se metabolizan en la mucosa respiratoria, sin que sean absorbidos y pasen a la sangre.
También se están estudiando fármacos más específicos en el asma, como los anticuerpos que bloquean la acción de las IgE o los inhibidores de las citocinas IL-420.
EPOC
En la EPOC los broncodilatadores han demostrado un pequeño aumento del FEV1 sobre el valor basal (cerca del 10%), y pueden mejorar los síntomas mediante la reducción de la hiperinsuflación, la tolerancia al esfuerzo y la calidad de vida. En especial el bromuro de ipratropio es el fármaco de primera línea en el tratamiento de la EPOC, ya que ejerce su acción en toda la vía bronquial, tiene los mismos efectos que los ß2-adrenérgicos, pero con menos riesgo de disminuir la pO2 y prácticamente sin efectos secundarios.
Por el contrario, en la EPOC los corticoides no suprimen la inflamación, ni siquiera a dosis elevadas21,22, posiblemente debido a que prolongan la vida del neutrófilo y no mejora la inflamación con participación de este tipo celular23. Únicamente un 10% de los enfermos con una EPOC estable mejoran con la administración de corticoides orales, y probablemente sean pacientes que tienen a la vez asma. Los corticoides inhalados pueden reducir la gravedad de las exacerbaciones en la EPOC24, pero no está tan claro el beneficio que reporta su utilización durante años. Esta discrepancia en la respuesta al tratamiento con corticoides en la EPOC puede que se deba a las diferencias en la respuesta inflamatoria entre la enfermedad de base y la exacerbación. Esta última cursa con un mayor número de eosinófilos25, IL-6 e IL-8.
Otro fármaco de interés en el tratamiento de la EPOC es el tiotropio. Es un nuevo fármaco anticolinérgico, 10 veces más potente que el bromuro de ipratropio, que tiene afinidad para los 3 receptores colinérgicos (M1, M2 y M3). Es de acción prolongada por tener una disociación lenta de los receptores muscarínicos M1 y M3, de forma que una inhalación al día es suficiente para el control de la enfermedad. El tiotropio hace disminuir los síntomas porque mejora la mecánica pulmonar y el intercambio de gases, también disminuye las agudizaciones y mejora la tolerancia al ejercicio de los pacientes con EPOC. Además, presenta un elevado margen de seguridad cuando es administrado por vía inhalada.
Se han publicado estudios referentes al tratamiento de la EPOC con antagonistas del leucotrieno B4, anti-IL-8, inhibidores de la elastasa neutrofílica, inhibidores de la fosfodiesterasa o inhibidores de las moléculas de adhesión, entre otros26.
En la actualidad, a excepción de los antileucotrienos, los fármacos disponibles para el tratamiento del asma y la EPOC son los mismos, pero a medida que vayan aumentando nuestros conocimientos sobre los diferentes procesos inflamatorios, los nuevos fármacos serán más específicos para cada enfermedad, e incluso nos plantearemos pautas de tratamientos «personalizadas» según las características clínicas del paciente.
Correspondencia: Karlos Naberan Toña. EAP del Clot. ICS de Barcelona Ciutat. C/ Biscaia 305, bajos. 08027 Barcelona. España. Correo electrónico: 13480knt@comb.es