En este artículo se presentan algunos conceptos acerca del sobrediagnóstico y sus consecuencias: sobretratamiento y medicalización de la sociedad. Se recuerda el origen del término a partir del cribado y diagnóstico del cáncer y se revisan las estrategias para «sobrediagnosticar», como la modificación de los umbrales diagnósticos de las enfermedades y la conversión de procesos vitales normales, así como los factores de riesgo, en enfermedad. Se exponen algunas estrategias para afrontar el sobrediagnóstico «desde la consulta», como son el manejo de la incertidumbre y la toma compartida de decisiones a través de la correcta interpretación de los estimadores de resultado de diagnóstico y de tratamiento. Finalmente, se presenta la medicina mínimamente disruptiva como la mejor estrategia para afrontar la carga de enfermedad a la que conduce el sobretratamiento en los pacientes con multimorbilidad.
This paper presents some concepts about overdiagnosis and its consequences: overtreatment and the medicalization of the society. It recalls the origin of the term, that comes from the screening and diagnosis of cancer, and it reviews the strategies to overdiagnose. Furthermore, it analyses the conversion of illnesses diagnostic thresholds as well as the transformation of normal and vital processes and risk factors in illnesses. It shows some strategies to confront overdiagnosis at the time of medical consultation, including the management of uncertainty and the shared decision making through the right interpretation of the diagnosis results and treatment estimators. Finally, it shows the minimally disruptive medicine as the best strategy to face the disease burden induced by the overtreatment in patients suffering from multimorbidity.
En este capítulo abordaremos algunos conceptos acerca del sobrediagnóstico, del sobretratamiento y de la medicalización a la que nos conducen. Como otros capítulos de la monografía, también se incluyen menciones a las causas y soluciones de este fenómeno, y hemos completado estos aspectos insistiendo en las soluciones desde la consulta.
El término «sobrediagnóstico» se remonta a los años setenta, pero sus definiciones explícitas se inspiran en las definiciones del término pseudodisease. Aun cuando hay una confusión semántica y en la literatura se utilizan múltiples términos para describir el fenómeno del sobrediagnóstico, así como diversos significados del término1, el origen del desarrollo del concepto está en la prevención del cáncer.
Welch y Black definen el sobrediagnóstico como el diagnóstico de una persona sin síntomas de una enfermedad que, en última instancia, nunca causará síntomas o la muerte durante la vida de la persona2. No debemos confundir el sobrediagnóstico con los falsos resultados positivos, es decir, una prueba positiva en un individuo que posteriormente se reconoce que no tiene la enfermedad o el cáncer.
El dilema consiste en distinguir si ante un nuevo diagnóstico de un cáncer, sobre todo por un programa de cribado, estamos ante un caso de sobrediagnóstico o ante uno clínicamente significativo. Precisamente, porque es imposible distinguir en el momento del diagnóstico entre un cáncer sobrediagnosticado y uno que será clínicamente significativo, la medición del sobrediagnóstico no es directa. La forma de saberlo es mediante la consulta o realización, fundamentalmente, de estudios ecológicos o de cohortes de calidad llevados a cabo por investigadores imparciales en diversos lugares del mundo3.
La sospecha de una elevada prevalencia de sobrediagnóstico en el cáncer viene avalada por el aumento de su incidencia, entre 1975-2010, con tasas de mortalidad estables1,4,5.
Para 5 tipos de cáncer, las tendencias muestran tasas crecientes de nuevos diagnósticos, pero no de muertes2.
Es especialmente llamativo el caso del cáncer de tiroides, cuya incidencia se ha doblado o triplicado en los últimos 20 años en los países desarrollados. En Corea del Sur, donde existe un programa poblacional de detección precoz, su incidencia se ha multiplicado por 15, sin haber conseguido ninguna reducción en la mortalidad específica. Pero ello ha producido, solo en el 2011, 30.000 tiroidectomías con necesidad de recibir tratamiento hormonal sustitutivo toda su vida, 3.000 casos de hipoparatiroidismo y 600 personas con alteración del habla por la afectación de los nervios recurrentes en las maniobras quirúrgicas6.
Todo ello lleva a pensar en la existencia de cánceres con diferentes patrones de comportamiento y repercusión pronóstica2. Los casos de cáncer «no progresivos» son de evolución muy lenta, de forma que los pacientes fallecen por otras causas. Las pruebas de detección cada vez más sofisticadas los identificarían sin distinción del resto de cánceres que pueden tener un desarrollo rápido y alta letalidad5.
Pero este fenómeno también se extiende a enfermedades no oncológicas como el tromboembolismo pulmonar (TEP) tras la introducción del angio-TC (angiografía pulmonar por tomografía computarizada)7 o el diagnóstico del infarto agudo de miocardio (IAM) tras la introducción de las troponinas ultrasensibles8.
Podríamos afirmar que, en realidad, el sobrediagnóstico no es un problema de diagnóstico sino de pronóstico9.
Algunos autores han profundizado en la definición de sobrediagnóstico aportando nuevos matices y ampliándola. Definen el sobrediagnóstico, medical overuse, como «la provisión de servicios clínicos cuando los riesgos de causar efectos indeseables exceden los de sus beneficios, cuando las mejoras que se pueden aportar son inapreciables o cuando se cree que los pacientes rechazarían la actuación si estuvieran bien informados»10.
En este sentido existe sobrediagnóstico no solo en los casos descritos. También cuando añadimos diagnósticos a pacientes con un pronóstico de vida limitado y sobre todo cuando aplicamos el enfoque sanitario redefiniendo como enfermedad cualquier malestar cotidiano sin que ello aporte necesariamente ningún beneficio, fenómeno conocido como medicalización.
Hemos visto como se redefinen múltiples procesos naturales desde la perspectiva de la enfermedad (sobrediagnóstico) y la actividad sanitaria se convierte en el eje central de la gestión de estos procesos (sobretratamiento), lo que margina abordajes alternativos basados en la autonomía de la persona.
Moynihan et al.11 han resumido las diferentes estrategias para la redefinición de enfermedades en:
- •
Convertir en problema médico los acontecimientos naturales de la vida (el embarazo, la menopausia, la muerte, etc.). El BMJ realizó una encuesta entre sus lectores acerca de motivos de consulta tipificables como «no enfermedad». El top de las 20 incluía, entre otros, motivos como el aburrimiento, la calvicie, las orejas de soplillo o la infelicidad12.
- •
Convertir en problema médico los problemas personales o los sociales (la timidez pasa a ser fobia social).
- •
Dar importancia excesiva a los síntomas: tanto al sobredimensionar los síntomas (disfunción eréctil, disfunción sexual femenina, andropausia) como al exagerar la gravedad de síntomas leves (colon irritable).
- •
Expandir los límites de la enfermedad: disminuyendo los valores de la «normalidad» para variables como la presión arterial, la glucemia o los lípidos se crean millones de «enfermos» candidatos a recibir estatinas o antihipertensivos.
- •
Convertir el factor de riesgo en enfermedad.
Entre las estrategias descritas cobra especial relevancia el hecho de transformar el factor de riesgo en enfermedad y el sobredimensionamiento de las actividades preventivas. La probabilidad matemática de tener en un futuro una enfermedad ha llevado a desarrollar actividades preventivas dirigidas a las personas sanas bajo el axioma «Más vale prevenir que lamentar».
Dentro de la prevención, adquieren especial relevancia las actividades dirigidas a la prevención del cáncer. Prevenir el cáncer es una idea muy seductora y cuenta con una gran aprobación por parte de la población.
Welch y Black advierten de los peligros de los programas de cribado2. Por una parte, el peligro de la prueba de cribado misma (el peligro de radiación de las mamografías), los falsos negativos (dando una sensación errónea de tranquilidad), los falsos positivos (generando ansiedad y una cascada diagnóstica) y, por último y más grave, el sobrediagnóstico.
Las consecuencias del sobrediagnósticoEl sobrediagnóstico es un reto para la sostenibilidad de los sistemas de salud y para la preservación de la salud. Se habla del mayor problema que acontece a la medicina moderna provocando daño innecesario y sufrimiento, así como significativos costes1.
Además, se autoalimenta a través de lo que se denomina retroalimentación engañosa: el sobrediagnóstico mejora mucho el pronóstico de los pacientes sobrediagnosticados ya que nunca estuvieron en riesgo de presentar complicaciones.
De esta manera, ampliando las definiciones de enfermedad y reduciendo los umbrales para las intervenciones preventivas, se crea la ilusión de la mejora de la salud de la población, cuando en realidad no hay diferencia alguna en los resultados para los individuos afectados13. La expansión de los límites de la enfermedad hace que cada vez más personas, consideradas sanas con anterioridad, se incluyan dentro de la definición de, por ejemplo, la hipertensión, la diabetes o el cáncer de mama. Así se produce la falsa impresión de que los resultados mejoran las tasas de accidentes cerebrovasculares, la amputación de pies diabéticos o la mortalidad por cáncer de mama.
Según un informe de 2013 del Instituto de Medicina, en EE.UU. se atribuyeron 210.000 millones de dólares del gasto sanitario a la actividad innecesaria, convirtiéndola en el mayor contribuyente al desperdicio14. El sobrediagnóstico de los sanos y el tratamiento insuficiente de los enfermos son dos caras de la misma moneda de la medicina moderna. El miedo a que no detectemos precozmente al enfermo supone en la práctica desviar recursos del cuidado de los enfermos hacia los sanos15.
Por otra parte, explica gran parte del potencial yatrógeno de la actividad sanitaria que, según un reciente estudio publicado en el BMJ, la sitúa como la tercera causa de mortalidad en EE.UU. después de las enfermedades cardíacas y el cáncer16.
Un caso especial de sobrediagnóstico y consecuentemente de sobretratamiento se presenta en los pacientes con multimorbilidad. La atención descoordinada a partir de la aplicación indiscriminada de múltiples guías de práctica clínica (GPC) individuales a estos pacientes puede llevar a la polimedicación17 y a exponerles a una «carga de trabajo» inasumible para el paciente y su entorno18.
Soluciones dirigidas a profesionales: afrontando el sobrediagnóstico desde la consultaEl fenómeno del sobrediagnóstico es un fenómeno complejo y multifactorial. Su explicación viene dada por una combinación tóxica de buenas intenciones, pensamiento ilusorio e intereses creados15.
Jamoulle19 plantea la «prevención cuaternaria» como el conjunto de medidas destinadas a evitar o atenuar las consecuencias de la actividad sanitaria excesiva e innecesaria.
Nos detendremos fundamentalmente en las que competen a los profesionales, aunque algunas son comunes a los sistemas sanitarios, ahondando en propuestas como son la formación de los profesionales y la toma de decisiones compartidas, que ya han sido comentadas en los capítulos de este monográfico desarrollados por Novoa y por Coll. Desarrollaremos también algunas propuestas específicas para afrontar el sobretratamiento en los pacientes con comorbilidad.
La práctica clínica en atención primaria (AP) se caracteriza por la necesidad de hacer frente a la incertidumbre. Nuestras decisiones diagnósticas pocas veces están avaladas por certezas absolutas, sino por probabilidades razonables de que lo que pensamos es cierto. Una forma de combatir el sobrediagnóstico pasa por el manejo y la tolerancia a la incertidumbre20.
El anumerismo nos vuelve más manipulables y esto cobra especial relevancia en la toma de decisiones clínicas. Los profesionales deben interpretar adecuadamente los estimadores de resultados en el campo del diagnóstico y el tratamiento para entender y saber presentar la información a los pacientes en la toma de decisiones compartida.
Estimadores de resultado (I): diagnósticoCuando valoramos el motivo de consulta de un paciente y sus características sociodemográficas le asignamos una probabilidad de padecer una enfermedad, denominada probabilidad preprueba. A falta de más datos, esta probabilidad corresponderá a la prevalencia de dicha enfermedad en la población origen. Por ejemplo, probabilidad de neumonía en un paciente previamente sano que consulta por fiebre y tos. Esta probabilidad puede modificarse a lo largo de la consulta tras realizar una anamnesis y exploración física iniciales. La probabilidad preprueba que estimemos puede variar en función de si el paciente refiere dolor pleurítico, disnea o presenta una auscultación pulmonar alterada.
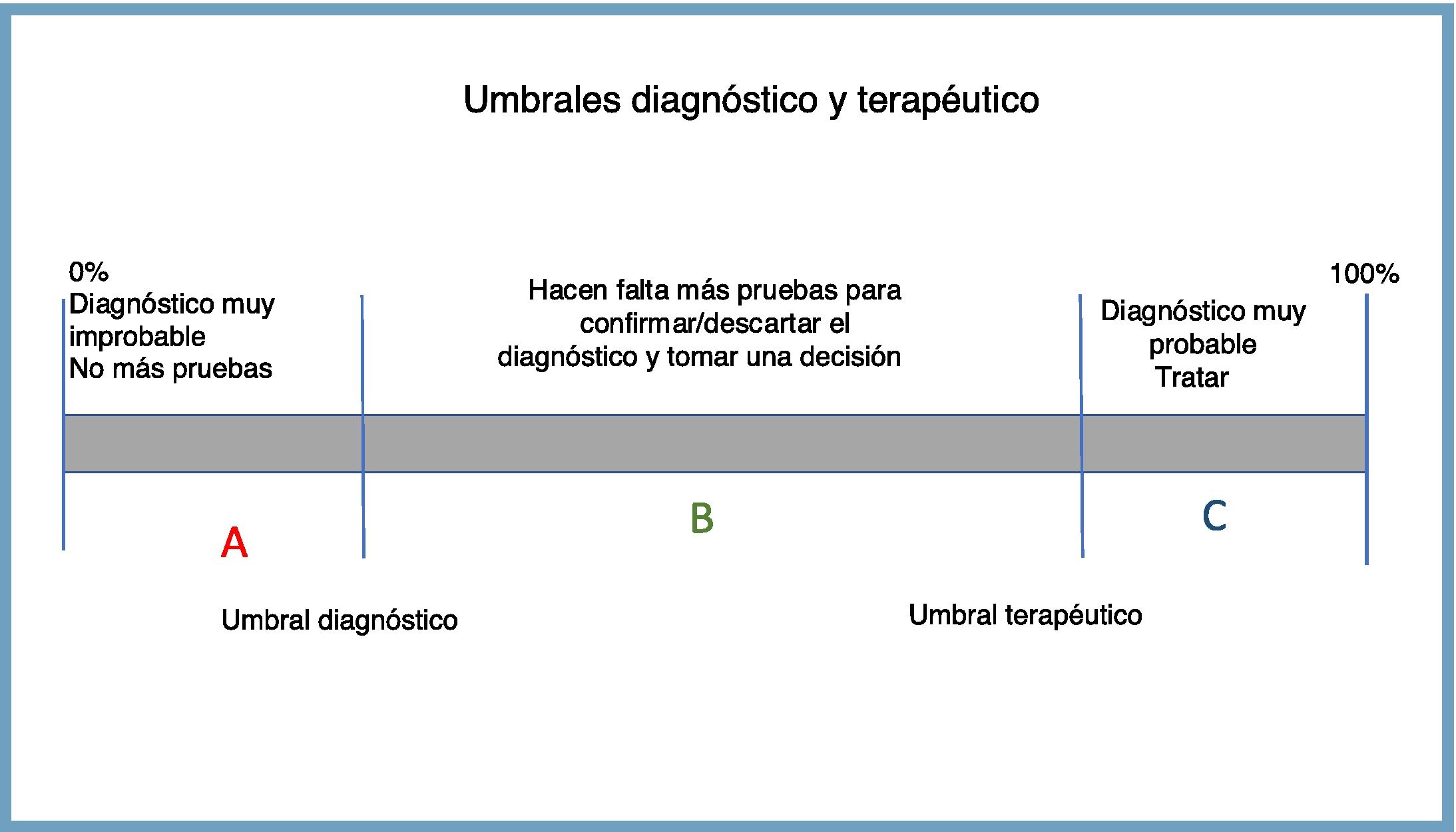
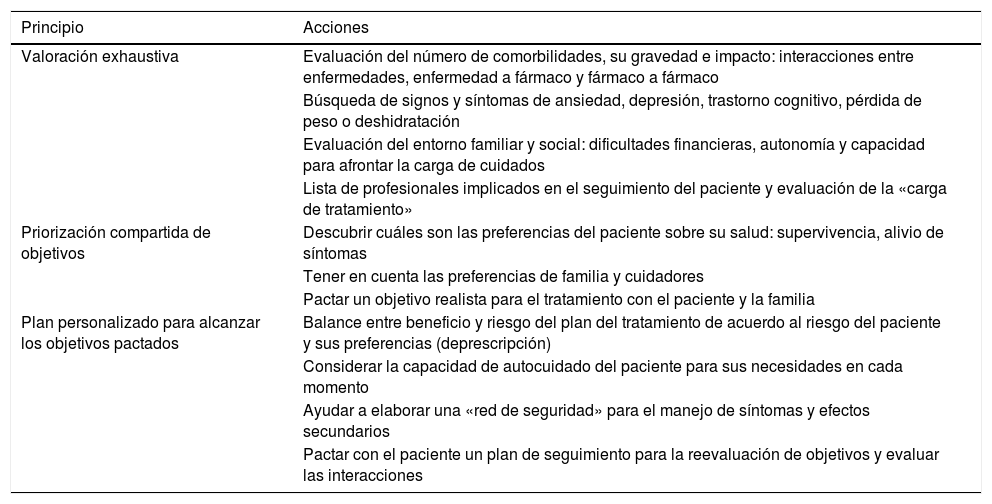
Continuamente nos movemos entre dos umbrales de probabilidad: el diagnóstico y el terapéutico. El umbral de diagnóstico es aquel valor de probabilidad por debajo del cual (zona A) podemos descartar la enfermedad de forma razonable, por lo que no tiene sentido realizar más pruebas. El umbral terapéutico es aquel valor por encima del cual (zona C) podemos confirmar razonablemente el diagnóstico e iniciar un tratamiento21 (fig. 1).
Nos podemos encontrar con que el paciente presente una probabilidad tan baja de enfermedad (A) que no justifique la realización de más pruebas (umbral diagnóstico) para el proceso que hemos sospechado en primer lugar. Y al revés, puede estar «tan claro» (C) que muchas veces no hace falta añadir más pruebas para comenzar algunos tratamientos (la probabilidad ya está por encima del umbral terapéutico). Lo habitual, sin embargo, es que nos encontremos en el punto intermedio (B) y necesitemos pruebas que nos ayuden a descartar o a confirmar nuestra sospecha diagnóstica. La aportación de la prueba diagnóstica es precisamente modificar la probabilidad preprueba para ayudarnos en la toma de decisiones.
Para seleccionar la prueba más idónea debemos familiarizarnos con las dos propiedades relacionadas con su validez, como son la sensibilidad (S) y la especificidad (E). La S y E pueden calcularse a partir de la tabla de 2×2 que compara los resultados de la prueba con el gold standard (tabla 1). Más importante que saber cómo calcularlas —para lo que existen herramientas muy sencillas de utilizar—, es ser capaz de interpretar su significado y cómo integrarlas en la toma de decisiones22.
Rendimiento diagnóstico de la auscultación de crepitantes ante la sospecha de neumonía para una prevalencia del 11,2%
| Neumonía confirmada | |||
|---|---|---|---|
| Crepitantes | Sí (Rx+) | No (Rx−) | Total |
| Presencia | 17 | 67 | 84 |
| a | b | ||
| Ausencia | 11 | 155 | 166 |
| c | d | ||
| Total | 28 | 222 | 250 |
Fuente: Sánchez Sánchez y Rotaeche del Campo23.
La S es la probabilidad de que la prueba clasifique correctamente a los enfermos o, dicho de otro modo, la probabilidad de que el enfermo dé positivo en la prueba.
S=total de enfermos con prueba positiva (VP)/total de enfermos (VP+FN)=a/a+c
S=Complementario de la probabilidad de FN.
La E es la probabilidad de que se clasifique correctamente a los sanos o, dicho de otro modo, de que los sanos obtengan un resultado negativo.
E=total de sanos con prueba negativa (VN)/total de sanos (VN+FP)=d/b+d
E=Complementario de la probabilidad de FP.
S y E son dos características intrínsecas de la prueba. Si lo que queremos es descartar una enfermedad, optaremos por seleccionar pruebas muy sensibles (donde la probabilidad de que sea FN es muy baja), y si lo que queremos es confirmarla, optaremos por pruebas muy específicas (donde la probabilidad de que sea un FP es muy baja).
Sin embargo, cuando aplicamos dicha prueba al paciente lo que en realidad necesitamos conocer es la nueva probabilidad, una vez obtenido un resultado positivo, de que el paciente esté enfermo y, en sentido contrario, una vez obtenido un resultado negativo, la nueva probabilidad de que esté sano. Es lo que conocemos como la probabilidad posprueba. De hecho, la verdadera utilidad de una prueba diagnóstica será que marque una buena distancia entre el antes y el después de su realización, tanto para confirmar el diagnóstico (si es positiva) como para descartarlo (si es negativa).
Estos conceptos vienen representados por los valores predictivos (VP) y pueden calcularse a partir de la tabla de 2×2 (tabla 1).
El valor predictivo positivo (VPP) es la probabilidad de que un paciente con un resultado positivo esté realmente enfermo, y se calcula dividiendo el número de enfermos con prueba positiva entre el número total de positivos.
VPP: Positivos enfermos (VP)/Total positivos en la prueba (VP+FP)=a/a+b
El valor predictivo negativo (VPN) es la probabilidad de que un paciente con un resultado negativo esté realmente sano, y es el cociente de sanos con resultado negativo entre el número total de negativos.
VPN: Negativos sanos (VN)/Total de negativos en la prueba (VN+FN)=d/c+d
Los valores predictivos, a diferencia de la S y E de la prueba, dependen de la prevalencia de la enfermedad que estamos sospechando. A medida que aumenta la prevalencia, aumenta el VPP y disminuye el VPN y viceversa.
Los cocientes de probabilidad (CP), también denominados razones de verosimilitud o likelihood ratios (LR, en la literatura anglosajona), son otra pareja de índices, menos conocidos que los anteriores, pero muy útiles para incorporar los resultados de las pruebas diagnósticas a la toma de decisiones.
El cociente de probabilidad positivo (CPP) nos indica cuánto más probable es obtener un resultado positivo en un enfermo (S) que en un sano (1−E) y se calcula como
CPP=S/(1−E).
Podemos calcular también el cociente de probabilidad negativo (CPN), que expresa cuánto más probable es obtener un resultado negativo en un enfermo (1−S) que en un sano (E).
CPN=1−S/E.
Se considera que los CP son el indicador más útil de la validez de una prueba diagnóstica ya que nos sirven para determinar la «potencia diagnóstica de la prueba». De hecho, un CP=1 indica que el resultado de la prueba no modifica la probabilidad de estar enfermo. En este caso el resultado del test sería igual en los enfermos que en los sanos, lo que lo equipara a tirar una moneda al aire. Si el CP es mayor que uno, aumenta esta probabilidad; y si el CP es menor, disminuye. Valores>10 (o bien<0,1) indican que se trata de una prueba muy potente que apoya (o contradice) fuertemente el diagnóstico; de 5-10 (o de 0,1-0,2) indican moderada potencia de la prueba para apoyar (o descartar) el diagnóstico; de 2-5 (o de 0,2-0,5) indican que la aportación de la prueba es escasa y, por último, de 1-2 (o de 0,5-1) indican que la prueba no tiene utilidad diagnóstica.
S=a/a+c 60,7%
E=d/b+d 69,8,%
VPP1=a/a+b 20,2%
VPN2=d/c+d 93,4%%
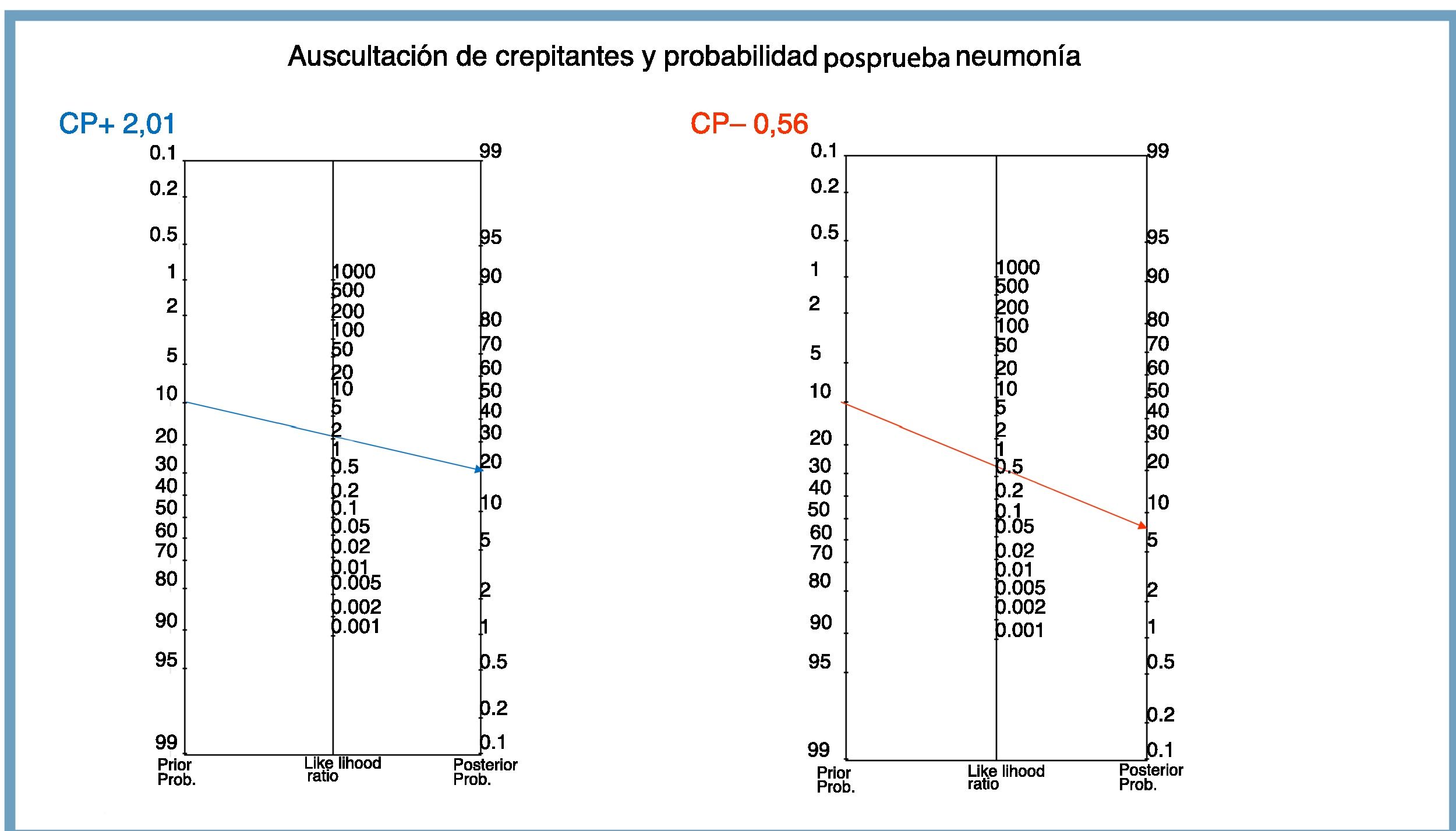
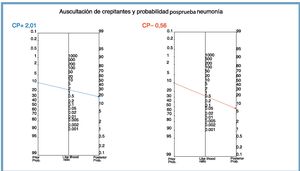
CPP=2,01 (si el resultado es positivo, la prueba modifica poco la nueva probabilidad. Su aportación es escasa).
CPN=0,56 (si la prueba es negativa, prácticamente no altera la probabilidad. No tiene apenas utilidad diagnóstica).
En cualquier caso, los CP no expresan una probabilidad directa.
Para calcular la nueva probabilidad podemos utilizar la regla del 15% (cada valor del CP modifica la probabilidad preprueba en porcentajes múltiplos del 15%) o a través del nomograma de Fagan.
Trazando una línea de intersección entre la probabilidad preprueba y el CP del resultado6 se obtiene la probabilidad posprueba de tener la enfermedad (fig. 2).
En la figura 2 se puede comprobar cómo la intersección de la línea para el CPP coincide con el cálculo del VPP (20,2%). El valor de la intersección del CPN nos permite calcular el VPN: 100−CPN (100−6,6=93,4%).
En la práctica resulta más sencillo usar una calculadora específica para obtener todos estos estimadores3.
Estimadores de resultado (II): tratamientoEn lo que respecta a la magnitud de las intervenciones, proponemos primar los valores absolutos frente a los relativos utilizando conceptos como el número de casos necesarios para tratar (NNT) y el número de casos necesario para dañar (NNH).
Es habitual que en los efectos de los nuevos fármacos se presenten en términos relativos, sobre todo la reducción del riesgo relativo (RRR). Esta cifra nos aporta muy poca información para tomar decisiones y magnifica los resultados. Sin embargo, los resultados presentados en términos absolutos aportan una idea más clara de la magnitud del resultado y nos permiten presentarlos a los pacientes en un proceso de toma de decisiones compartidas.
Supongamos que nos presentan los resultados de un ensayo clínico sobre un nuevo fármaco antihipertensivo. El estudio incluye a 1.000 pacientes (500 reciben el tratamiento habitual y 500 un nuevo antihipertensivo).
La publicidad del laboratorio patrocinador afirma que el nuevo fármaco reduce los eventos cardiovasculares en un 10% respecto al tratamiento habitual (grupo control) tras 5 años de tratamiento. En este caso se utiliza el RRR (tabla 2) como estimador de resultado del nuevo fármaco. Pero este valor no nos informa de la magnitud real del efecto, que depende del riesgo de la población representada por la tasa de eventos con el tratamiento habitual y de la diferencia en número de eventos absolutos en ambos grupos.
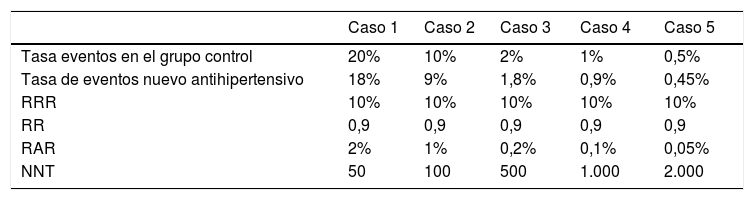
Estimadores de resultado de tratamiento en función de la tasa de eventos del grupo control
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | |
|---|---|---|---|---|---|
| Tasa eventos en el grupo control | 20% | 10% | 2% | 1% | 0,5% |
| Tasa de eventos nuevo antihipertensivo | 18% | 9% | 1,8% | 0,9% | 0,45% |
| RRR | 10% | 10% | 10% | 10% | 10% |
| RR | 0,9 | 0,9 | 0,9 | 0,9 | 0,9 |
| RAR | 2% | 1% | 0,2% | 0,1% | 0,05% |
| NNT | 50 | 100 | 500 | 1.000 | 2.000 |
En la tabla 2 presentamos los efectos del tratamiento dependiendo de poblaciones con un gradiente decreciente de padecer eventos cardiovasculares.
En el caso 1 (alto riesgo) necesitaremos tratar a 50 pacientes durante 5 años para evitar un evento cardiovascular, mientras que en el caso 5 (riesgo más bajo) sería necesario tratar a 2.000. En ambos casos el riesgo relativo (RR) es el mismo 0,9 y el RRR es igualmente del 10%.
En la tabla 3 se ilustran los conceptos de estimadores de resultado y su cálculo a partir del caso 3 del ejemplo.
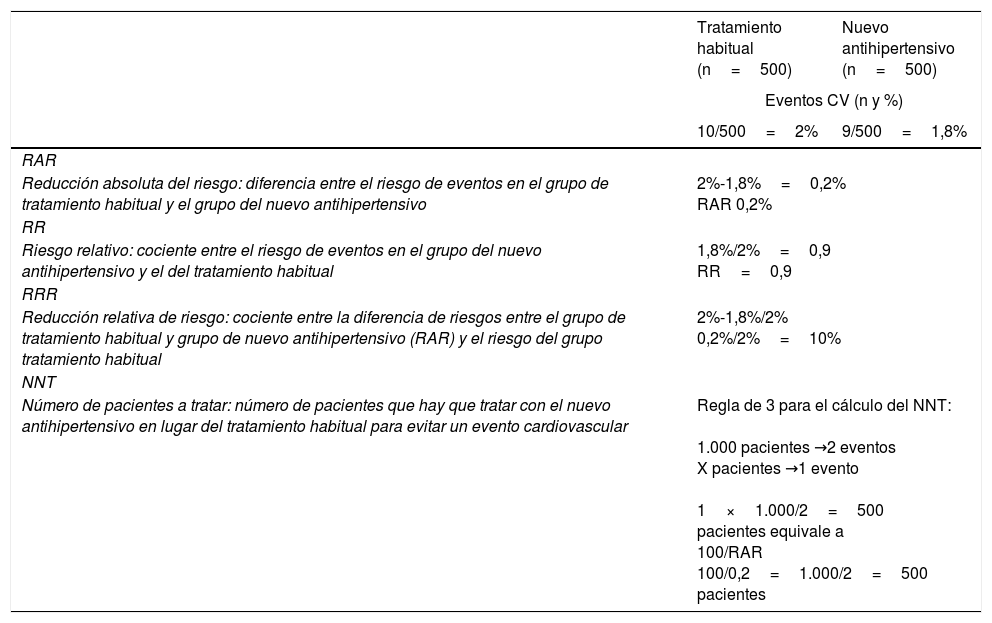
Cálculo de estimadores de resultado de un tratamiento
| Tratamiento habitual (n=500) | Nuevo antihipertensivo (n=500) | |
|---|---|---|
| Eventos CV (n y %) | ||
| 10/500=2% | 9/500=1,8% | |
| RAR | ||
| Reducción absoluta del riesgo: diferencia entre el riesgo de eventos en el grupo de tratamiento habitual y el grupo del nuevo antihipertensivo | 2%-1,8%=0,2% RAR 0,2% | |
| RR | ||
| Riesgo relativo: cociente entre el riesgo de eventos en el grupo del nuevo antihipertensivo y el del tratamiento habitual | 1,8%/2%=0,9 RR=0,9 | |
| RRR | ||
| Reducción relativa de riesgo: cociente entre la diferencia de riesgos entre el grupo de tratamiento habitual y grupo de nuevo antihipertensivo (RAR) y el riesgo del grupo tratamiento habitual | 2%-1,8%/2% 0,2%/2%=10% | |
| NNT | ||
| Número de pacientes a tratar: número de pacientes que hay que tratar con el nuevo antihipertensivo en lugar del tratamiento habitual para evitar un evento cardiovascular | Regla de 3 para el cálculo del NNT: 1.000 pacientes →2 eventos X pacientes →1 evento 1×1.000/2=500 pacientes equivale a 100/RAR 100/0,2=1.000/2=500 pacientes | |
En caso de que en el grupo de nuevo antihipertensivo se produjera aumento en lugar de reducción de eventos, hablaríamos de NNH. Este mismo concepto lo utilizaremos cuando estudiemos los efectos desfavorables de una intervención como, por ejemplo, toxicidad o efectos secundarios de un fármaco.
Los posibles efectos favorables de una intervención deben ser contrastados con sus efectos perjudiciales. Para ello deberemos tener en cuenta tanto la importancia-gravedad de los efectos como su magnitud (NNT vs. NNH).
Medidas que competen a los sistemas de salud y profesionalesAplicar el enfoque de la medicina mínimamente disruptivaLos sistemas sanitarios se encuentran ocupados en dar respuesta al reto que supone la correcta atención al creciente número de pacientes cada vez más mayores y con múltiples enfermedades. Es habitual que estos pacientes sean atendidos por múltiples especialistas, presenten frecuentes ingresos hospitalarios y tiendan a acumular intervenciones que, si bien son apropiadas para cada una de las condiciones que los aqueja, en conjunto representan una carga pesada para el paciente crónico y su familia, lo cual se traduce en polimedicación, cambios en el estilo de vida, implicación en la gestión de su enfermedad, necesidad de acudir a múltiples controles, etc.
Pocas veces se hace una valoración de si el paciente dispone de suficiente apoyo familiar o si él mismo está capacitado para entender y realizar todo lo que el sistema le pide. Si la carga de cuidados que el sistema deposita sobre el paciente y su familia desborda su capacidad para afrontarla, estamos también ante un caso de sobretratamiento. La carga de la enfermedad se suma de manera acumulativa a la carga de tratamiento excediendo la capacidad finita para entender, organizar, ejecutar y evaluar el trabajo de ser paciente. Las consecuencias inmediatas son conocidas: incumplimiento farmacológico, reagudizaciones y reingresos, sobrecarga del cuidador, aumento de la incidencia de problemas de salud mental, etc. Estas consecuencias, además, afectan más a los pacientes con menor nivel socioeconómico.
Desde hace años, algunos autores proponen hacer frente a este fenómeno mediante la práctica de la medicina mínimamente disruptiva (minimally disruptive medicine, MMI)18.
La MMI constituye un modelo teórico útil para el trabajo clínico y social con los pacientes complejos, basado en el abordaje biopsicosocial de la persona enferma y superando el antiguo (pero aún vigente) modelo de visión organicista de las enfermedades. Básicamente la MMI consiste en ajustar los planes de tratamiento a la realidad cotidiana de los pacientes y su entorno.
Esto supone la evaluación integral de cada persona enferma y la elaboración de planes individualizados de cuidados y terapéuticos ajustados a sus capacidades y realidades. Para practicarla los sistemas sanitarios y profesionales deberían:
- •
Establecer el «peso de la carga» del tratamiento: evaluada de acuerdo a la capacidad individual de cada paciente y su familia con el fin de identificar a aquellos pacientes más vulnerables. La evaluación debería ser lo más objetiva y fiable. Recientemente se han desarrollado al menos dos herramientas generales autoinformadas de medida de la carga de tratamiento para pacientes con cualquier condición crónica: la medida de experiencia del paciente con tratamiento y autocontrol (PETS) y el cuestionario de carga de tratamiento (TBQ), pero todavía no han sido validadas y además presentan problemas de aplicabilidad en sistemas sanitarios de cobertura pública y universal24. Ambas herramientas tienen en cuenta el esfuerzo del paciente para seguir los tratamientos farmacológicos: número de medicamentos, posología, interacción de la toma de fármacos con actividades de la vida cotidiana (comidas, conducir, precauciones de la forma de administración, etc.), frecuencia de las consultas y su gestión, carga administrativa y económica, dificultad en el seguimiento en modificaciones del estilo de vida (dieta, ejercicio), impacto de su enfermedad en las relaciones sociales, etc.
- •
Promover una práctica clínica coordinada: una apuesta decidida por potenciar el liderazgo de la AP parece la mejor estrategia para conseguirlo25.
- •
Aplicar la metodología de la medicina basada en la evidencia (MBE) a la comorbilidad: es preciso buscar y generar evidencias para dar respuestas a los retos que plantea la atención a la comorbilidad. Los pacientes mayores con multimorbilidad se excluyen sistemáticamente de los ensayos clínicos26. De esta forma es difícil que estos pacientes estén representados en las GPC que se usan para atenderles. Como se ha comentado previamente, la aplicación de las GPC individuales aplicadas de forma irreflexiva, sobre todo por diferentes especialistas, es una forma de aumentar la carga de la enfermedad. Son escasas las GPC diseñadas sobre la comorbilidad, aunque ya existen las bases metodológicas para elaborarlas27. La aplicación de la MBE también debería exigirse a los diferentes planes y estrategias institucionales que han proliferado en nuestro medio para hacer frente al fenómeno de la multimorbilidad. En este sentido, la consulta de herramientas como el AGREE-HS (Health Systems) debería ser obligada para nuestros responsables sanitarios28. Este instrumento está diseñado de forma específica para evaluar aquellas iniciativas institucionales destinadas a hacer frente a los nuevos desafíos sociosanitarios, como el de la correcta gestión y atención a la comorbilidad.
- •
Establecer prioridades en la gestión de la comorbilidad y sus implicaciones desde el punto de vista del paciente: en la práctica supone que el sistema sanitario respete y sea coherente con los principios de autonomía de los pacientes y de la toma de decisiones compartida. Esta se define como un proceso a través del cual los clínicos y los pacientes toman juntos las decisiones en el cuidado de la salud. Sin embargo, la forma en que el clínico proporciona información puede afectar fuertemente las preferencias de las personas, lo que provoca la necesidad de información estandarizada, como las ayudas a la decisión del paciente29, asegurando la transparencia en la información. Las personas expuestas a las ayudas a la decisión se sienten más informadas, tienen una percepción del riesgo más precisa y probablemente tienen un papel más activo en la toma de decisiones. No hay efectos adversos en los resultados de salud ni en la satisfacción29.
La AP se encuentra en una posición privilegiada para liderar la práctica de la MMI en nuestro medio por las características que la definen, como son el abordaje biopsicosocial, el método centrado en el paciente y la longitudinalidad, así como el perfil de sus profesionales y la incorporación de conocimientos y habilidades en comunicación a su formación.
La implementación de la MMI en AP se podría resumir en la aplicación de los principios de Ariadne en la práctica clínica diaria30. Muth et al. proponen incorporar estos principios a las consultas de AP de forma que los objetivos del plan individualizado de tratamiento se pacten entre profesional y paciente. Los principios de Ariadne y las acciones que conllevan deberían tenerse en cuenta y aplicarse en cada encuentro, tanto médico como de enfermería, con el paciente:
- •
Valoración exhaustiva de la comorbilidad en el contexto del paciente.
- •
Priorización compartida de objetivos.
- •
Plan personalizado para alcanzar los objetivos pactados.
En la tabla 4 aparece una explicación más detallada de los mismos.
Desarrollo de los principios de Ariadne
| Principio | Acciones |
|---|---|
| Valoración exhaustiva | Evaluación del número de comorbilidades, su gravedad e impacto: interacciones entre enfermedades, enfermedad a fármaco y fármaco a fármaco |
| Búsqueda de signos y síntomas de ansiedad, depresión, trastorno cognitivo, pérdida de peso o deshidratación | |
| Evaluación del entorno familiar y social: dificultades financieras, autonomía y capacidad para afrontar la carga de cuidados | |
| Lista de profesionales implicados en el seguimiento del paciente y evaluación de la «carga de tratamiento» | |
| Priorización compartida de objetivos | Descubrir cuáles son las preferencias del paciente sobre su salud: supervivencia, alivio de síntomas |
| Tener en cuenta las preferencias de familia y cuidadores | |
| Pactar un objetivo realista para el tratamiento con el paciente y la familia | |
| Plan personalizado para alcanzar los objetivos pactados | Balance entre beneficio y riesgo del plan del tratamiento de acuerdo al riesgo del paciente y sus preferencias (deprescripción) |
| Considerar la capacidad de autocuidado del paciente para sus necesidades en cada momento | |
| Ayudar a elaborar una «red de seguridad» para el manejo de síntomas y efectos secundarios | |
| Pactar con el paciente un plan de seguimiento para la reevaluación de objetivos y evaluar las interacciones |
La aplicación de estos principios puede suponer un cambio organizativo en muchos centros de salud de nuestro país. En la actualidad se está realizando un ensayo clínico con un diseño pragmático para evaluar la efectividad de esta estrategia en nuestro medio31.
- •
El sobrediagnóstico y la medicalización (sobretratamiento) consituyen un serio peligro para la salud de la población y ponen en riesgo la sostenibilidad de los sistemas de salud.
- •
La explicación de este complejo fenómeno viene dada por una combinación tóxica de buenas intenciones, pensamiento ilusorio (más es mejor) e intereses creados.
- •
La atención descoordinada y la aplicación irreflexiva de guías de práctica clínica individuales a los pacientes con multimorbilidad desborda su capacidad de afrontar la enfermedad y constituye una nueva forma de sobretratamiento.
- •
La tolerancia a la incertidumbre, la toma de decisiones compartida con una aplicación juiciosa de la MBE y la práctica de la medicina mínimamente impertinente son las herramientas que se proponen para afrontar el sobrediagnóstico desde la consulta.
Los tres autores declaran ausencia de conflictos de interés con relación al tema desarrollado en el artículo.
Cálculos realizados partir de los datos del artículo mediante la calculadora de CASP. Disponible en: http://www.redcaspe.org/herramientas/calculadoras
Cálculos realizados partir de los datos del artículo mediante la calculadora de CASP. Disponible en: http://www.redcaspe.org/herramientas/calculadoras