En la presente actualización se ha realizado una revisión del deterioro cognitivo, incidiendo en la evidencia sobre factores de riesgo, test diagnósticos e intervenciones preventivas.
Además, se han revisado los temas de ejercicio físico, déficits sensoriales, fragilidad, caídas y medicación. Como en años anteriores, las actividades preventivas comunes con el adulto se encuentran en los apartados correspondientes.
Deficiencias sensoriales en los mayoresAunque el envejecimiento fisiológico varía de una persona a otra debido a la predisposición genética, el medio ambiente y el estado de salud, los estudios de prevalencia demuestran que los deterioros sensoriales aumentan con la edad y parece claro que la mayoría de las personas mayores experimentarán un deterioro sensorial si viven lo suficiente1.
Entre todos los problemas oftalmológicos, los errores de refracción, las cataratas, la degeneración macular asociada a la edad (DMAE), la retinopatía diabética y el glaucoma crónico de ángulo abierto representan las afecciones más comunes y las principales causas de discapacidad visual en los ancianos. En un estudio realizado en nuestro país2, la prevalencia de deficiencia visual y de ceguera en mayores de 65 años, según los criterios de la OMS, alcanza al 6,3 y al 2,0%, respectivamente. Las alteraciones de la función visual repercuten gravemente en el estado funcional y ocasionan peor salud percibida, menor actividad social y mayor mortalidad3.
Aunque el abordaje precoz de los trastornos de refracción, las cataratas y la DMAE mejora o previene la pérdida de la agudeza visual, el U.S. Preventive Services Task Force (USPSTF) y la American Academy of Family Physicians concluyen que la evidencia actual es insuficiente para evaluar el balance de beneficios y riesgos del cribado de la deficiencia visual en las personas mayores de 65 años4. Una revisión Cochrane reciente concluye igualmente que los resultados de los ensayos realizados hasta la fecha no respaldan el cribado en las personas mayores que viven de forma independiente en la comunidad5.
En cuanto a la deficiencia auditiva, la causa más frecuente de hipoacusia en las personas mayores es la presbiacusia, que supone más del 90% de todas las hipoacusias6.
La deficiencia auditiva afecta al 25-40% de los mayores de 65 años y es > 80% en mayores de 85 años7. Se asocia con depresión, deterioro cognitivo, declive funcional, aislamiento social, pérdida de calidad de vida e incremento de la mortalidad.
El USPSTF también concluye que la evidencia actual es insuficiente para evaluar los riesgos y beneficios de llevar a cabo un cribado de deficiencia auditiva en personas asintomáticas a partir de los 50 años, lo que no es de aplicación en quienes perciben problemas de audición o sufren síntomas cognitivos o afectivos que pueden guardar relación con la pérdida de audición4.
- •
Aunque en las personas mayores la medición de la agudeza visual permite identificar adecuadamente los defectos de refracción, la evidencia es insuficiente para recomendar el cribado de la deficiencia visual en los mayores de 65 años
- •
La evidencia actual también es insuficiente para evaluar los riesgos y beneficios de un cribado de deficiencia auditiva en personas asintomáticas a partir de los 50 años
La actividad física se considera uno de los determinantes de salud con mayor influencia sobre la morbilidad. En las personas mayores, los beneficios del incremento de la actividad física incluyen mayor movilidad, flexibilidad o fuerza y mejor condición física, en general. La actividad física sostenida se asocia con un aumento de la longevidad y también con una mejor conservación de las funciones física y mental, conocida como envejecimiento saludable8. La actividad física, incluso de intensidad limitada y adaptada a las limitaciones funcionales, también es útil en mayores frágiles o con múltiples enfermedades9. Todas las personas mayores pueden beneficiarse de la actividad física. En presencia de enfermedades crónicas, alguna actividad física es mejor que ninguna y la participación en cualquier actividad física implica beneficios para la salud10. La American Heart Association y el American College of Sports Medicine proporcionan recomendaciones sobre ejercicio físico para mayores de 65 años3 (tabla 1).
Recomendaciones sobre actividad física en las personas mayores
| Tipo de actividad | Recomendación | Ejemplos |
|---|---|---|
| Ejercicio aeróbico | Se recomienda un mínimo de 30 min de actividad aeróbica de intensidad moderada 5 días a la semana, un mínimo de 20 min de actividad física intensa durante 3 días a la semana o alguna combinación de ambas | Caminar a paso ligero, correr, nadar, aeróbic acuático, tenis, golf, clases de ejercicios aeróbicos, bailar, montar en bicicleta y uso de aparatos como máquinas elípticas, máquinas de subir escaleras, bicicletas estáticas y cintas de correr |
| Fortalecimiento muscular | Debe realizarse un mínimo de 2 días no consecutivos a la semana y debe dirigirse a los grandes grupos musculares (abdomen, brazos, piernas, hombros y caderas). No hay un tiempo recomendado, pero deben realizarse de 10 a 15 repeticiones de cada ejercicio a un nivel moderado o alto de intensidad | Se incluye el entrenamiento con pesas, ejercicios de calistenia que soportan peso o entrenamiento de resistencia |
| Flexibilidad | Este tipo de ejercicio se debe realizar 2 veces a la semana durante al menos 10 min. Los estiramientos deben mantenerse de 10 a 30 s | Estiramientos de hombros, brazos, pantorrillas y yoga |
| Equilibrio | Estos ejercicios deben realizarse 3 veces por semana | Se recomienda bailar, practicar taichí, ejercicios de pies a talón o permanecer sobre un pie |
- •
Se recomienda la realización de ejercicio físico de forma planificada y estructurada, incluyendo actividad aeróbica durante la mayor parte de los días de la semana y ejercicios de fortalecimiento muscular, flexibilidad y equilibrio durante algunos días de la semana
- •
En presencia de enfermedades crónicas, alguna actividad física es mejor que ninguna y la participación en cualquier actividad física implica beneficios para la salud
Los pacientes mayores de 65 años suponen cada vez más una mayoría de la población española y consumen tres cuartas partes de los fármacos1. Los principales problemas de la medicación1 en los mayores son la polifarmacia, el consumo de medicación inapropiada, el incumplimiento terapéutico, la automedicación, las interacciones farmacológicas y las reacciones adversas a medicamentos (RAM). En la presente revisión se tratarán algunos de estos aspectos y la deprescripción farmacológica.
La polifarmacia se suele definir de manera cuantitativa, y la definición más frecuente es el consumo diario de 5 o más fármacos2. Es menos frecuente que se utilicen criterios cualitativos2, que son más importantes, puesto que una persona mayor puede tomar 5 o más fármacos y estar correctamente indicados (polifarmacia difícilmente evitable). Lo realmente importante es tratar de suprimir la polifarmacia evitable. La polifarmacia supone, entre otros, un mayor riesgo de utilización de medicación inadecuada1, de RAM1, de incumplimiento terapéutico1, de interacciones farmacológicas3 y de desarrollo de fragilidad4. Diversas intervenciones pueden reducir la polifarmacia1, pero la revisión de la medicación no ha demostrado disminuir la mortalidad, los ingresos hospitalarios ni las caídas, ni mejorar el estado cognitivo de los pacientes5.
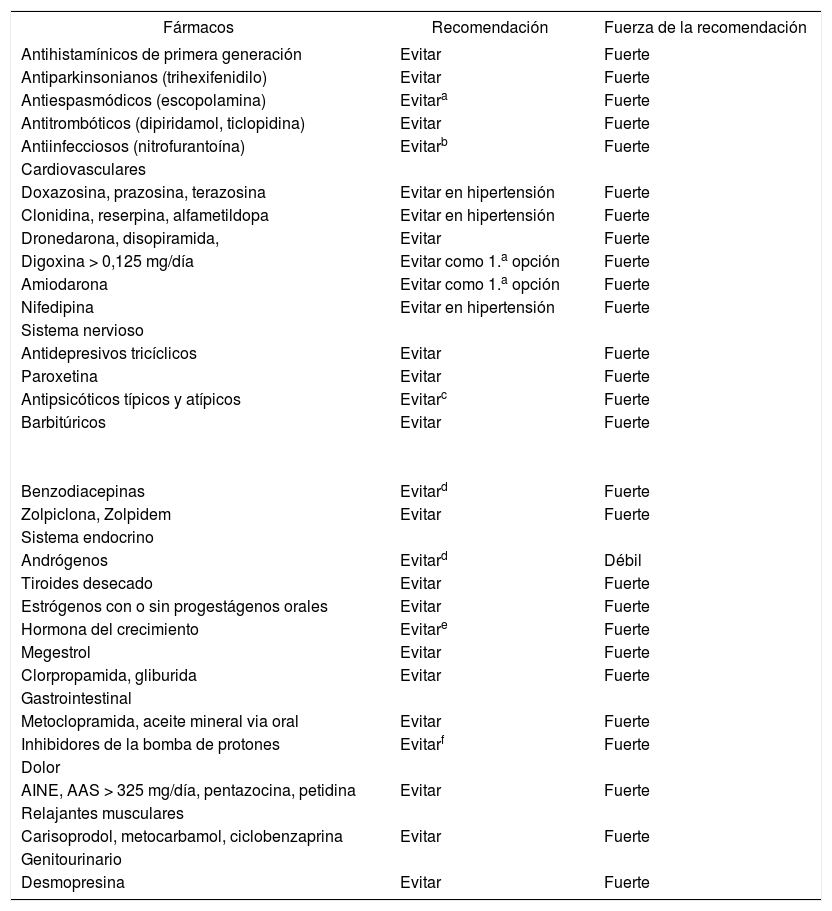
Diversos consensos de expertos han elaborado listas de medicación inapropiada. Los más conocidos son los criterios STOPP6 y los criterios de Beers7. Recientemente se han publicado los criterios STOPPFrail8 para mayores con fragilidad. La medicación inapropiada (criterios de Beers) es un factor de riesgo de mortalidad en > 60 años9. En una revisión Cochrane, las intervenciones para reducir el consumo de medicación inapropiada son efectivas, pero sin efecto claro sobre los ingresos hospitalarios o la calidad de vida10. El método más efectivo son los sistemas informáticos de alerta, aunque no son útiles cuando los pacientes ya toman estos fármacos11. En la revisión actual se siguen aconsejando los criterios de Beers7 (tabla 1), al seguir la metodología GRADE recomendada por el PAPPS y tener tablas para la función renal e interacciones entre fármacos, y entre fármacos y diversos síndromes o enfermedades7. Recientemente se ha publicado una revisión Cochrane sobre la efectividad de las intervenciones en atención primaria para prevenir errores de la medicación12, y no encuentra evidencias claras de que reduzcan los ingresos hospitalarios, las visitas a servicios de urgencias o la mortalidad.
Fármacos inapropiados en el mayor (adaptada de los criterios de Beers 2015)
| Fármacos | Recomendación | Fuerza de la recomendación |
|---|---|---|
| Antihistamínicos de primera generación | Evitar | Fuerte |
| Antiparkinsonianos (trihexifenidilo) | Evitar | Fuerte |
| Antiespasmódicos (escopolamina) | Evitara | Fuerte |
| Antitrombóticos (dipiridamol, ticlopidina) | Evitar | Fuerte |
| Antiinfecciosos (nitrofurantoína) | Evitarb | Fuerte |
| Cardiovasculares | ||
| Doxazosina, prazosina, terazosina | Evitar en hipertensión | Fuerte |
| Clonidina, reserpina, alfametildopa | Evitar en hipertensión | Fuerte |
| Dronedarona, disopiramida, | Evitar | Fuerte |
| Digoxina > 0,125 mg/día | Evitar como 1.a opción | Fuerte |
| Amiodarona | Evitar como 1.a opción | Fuerte |
| Nifedipina | Evitar en hipertensión | Fuerte |
| Sistema nervioso | ||
| Antidepresivos tricíclicos | Evitar | Fuerte |
| Paroxetina | Evitar | Fuerte |
| Antipsicóticos típicos y atípicos | Evitarc | Fuerte |
| Barbitúricos | Evitar | Fuerte |
| Benzodiacepinas | Evitard | Fuerte |
| Zolpiclona, Zolpidem | Evitar | Fuerte |
| Sistema endocrino | ||
| Andrógenos | Evitard | Débil |
| Tiroides desecado | Evitar | Fuerte |
| Estrógenos con o sin progestágenos orales | Evitar | Fuerte |
| Hormona del crecimiento | Evitare | Fuerte |
| Megestrol | Evitar | Fuerte |
| Clorpropamida, gliburida | Evitar | Fuerte |
| Gastrointestinal | ||
| Metoclopramida, aceite mineral via oral | Evitar | Fuerte |
| Inhibidores de la bomba de protones | Evitarf | Fuerte |
| Dolor | ||
| AINE, AAS > 325 mg/día, pentazocina, petidina | Evitar | Fuerte |
| Relajantes musculares | ||
| Carisoprodol, metocarbamol, ciclobenzaprina | Evitar | Fuerte |
| Genitourinario | ||
| Desmopresina | Evitar | Fuerte |
AAS: ácido acetilsalicilico; AINE: antiinflamatorios no esteroideos.
cExcepto en la esquizofrenia, el trastorno bipolar y los trastornos conductuales en demencias durante períodos cortos, y como antieméticos durante la quimioterapia.
En los últimos años se ha abogado por realizar una deprescripción farmacológica, especialmente en mayores con poli-farmacia o fragilidad, sobre todo si hay demencias avanzadas o enfermedades terminales. No hay “medicamentos para toda la vida”, y los mayores deben soportar una carga terapéutica razonable para evitar el incumplimiento terapéutico. Es obligatoria ante duplicidades no justificadas, interacciones y RAM graves, ausencia de eficacia en ensayos clínicos y sobretratamiento farmacológico (frecuente en mayores con hipertensión arterial y diabetes mellitus). La deprescripción es un proceso continuo e individualizado, que debe realizarse fármaco a fármaco. Se debe identificar el problema de salud que hay que tratar, especificar unos objetivos terapéuticos, verificar si el tratamiento es adecuado, dar instrucciones adecuadas a los pacientes y monitorizar la efectividad del tratamiento13. En un estudio de cohortes en ancianos de la comunidad, la reducción de 3 fármacos mejoró la calidad de vida y no aumentó la mortalidad14. En un reciente ensayo clínico15 con pocos participantes (95 ancianos frágiles), la reducción de 2 fármacos redujo la mortalidad en un 40%, aunque sin significación estadística, por el limitado tamaño muestral. Son precisos más ensayos clínicos con tamaño muestral suficiente. Las recomendaciones se resumen en la tabla 2, y se remite a la anterior actualización para los aspectos no abordados en la presente revisión16.
Recomendaciones PAPPS para mejorar la prescripción farmacológica en los ancianos
| Problema farmacológico | Recomendación |
|---|---|
| Polifarmacia Medicación inadecuada Adherencia terapéutica |
|
| Interacciones y reacciones adversas Deprescripción |
|
HbAc1: hemoglobina glucosilada.
Según datos de la OMS, las caídas son la segunda causa mundial de muerte por lesiones accidentales o no intencionales, de ahí la importancia de la prevención. Aproximadamente un 30% de las personas mayores de 65 años y un 50% de las mayores de 80 años que viven en la comunidad se caen al menos una vez al año. Las mujeres tienen un mayor riesgo de caídas que los varones, con un mayor porcentaje de fracturas de cadera1.
Una de las consecuencias más importantes de las caídas es la pérdida de autonomía y el denominado síndrome de temor a caerse, que implican el inicio de la discapacidad en el anciano2.
La etiología de las caídas es multifactorial; sin embargo, no hay ningún instrumento basado en la evidencia que permita identificar con precisión a los ancianos que tienen mayor riesgo de sufrir caídas3-5. La edad y el antecedente de una caída previa son los marcadores más utilizados. El riesgo de caídas aumenta con el número de enfermedades crónicas, la debilidad muscular y las alteraciones de la marcha y del equilibrio1,5.
Las intervenciones mutifactoriales tienen un beneficio bajo en la prevención de caídas. La última actualización de la USPSTF aconseja recomendarlas de forma selectiva en adultos de 65 años o más que viven en la comunidad y tienen mayor riesgo de sufrir caídas.
Vitamina DLos pacientes de edad avanzada a menudo tienen niveles bajos de vitamina D por falta de exposición a la luz solar e ingesta dietética inadecuada. Los mayores de 65 años con concentraciones bajas de 25-hidroxivitamina D (25-(OH)-D) en suero (< 10 ng/ml [25 nmol/l]) tienen un mayor riesgo de pérdida de masa muscular y fuerza, y de fracturas de cadera1,5.
La suplementación de vitamina D puede mejorar la densidad mineral ósea y la función muscular. Sin embargo, el efecto de la vitamina D sobre el riesgo de caídas sigue sin estar claro. La vitamina D podría reducir las caídas por un efecto sobre la fuerza muscular y el equilibrio. Los resultados de los metaanálisis y los ensayos aleatorizados publicados hasta ahora son discordantes, posiblemente debido a los diferentes criterios de inclusión utilizados, diferentes niveles iniciales de vitamina D y diferentes esquemas de dosificación para la vitamina D. Sería útil saber más sobre la repercusión que tienen el estado basal de vitamina D, el efecto de la dosis sobre los niveles de 25-(OH)-D y la relación de la ingesta de calcio al inicio y durante la suplementación para ayudar a interpretar sus efectos sobre las caídas y el riesgo de fractura5,6.
La USPSTF acaba de publicar sus últimas recomendaciones. Dada la falta de evidencia sobre la suplementación con vitamina D no se recomienda su administración en mayores de 65 años con riesgo de caídas, sin déficit o insuficiencia de vitamina D. Por otra parte concluye que la evidencia actual es insuficiente para evaluar el equilibrio de los beneficios y los daños del cribado de la deficiencia de vitamina D en adultos asintomáticos4.
Por otra parte, han aparecido estudios que relacionan las dosis altas de vitamina D con un aumento en el riesgo de caídas, sobre todo cuando se administran de forma intermitente5,8. En uno de estos estudios, el tratamiento con dosis elevadas de vitamina D fue más efectivo a la hora de aumentar los niveles en suero de vitamina D, pero se asoció a un mayor riesgo de caídas y no se demostraron beneficios en la capacidad funcional de los pacientes8.
- •
No se recomienda el uso de protectores de cadera en las personas mayores que viven en la comunidad
- •
Se recomienda colocar marcapasos en pacientes con caídas y enfermedad del seno carotídeo
- •
Se aconseja la corrección quirúrgica de cataratas del primer ojo afectado
- •
En ancianos con dolor de pies se aconsejan intervenciones podológicas
- •
Debe retirarse gradualmente la medicación psicotropa que sea posible
- •
Se recomiendan los ejercicios que incluyen el entrenamiento del equilibrio, el fortalecimiento muscular y la marcha, aunque su eficacia es menor en los pacientes más frágiles
- •
Con la evidencia actual no puede aconsejarse administrar suplementos de vitamina D en mayores de 65 años que viven en la comunidad
- •
Se recomienda la corrección de los riesgos del hogar en personas mayores con alto riesgo de caídas
- •
Las intervenciones multifactorials evalúan el riesgo de caídas, pero su eficacia sobre la reducción del riesgo de caídas es pequeña, por lo que no se recomiendan
La demencia (trastorno neurocognitivo mayor en el DSM-5) es un síndrome clínico que se caracteriza por deterioro de más de un dominio cognitivo (memoria, lenguaje, capacidad ejecutiva, etc.) respecto del nivel previo del paciente, lo suficientemente intenso como para provocarle una limitación funcional en sus actividades sociolaborales o familiares1,2. Habitualmente son cuadros progresivos e irreversibles, con una supervivencia de 4-11 años2, y suponen un gran coste económico sociofamiliar asumido, en su mayor parte, por cuidadores informales.
El deterioro cognitivo leve (DCL)1-3 (llamado trastorno neurocognitivo menor en el DSM-5) se caracteriza por afectación adquirida y prolongada en el tiempo de algún área cognitiva objetivada por test y refrendada por un informador, pero sin interferir, o haciéndolo mínimamente, en las actividades diarias. Se han establecido diferentes subgrupos según afectación o no de la memoria y presencia o no de otras áreas cognitivas afectadas2,3. La alteración conductual leve o mild behavioral impairment (MBI) es un nuevo concepto que encuadra a las alteraciones de la conducta en el adulto mayor, no asociadas a DCL, a demencia ni a procesos psiquiátricos intercurrentes, que duren más de 6 meses. Los pacientes con DCL o con MBI evolucionan a demencia en mayor proporción que la población general3.
La mayor parte de las demencias están asociadas a procesos vasculares o degenerativos (principalmente enfermedad de Alzheimer) relacionados con el envejecimiento, razón por la que la incidencia de demencias aumenta con la edad. Sin embargo, a pesar del envejecimiento poblacional, en las últimas décadas su prevalencia4 está disminuyendo en países desarrollados. Se cree que esto se relaciona con modificaciones en el estilo de vida y un aumento del nivel educativo4. Ello ofrece una esperanza a la hora de plantear actividades de prevención, sobre todo a nivel institucional. Los estudios de simulación sugieren que retrasar el inicio de la enfermedad, incluso en 2 años, no solo disminuiría el promedio de años vividos con la enfermedad, sino que también tendría importantes beneficios para la salud pública, la economía y la sociedad5. Por esta razón, la OMS ha declarado la prevención y el tratamiento de la demencia una prioridad de salud pública5.
A pesar de la escasa posibilidad actual de tratamiento curativo de la demencia, un diagnóstico realizado en las fases iniciales del proceso podría permitir planificar cuidados y tratamiento con el paciente y la familia, lo que disminuiría riesgos. La divulgación del diagnóstico suele disminuir la ansiedad en pacientes y cuidadores, y da al paciente la oportunidad de mantener su autonomía ante decisiones vitales (voluntades anticipadas)1. En el sentido contrario, el tratamiento de la demencia leve-moderada con terapia farmacológica y no farmacológica solo produce pequeñas mejorías de discutible importancia clínica, y los fármacos que se utilizan pueden tener efectos secundarios. La evidencia actual del efecto del cribado sobre las decisiones o planificación por parte de pacientes, cuidadores o médicos todavía es insuficiente6, y hay que tener en cuenta también los potenciales efectos secundarios de un falso diagnóstico sobre pacientes sanos7. Estas cuestiones centran el debate sobre la oportunidad o no de realizar un cribado poblacional que favorezca la detección temprana.
Cribado de deterioro cognitivo leve y demencia. Síntesis de la evidenciaEn el momento actual, no hay suficiente evidencia que demuestre los beneficios o los riesgos de los programas de cribado de deterioro cognitivo en población mayor de 65 años asintomática6,7.
Hay organizaciones sanitarias que han incorporado el cribado del deterioro cognitivo en sus revisiones anuales (Medicare en 2011, Alzheimer’s Association en 2013). Algunas guías (National Institute for Health and Care Excellence [NICE]) o consensos4 recomiendan vigilar a la población con procesos asociados a mayor riesgo de demencia, como la enfermedad de Parkinson, haber padecido ictus o tener criterios de fragilidad. La guía NICE de 2015 sobre demencia, discapacidad y fragilidad recomienda incluir la demencia en las estrategias de prevención de enfermedades crónicas no transmisibles y deja claro que algunos comportamientos no saludables pueden aumentar el riesgo de demencia4.
Hay acuerdo en reconocer la importancia de la evaluación clínica (entrevista, test, exploraciones complementarias) cuando la familia o el paciente expresen su preocupación ante un potencial deterioro cognitivo o pérdida de autonomía funcional, como forma de garantizar un diagnóstico temprano de demencia que garantice un abordaje adecuado del paciente1,6,7.
La entrevista debe confrontarse, si es posible, con algún informador fiable e investigar la presencia de síntomas cognitivos y la pérdida funcional, sin olvidar preguntar por síntomas neuropsiquiátricos (apatía, alucinaciones, agitación, depresión), presentes en el 80% de los pacientes con demencia1 y en el 60% de los pacientes con DCL3, ya que pueden aparecer precozmente y facilitar el diagnóstico temprano.
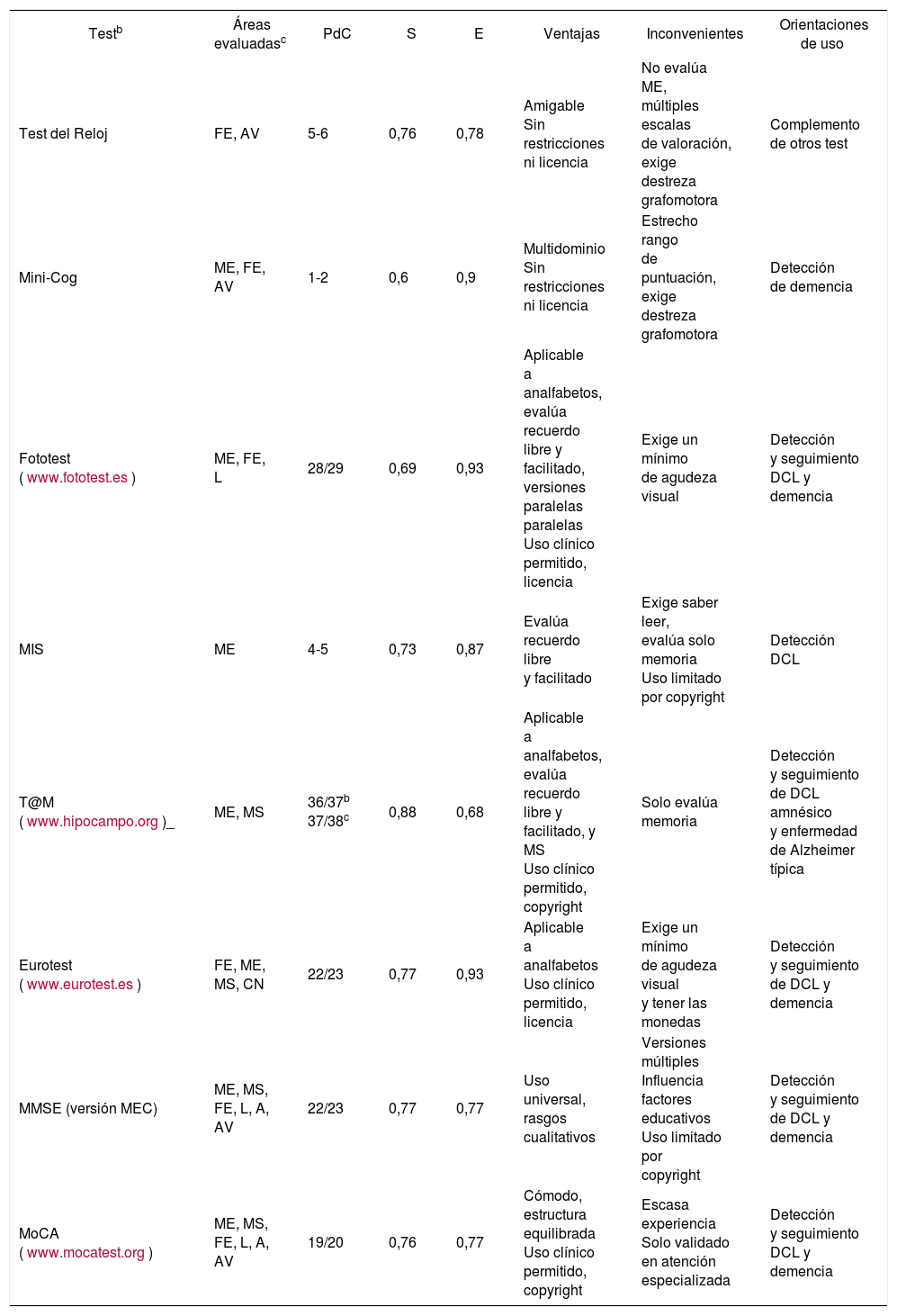
Aunque no hay evidencia para la utilización de test cognitivos en cribado poblacional por la alta frecuencia de falsos positivos (uno de cada 10 con el MMSE, el test más comúnmente empleado)7, es recomendable hacerlos ante la sospecha de DCL o de demencia, como método válido para objetivar el deterioro cognitivo, e incluso para realizar un seguimiento en los casos dudosos. Deben usarse test o cuestionarios validados para la población de referencia1,8. En la tabla 1 se reflejan los test cognitivos cortos validados en población española para el estudio de DCL o demencia. La capacidad de detección de los test cognitivos mejora si se asocian con escalas de valoración funcional.
Test cognitivos breves para la detección del deterioro cognitivo validados en Españaa
| Testb | Áreas evaluadasc | PdC | S | E | Ventajas | Inconvenientes | Orientaciones de uso |
|---|---|---|---|---|---|---|---|
| Test del Reloj | FE, AV | 5-6 | 0,76 | 0,78 | Amigable Sin restricciones ni licencia | No evalúa ME, múltiples escalas de valoración, exige destreza grafomotora | Complemento de otros test |
| Mini-Cog | ME, FE, AV | 1-2 | 0,6 | 0,9 | Multidominio Sin restricciones ni licencia | Estrecho rango de puntuación, exige destreza grafomotora | Detección de demencia |
| Fototest (www.fototest.es) | ME, FE, L | 28/29 | 0,69 | 0,93 | Aplicable a analfabetos, evalúa recuerdo libre y facilitado, versiones paralelas paralelas Uso clínico permitido, licencia | Exige un mínimo de agudeza visual | Detección y seguimiento DCL y demencia |
| MIS | ME | 4-5 | 0,73 | 0,87 | Evalúa recuerdo libre y facilitado | Exige saber leer, evalúa solo memoria Uso limitado por copyright | Detección DCL |
| T@M (www.hipocampo.org)_ | ME, MS | 36/37b 37/38c | 0,88 | 0,68 | Aplicable a analfabetos, evalúa recuerdo libre y facilitado, y MS Uso clínico permitido, copyright | Solo evalúa memoria | Detección y seguimiento de DCL amnésico y enfermedad de Alzheimer típica |
| Eurotest (www.eurotest.es) | FE, ME, MS, CN | 22/23 | 0,77 | 0,93 | Aplicable a analfabetos Uso clínico permitido, licencia | Exige un mínimo de agudeza visual y tener las monedas | Detección y seguimiento de DCL y demencia |
| MMSE (versión MEC) | ME, MS, FE, L, A, AV | 22/23 | 0,77 | 0,77 | Uso universal, rasgos cualitativos | Versiones múltiples Influencia factores educativos Uso limitado por copyright | Detección y seguimiento de DCL y demencia |
| MoCA (www.mocatest.org) | ME, MS, FE, L, A, AV | 19/20 | 0,76 | 0,77 | Cómodo, estructura equilibrada Uso clínico permitido, copyright | Escasa experiencia Solo validado en atención especializada | Detección y seguimiento DCL y demencia |
A: área de atención; AV: área visuoespacial; CM: capacidades numéricas; DCL: deterioro cognitivo leve; E: especificidad (salvo el MoCA, solo se han puesto los valores de estudios validados en atención primaria); FE: funciones frontales/ejecutivas; L: lenguaje; ME: memoria episódica; MEC: Mini-Examen Cognoscitivo; MIS: Memory Impairment Screen; MMSE: Mini-Mental State Examination; MoCA: Montreal Cognitive Assessment; MS: memoria remota/semántica; PdC: punto de corte; S: sensibilidad; T@M: Test de Alteración de Memoria.
Modificada de referencia 8.
Si tras la valoración se detecta DCL, es recomendable un seguimiento clínico periódico, ya que entre el 10 y el 15% de los pacientes evoluciona cada año a demencia1,3.
Factores de riesgo y prevenciónEl riego de desarrollar demencia, discapacidad y fragilidad podría reducirse o retrasarse mediante cambios saludables en el estilo de vida4 y mejor acceso a la educación; la probabilidad de reducir el riesgo es mayor cuanto antes se integren estos cambios en la rutina diaria4. Algunos riesgos no podrán modificarse, como la edad, que es el factor de riesgo más importante para demencia, o las alteraciones genéticas relacionadas con algunos tipos de demencia. Sin embargo, alrededor del 35-48% de la demencia puede atribuirse a una combinación de factores de riesgo modificables5,9, asociados también a discapacidad y fragilidad: educación (nivel bajo o medio de escolarización), aislamiento social, pérdida de audición, depresión en > 65 años, inactividad física, tabaquismo, diabetes, hipertensión y obesidad en mediana edad. En personas mayores, por el contrario, la asociación de alguno de estos factores es inversa, de modo que la hipotensión y el bajo peso pueden suponer mayor riesgo. Los individuos con un mayor número de años de educación y mejor funcionamiento cognitivo muestran síntomas de demencia más tarde que aquellos con un nivel educativo más bajo. Sin embargo, una vez que los individuos con mayor reserva cognitiva muestran síntomas de demencia, la progresión de la enfermedad es más rápida que en los individuos en el otro extremo del espectro. Esta observación habla de la relación compleja entre la reserva cognitiva y el deterioro cognitivo5.
En la tabla 2 pueden verse otros factores de riesgo modificables9,10.
Factores de riesgo (FR) de demencia y eficacia de las intervenciones preventivas
| FR de DCL y demencia4,9,10 | |
| Accidente cerebrovascular (ACV) | El 10% de los pacientes desarrolla demencia de nueva aparición después de un primer ACV, y un tercio de los pacientes desarrolla demencia después de un ACV recurrente. Las microhemorragias cerebrales subclínicas también se han asociado con un mayor riesgo de demencia incidental, incluida la EA |
| Fibrilación auricular | Varios MAy estudios observacionales han encontrado relación directa entre la fibrilación auricular y el riesgo de demencia. Parece ser un FR independiente de otras comorbilidades como la diabetes, la hipertensión y la insuficiencia cardíaca |
| Insuficiencia cardíaca | En un reciente MA, la insuficiencia cardíaca se asoció con un aumento del riesgo de demencia del 60% (RR: 1,60) |
| ERC | Hay evidencia, basada en MA, que muestra que la albuminuria aumenta el riesgo de desarrollar DCL y demencia |
| Trastornos del sueño | La apnea obstructiva del sueño se ha asociado con un mayor riesgo de demencia en estudios observacionales y en MA |
| Consumo de alcohol | En estudios observacionales se ha descrito asociación entre alcohol y demencia tipo U: hay menor riesgo en personas que beben poco frente a los no bebedores, pero al aumentar el consumo, el riesgo progresa; sin embargo, en otros estudios, se ha encontrado una relación ante cualquier consumo de alcohol, con aumento lineal del riesgo al aumentar el consumo |
| Concentración elevada de homocisteína | La homocisteína refleja el estado funcional de 3 vitaminas (ácido fólico, vitaminas B12 y B6). Su elevación es un factor de riesgo para el DCL y la demencia (RR: 1,5-2,5) |
| Déficit crónico de folato | Frecuente entre las personas de ≥ 65 años, debido a la ingesta dietética reducida y a la malabsorción intestinal. Se ha asociado en estudios poblacionales con depresión, DCL y demencia, en particular EA |
| Déficit de vitamina D | Una RS asocia los niveles bajos de vitamina D con DCL y EA, siendo el efecto de la asociación bajo y de significado incierto |
| Eficacia de las intervenciones | en prevención de la demencia o prevención del paso de DCL leve a demencia2,10,11,12 |
| Ejercicio físico | Los efectos protectores del ejercicio aún no se han demostrado. Ensayos con ejercicio aerobico con personas mayores cognitivamente sanas no demostraron efecto en la puntuación de los test cognitivos a las 8-24 semanas de seguimiento. Es posible que el ejercicio físico tenga beneficios sinérgicos como parte de una estrategia integral de reducción de los factores de riesgo |
| Control de la glucemia | A pesar de que la DM se ha asociado a mayor riesgo de demencia vascular y EA, no está claro si su tratamiento efectivo reduce el riesgo de demencia |
| Terapia antihipertensiva | Aunque la hipertensión parece estar asociada con un mayor riesgo de demencia vascular y EA, el efecto del tratamiento antihipertensivo sobre la reducción del riesgo es incierto: leve disminución, no estadísticamente significativa (OR: 0,89 [0,74-1,07]), de la incidencia de demencia con tratamiento frente a placebo |
| Entrenamiento cognitivo | En adultos con cognición normal, el entrenamiento mejora el rendimiento cognitivo en el dominio entrenado, pero no en los no entrenados. Los dominios cognitivos en los que se ha encontrado mejoría con la estimulación cognitiva son la función ejecutiva, la velocidad de atención y procesamiento, y la memoria, pero no la memoria de trabajo La evidencia con respecto a la prevención o el retraso del deterioro cognitivo o la demencia es insuficiente |
| Modificaciones dietéticas | Aunque la evidencia es insuficiente, múltiples estudios de cohortes y el ensayo PREDIMED han sugerido que la dieta mediterránea mejora los resultados cardiovasculares, incluido el ACV, y estos efectos podrían promover directa o indirectamente un menor riesgo de demencia. |
| Consumo de alcohol | Aunque el consumo moderado de alcohol se ha asociado en estudios poblacionales a menor riesgo de EA, la evidencia científica disponible sugiere que los riesgos globales del alcohol se sitúan muy por encima de sus posibles y ligeros beneficios, por lo que no se recomienda su consumo para disminuir el riesgo de demencia |
| Terapia hormonal sustitutiva | La terapia hormonal sustitutiva no es eficaz en la prevención primaria de la demencia |
| Terapia con AINE | Existe evidencia de calidad moderada de que los AINE no previenen la demencia y, dados los posibles daños, no deben usarse para el tratamiento o la prevención de la demencia o el deterioro cognitivo |
| Estatinas | Existe evidencia que sustenta que administrar estatinas a personas mayores con riesgo vascular no previene el desarrollo de DCL ni de demencia. No han demostrado superioridad frente a placebo (OR: 1,00 [0,61-1,65]) |
| Vitaminas antioxidantes (vitamina E, betacaroteno, flavonoides, vitamina C) | Debido a que existen riesgos potenciales de suplementación de vitamina E, no se recomienda la suplementación con vitamina E u otros antioxidantes para la prevención de la EA u otros tipos de demencia No hay evidencia de que la vitamina E prevenga la progresión de DCL a demencia, ni de que mejore la función cognitiva en los pacientes con DCL. En personas con DCL, los suplementos de vitamina E tienen pocos o ningñn efecto sobre la incidencia de EA (índice de riesgo: 1,02 [0,74-1,41]) a los 36 meses, en comparación con el placebo |
| Vitaminas B6, B12 y folato | No hay evidencia suficiente de que la suplementación con vitaminas prevenga la demencia |
| Vitamina D | No existe evidencia para recomendar suplementos de vitamina D con el fin de prevenir el deterioro cognitivo o la demencia |
| Ácidos grasos omega-3 | Los estudios disponibles no han demostrado un beneficio para la función cognitiva y han carecido de poder y duración para probar si el consumo reduce la demencia incidente En personas con DCL, los ácidos grasos omega-3 mostraron poca o ninguna diferencia respecto a placebo en la progresión a demencia en estudios de 14 a 24 semanas. Tampoco han demostrado su eficacia en mayores sanos ni en personas con demencia. Se están estudiando asociaciones con otros nutrientes como el ácido fólico, el selenio o las vitaminas C, E, B6 y B12 para ver su efecto sobre la memoria3 |
| Inhibidores de la colinesterasa (ICE) | En pacientes con deterioro cognitivo leve, los ICE no han demostrado disminución en la progresión a la demencia (RR: 0,84 [0,70-1,02]) a los 3 años, y presentan más eventos adversos que el placebo (RR: 1,09 [1,02-1,16]), por lo que no están indicados para este propósito |
| Ginkgo biloba | Aunque en la demencia leve se ha demostrado un pequeño efecto sobre la conducta, la ansiedad y las funciones ejecutivas3, no existe evidencia para recomendar suplementos de Gingko biloba para prevenir el deterioro cognitivo o la demencia |
ACV: accidente cerebrovascular; AINE: antiinflamatorios no esteroideos; DCL: deterioro cognitivo leve; DM: diabetes mellitus;
EA: enfermedad de Alzheimer; ERC: enfermedad renal crónica; ICE: inhibidores de la colinesterasa; MA: metaanálisis; OR: odds ratio:
RR: riesgo relativo; RS: revisión sistemática.
La presencia de DCL aumenta el riesgo de progresión a demencia, con porcentajes que varían según la definición utilizada para DCL. Alteraciones metabólicas, fármacos, problemas sensoriales, depresión, etc. pueden ser causas de DCL que podrían mejorar con un adecuado abordaje. Los eventos isquémicos cerebrales pueden, según su extensión, provocar demencia vascular o DCL, que evolucionará o no en el tiempo. Y no hay que olvidar que la etapa prodrómica de la enfermedad de Alzheimer empieza años antes de desarrollarse la demencia, primero de forma asintomática y luego con DCL, para finalmente desembocar en el cuadro de demencia, por lo que, en estos casos, el DCL está ya manifestando la enfermedad. Cuando el DCL se asocia a síntomas neuropsiquiátricos, la progresión a demencia se duplica. La aparición de estos síntomas en población mayor, incluso en ausencia inicial de DC, aumenta la progresión a demencia, por lo que obligan a un seguimiento en el que se vigile la aparición de enfermedad neurodegenerativa.
Eficacia de las intervenciones en prevención de la demencia o prevención del paso de deterioro cognitivo leve a demenciaNo existe ninguna intervención única que sea efectiva para retrasar o prevenir la demencia. La bibliografía existente, incluido el World Alzheimer Report, aboga por un enfoque múltiple para la prevención temprana de la demencia, dado el papel que juegan los múltiples factores de riesgo de la enfermedad.
En la tabla 2 se resume la evidencia de las intervenciones aisladas en la prevención sobre el deterioro cognitivo y la demencia10-12. Es posible que las intervenciones preventivas fuesen más eficaces si se dirigiesen a múltiples factores de riesgo, teniendo en cuenta la etiología multifacética de la enfermedad11, pero actualmente no hay evidencia que lo respalde. Los estudios que evalúan la efectividad de las intervenciones para prevenir la incidencia de DCL o demencia son de duración y seguimiento excesivamente cortos, inadecuados para este objetivo. Los estudios más largos pueden contener sesgos derivados de pérdidas por mortalidad a lo largo del seguimiento.
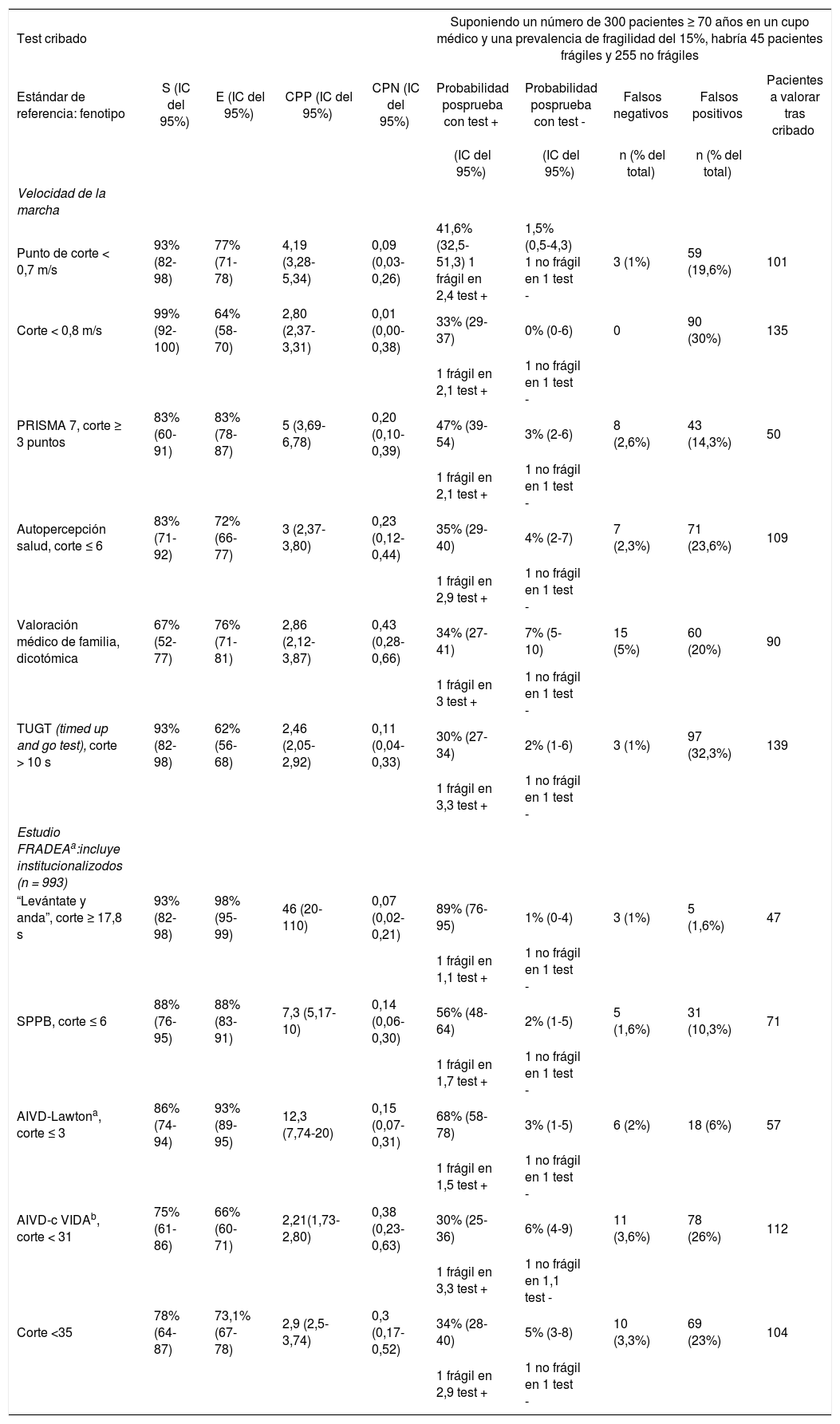
Validez diagnóstica de diferentes herramientas para identificar fragilidad, con estimación en una muestra hipotética
| Test cribado | Suponiendo un número de 300 pacientes ≥ 70 años en un cupo médico y una prevalencia de fragilidad del 15%, habría 45 pacientes frágiles y 255 no frágiles | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Estándar de referencia: fenotipo | S (IC del 95%) | E (IC del 95%) | CPP (IC del 95%) | CPN (IC del 95%) | Probabilidad posprueba con test + | Probabilidad posprueba con test - | Falsos negativos | Falsos positivos | Pacientes a valorar tras cribado |
| (IC del 95%) | (IC del 95%) | n (% del total) | n (% del total) | ||||||
| Velocidad de la marcha | |||||||||
| Punto de corte < 0,7 m/s | 93% (82-98) | 77% (71-78) | 4,19 (3,28-5,34) | 0,09 (0,03-0,26) | 41,6% (32,5-51,3) 1 frágil en 2,4 test + | 1,5% (0,5-4,3) 1 no frágil en 1 test - | 3 (1%) | 59 (19,6%) | 101 |
| Corte < 0,8 m/s | 99% (92-100) | 64% (58-70) | 2,80 (2,37-3,31) | 0,01 (0,00-0,38) | 33% (29-37) | 0% (0-6) | 0 | 90 (30%) | 135 |
| 1 frágil en 2,1 test + | 1 no frágil en 1 test - | ||||||||
| PRISMA 7, corte ≥ 3 puntos | 83% (60-91) | 83% (78-87) | 5 (3,69-6,78) | 0,20 (0,10-0,39) | 47% (39-54) | 3% (2-6) | 8 (2,6%) | 43 (14,3%) | 50 |
| 1 frágil en 2,1 test + | 1 no frágil en 1 test - | ||||||||
| Autopercepción salud, corte ≤ 6 | 83% (71-92) | 72% (66-77) | 3 (2,37-3,80) | 0,23 (0,12-0,44) | 35% (29-40) | 4% (2-7) | 7 (2,3%) | 71 (23,6%) | 109 |
| 1 frágil en 2,9 test + | 1 no frágil en 1 test - | ||||||||
| Valoración médico de familia, dicotómica | 67% (52-77) | 76% (71-81) | 2,86 (2,12-3,87) | 0,43 (0,28-0,66) | 34% (27-41) | 7% (5-10) | 15 (5%) | 60 (20%) | 90 |
| 1 frágil en 3 test + | 1 no frágil en 1 test - | ||||||||
| TUGT (timed up and go test), corte > 10 s | 93% (82-98) | 62% (56-68) | 2,46 (2,05-2,92) | 0,11 (0,04-0,33) | 30% (27-34) | 2% (1-6) | 3 (1%) | 97 (32,3%) | 139 |
| 1 frágil en 3,3 test + | 1 no frágil en 1 test - | ||||||||
| Estudio FRADEAa:incluye institucionalizodos (n = 993) | |||||||||
| “Levántate y anda”, corte ≥ 17,8 s | 93% (82-98) | 98% (95-99) | 46 (20-110) | 0,07 (0,02-0,21) | 89% (76-95) | 1% (0-4) | 3 (1%) | 5 (1,6%) | 47 |
| 1 frágil en 1,1 test + | 1 no frágil en 1 test - | ||||||||
| SPPB, corte ≤ 6 | 88% (76-95) | 88% (83-91) | 7,3 (5,17-10) | 0,14 (0,06-0,30) | 56% (48-64) | 2% (1-5) | 5 (1,6%) | 31 (10,3%) | 71 |
| 1 frágil en 1,7 test + | 1 no frágil en 1 test - | ||||||||
| AIVD-Lawtona, corte ≤ 3 | 86% (74-94) | 93% (89-95) | 12,3 (7,74-20) | 0,15 (0,07-0,31) | 68% (58-78) | 3% (1-5) | 6 (2%) | 18 (6%) | 57 |
| 1 frágil en 1,5 test + | 1 no frágil en 1 test - | ||||||||
| AIVD-c VIDAb, corte < 31 | 75% (61-86) | 66% (60-71) | 2,21(1,73-2,80) | 0,38 (0,23-0,63) | 30% (25-36) | 6% (4-9) | 11 (3,6%) | 78 (26%) | 112 |
| 1 frágil en 3,3 test + | 1 no frágil en 1,1 test - | ||||||||
| Corte <35 | 78% (64-87) | 73,1% (67-78) | 2,9 (2,5-3,74) | 0,3 (0,17-0,52) | 34% (28-40) | 5% (3-8) | 10 (3,3%) | 69 (23%) | 104 |
| 1 frágil en 2,9 test + | 1 no frágil en 1 test - | ||||||||
CPN: cociente de probabilidad negativo; CPP: cociente de probabilidad positivo; E: especificidad; IC: interzalo de confianza; S: sensibilidad;
Los datos de S, E, CPP y CPN de la velocidad de la marcha, PRISMA 7, autopercepción de salud, valoración del módico de familia y TUGT se basan en el artículo de Clegg et al5. Los del test “Levántate y anda”, SPPB y AlVD-Lawtonn, en datos del estudio FRADEA.
Los del cuestionario VIDA, en datos del estudio FUNCIPLUR, con corte en < 31 puntos en pacientes pluripatológicos sin importante alteración en las actividades básicas de la vida diaria (ABVD, índice de Barthel > 60 puntos) y del estudio KOS-FRAGIL, con corte en < 35 puntos en personas con Barthel > 90 puntos. Los valores de probabilidad preprueba (prevalencia) del 15% corresponden al estudio FRADEA, citado en el Documento de consenso de fragilidad y caídas del SNS4. Los IC, probabilidad posprueba y pacientes que se deben valorar, referidos a una muestra hipotética de 300 personas ≥ 70 años de una consulta estándar de atención primaria, se han calculado a partir de los resultados aportados por los estudios.
- •
No se recomienda cribado de demencia en población asintomática mayor de 65 años
- •
Se recomienda su estudio ante síntomas de alarma, como fallos cognitivos o pérdida de autonomía funcional, referidos por el paciente, la familia o los profesionales sanitarios
- •
Se aconseja una vigilancia especial a pacientes con mayor riesgo de deterioro cognitivo o demencia (pacientes frágiles o de edad muy avanzada, enfermedad de Parkinson, antecedentes de ictus)
- •
Se recomienda un seguimiento periódico de las personas con DCL o síntomas neuropsiquiátricos, por su elevado riesgo de desarrollo de demencia
- •
Se aconseja un diagnóstico temprano de la demencia para poder planificar los cuidados, evitar los riesgos y permitir al paciente y a la familia tomar decisiones sobre su futuro
- •
Se recomienda (a nivel personal y como estrategia de prevención en salud pública) fomentar la actividad física, potenciar la alimentación saludable, la prevención de factores de riesgo cardiovascular, en especial de hipertensión arterial en edades medias, reducir el consumo de alcohol, dejar de fumar, mantener un peso adecuado y el control de enfermedades crónicas
- •
Se aconsejan las actividades sociales que eviten el aislamiento y la vigilancia de síntomas depresivos, sobre todo si aparecen en edades tardías
- •
En el momento actual, no se recomiendan los inhibidores de la acetilcolinesterasa, las estatinas ni los antiinflamatorios no esteroideos para prevenir el deterioro cognitivo o su progresión a demencia
- •
En el momento actual, no hay suficiente evidencia para aconsejar suplementos vitamínicos B o C, ácidos grasos ni Ginkgo biloba para prevenir el deterioro cognitivo o la demencia
La fragilidad se define como un deterioro progresivo de los sistemas fisiológicos, relacionado con la edad, que disminuye las reservas de capacidad intrínseca, lo que confiere mayor vulnerabilidad a factores de estrés y mayor riesgo de resultados adversos en salud (WHO, 2015)1, tales como caídas y fracturas, hospitalización, institucionalización, discapacidad (odds ratio [OR] para alteración de actividades de la vida diaria: 2,05; intervalo de confianza [IC] del 95%, 1,73-2,44) y mortalidad prematura (OR: 2,34; IC del 95%, 1,77-3,09). La prevalencia es de un 10-15% de las personas > 65 años, más frecuente a mayor edad y en mujeres1-4.
Aunque espontáneamente tiende a evolucionar y progresar adversamente, con intervenciones adecuadas, intensas y precoces se pueden revertir, enlentecer o aminorar sus consecuencias. Su prevención se entiende a 3 niveles: a) prevención primaria, para evitar que aparezca la situación de fragilidad (con medidas de fomento de la actividad física y los hábitos de vida saludable, y otras específicas); b) prevención secundaria, con detección precoz antes de que sea evidente o en los primeros estadios; c) prevención terciaria, para evitar las consecuencias desfavorables asociadas (discapacidad, eventos adversos de salud, etc.) una vez ya establecida. La atención primaria (AP) se muestra como el medio asistencial idóneo para detectar y abordar la fragilidad1,4.
Diagnóstico y estrategias de detecciónHerramientas para la detección y diagnóstico. Existen 2 modelos de fragilidad de referencia, el modelo físico (basado en el fenotipo de Fried, que valora de manera objetiva la pérdida de peso, la debilidad muscular, la baja resistencia o el agotamiento, la lentitud en la marcha y el nivel de actividad física bajo) y el modelo acumulativo de déficits o multidimensional, basado en déficits en diferentes dominios (clínico-físico, funcional, mental y social). Otras herramientas desarrolladas se sustentan en la combinación de ambos modelos, en pruebas de ejecución, en la valoración geriátrica integral (VGI), en escalas de actividades instrumentales de la vida diaria (AIVD), en autopercepción de la salud o en el criterio del clínico. La tabla 1 resume las principales pruebas para la detección de la fragilidad y algunas características importantes para orientar su elección1,3,5,6.
Características de las principales herramientas empleadas en la detección de fragilidad
| Herramienta | Fundamento y composición | Características | Factibilidad aplicación sistemática | Utilización/ recomendada en España |
|---|---|---|---|---|
| Modelo físico de fragilidad | ||||
| Fenotipo de Fried | 5 criterios: pérdida de peso, debilidad muscular, baja resistencia, lentitud en velocidad de la marcha y baja actividad física | Define fragilidad. Buena fiabilidad y validez pronóstica. Requiere dinamómetro | + | ++/+ |
| Escala SHARE-FI | Criterios de Fried modificados. Calculadora web: https://sites.google.com/a/tcd.ie/share-frailty-instrument-calculators/ | Requiere dinamómetro, como en el fenotipo de Fried | ||
| Modelo multidimensional | ||||
| Fl | Puntuación acumulativa, 0 a 1; n/total de ≥ 30 déficits posibles en varias dimensiones (física, mental, social) o discapacidades | Define fragilidad. Corte fragilidad en 0,25 | ++ | -/- |
| eFI | Basado en registros de la historia clínica electrónica | Estratifica el riesgo poblacional de fragilidad | ||
| PRISMA-7 | 7 ítems de sexo, autonomía, marcha, soporte social y medioambiente | Moderada capacidad pronóstica | ||
| Escalas mixtas (modelo físico y multidimensional) | ||||
| Escala FRAIL | ítems: fatiga, resistencia, deambulación, número de enfermedades, pérdida de peso | No requiere aparataje | ++ | -/- |
| Índice de Tilburg (mixta) | 15 ítems en 3 dominios (físico, psicológico y social) | Elevada fiabilidad y validez. Muy estudiada | ||
| “Levántate y anda” | Tiempo en levantarse de la silla, caminar 3 m, y sentarse de nuevo | Corte para fragilidad > 20 s (algunos consideran 10) | ||
| SPPB | Valora equilibrio (pies juntos, semitàndem y tándem), marcha a 4 m, y levantarse y sentarse de una silla | Puntuación de 0 a 12 puntos. Corte fragilidad < 10. Validada en España, con buena fiabilidad y validez predictiva, y convergente con otras medidas físicas y de funcionalidad, y con los criterios de Fried | ||
| Escolas AIVD | ||||
| índice Lawton-Brody | Valora 8 ítems de AIVD: uso del teléfono, hacer compras, usar medios de transporte, responsabilizarse de medicación, llevar asuntos económicos, preparar comida, tareas domésticas, lavar ropa (en varones algunas versiones solo valoran los 4 primeros ítems) | Apenas validada, a pesar de amplio uso y poco discriminante. Probable sesgo de sexo (hay versión que evita los ítems en varones que más condicionan) | +++ | +/++ |
| Cuestionario VIDA | 10 ítems-actividades (tomar medicación, usar teléfono, tareas domésticas, asuntos económicos, desplazamiento, control de riesgos, compras, abrir puertas, usar transportes, relación social) y puntuación sumativa de 10 a 38 puntos | Corte fragilidad < 31 puntos. Sencillo (3-4 min), válido y fiable, con amplio rango y discriminación, originado en nuestro medio y sin sesgo de sexo | ||
| Criterio del profesional | Con preguntas de reflexión como “¿considerarías a este paciente frágil, definido como pérdida de capacidad funcional (física, psicológica, social), con incremento del riesgo de efectos adversos? | Baja sensibilidad y especificidad moderada, aunque mejora si se acompaña de medidas objetivas | + | +/- |
AIVD: actividades instrumentales de la vida diaria; eFI: índice electrónico de fragilidad; FI: índice de fragilidad; SPPB: prueba corta de desempeño físico (short physical performance battery).
¿Qué herramienta elegir? Además de sus características, hay que tener en cuenta aspectos como la finalidad de la prueba (cribado de personas probablemente frágiles, confirmar el diagnóstico, etc.) y su ámbito de aplicación. Para AP, las pruebas han de ser sencillas y compatibles con la clínica habitual. Por otro lado, la VGI, como herramienta estructurada de evaluación y abordaje de problemas detectados, es probablemente la mejor manera de valorar y corroborar la fragilidad y de establecer una intervención adecuada e individualizada. De hecho, el enfoque de valoración clínica multidimensional es un componente habitual en la mayoría de programas de detección y abordaje de la fragilidad.
La tabla 2 recoge los índices de validez como pruebas diagnósticas de las principales herramientas utilizadas en nuestro medio3,5,6 y su aplicación práctica a una población hipotética de pacientes. Si nos centramos en nuestro entorno, se recomiendan las pruebas de ejecución para la detección de fragilidad3,4. En la práctica clínica habitual, también es importante la monitorización de las AIVD para la detección de una pérdida funcional precoz, con escalas como la de Lawton y Brody, y el cuestionario VIDA (https://www.bibliopro.org/buscador/1243/vida-diaria-del-anciano-vida). Los índices acumulativos, especialmente los que utilicen registros electrónicos existentes, podrían ofrecer posibilidades que convendría explorar.
Estrategias de detección. Actualmente existe una tendencia de los sistemas sanitarios a articular estrategias activas de detección sistemática de la fragilidad, por su prevalencia y relevancia, así como por la existencia de métodos de detección razonablemente válidos e intervenciones potencialmente beneficiosas.
El consenso del SNS sobre prevención de fragilidad y caídas en la persona mayor recomienda la detección oportunista organizada de la fragilidad a personas > 70 años no dependientes (Barthel ≥ 90 puntos) en AP, preferentemente a través de pruebas de ejecución (short physical performance battery [SPPB], test de velocidad de la marcha o test “levántate y anda”), seguida idealmente de una valoración multidimensional en forma de VGI y de una intervención centrada en la actividad física4.
El National Health Service incluye, en el contrato con los médicos de familia, la identificación proactiva rutinaria de los > 65 años potencialmente frágiles en grado moderado o grave, a través de herramientas como el eFI (índice electrónico de fragilidad), que permite la estratificación del riesgo. El diagnóstico definitivo se realiza mediante el juicio y criterio clínicos del profesional o con una evaluación más exhaustiva, que podría apoyarse en instrumentos como el cuestionario PRISMA-7, el test “levántate y anda”, el de velocidad de la marcha o la escala clínica de fragilidad (CSF). Tras el diagnóstico se propone un plan de intervención (https://www.england.nhs.uk/publication/supporting-rou-tine-frailty-identification-and-frailty-through-the-gp-con-tract-20172018/).
Una reciente guía canadiense recomienda la “detección de casos” proactiva, que identifica posibles signos de fragilidad o vulnerabilidad de tipo médico, mental, funcional, medicamentoso o social. Ante la sospecha de fragilidad aconseja una evaluación formal para su confirmación a través de herramientas aplicables en AP (cuestionario PRISMA-7, test de velocidad de la marcha o “levántate y anda” y test de valoración cognitiva)7.
Intervención en fragilidadEl ejercicio y la actividad física constituyen la intervención más efectiva en la fragilidad, bien sola o combinada con otras intervenciones1-4,8,9, no solo en su abordaje sino también en su prevención primaria, fundamentalmente en forma de ejercicio multicomponente, que ejercita fuerza, equilibrio, resistencia, coordinación, flexibilidad y ejercicio aeróbico, y adecuado a las características individuales de las personas.
La nutrición es otro factor importante y modificable que se asocia a la fragilidad, considerando una ingesta proteica ≥ 1 g/kg de peso/día, el mantenimiento del peso adecuado, un estilo de dieta saludable en forma de dieta mediterránea y nutrientes específicos, según el caso1. Se necesitan más estudios que evidencien la efectividad del binomio dieta/ nutrientes y fragilidad.
Otras medidas de intervención reconocidas son la revisión y la adecuación de la medicación, y el correcto abordaje clínico de patologías, situaciones clínicas y síndromes geriátricos que pueden afectar la situación funcional. También hay cierta evidencia del beneficio de la terapia ocupacional en ancianos frágiles en la comunidad.10
Las intervenciones multidominio combinan varias de las intervenciones mencionadas. Los resultados parecen positivos9, aunque se necesitan más estudios que evalúen su efectividad.
- •
Se recomienda la detección oportunista de fragilidad en AP en personas > 70 años
- •
Las herramientas de detección recomendadas en AP en nuestro medio son las pruebas de ejecución
- •
Es aconsejable la monitorización de las AIVD en personas > 70 años para detectar precozmente el declive funcional
- •
Ante la sospecha de fragilidad se recomienda una valoración clínica de tipo multidimensional, o en forma de VGI en los casos establecidos o más avanzados, para corroborar la fragilidad, valorar las necesidades y establecer planes de intervención adecuados e individualizados
- •
Se recomienda la actividad o el ejercicio físico, adaptados en intensidad y estructurados (multicom- ponente), como intervención principal para prevenir o retrasar la pérdida funcional en la fragilidad
- •
Otras intervenciones recomendadas son la intervención nutricional, la revisión y adecuación de la medicación, y el correcto abordaje de situaciones clínicas coincidentes
Los autores declaran no tener ningún conflicto de intereses.