La hipertensión pulmonar tromboembólica crónica (HPTEC) es un subtipo de hipertensión pulmonar (HP) caracterizada por la obstrucción mecánica de las arterias pulmonares causada por una tromboembolia pulmonar. Sin tratamiento es una enfermedad progresiva y devastadora, y es el único subgrupo de HP potencialmente curable mediante la endarterectomía pulmonar. La magnitud, así como la recurrencia de la embolia pulmonar, son determinantes y contribuyen al desarrollo de la HPTEC aun cuando está asociada solo a algunos factores trombofílicos. Una hipótesis es que la enfermedad es consecuencia de la resolución incompleta y la organización del trombo, favorecido por fenómenos de inflamación, inmunitarios y/o genéticos que promueven el desarrollo de estenosis de tipo fibroso que culminan con el remodelado vascular oclusivo de vasos proximales y distales. Los mecanismos involucrados en la fallida resolución del trombo aún no están esclarecidos. Los pacientes con HPTEC con frecuencia exhiben HP severa que no puede ser explicada por el grado de obstrucción vascular demostrada en estudios por imagen. En tales casos la arteriopatía pulmonar y las lesiones trombóticas obstructivas, distales al nivel subsegmentario, pueden contribuir al incremento fuera de proporción de las resistencias vasculares pulmonares. Los procesos que llevan al desarrollo de la arteriopatía pulmonar y los cambios microvasculares que ocurren en la HPTEC explican el comportamiento progresivo de la HP y el deterioro clínico gradual con pobre pronóstico para los pacientes, así como también la falta de correlación entre la magnitud de la obstrucción vascular y la medición de parámetros hemodinámicos, aun en ausencia de tromboembolismo venoso recurrente. Esta revisión resume los aspectos más relevantes y actuales de la patobiología y fisiopatología de la HPTEC.
Chronic thromboembolic pulmonary hypertension (CTEPH) represents a unique subtype of pulmonary hypertension characterized by the presence of mechanical obstruction of the major pulmonary vessels caused by venous thromboembolism. CTEPH is a progressive and devastating disease if not treated, and is the only subset of PH potentially curable by a surgical procedure known as pulmonary endarterectomy. The clot burden and pulmonary embolism recurrence may contribute to the development of CTEPH however only few thrombophilic factors have been found to be associated. A current hypothesis is that CTEPH results from the incomplete resolution and organization of thrombus modified by inflammatory, immunologic and genetic mechanisms, leading to the development of fibrotic stenosis and adaptive vascular remodeling of resistance vessels. The causes of thrombus non-resolution have yet to be fully clarified. CTEPH patients often display severe PH that cannot be fully explained by the degree of pulmonary vascular obstruction apparent on imaging studies. In such cases, the small vessel disease and distal obstructive thrombotic lesions beyond the sub-segmental level may contribute for out of proportion elevated PVR. The processes implicated in the development of arteriopathy and micro-vascular changes might explain the progressive nature of PH and gradual clinical deterioration with poor prognosis, as well as lack of correlation between measurable hemodynamic parameters and vascular obstruction even in the absence of recurrent venous thromboembolism. This review summarizes the most relevant up-to-date aspects on pathobiology and pathophysiology of CTEPH.
La hipertensión pulmonar tromboembólica crónica (HPTEC) es una variante distintiva de hipertensión pulmonar (HP) en cuanto a su etiología y respuesta al tratamiento1,2. Es causada por la obstrucción mecánica de las arterias pulmonares debido a una tromboembolia pulmonar aguda o de repetición, a menudo subdiagnosticada; su retraso en el diagnóstico tiene como consecuencia el desarrollo de enfermedad de vasos pequeños y HP progresiva. Es el único subgrupo (subgrupo 4) de la clasificación de HP potencialmente curable mediante un procedimiento quirúrgico denominado endarterectomía pulmonar (EAP), que consiste en la remoción de los trombos organizados y de la capa neo-íntima que recubre las arterias pulmonares obstruidas. La EAP, realizada previa selección de los pacientes y en centros de experiencia, tiene baja mortalidad perioperatoria y proporciona mejoría clínica-hemodinámica significativa y en la sobrevida de los enfermos. Sin embargo, sin intervención el pronóstico es pobre y está en función de la severidad de los cambios hemodinámicos, con una sobrevida estimada a 5 años del 10% cuando la presión media de la arteria pulmonar es mayor a 50mmHg3–5.
La verdadera incidencia y prevalencia son desconocidas; no obstante, de acuerdo con un registro del Reino Unido, se estima una incidencia de ≈5 individuos por millón/habitantes/año5. Según algunos estudios prospectivos observacionales recientes la prevalencia posterior a un evento de tromboembolismo pulmonar agudo es del 0.4% al 9.1%6–10. El amplio rango de estimaciones se ha atribuido al diseño de los estudios, a la población de pacientes analizada, a los métodos y criterios diagnósticos y a la falta de cateterismo derecho en muchos de los estudios.
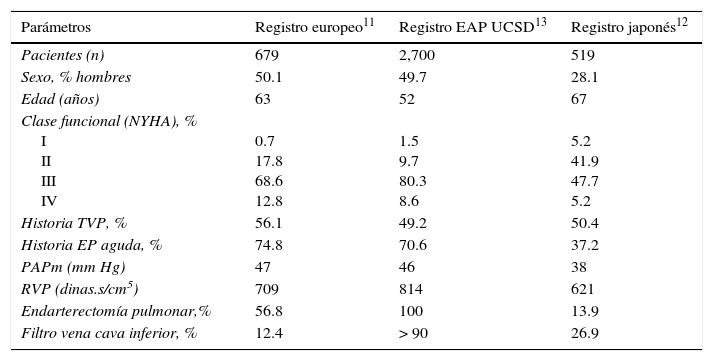
De acuerdo con un registro prospectivo internacional, la edad promedio al momento del diagnóstico es de 63 años, y los casos en edad pediátrica son raros11. Afecta ambos sexos por igual, mientras que en el registro japonés hay preponderancia de las mujeres12. Por otra parte, el registro de trombo-endarterectomías realizadas en la Universidad de California, en San Diego, que incluyó 2,700 pacientes, reportó un promedio de edad de 52 años (rango 8-88) al momento de ser intervenidos13 (tabla 1).
Principales características de pacientes incluidos en 3 registros de hipertensión pulmonar tromboembólica crónica
| Parámetros | Registro europeo11 | Registro EAP UCSD13 | Registro japonés12 |
|---|---|---|---|
| Pacientes (n) | 679 | 2,700 | 519 |
| Sexo, % hombres | 50.1 | 49.7 | 28.1 |
| Edad (años) | 63 | 52 | 67 |
| Clase funcional (NYHA), % I II III IV | 0.7 17.8 68.6 12.8 | 1.5 9.7 80.3 8.6 | 5.2 41.9 47.7 5.2 |
| Historia TVP, % | 56.1 | 49.2 | 50.4 |
| Historia EP aguda, % | 74.8 | 70.6 | 37.2 |
| PAPm (mm Hg) | 47 | 46 | 38 |
| RVP (dinas.s/cm5) | 709 | 814 | 621 |
| Endarterectomía pulmonar,% | 56.8 | 100 | 13.9 |
| Filtro vena cava inferior, % | 12.4 | > 90 | 26.9 |
EAP: endarterectomía pulmonar; EP: embolia pulmonar; PAPm: presión arterial pulmonar media; RVP: resistencia vascular pulmonar; TVP: trombosis venosa profunda; UCSD: Universidad de California en San Diego.
Puede ocurrir un largo período de meses o años entre el evento inicial de tromboembolia pulmonar que puede ser asintomático o silencioso, y la aparición de síntomas de HPTEC, descrito como período de «luna de miel». La sintomatología consiste en disnea progresiva de esfuerzo, fatiga, edema y hemoptisis, en tanto que el dolor de pecho y el síncope son poco frecuentes. Los signos de falla cardiaca derecha aparecen en fase tardía. Debido a los síntomas inespecíficos o a la ausencia de ellos al inicio, el índice de sospecha diagnóstica es bajo y no es infrecuente el retraso en su detección temprana; desafortunadamente, la mayoría de los pacientes (80%) son detectados en clase funcional avanzada iii-iv (New York Heart Association). El tiempo promedio entre el inicio de los síntomas hasta el momento del diagnóstico es de 14 meses11,13.
El diagnóstico de HPTEC puede sustentarse solo si después de 3 meses de terapia anticoagulante eficaz la presión media de la arteria pulmonar es ≥25mmHg y la presión en cuña de la arteria pulmonar ≤15mmHg, coincidiendo con al menos un defecto segmentario de perfusión pulmonar demostrado mediante estudio de gamagrafía pulmonar V/Q, tomografía del tórax multicorte o angiografía pulmonar convencional1,14–17.
Las principales características de la HPTEC, a diferencia de la hipertensión arterial pulmonar (HAP), son distribución no homogénea de la perfusión en segmentos de la vasculatura pulmonar y su asociación con la enfermedad tromboembólica venosa (ETV). Según datos del registro prospectivo internacional antes mencionado, el 74.8% de los pacientes tuvo un tromboembolismo pulmonar (TEP) agudo previo y el 54.1% tenía historia de trombosis venosa profunda11. Cabe señalar que aun cuando se ha mencionado la ausencia del perfil de riesgo clásico para ETV aguda (por ejemplo deficiencia de proteína C y proteína S, deficiencia de antitrombina iii, hiperhomocisteinemia, mutación G20210A de protrombina) en la HPTEC, existe evidencia de un estado protrombótico que está asociado con títulos elevados del anticoagulante lúpico y/o anticuerpos antifosfolípidos en el 10% al 20% de los pacientes, aumento del factor viii y del factor de von Willebrand18,19. Por otra parte, los grupos sanguíneos tipo A, B y AB (grupo no «O») son significativamente más comunes en pacientes con HPTEC vs pacientes con HAP (88% vs 56%)20. Se ha señalado que los portadores del grupo no «O» tienen concentraciones más elevadas de factor von Willebrand y factor viii, ambos considerados factores de riesgo para ETV21,22 y HPTEC23. De acuerdo a un estudio que incluyó 305 pacientes seguidos de manera prospectiva, publicado por Pengo et al., el análisis multivariado señaló que la edad más joven (RR 1.79 por década, IC 95%: 1.23-2.56), embolia pulmonar previa (RR 19.0, IC 95%: 4.5-79.8) y su presentación idiopática o «no provocada» (RR 5.70, IC 95%: 1.41-22.97), así como defectos de perfusión extensos (RR 2.22, IC 95%: 1.49-3.31), estuvieron asociados con riesgo incrementado para HPTEC8.
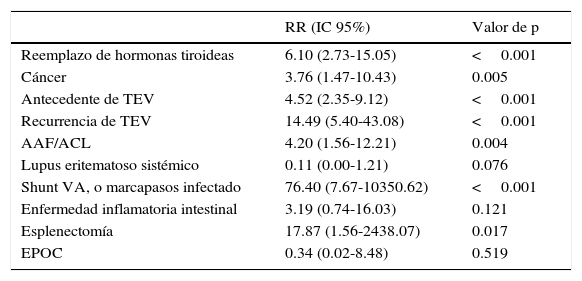
Otros factores asociados con mayor incidencia y pobre pronóstico de la HPTEC son la enfermedad inflamatoria intestinal, esplenectomía y derivaciones ventrículo-atriales para el tratamiento de la hidrocefalia, o cables de marcapasos infectados24–26. En una base de datos retrospectiva de 3 centros europeos de EAP se compararon los datos de 687 casos prevalentes de HPTEC con los encontrados en pacientes con HP precapilar no tromboembólica de dichos centros. Se informó de una asociación más frecuente con HPTEC en aquellos casos de derivaciones ventrículo-atriales y marcapasos infectados, esplenectomía, tromboembolismo venoso (TEV) previo, TEV recurrente, y anticoagulante lúpico/anticuerpos anti-fosfolípidos. Además, la terapia de sustitución hormonal tiroidea y el antecedente de cáncer surgieron como nuevos factores de riesgo para HPTEC (tabla 2). Los resultados de dicha base de datos corroboraron el conocimiento que se tiene sobre factores de riesgo para HPTEC e identificaron la terapia de sustitución tiroidea y el antecedente de cáncer como nuevas condiciones médicas asociadas. Se ha descrito que el tratamiento con levotiroxina aumenta las concentraciones del factor de von Willebrand y reduce el tiempo para la formación del trombo plaquetario in vitro, lo que explica posiblemente la trombogenicidad20.
Razón de momios, ajustada por edad y sexo, para el riesgo de desarrollar hipertensión pulmonar tromboembólica crónica
| RR (IC 95%) | Valor de p | |
|---|---|---|
| Reemplazo de hormonas tiroideas | 6.10 (2.73-15.05) | <0.001 |
| Cáncer | 3.76 (1.47-10.43) | 0.005 |
| Antecedente de TEV | 4.52 (2.35-9.12) | <0.001 |
| Recurrencia de TEV | 14.49 (5.40-43.08) | <0.001 |
| AAF/ACL | 4.20 (1.56-12.21) | 0.004 |
| Lupus eritematoso sistémico | 0.11 (0.00-1.21) | 0.076 |
| Shunt VA, o marcapasos infectado | 76.40 (7.67-10350.62) | <0.001 |
| Enfermedad inflamatoria intestinal | 3.19 (0.74-16.03) | 0.121 |
| Esplenectomía | 17.87 (1.56-2438.07) | 0.017 |
| EPOC | 0.34 (0.02-8.48) | 0.519 |
p≤0.05 tiene significación estadística.
AAF/ACL: anticuerpo antifosfolípido/anticoagulante lúpico; EPOC: enfermedad pulmonar obstructiva crónica. TEV: tromboembolismo venoso; VA: ventrículo-auricular.
Fuente: Bonderman et al.20.
Basado en esta información parece apropiado considerar a la HPTEC como la secuela de un tromboembolismo pulmonar clásico modificado, debido a la resolución incompleta y organización del trombo, y que quizás esté favorecido por fenómenos de inflamación, inmunitarios y/o genéticos, lo que promueve el desarrollo de obstrucciones fibrosas que culminan con el remodelado vascular de vasos proximales y distales27,28.
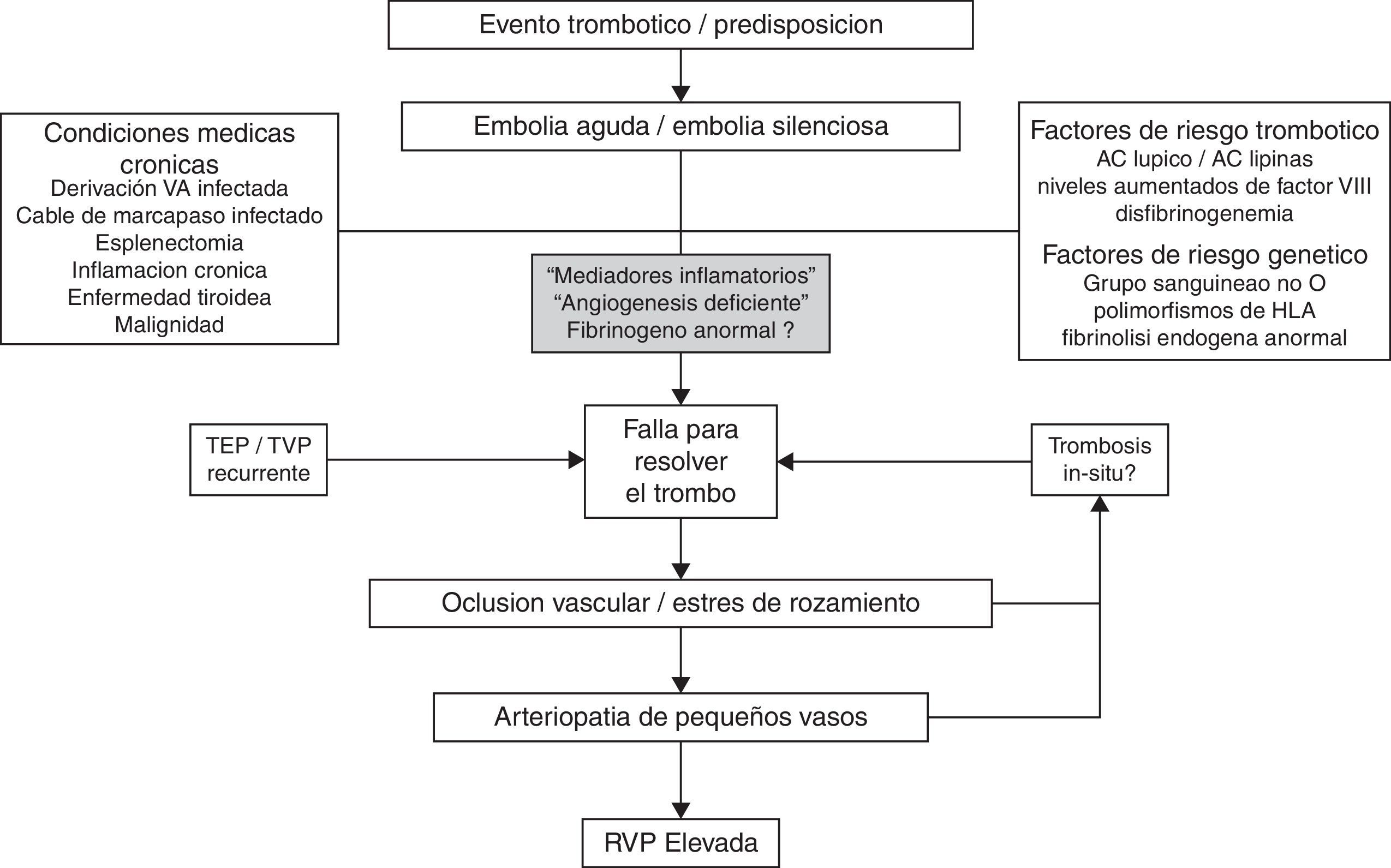
La HPTEC se puede describir como un padecimiento vascular pulmonar dual o compartimentado debido a la obstrucción de las arterias pulmonares centrales, con resolución incompleta de los trombos, combinado con enfermedad de vasos pequeños que afecta las arteriolas y los vasos precapilares<100μm de diámetro. La incorporación del tromboémbolo a la pared vascular promueve la formación de tejido fibroso que sustituye a la íntima, ocasionando estenosis de grado variable, dando la apariencia angiográfica de «redes vasculares» y «bandas». En consecuencia, ello provoca redistribución del flujo hacia el territorio vascular no obstruido que lo expone a flujo y presión aumentada y, por ende, a incremento en fuerzas de fricción, que contribuye al desarrollo de arteriopatía pulmonar en pequeños vasos favorecido por la presencia potencial de mediadores de inflamación29–33. Lo anterior provoca incremento de las RVP con HP progresiva, y finalmente disfunción y falla del ventrículo derecho (fig. 1). Se desconoce si la magnitud de la arteriopatía pulmonar guarda relación con el tiempo que el paciente ha tenido HP antes del diagnóstico de HPTEC. Sin embargo, se ha reportado que la incidencia de enfermedad de vasos pequeños puede ser mayor en presencia de condiciones médicas asociadas (por ejemplo esplenectomía, catéter venoso central permanente, estados inflamatorios crónicos de bajo grado) y es predictor de pobre sobrevida24.
Patobiología de la hipertensión pulmonar tromboembólica crónica.
Fuente: modificado de Marshall et al.71.
La arteriopatía pulmonar consiste en la extensión distal de la muscularización de pequeñas arteriolas, fibroelastosis concéntrica de la lámina íntima, fibrosis excéntrica de la íntima, hipertrofia de la capa media y lesiones vasculares complejas aisladas. De acuerdo con una revisión de material de autopsia y patología quirúrgica de la Universidad de California, en San Diego, de 1990-1998, en 5/22 pacientes se identificaron lesiones vasculares complejas y la presencia de trombos recanalizados, sin aparente correlación entre sitios con o sin obstrucción proximal34.
Los cambios microvasculares han sido atribuidos a un estado de disfunción endotelial, caracterizado por acumulación anormal de dimetil arginina asimétrica (ADMA), inhibidor competitivo de la sintetasa del óxido nítrico. Se ha descrito además proliferación de células endoteliales y células de músculo liso, migración de fibroblastos y células de músculo liso e inhibición de la apoptosis de células de músculo liso vascular y de trombosis in situ. El remodelado vascular se caracteriza entonces por el engrosamiento de las 3 capas de la pared vascular con hipertrofia e hiperplasia del tipo celular predominante que la compone (por ejemplo células endoteliales, células de músculo liso y fibroblastos) y puede involucrar además el cúmulo de células progenitoras endoteliales35. La naturaleza progresiva de la HPTEC se puede explicar por estos cambios microvasculares e histopatológicos, aun sin la recurrencia de eventos tromboembólicos, que se asemejan a los mecanismos descritos en la HAP con la formación de lesiones vasculares complejas en ambas condiciones34.
Los estudios histopatológicos más recientes han confirmado estas observaciones destacando la presencia de hiperplasia concéntrica severa de la íntima en áreas vasculares «abiertas» (circulación no obstruida) y, por otra parte, cambios vasculares leves y escasos vasos sanguíneos en áreas distales a una arteria pulmonar ocluida36.
El sistema endotelina (ET), como en otros modelos de hipertensión pulmonar severa, se encuentra activado, y puede contribuir a la vasoconstricción y al remodelado vascular. Existe aumento en la producción sistémica de ET y en la expresión del receptor ETB en células de músculo liso. También se ha descrito la sobreestimulación de los receptores de endotelina, distal a la obstrucción vascular en el modelo experimental animal37–40. Reesink et al. estudiaron la correlación entre la concentración de ET-1 y variables clínico-hemodinámicas pre y postendarterectomía. Las concentraciones de ET-1 estuvieron aumentadas en 35 pacientes con HPTEC comparado con controles sanos (1.62±0.21pg/ml−1 vs 0.75±0.06pg/ml−1, p<0.02); además, encontraron correlación con la PAPm (r=0.70), índice cardiaco (r=–0.76), RPT (r=0.72), saturación de oxígeno en sangre venosa mezclada (r=–0.87) y prueba de caminata de 6 minutos (r=–0.59; p<0.005). Tres meses después de la EAP la concentración de ET-1 había disminuido (p<0.002), sin embargo aquellos pacientes con concentración preoperatoria más elevada (>1.77pg/ml) tuvieron peor desenlace postoperatorio y mayor propensión a desarrollar HP persistente post-EAP40.
Resolución del trombo en las venas periféricasEn sujetos sanos los trombos venosos son eliminados mediante complejos procesos de degradación y organización del trombo, incluyendo el remodelado adaptativo y la recanalización del vaso, comparable a lo que ocurre durante los procesos de cicatrización y formación de tejido de granulación. En la remoción del trombo desempeña un papel fundamental el reclutamiento de leucocitos y la angiogénesis. Al inicio los neutrófilos promueven fibrinólisis y colagenólisis dentro del trombo, seguido por la incorporación de los monocitos, que mediante la expresión de la proteína quimiotáctica de los monocitos tipo-1 (MCP-1), factores de crecimiento (VEGF, bFGF, TGF-α y β-1), proteasas (activador de plasminógeno tipo urocinasa) y metalo-proteinasas de matriz contribuyen a la reorganización del trombo41,42. Por otra parte, durante la angiogénesis normal los vasa vasorum y los vasos colaterales preexistentes se abren, y en la fase temprana de la disolución los trombos se contraen y retraen de la pared vascular formando verdaderos «canales vasculares» recubiertos de células, entre el trombo y la íntima de la vena43. La presencia en el trombo organizado del factor de crecimiento del endotelio vascular (VEGF) y factor de crecimiento de fibroblastos (FGF), ambos considerados reguladores positivos de la neovascularización, promueven la activación del endotelio, y se ha sugerido que el aumento de la expresión de estos factores de crecimiento puede tener algún papel en la eliminación y recanalización del trombo44–46.
Resolución deficiente del trombo en la circulación pulmonarSe ha descrito que la circulación pulmonar posee una extraordinaria capacidad fibrinolítica47,48 y que la resolución de los tromboémbolos pulmonares en etapa aguda ocurre generalmente en un lapso promedio de 6 meses49; sin embargo, en 0.1% al 3.8% de los casos los tromboémbolos se someten a procesos de organización transformándose en tejido fibroso adherente que ocasiona obstrucción permanente de la vasculatura pulmonar8. Intentar reproducir los mecanismos de trombosis y resolución del trombo de forma experimental en el modelo animal con embolizaciones repetidas ha resultado infructuoso, debido a que estos son eliminados rápidamente. No obstante, un modelo porcino desarrollado a partir de la ligadura de la arteria pulmonar izquierda y embolizaciones repetidas de histoacryl en el lóbulo inferior derecho, por un periodo de 5 semanas, logró reproducir los cambios vasculares de la HPTEC y parece ser promisorio50. Por otra parte, la ligadura de vena cava en el modelo murino para reproducir la trombosis venosa profunda, y mediante deleción genética de la molécula de adhesión plaquetaria tipo-1 de células endoteliales, demostró el papel decisivo que ejerce la migración leucocitaria y angiogénesis en la resolución del trombo51. A pesar de la evidencia, el estudio de la trombosis y la resolución del trombo en el modelo experimental animal e in vitro tiene sus limitaciones.
InflamaciónSe ha señalado que el factor etiológico más importante en la progresión de la tromboembolia pulmonar a la HPTEC es la magnitud del trombo inicial y el embolismo pulmonar recurrente, sin embargo los mecanismos involucrados en la persistencia y progresión del trombo-fibroso aún es materia de especulación. Existe un interés creciente en el estudio de la inflamación, e incluso de la infección en el desarrollo de la HPTEC. Se ha reportado que la presencia de inflamación puede alterar los mecanismos normales de desintegración del trombo (trombosis inflamatoria). Además, se ha demostrado que los marcadores inflamatorios, como la proteína C-reactiva, MCP-1, factor de necrosis tumoral-α y proteína-10 inducida por interferón-γ (IP-10) están aumentados en el plasma y material quirúrgico de EAP en pacientes con HPTEC, y la MCP-1 mostró una correlación positiva con la resistencia vascular pulmonar52,53. Por otra parte, se ha observado una prevalencia incrementada de enfermedades inflamatorias crónicas19,20, así como la presencia del antígeno de estafilococo en pacientes con HPTEC con antecedente de derivación ventrículo-atrial e implante de marcapasos. Bonderman et al. han informado de la asociación de infección por estafilococo en trombos de pacientes con HPTEC27; además, señalaron que la infección estafilocócica retrasó la resolución del trombo y simultáneamente aumentó la expresión del factor de transformación del crecimiento-β y del factor de crecimiento del tejido conectivo en un modelo murino27. En pacientes con HPTEC se ha descrito la presencia de abundantes células inflamatorias (por ejemplo CD45+) y células secretoras de colágeno en la pared vascular34,36,54. Zabini et al. informaron de que la IP-10, una citocina pro-inflamatoria, causa disfunción en células endoteliales de arterias pulmonares en humanos55. Estos mismos autores, más recientemente, utilizaron el método translacional y analizaron una muestra de tejido de EAP, suero de pacientes con HPTEC y HAP, además compararon las características clínico-hemodinámicas de los pacientes con controles sanos y también realizaron ensayo in vitro. En sus hallazgos reportaron aumento de la IP-10 tanto en la concentración de la proteína y mARN en tejido de EAP como en el suero de pacientes con HPTEC. Encontraron una correlación negativa significativa con el gasto cardiaco (r=–0.71, p=0.002), índice cardiaco (r=–0.54, p=0.03) y caminata de 6 minutos (r=–0.66, p=0.01) en pacientes con HPTEC pero no con HAP idiopática. También señalaron que el remodelado de arterias pulmonares obstruidas podría ser mediado por la IP-10 al facilitar la migración de fibroblastos in vitro56. Se especula que la IP-10 local pueda atraer fibroblastos desde la adventicia, o quizá fibrocitos circulantes hacia el trombo, y al inducir acumulación de células secretoras de colágeno le confiere mayor rigidez y contribuye a su crecimiento56.
Fibrinólisis anormalEntre los mecanismos que contribuyen a la resolución incompleta del trombo se ha señalado también a la fibrinólisis anormal, expresada por un aumento significativo del inhibidor del activador del plasminógeno tipo-1 en las células endoteliales en contacto con la superficie del trombo y disminución del antígeno del activador del plasminógeno tisular (t-PA)57,58. La conversión del fibrinógeno por la trombina para formar fibrina es un paso importante en la conformación y estructura del coágulo. El aumento en su concentración es considerado un factor de riesgo para enfermedades vasculares trombóticas, aun cuando los mecanismos involucrados en su fisiopatología no han sido totalmente esclarecidos. Se ha descrito que las anormalidades estructurales o funcionales del fibrinógeno pueden conferir resistencia del coágulo de fibrina a la fibrinólisis59. En 2006 Morris et al60. describieron una relativa resistencia de la fibrina a la lisis por la plasmina in vitro, aunque el efecto fue modesto y Miniati et al61., en 2010, corroboraron la disminución en la degradación de la fibrina en pacientes con HPTEC, HAP y también, aunque en menor grado, en pacientes con tromboembolia pulmonar sin HP comparado con sujetos sanos. En este contexto han sido reportadas variantes anormales del fibrinógeno62,63 y cierta susceptibilidad genética, con incremento del polimorfismo del fibrinógeno Aα Thr312Ala, lo que modifica la estructura de la fibrina del coágulo mediante aumento en las uniones de las cadenas alfa e incrementa la resistencia a la lisis. Morris et al., en 2009, informaron de la presencia de mutaciones del fibrinógeno (dis-fibrinogenemias) en 5 de 33 (15%) pacientes con HPTEC en quienes el análisis funcional demostró alteraciones en la estructura del polímero de fibrina y/o lisis62. Los autores señalan que las mutaciones en la molécula de fibrina pueden ocasionar fibras de fibrina delgada que producen coágulos transparentes más resistentes a la lisis, comparado con los coágulos opacos que poseen fibras más gruesas. Es interesante señalar que las variantes del fibrinógeno no fueron observadas en todos los pacientes, por lo tanto es probable que otras condiciones clínicas contribuyan en la progresión de la enfermedad. Además, ser portador de la mutación no fue suficiente para desarrollar HPTEC, sino que requirió la combinación de TEP aguda (por ejemplo cirugía ortopédica y factor de riesgo trombogénico genético) y resistencia a la fibrinólisis63–65.
Por otra parte, la presencia de miofibroblastos en el trombo organizado, consideradas células progenitoras mesenquimatosas pluripotenciales, ha sido descrita en tejidos endarterectomizados de pacientes con HPTEC; no obstante, se desconoce el papel que desempeñan en la reparación tisular de tipo fibroso66–68. Aun cuando se requiere de más estudios, estas observaciones apuntan a diversos aspectos fisiopatológicos que podrían contribuir a la falta de disolución del trombo en pacientes con HPTEC.
Angiogénesis deficiente o defectuosaDurante la fase de resolución temprana del trombo las alteraciones en la angiogénesis constituyen un mecanismo biológico importante en el proceso de remodelado vascular después del TEV69. Estudios en animales han informado de que la recanalización de la pared venosa puede ocurrir en las primeras 24 horas de la formación del coágulo. En el proceso de organización del trombo los reguladores positivos de angiogénesis (por ejemplo VEGF y bFGF), en presencia de un endotelio activado, penetran en el trombo y forman espacios recubiertos de células con apariencia de canales vasculares; sin embargo, el hallazgo de células secretoras de colágeno en el tejido endarterectomizado de pacientes con HPTEC sugiere que estas podrían contribuir a crear un microambiente dentro del trombo organizado opuesto al proceso angiogénico normal. La disminución en la expresión de genes que favorecen angiogénesis y la disfunción endotelial pueden, en conjunto, ocasionar falla en la recanalizacion y resolución del trombo45,66.
A pesar del papel relevante que desempeña la microcirculación en la HPTEC, nuestro conocimiento acerca de la histopatología puede considerarse aún rudimentario, y hasta fecha reciente limitado a la circulación precapilar pulmonar34,70–72. Dorfmüller et al73. describieron el análisis histológico de los pulmones de 16 pacientes con HPTEC que recibieron trasplante pulmonar y un caso resultado de autopsia, de ellos, 8 casos considerados inoperables y 9 casos con HP persistente después de la endarterectomía. El reporte describe anormalidades en el lecho capilar similar a lo observado en la hemangiomatosis capilar pulmonar, así como de la circulación poscapilar con involucro de las venas pulmonares. Además de la presencia de shunts arteria bronquial-vena pulmonar descritos con anterioridad, el grado de remodelado y fibrosis venosa y de los cambios microvasculares de tipo hemangiomatoso fue de moderada intensidad, y de menor magnitud que lo observado en la enfermedad veno-oclusiva pulmonar. Aún se desconoce el significado clínico de este hallazgo y si existe la posibilidad de involución, como ha sido descrito con los vasos sistémicos bronquiales al eliminar la obstrucción luego de EAP exitosa74. Por otra parte, se especula con que los hallazgos microvasculares, en particular el remodelado venoso poscapilar y los shunts bronquio-venosos pulmonares, podrían contribuir al daño por reperfusión y a la hemorragia pulmonar que se puede presentar postendarterectomía75–78.
Finalmente, los pacientes con HPTEC con frecuencia exhiben HP severa que no puede ser explicada por el grado de obstrucción vascular demostrado en estudios por imagen. En tales casos la enfermedad de vasos pequeños y las lesiones trombóticas obstructivas, distales al nivel subsegmentario, contribuyen al incremento fuera de proporción de las RVP, y son considerados malos candidatos quirúrgicos. Los procesos que llevan al desarrollo de la arteriopatía pulmonar y los cambios microvasculares que ocurren en la HPTEC explican el comportamiento progresivo de la HP y el deterioro clínico gradual con pobre pronóstico para los pacientes, así como también la falta de correlación entre la magnitud de la obstrucción vascular y la medición de parámetros hemodinámicos, aun en ausencia de tromboembolismo pulmonar de repetición33,70. Una vez establecida la arteriopatía pulmonar, el paciente con HPTEC puede llegar a ser excluido de cirugía, aun en centros con experiencia en EAP o, por otra parte, persistir con HP luego de la endarterectomía pulmonar.
ConclusionesLa HPTEC es una enfermedad compleja y distinta de otras formas de hipertensión pulmonar en cuanto a su etiología y respuesta al tratamiento. En su etiopatogenia se ha descrito el antecedente de TEP y la existencia de un estado protrombótico que lo diferencia de la HAP; no obstante, los procesos fisiopatológicos implicados en la resolución incompleta y organización del trombo aún no han sido completamente esclarecidos. Diversas condiciones médicas con un componente inflamatorio están asociadas a HPTEC y tienen un impacto negativo en el pronóstico. Aunado al desequilibrio entre coagulación y fibrinólisis y angiogénesis defectuosa con recanalización incompleta del trombo, se ha señalado a la inflamación asociada a la trombosis (trombosis inflamatoria) como un mecanismo fisiopatológico crucial en la HPTEC. El papel de la inflamación en la fisiopatología de la HAP se ha documentado extensamente en el modelo experimental y en la clínica, sin embargo en la HPTEC aún es impreciso. Otra alternativa fisiopatológica son las variantes anormales del fibrinógeno y su fragmentación anormal por activadores del plasminógeno, sin embargo las mutaciones no ocurren en todos los casos, y ser portador no es suficiente para desarrollar la enfermedad, por lo que se requiere de otros factores precipitantes.
Es evidente que a pesar de los avances logrados nuestro conocimiento de la fisiopatología de la HPTEC es limitado. La dificultad para crear un modelo experimental animal que permita reproducir la enfermedad ha sido factor determinante. Indudablemente se requiere mayor investigación para comprender mejor los mecanismos que ocurren durante el remodelado vascular obstructivo, y de manera muy importante desarrollar métodos para prevenir y predecir la enfermedad microvascular, que es el factor principal en la progresión de la HPTEC y del pronóstico después de la endarterectomía pulmonar.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses relacionado con este artículo.