Los síndromes coronarios agudos que pueden observarse en el posoperatorio de una intervención cardiovascular son esencialmente dos: el infarto agudo del miocardio y la angina inestable.
Infarto perioperatorio
Etiología
Durante la cirugía cardiaca, a pesar de la protección miocárdica intraoperatoria y la mejoría en la técnica quirúrgica, se puede producir cierto grado de aturdimiento miocárdico debido a la liberación de citocinas proinflamatorias y la apoptosis. Sin embargo del 2% a 15% de los pacientes sometidos a un procedimiento de revascularización miocárdica sufren infarto del miocardio perioperatorio; la incidencia de esta complicación es menor en una persona con diagnóstico preoperatorio de angina estable y la mayor frecuencia se identifica en individuos con síndrome coronario agudo o pacientes inestables.
Los pacientes sometidos a revascularización miocárdica con colocación de injertos aortocoronarios conforman la mayor parte de los casos; sin embargo este problema también se presenta en sujetos intervenidos quirúrgicamente por cardiopatías distintas de la isquémica debido a la ateroesclerosis coronaria.
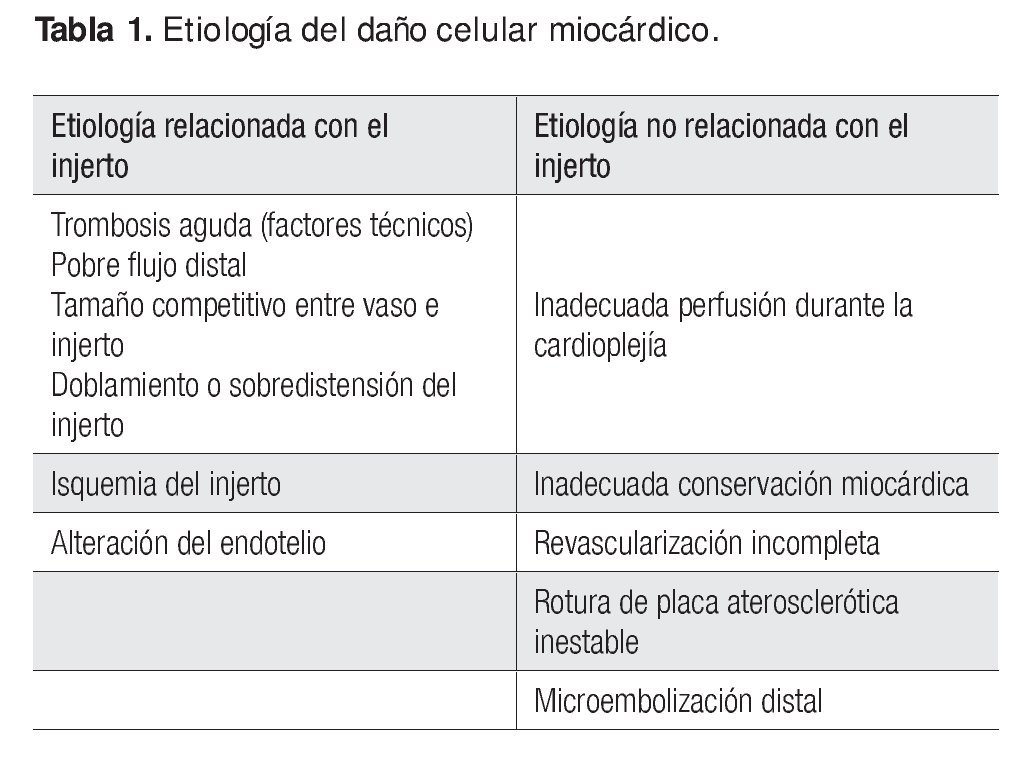
La patogenia del daño celular miocárdico posterior a la operación cardiaca ha sido objeto de distintos estudios; se considera que la causa puede relacionarse con el injerto o con otras anomalías no relacionadas (Tabla 1).
Daño celular relacionado con el injerto
• Trombosis aguda de injerto: se considera la causa más frecuente y se vincula con diversos factores técnicos, entre ellos un calibre pequeño del vaso revascularizado, cuyo resultado es un pobre flujo distal; la desproporción del tamaño y el flujo competitivo entre el injerto y el vaso nativo, lo que genera flujo turbulento y favorece la trombosis; el doblamiento o la sobredistensión del injerto, que dan lugar a la reducción del flujo.
• Isquemia del injerto.
• Lesión del endotelio como resultado del traumatismo mecánico; esta pérdida del endotelio promueve la adhesión plaquetaria y trombosis, así como el vasoespasmo resultante por disminución de los niveles del óxido nítrico.
Daño celular miocárdico no relacionado con el injerto
• Inadecuada perfusión durante la cardioplejía y conservación miocárdica intraoperatoria subóptima debido a que ambas desencadenan la liberación de mediadores de la inflamación del tipo interleucina 1α, 1β, interleucina 6 , interleucina 8 y factor de necrosis tumoral α, que puede precipitar la cascada de la apoptosis celular.
• Revascularización incompleta.
• Rotura de una placa aterosclerótica inestable con la subsecuente oclusión trombótica coronaria; asimismo, se han observado roturas de placas con microémbolos distales, casi siempre compuestos por agregados plaquetarios y material hialino, y de la placa aterosclerótica, incluidos cristales de colesterol.
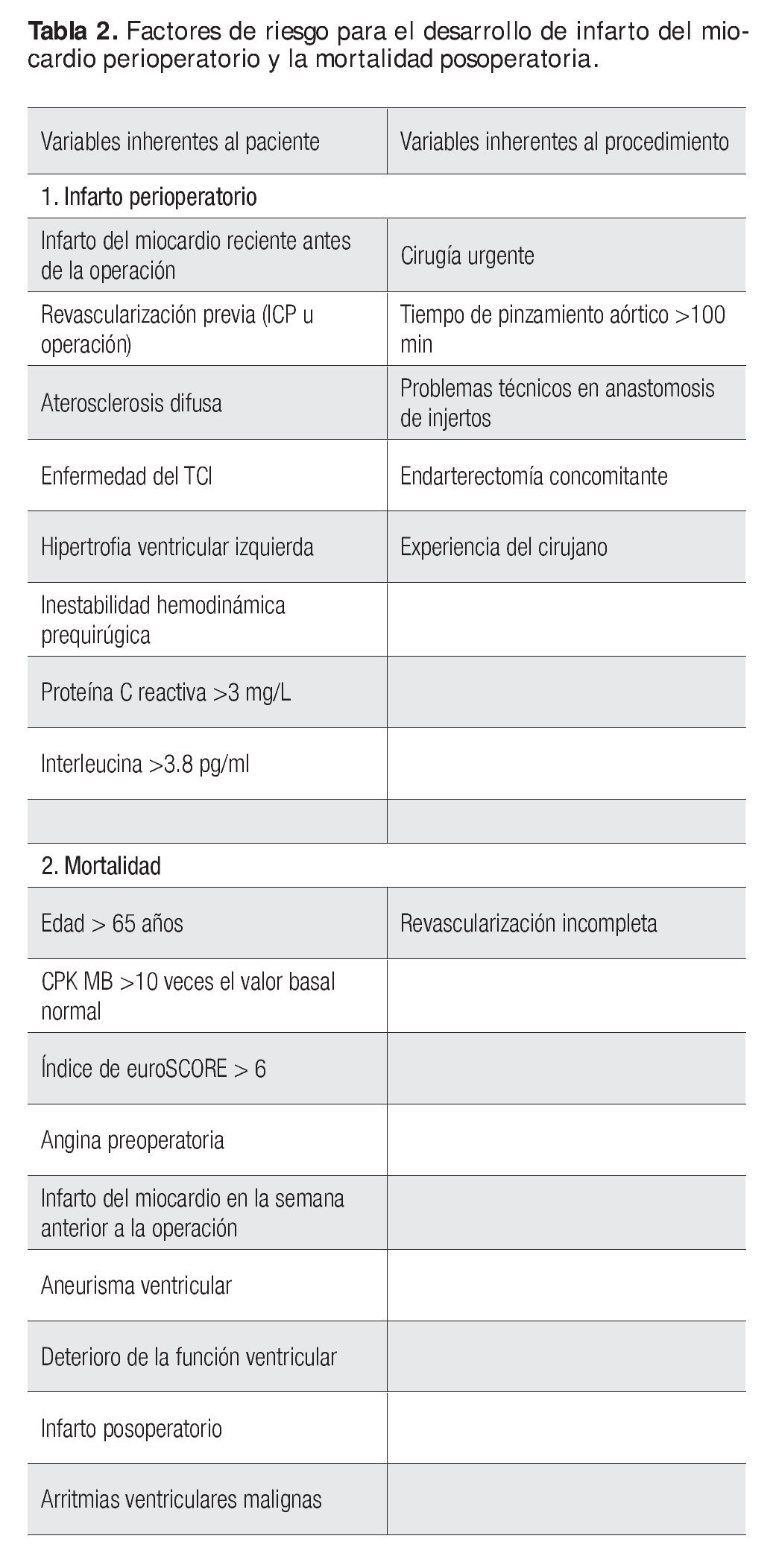
En diferentes estudios, con base en análisis de regresión multivariado, se han descrito factores de riesgo independiente para el desarrollo de infarto del miocardio perioperatorio, los cuales incluyen sobre todo tiempo de pinzamiento aórtico > 100 min, debido a que se ha vinculado con concentraciones elevadas de citocinas; operación urgente; infarto del miocardio reciente (dentro de la semana anterior a la intervención); antecedente de revascularización (angioplastía coronaria transluminal percutánea o puentes aortocoronarios); aterosclerosis difusa de las arterias coronarias distales; problemas técnicos relacionados con las anastomosis de los injertos, mayores necesidades de oxígeno del miocardio como en la hipertrofia ventricular izquierda; endarterectomía; enfermedad grave del tronco común izquierdo; trastornos hemodinámicos durante el periodo posoperatorio; y experiencia del cirujano.
En fecha reciente ha cobrado especial interés la determinación de los niveles de proteína C reactiva, tras considerar que ésta induce la síntesis del factor tisular de monocitos y del inhibidor del activador del plasminógeno 1 (marcador de aterotrombosis); las cifras > 3 mg/L parecen tener un efecto como factor pronóstico en pacientes sometidos a una operación cardiaca (p = 0.04). Es el mismo caso de la interleucina 6, que posee efectos procoagulantes al estimular la liberación de la interleucina 8 y fibrinógeno, entre otras acciones; mediante curva ROC se ha considerado un punto de corte de 3.8 pg/ml.
Pronóstico
El Sistema Europeo para la Evaluación del Riesgo de Cirugía Cardiaca (euroSCORE) es un sistema predictor de mortalidad e identifica tres tipos de factores de riesgo: factores relacionados con el paciente (edad > 60 años, género, enfermedad pulmonar obstructiva crónica, enfermedad arterial periférica, disfunción neurológica, operación cardiaca previa, creatinina sérica > 200 μmol/L, endocarditis activa y estado preoperatorio crítico); factores cardiacos (angina inestable o nitratos intravenosos, fracción de expulsión ventricular izquierda <30%, infarto del miocardio reciente, presión sistólica de la arteria pulmonar > 60 mmHg); y factores relacionados con la intervención (operación de urgencia, operación con revascularización miocárdica, procedimiento de aorta torácica, operación por rotura septal posinfarto). El resultado del índice euroSCORE pronostica la mortalidad estimada: cuanto mayor sea la puntuación resultante, mayor será la mortalidad estimada (se considera alto riesgo si el puntaje es > 6). Esta escala se encuentra bien validada y por ello algunos autores han comparado su resultado con los niveles de troponina I; por consiguiente los pacientes que sufren infarto del miocardio perioperatorio y tienen concentraciones de troponina I muy elevadas se consideran de alto riesgo y necesitan tratamientos radicales para disminuir la incidencia de episodios adversos. Sin lugar a duda, aun cuando este índice se encuentra ya validado, existe la necesidad de diseñar nuevos instrumentos que incluyan, además de las variables inherentes al pacientes como el euroSCORE, biomarcadores de inflamación y probablemente también metabólicos (proteína C reactiva e interleucinas, hemoglobina glicada, entre otros), así como variables inherentes al procedimiento (características anatómicas de las arterias coronarias, dificultades técnicas quirúrgicas, etcétera.), de tal modo que sea posible identificar a los sujetos de alto riesgo de infarto perioperatorio e instituir las medidas preventivas o los tratamientos oportunos.
De los pacientes sometidos a revascularización miocárdica, se considera que al año cerca del 15 al 20% de los injertos se habrán concluido. Entre uno y seis años después de la operación de injerto aortocoronario, el índice de oclusión anual es del 1% al 2%, con posterior incremento del 4% al 6% por año. Después de diez años, sólo el 60% de los injertos venosos permanece permeable. En aquellos pacientes con un procedimiento cardiaco, y que además experimentaron infarto del miocardio perioperatorio, la mortalidad hospitalaria es del 10% al 15% mayor que en aquellos que no sufrieron infarto. Además, a los dos años tras la operación, la probabilidad de permanecer libre de episodios cardiovasculares es del 51% en personas que presentaron infarto perioperatorio comparado con 96% en aquéllos sin esta complicación.
Las características de los pacientes que incrementan el riesgo de muerte a corto plazo, después de un infarto del miocardio perioperatorio, incluyen edad > 65 años, angina inestable preoperatoria, infarto del miocardio durante la semana anterior a la operación, aneurisma ventricular izquierdo, trastorno de la conducción interventricular y necesidad de reoperación por hemorragia. Alrededor de las dos terceras partes de la mortalidad posoperatoria se deben al fracaso de la función de bomba y la otra tercera parte es consecuencia de taquiarritmias ventriculares malignas. El infarto del miocardio posoperatorio también tiene efecto adverso sobre el pronóstico a largo plazo, en particular si se vincula con revascularización incompleta y función ventricular izquierda deprimida. En la Tabla 2 se describen los factores relacionados con la mortalidad en pacientes posoperados de cirugía cardiaca.
Criterios diagnósticos
La variabilidad en la frecuencia del infarto perioperatorio notificada por los diferentes estudios puede deberse a la dificultad para establecer el diagnóstico y el tiempo de presentación del episodio después de la intervención. Se considera como infarto perioperatorio aquel que se presenta durante el procedimiento quirúrgico y hasta 30 días después de éste. Aun cuando, de acuerdo con la clasificación de la definición universal del infarto del miocardio publicada en el 2007, se considera un infarto tipo 1 cuando se presenta en forma espontánea debido a un episodio coronario primario por rotura o erosión de la placa, y al infarto tipo 2 cuando éste es consecuencia del desequilibrio en el aporte-demanda prolongado, la frecuencia de estas causas como origen del infarto en el contexto quirúrgico se desconoce. Por lo tanto, cuando un infarto se vincula con una operación de revascularización miocárdica, se considera un infarto tipo 5, en el cual también se incluyen las posibles diferentes etiologías vinculadas con el procedimiento (daño por manipulación, inadecuada cardioprotección, disección, embolismo microvascular, etcétera). En esta definición universal se describen los siguientes criterios diagnósticos para su identificación:
• Elevación de marcadores de necrosis miocárdica
• ≥ 5 veces el percentil 99% del valor basal normal
• Cambios electrocardiográficos:
• Ondas Q de novo
• BRIHH
• Evidencia angiográfica de oclusión del injerto o arteria nativa revascularizada o no revascularizada
• Pérdida de tejido viable de nueva aparición: sea por imágenes ecocardiográficas, medicina nuclear o resonancia magnética.
Electrocardiograma
Los cambios electrocardiográficos que se observan en el infarto perioperatorio son similares a los que se presentan en otras anomalías. No obstante, en personas sometidas a una intervención cardiaca, los cambios en la morfología de las ondas T y segmento ST también se presentan por otras causas, sin que su aparición sea dato inequívoco de un compromiso circulatorio en el lecho coronario. Por lo tanto, los criterios de mayor peso considerados hasta este momento son la presencia de ondas Q de novo, así como el bloqueo de rama izquierda de nueva aparición, por lo que es preciso hacer énfasis en el análisis comparativo con los trazos electrocardiográficos con los que cuente el paciente antes de la operación. Para considerar como significativa la presencia de ondas Q, éstas deben tener una duración de 0.02 s en las derivaciones V2 y V3, o bien la presencia de ondas QS en estas mismas derivaciones con una duración de 0.03 s y una profundidad mayor de 0.1 mV en el resto de las derivaciones. La presencia de ondas Q de novo se ha relacionado con un peor pronóstico; en el estudio CASS se observó que los pacientes que presentaron esta alteración tenían un incremento de la mortalidad intrahospitalaria (9.6% vs 1.0% de los paciente que no lo presentaron). Resultados similares se comunicaron en el estudio BARI, pero con incremento de la mortalidad a cinco años (8.5% en pacientes con cambios nuevos en el ECG vs 3.7% sin cambios, con riesgo ajustado de 2.6, p = 0.04). Diferentes estudios informaron que la presencia de cambios en el segmento ST, sobre todo elevación del segmento, se vinculó con falla de los puentes coronarios. En realidad, Alter y colaboradores señalaron que la elevación del segmento ST tenía una sensibilidad de 0.69, especificidad de 0.70, valor predictivo positivo de 0.53 y valor predictivo negativo de 0.83 para diagnosticar apropiadamente la isquemia miocárdica posoperatoria. Aun cuando la sensibilidad y especificidad son bajas, diferentes estudios consideran estos cambios como criterios de sospecha de isquemia miocárdica.
Biomarcadores
La necrosis miocárdica conlleva la liberación de diferentes proteínas al torrente sanguíneo, como CK, CK-MB, DHL y troponina I y T, que se liberan al momento de la manipulación quirúrgica. Se ha demostrado que la elevación de biomarcadores de necrosis miocárdica se relaciona con una morbimortalidad significativamente mayor, tanto a corto, mediano y largo plazos (seis meses, uno, tres y hasta cinco años). Klatte y colaboradores demostraron en el estudio GUARDIAN que la magnitud de la elevación de CPK MB era directamente proporcional al incremento de la mortalidad a seis meses en 2 918 individuos sometidos a revascularización, con una elevación <5 veces del valor basal, la mortalidad fue menor del 3.4%, de cinco a seis veces fue de 5.8%, de 10 a 20 veces fue de 7.8% y >20 veces fue de 20.2%, incluso ajustado a posibles factores de confusión. Brener y colaboradores publicaron resultados similares en 3 812 individuos sometidos a procedimientos de revascularización quirúrgica; la elevación de CPK MB > 10 veces fue un predictor independiente de muerte, con un cociente de riesgo de 1.3 (IC 95%, 1.1-1.5), lo que implica un incremento del 30% del riesgo de muerte.
De acuerdo con la definición universal de infarto, se considera que una elevación de cualquier marcador de necrosis miocárdica ≥ 5 veces respecto del percentil 99% de los niveles normales basales es indicativa de infarto del miocardio en el posoperatorio de cirugía cardiaca.
Con respecto a las troponinas, aún se debate el valor preciso que determina la sospecha de un episodio coronario agudo en el paciente sometido a revascularización miocárdica. Carrier y colaboradores publicaron concentraciones de troponina T > 3.4 ng/L a las 48 h después de la operación como predictivo de un infarto perioperatorio, con una sensibilidad del 90% y una especificidad del 94%, además de un valor predictivo positivo del 41% y uno negativo del 99%. Los niveles de troponina I > 3.9 ng/L a las 24 h después de la intervención confirman el diagnóstico de infarto, con una sensibilidad del 80% y una especificidad del 85%, un valor predictivo positivo del 24% y uno negativo del 99%. Otros autores como Onorati y colegas definieron concentraciones de troponina I > 3.1 ng/L a las 12 h de la operación como el mejor marcador de infarto. Sin embargo, Thielman y colaboradores notificaron concentraciones mayores de las informadas previamente, troponina I > 21.5 ng/ml a las 12 h (sensibilidad de 82% y especificidad de 66%) y de 33.4 ng/ml a las 24 h (sensibilidad de 98% y especificidad de 82%).
Se han realizado determinaciones de marcadores de inflamación, como la interleucina 6, la proteína C reactiva y la endotelina 1, con fines pronósticos. Sólo se ha demostrado un nexo significativo con la oclusión de los puentes y episodios cardiovasculares cuando la IL-6 se encuentra por arriba de 3.8 pg/mL, además de que una PCR > 3 mg/L se correlacionó con la oclusión de los injertos. La endotelina 1 no demostró ser un marcador confiable de compromiso del injerto ni de episodios cardiovasculares. Alter y colaboradores señalaron que la combinación de criterios diagnósticos (leucocitosis >14 000 más cambios electrocardiográficos de elevación en el segmento ST o elevación de la CPK MB > 35 U/L en las primeras 6 h tras la revascularización) incrementa la sensibilidad para detectar infarto perioperatorio en forma más temprana.
En conclusión, tanto la CK MB como las troponinas han mostrado su utilidad para establecer el diagnóstico de necrosis miocárdica, si bien los estudios recientes apoyan el hecho de que la elevación de troponinas ofrece mayor sensibilidad, pero además se ha demostrado que es un predictor independiente de muerte a corto plazo, por lo que se consideran como primera opción como apoyo diagnóstico. En caso de no contar con este recurso, la CPK MB es una buena alternativa. Pese a la elevación de los biomarcadores de reacción inflamatoria, con excepción de la proteína C reactiva, aún no existe evidencia suficiente que apoye su determinación en forma sistemática.
Ecocardiograma
El ecocardiograma es un método útil, no invasivo, con el cual es posible determinar en tiempo real, con una resolución espacial y temporal, el grosor miocárdico y su movilidad en la cama del enfermo. Para el diagnóstico de infarto perioperatorio, además de los criterios enzimáticos y electrocardiográficos, el ecocardiograma ocupa el tercer lugar de los métodos más aceptados. El movimiento anormal circunscrito a uno o más segmentos parietales es el dato a considerar, en particular cuando es posible demostrar que se trata de una alteración nueva en comparación con un estudio ecocardiográfico preoperatorio.
Algunos autores señalan que los cambios en la movilidad de la pared, luego de la revascularización miocárdica, no siempre son secundarios a infarto perioperatorio, sobre todo en los que se han requerido la utilización de circulación extracorpórea; aducen que éstos pueden deberse al fenómeno de aturdimiento miocárdico. En realidad, Yang y colaboradores demostraron que la presencia de nuevas zonas acinéticas correspondientes a áreas irrigadas por arterias no revascularizadas, en un sujeto sometido a revascularización miocárdica sin bomba, sugeriría que la causa de esas alteraciones de la contractilidad podía deberse a la manipulación quirúrgica y no a una oclusión temprana de los puentes, hecho que se corroboró mediante tomografía helicoidal. En el mismo estudio se demostró incluso que sólo los niveles elevados de troponinas eran variables predictoras de infarto perioperatorio. Por consiguiente, si se identifica una nueva zona de acinesia, debe juzgarse cautelosamente la presencia de un episodio coronario perioperatorio y realizarse además ecografías de control.
Se ha considerado el uso de la ecocardiografía de contraste como una alternativa para demostrar alteraciones en la perfusión miocárdica, movilidad parietal segmentaria y global, como técnica no invasiva, rápida, fácil y segura para reducir los resultados falsos positivos o negativos en aquellos paciente en quienes, por su condiciones de gravedad, se presentan dificultades para la realización del estudio debido a la inestabilidad del paciente, dificultades para colocarlo en posición óptima para el estudio, dado que se encuentra bajo asistencia mecánica ventilatoria, la herida quirúrgica, la presencia de sondas torácicas, etcétera. Este método, además, hace posible diferenciar la presencia de miocardio aturdido o necrosis al permitir valorar la integridad microvascular.
El ecocardiograma transesofágico se considera de mayor utilidad para identificar de forma transoperatoria a pacientes de alto riesgo de infarto perioperatorio, en particular aquellos en los que se visualizan alteraciones de la movilidad de forma sostenida (3 h) luego del pinzamiento aórtico; sin embargo, no se sugiere la realización de este estudio de forma sistemática.
El ecocardiograma tridimensional y el strain rate se consideran técnicas promisorias de detección temprana de isquemia miocárdica y pueden ofrecer mejoría de la morbimortalidad del infarto perioperatorio.
El ecocardiograma es una herramienta útil en el diagnóstico de infarto perioperatorio, en particular cuando las alteraciones electrocardiográficas no son concluyentes, pero existe elevación de los marcadores de necrosis miocárdica. Sin embargo, su uso se ve limitado debido a las molestias que produce la herida quirúrgica en el posoperatorio inmediato y mediato; las nuevas tecnologías podrían favorecer su utilidad.
Otros métodos de evaluación
La tomografía helicoidal multicorte ha demostrado ser una herramienta útil en la evaluación de la permeabilidad de los puentes, ya que permite combinar una alta resolución espacial con la capacidad de demostrar la anatomía a través de imágenes de volumen, lo que produce una evaluación más sensible que la tomografía convencional o espiral. Se ha descrito que tiene buena capacidad para detectar la oclusión de los puentes; en realidad, la sensibilidad para la detección de oclusión de los puentes varía de acuerdo con los estudios, desde un 85.7% hasta un 100% y una especificidad del 94% al 100%. La frecuencia cardiaca, y por lo tanto el movimiento del miocardio, es un factor que puede dificultar la interpretación de los resultados sobre todo en los puentes dirigidos a la arteria coronaria derecha. En comparación con la angiografía coronaria, ésta tiene la ventaja de no someter a un procedimiento invasivo al paciente con sus posibles complicaciones, si bien pocas.
Las pruebas de medicina nuclear, como los estudios perfusorios reposo-reposo con talio 201 en los cuales se demuestra una zona de hipocaptación persistente del radiotrazador, podrían ser sugestivas, aunque se requeriría un estudio antes de la intervención para su comparación. Asimismo, el estudio de Tc pirofosfatos podría ser de utilidad en personas sin complicaciones hemodinámicas; un estudio positivo es altamente indicativo de infarto perioperatorio. Sin embargo, para sujetos con infartos no transmurales, la sensibilidad del estudio es baja. Además, al igual que otros estudios de imagen, tienen la limitante de que, en pacientes que se encuentran con inestabilidad hemodinámica o con intubación bucotraqueal, existe mayor riesgo en trasladar al sujeto que el potencial beneficio que podrían obtenerse con dicho estudio, lo cual no justifica su uso en estos casos.
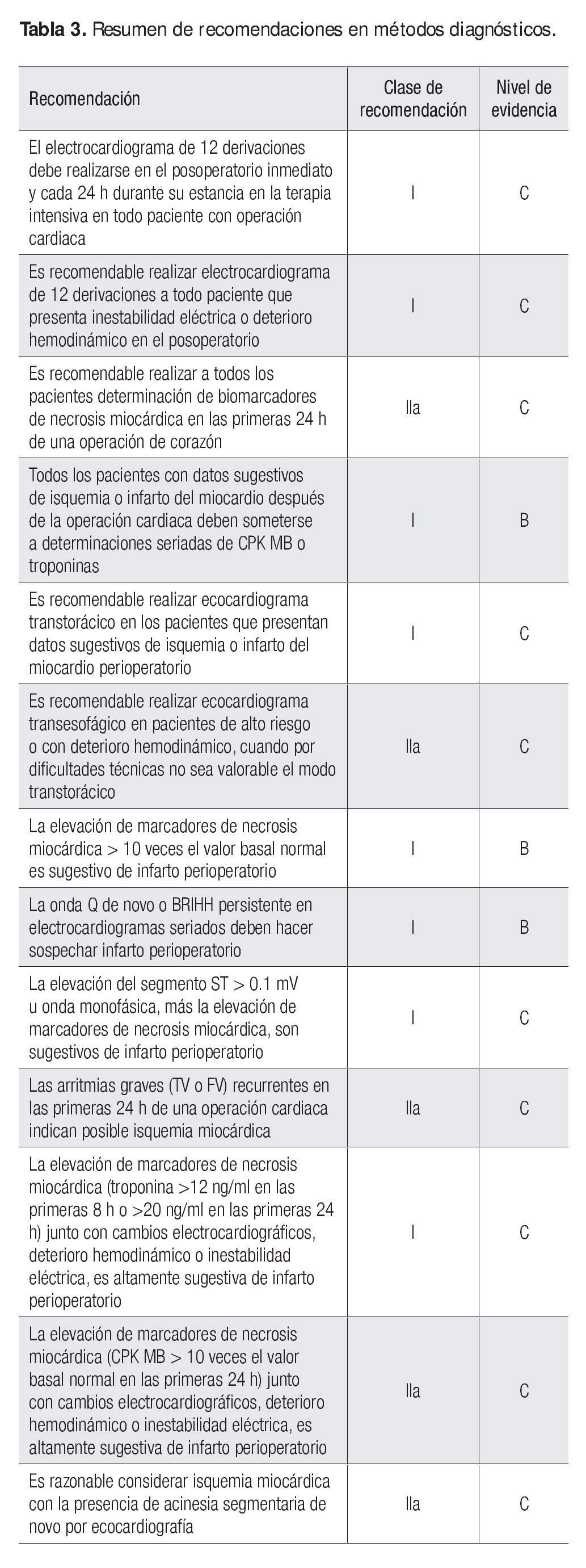
Es importante recordar que la simple elevación de los biomarcadores no es diagnóstica de infarto y debe tomarse en cuenta, además, cualquiera de los hallazgos descrito para considerar ese diagnóstico (Tabla 3).
Indicaciones de cateterismo, reintervención y tratamiento
La isquemia miocárdica y el infarto perioperatorio con daño celular miocárdico irreversible son las complicaciones más graves después de la cirugía de revascularización miocárdica, que se vincula con un incremento sustancial de los índices de morbilidad y mortalidad intrahospitalaria. Se ha informado una incidencia muy variable, desde 2% hasta 13%, con una mortalidad intrahospitalaria del 68% y con reducción de los índices de sobrevida a largo plazo. La oclusión temprana del puente de AMI tiene una incidencia del 10% a 12%, pero es el puente causante en la tercera parte y hasta más de la mitad de las complicaciones isquémicas después de la revascularización, aun cuando sólo el 5% al 6% de los pacientes presenta manifestaciones clínicas de isquemia miocárdica. Zhao y colaboradores46 demostraron la presencia de 12% de defectos angiográficos significativos en los pacientes posoperados de revascularización miocárdica, pese a que ellos demostraron que el procedimiento con menor riesgo y mejor resultado, en este grupo de paciente, es la intervención coronaria percutánea para el tratamiento de esta complicación.
Por lo tanto, es importante establecer en forma oportuna el diagnóstico diferencial entre la trombosis temprana o aguda de los puentes y otras causas de daño celular miocárdico posoperatorio, para establecer la mejor medida terapéutica y, si es necesaria, una reintervención para revascularización mediante intervención coronaria percutánea o reoperación con revisión de los puentes, de tal modo que se salve el daño isquémico reversible, con la finalidad de preservar la función ventricular y mejorar el pronóstico del pacientes. En realidad, en 55% a 75% de los pacientes que presentan datos enzimáticos, clínicos y electrocardiográficos altamente sugestivos de infarto perioperatorios, y que se someten a angiografía coronaria, se logra demostrar oclusión de los puentes o de las arterias nativas no revascularizadas.
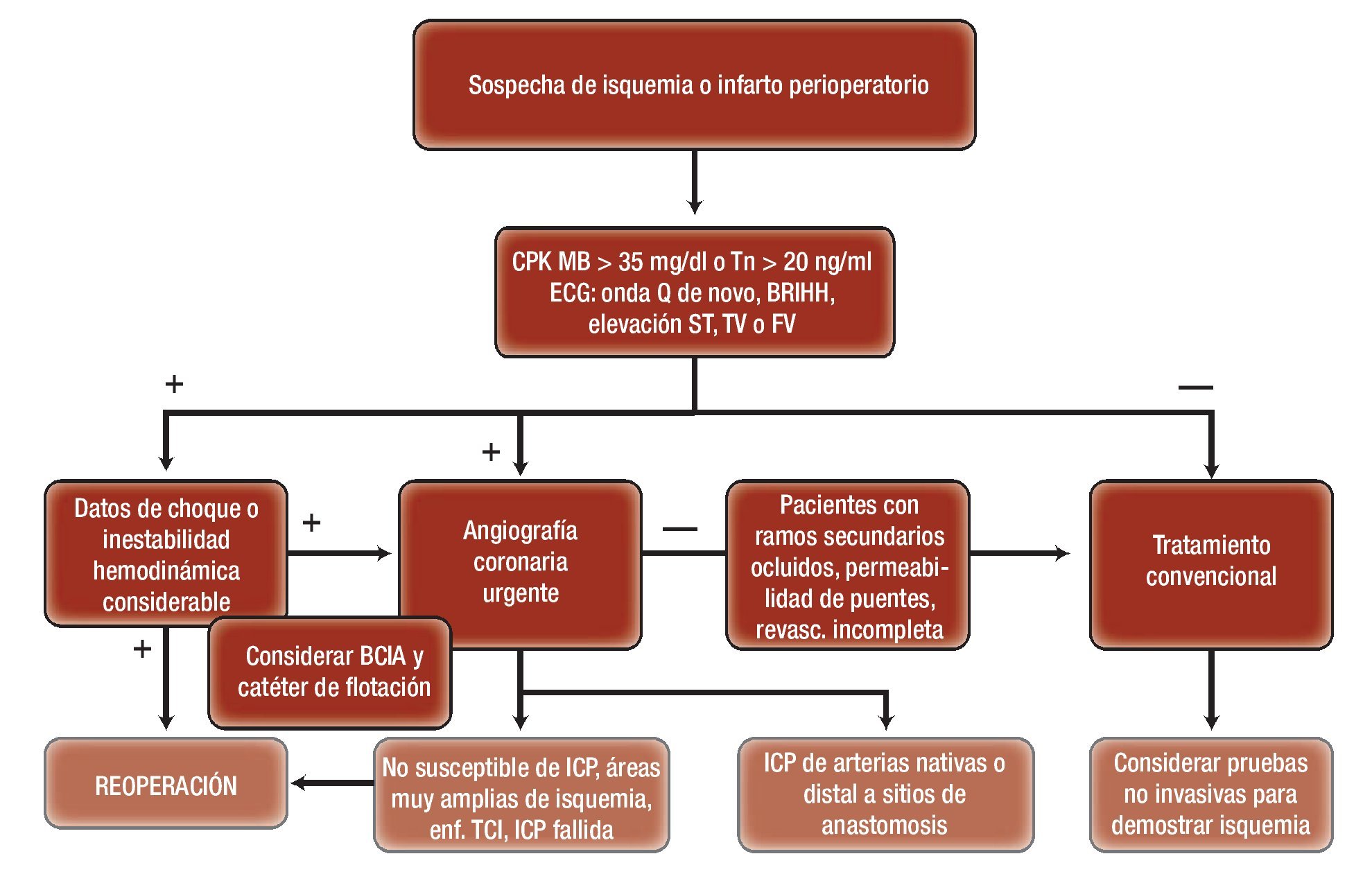
Se considera que los criterios para realizar una angiografía coronaria en pacientes posoperados, ante la sospecha de infarto perioperatorio, son los siguientes:
• Elevación de troponinas >20 ng/ml, dentro de las primeras 24 h de la operación o CPK MB >35 mg/dl en las primeras 6 h.
• Cambios de desnivel del segmento ST en dos derivaciones contiguas, >0.2 mV en derivaciones V1, 2 o 3, y >0.1 mV en cualquier otra derivación, o aparición de nuevas ondas Q
• Nuevos episodios de taquicardia ventricular o fibrilación.
• Inestabilidad hemodinámica a pesar de apoyo con inotrópicos intravenosos (>3 μg/kg/min) y signos de falla ventricular izquierda, con datos de bajo gasto cardiaco o choque cardiogénico.
Las guías de práctica clínica de la Sociedad Europea de Cardiología y de la Asociación Europea de Cirugía Cardiotorácica establecen que la angiografía coronaria está indicada en pacientes muy sintomáticos, o con inestabilidad hemodinámica posoperatoria, o con la presencia de biomarcadores y cambios electrocardiográficos sugestivos de infarto perioperatorio, con una clase de recomendación I y nivel de evidencia C.
La intervención coronaria percutánea (ICP) se recomienda en pacientes que cursan con datos sugestivos de isquemia o infarto en la fase temprana después de una operación de revascularización (dentro del primer mes) y es técnicamente posible de realizar. La intervención coronaria se realiza sobre la arteria nativa cuyo puente esté ocluido. Sin embargo, los principales riesgos del procedimiento son la posibilidad de perforación arterial o alteración de suturas, cuando la dilatación se lleva a cabo en el sitio de anastomosis con el puente arterial, en suturas recientes y el riesgo de sangrados. Thielmann y colaboradores señalaron que de 5 427 pacientes sometidos a un procedimiento de revascularización, 118 presentaron datos sugestivos de infarto perioperatorio, los cuales se sometieron a angiografía coronaria 13.5 ± 1 h después de la operación; en 67 se confirmó falla aguda de puentes y 25 se sometieron a ICP en un promedio de 13 ± 3min; 15 se programaron para una reoperación en un promedio de 4.7 ± 0.4 h y 27 permanecieron con tratamiento médico. La causa más frecuente de la falla de los puentes fue la oclusión, seguido del doblamiento del puente y por último la estenosis de la anastomosis. En el grupo de reoperación se observó mayor elevación de troponinas, las más de las veces del síndrome de bajo gasto cardiaco, pero sin relevancia estadística. Sin embargo, el grupo de sujetos sometidos a ICP requirió con mayor frecuencia tratamiento renal sustitutivo. Se presentó una mortalidad intrahospitalaria y a un año del 12% y 20% en los individuos sometidos a ICP, de 20% y 27% en reoperación y de 14.8% y 18.5% con tratamiento médico, respectivamente. La limitante del estudio, así como de la mayoría que se ha descrito hasta la actualidad, es que no son aleatorizados y además, aun cuando la decisión se tomó con base en una sesión médico-quirúrgica conjunta, es susceptible de sesgos de selección. Fabricius y colegas publicaron resultados similares; de una cohorte de 2 052 pacientes, 113 cumplieron criterios para infarto perioperatorio, se confirmaron por angiografía oclusión de los puentes en 63, de los cuales 23 requirieron reoperación en quienes se registró una mortalidad del 9.3%, en comparación con 34 paciente que se sometieron a reoperación sin angiografía previa y que mostraron un mortalidad del 39.1%; sólo nueve pacientes se sometieron a ICP (con un 9.3% de mortalidad publicada). Hanratty y colaboradores informaron que de 494 pacientes sometidos a la operación, 23 (4.7%) presentaron datos sugestivos de infarto perioperatorio (elevación o depresión del segmento ST ≥ 1 mm, episodios de taquicardia o fibrilación ventricular nuevos o recurrentes, inestabilidad hemodinámica súbita o inexplicable) y fueron sometidos a angiografía coronaria; en ellos se identificó la oclusión del puente en 16 pacientes, ocho se programaron a reoperación y ocho a ICP, sin que se presentaran complicaciones por el procedimiento. En este mismo sentido, Rasmussen y colegas encontraron que de 2003 pacientes sometidos a operación en forma consecutiva, el 3.5% (71 pacientes) mostró cambios sugestivos de isquemia miocárdica, de los cuales 11 se sometieron a reoperación debido al deterioro hemodinámico considerable; 59 sujetos se programaron para angiografía coronaria y se demostró falla de los puentes en el 73% de los casos (43 pacientes); la causa más frecuente fue la trombosis en el 32%, seguido de bajo flujo a través de las arterias nativas. Sin embargo, en 16 individuos (27%) no se logró detectar una causa objetiva como causante de la isquemia. De los 43 sujetos con oclusión de los puentes, 27 se sometieron a una reintervención quirúrgica y los 16 pacientes restantes quedaron con tratamiento conservador. Se comunicó una mortalidad hospitalaria del 7% de los pacientes a quienes se les practicó angiografía coronaria antes de la reintervención y del 50% en los pacientes que se programaron para una intervención por deterioro hemodinámico.
Hasta el momento es poca la experiencia informada en las publicaciones que permita evaluar los resultados de la ICP con el empleo de stents liberadores de fármacos en este grupo de enfermos; al parecer, su uso y la necesidad de emplear esquemas antiagregantes dobles o triples, además de antitrombóticos, incrementan el riesgo de sangrado en etapas muy tempranas después de la operación, por lo que su utilización debe considerarse sólo después de una estratificación del riesgo de sangrado y evaluar la relación riesgo-beneficio con su empleo.
La reoperación en pacientes con procedimiento de revascularización previo está indicada en pacientes en quienes se demuestra la oclusión de los puentes, pero que muestran enfermedad del tronco de la coronaria izquierda o enfermedad de múltiples vasos, en particular cuando se han identificado por métodos no invasivos áreas muy amplias en riesgo. Se debe tomar en consideración que los pacientes que cursan con complicaciones isquémicas después de una operación cardiaca pueden cursar con daño miocárdico, lo que incrementa su morbilidad y riesgo de muerte. En los pacientes no susceptibles de ICP o con ICP fallida también se ha considerado la revisión de los puentes mediante Doppler con la flujometría del tiempo de flujo de tránsito a través de ellos para verificar la funcionalidad. Los puentes que muestren flujo insatisfactorio deben sustituirse por nuevos injertos y es necesario remover los trombos tanto de las arterias nativas como de los puentes. En caso de que el puente de arteria mamaria interna sea la que falle, se coloca nuevo injerto de vena safena reversa; debe considerarse la posibilidad de requerir apoyo con balón de contrapulsación intraaórtico para salir de la bomba extracorpórea. De cualquier forma, se ha observado un incremento del riesgo de muerte hospitalaria hasta tres veces mayor en la reoperación, en comparación con la primera intervención.
La reoperación inmediata se debe considerar en los casos en que el puente venoso o de arteria con sospecha de oclusión comprometa un área muy amplia y que provoque rápido deterioro hemodinámico, signos de choque cardiogénico o arritmias graves refractarias o recurrentes en el posoperatorio inmediato.
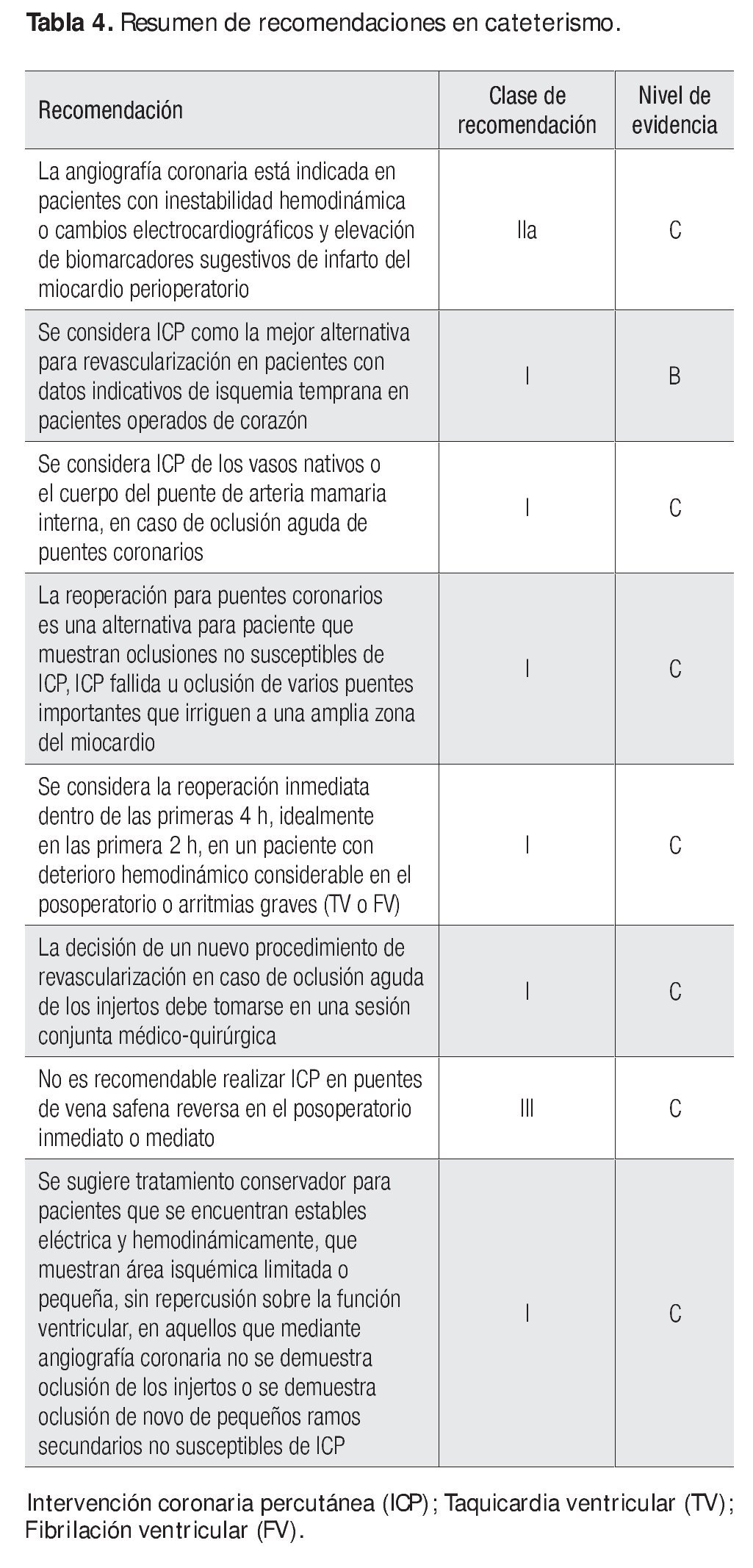
Se consideran como medidas conservadoras el tratamiento antiisquémico radical, el control del dolor, el empleo de bloqueadores β, ASA, heparina, además del apoyo circulatorio mediante balón de contrapulsación intraaórtico. El tratamiento conservador se aconseja para sujetos que se encuentran estables eléctrica y hemodinámicamente, que muestran áreas isquémicas limitadas o pequeñas, que no representan repercusión sobre la función ventricular, y aquellos sujetos en quienes no se demuestra mediante angiografía coronaria oclusión de los injertos o se reconoce la presencia de oclusión de novo de pequeños ramos secundarios no susceptibles de ICP (Tabla 4).
Angina
Se ha notificado la presencia de episodios de isquemia recurrente en fase temprana (dentro de los primeros 90 días) después de una operación de revascularización miocárdica, desde un 6% hasta un 15%, debido a la estenosis de los puentes, con o sin oclusión total. Otros mecanismos que se han observado como causantes de la recurrencia de angina pueden deberse a lesiones coronarias de arterias que no fueron susceptibles de puentearse (revascularización incompleta) y lesiones obstructivas de las arterias nativas en segmentos distales al sitio de anastomosis del injerto, además de los mecanismos ya mencionados para el infarto perioperatorio, como la trombosis del puente, que puede presentarse hasta en un 7% de los puentes de vena safena reversa a pesar del empleo de la terapia antiagregante plaquetaria. En este grupo de pacientes, la angioplastia coronaria parece ser una mejor alternativa terapéutica que la reoperación, con una menor mortalidad. En realidad, uno de los indicadores de la necesidad de reoperación a mediano y largo plazos es la recurrencia de la angina. Se ha calculado una incidencia de episodios de angina recurrente de 3.5% a 7.2% por año; esta recurrencia de los síntomas extrapolada a diez años podría ser de 35% a 70% de los pacientes y pueden requerirse nuevos estudios para evaluar la isquemia y reconsiderar algún procedimiento de revascularización. Kahn y colaboradores informaron 95% de éxito en la angioplastia de arterias nativas y 89% en puentes aortocoronarios, y lograron alcanzar un 84% de revascularización completa, limitando los episodios de angina en el 79% de los pacientes.
Tratamiento antitrombótico
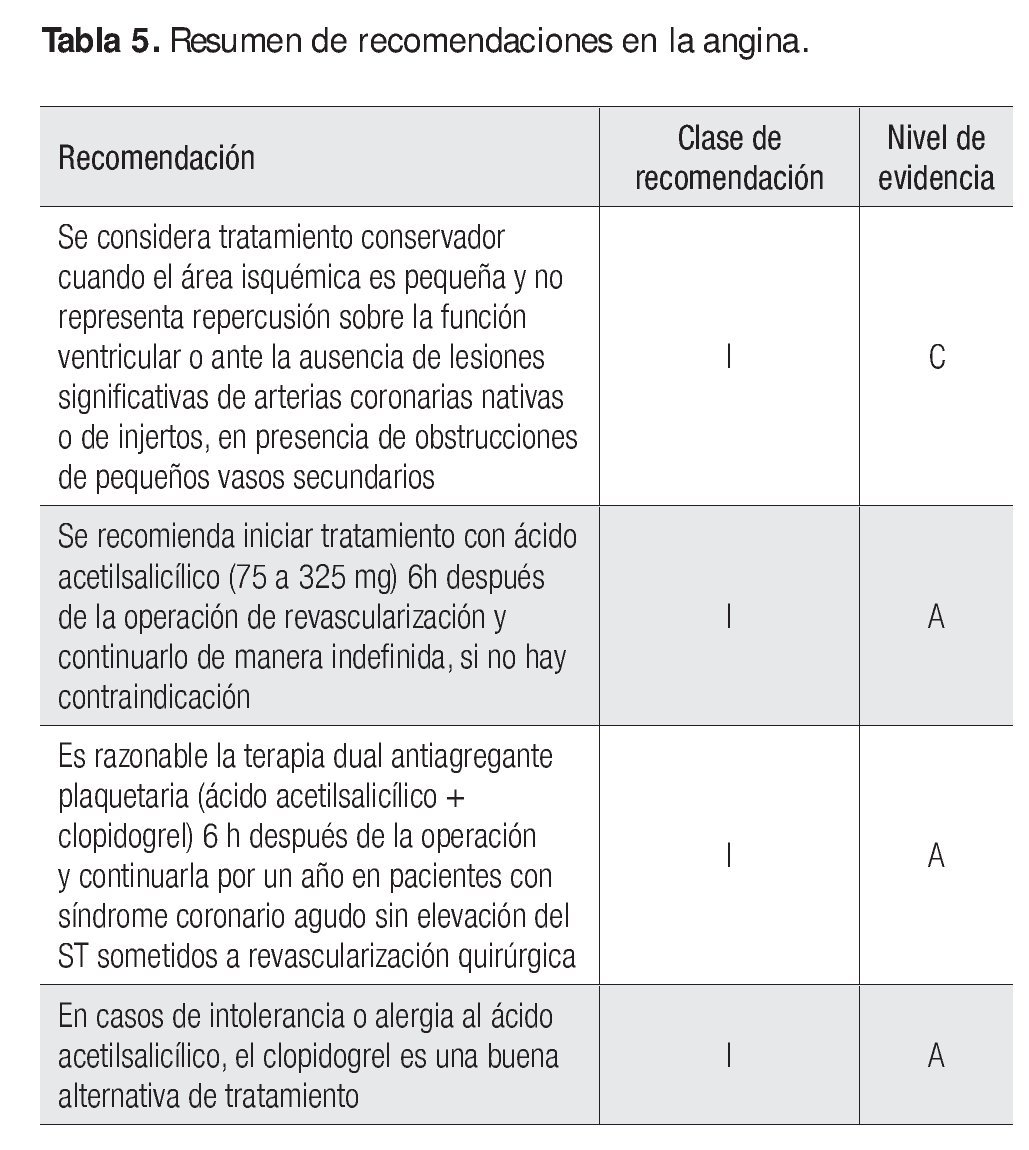
Sin lugar a dudas, la principal complicación de la operación de revascularización es la oclusión de los injertos. La denudación del endotelio vascular de los injertos de vena o arteria, que se presenta después de la manipulación de éstos para su anastomosis, genera un endotelio altamente trombogénico; también lo producen diferentes mecanismos relacionados con problemas técnicos de las anastomosis, la calidad de los injertos y otros aspectos vinculados con el procedimiento quirúrgico. Por esta razón se considera necesario iniciar la terapia antiagregante plaquetaria en forma temprana después de la intervención si no existe contraindicación para su uso. En realidad, el meta-análisis sobre ensayos clínicos que realizó el Antiplatelet Trialists' Collaboration mostró un efecto protector del inicio del ácido acetilsalicílico (ASA) dentro de las primeras seis a 24 h tras la operación de revascularización, con una reducción de la probabilidad de oclusión del puente del 44% en un promedio de un año; no se encontró un gradiente de dosis y las diferencias no fueron significativas cuando se comparó el efecto de la dosis habitual contra la dosis alta.
Recomendación clase I, nivel de evidencia A
El estudio CURE, que incluyó a 12 562 pacientes con síndrome coronario agudo sin elevación del segmento ST, de los cuales 4 577 se aleatorizaron para algún procedimiento de revascularización quirúrgica o percutánea, aun cuando sólo 2 072 (16.5%) se sometieron a revascularización quirúrgica, demostró que el tratamiento con clopidogrel (300 mg de carga, seguido de 75 mg/día) comparado con placebo, en adición al ácido acetilsalicílico, tenía un efecto protector con menor riesgo de episodios primarios (muerte, infarto no letal o episodio vascular cerebral) a un año (RR, 0.56; IC 95%, 0.43 - 0.72) cuando se analizó el grupo completo de pacientes revascularizados (no se cuenta con los resultados independientes para los pacientes con revascularización quirúrgica). De cualquier forma, no se observó un incremento significativo del riesgo de sangrado con la terapia dual. Por consiguiente, se considera que para este grupo de pacientes de alto riesgo con síndrome coronario agudo, sin elevación del segmento ST sometidos a revascularización, la terapia dual con ácido acetilsalicílico y clopidogrel es razonable iniciarla 6 h después de la intervención y continuarla por un año (Tabla 5).
Recomendación clase I, nivel de evidencia A
En el estudio CAPRIE (clopidogrel o ácido acetilsalicílico en pacientes con riesgo de episodios isquémicos), que incluyó a un total de 19 185 pacientes, en un seguimiento de uno a tres años, se encontró riesgo relativo para episodios cerebrales isquémicos, infarto del miocardio o muerte vascular de 5.8% y 5.3%, para ASA y clopidogrel respectivamente. Los resultados proporcionaron evidencia de que el clopidogrel es tan efectivo como el ASA. Sin embargo, aun cuando en el subanálisis que incluyó a 1 480 pacientes sometidos a operación de revascularización, se encontró una reducción de la frecuencia de episodios cardiovasculares al año (muerte, infarto, accidente cerebrovascular y necesidades de rehospitalización) en los pacientes aleatorizados para recibir clopidogrel (15.9%) en comparación con los que recibieron ASA (22.3%; p <0.001); con ambos se observó una reducción del riesgo relativo anual para cada uno de los puntos finales. En consecuencia, se considera que el clopidogrel puede ser una buena alternativa en el tratamiento de pacientes con alergia o intolerancia al ASA (Figura 1).
Figura 1. Algoritmo terapéutico de los pacientes con signos sugestivos de isquemia o infarto perioperatorio.
Recomendación clase I, nivel de evidencia A
Bibliografía
Alamanni F, Dainese L, Naliato M, et al. On-and off-pump coronary surgery and perioperative myocardial infarction: an issue between incomplete and extensive revascularization. Eur J Cardiothorac Surg 2008;34:118-126.
Ali K, Ziba J, Anthony J, et al. Apoptosis: pathophysiology and therapeutic implications for the cardiac surgeon. Ann Thorac Surg 2004;78:1109-1118.
Alter P, Vogt S, Herzum M, et al. Indications for angiography subsequent to coronary artery bypass grafting. Am Heart J 2005;149:1082-1090.
Anselmi A, Abbate A, Girol F, et al. Myocardial ischemia, stunning, inflammation and apoptosis during cardiac surgery: a review of evidence. Eur J Cardiothorac surg 2004;25:304-311.
Antiplatelet Trialists' Collaboration. Collaborative overview of randomised trials of antiplatelet therapy-II: Maintenance of vascular graft or arterial patency by antiplatelet therapy. BMJ 1994:308:159-168.
Bassri H, Salari F, Noohi, F, et al. Evaluation of early coronary graft patency after coronary artery bypass graft surgery using multis-lice computed tomography angiography. BMC Cardiovasc Disord 2009;9:53-57.
Brener SJ, Lytle BW, Schneider JP, et al. Association between CK-MB elevation after percutaneous or surgical revascularization and three-year mortality. J Am Coll Cardiol 2002;40:1961-1967.
CAPRIE Steering Committee. A rondomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events. Lancet 1996;348:1329-1339.
Carrier M, Pellerin M, Perrault LP, et al. Troponin levels in patients with myocardial infarction after coronary artery bypass grafting. Ann Thorac Surg 2000;69:435-440.
Chaitman BR, Alderman EL, Sheffield LT, et al. Use of survival analysis to determine the clinical significance of new Q waves after coronary bypass surgery. Circulation 1983;67:302-309.
Croal B, Hillis G, Gibson P, et al. Relationship between postoperative cardiac troponin I levels and outcome of cardiac surgery. Circulation 2006;114:1468-1475.
CURE Investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001;345:494-502.
Dahlin L, Olin C, Svedheholm R. Perioperative myocardial infarction in cardiac surgery-risk factors and consequences. A case control study. scand Cardiovasc J 2000;34(5):522-527.
Diller G, Wasan B, Kyriacou A, et al. Effect of coronary artery bypass surgery on myocardial function as assessed by tissue Doppler echocardiography. Eur J Cardiothorac Surg 2008;34-995-999.
Eagle KA, Guyton RA, Davidoff R, et al. ACC/AHA 2004 Guideline Up-date for Coronary Artery Bypass Graft Surgery. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1999 Guidelines for Coronary Artery Bypass Graft Surgery). Circulation 2004;110;e340-e437.
Fabricius AM, Gerber W, Hanke M, et al. Early angiographic control of perioperative ischemia after coronary artery bypass grafting. Eur J Cardiothorac Surg 2001;19:853-858.
Greaves S, Rutherford J, Aranki S, et al. Current incidence and determinants of perioperative myocardial infarction in coronary artery surgery. Am Heart J 1996;132:572-578.
Guiteras P, Conrad L, Galinanes M, et al. Diagnostic criteria and prognosis of perioperative myocar¬dial infarction following coronary bypass. J Thorac Cardiovasc Surg 1983;86:878-886.
Hanratty CG, Koyama Y, Ward MR. Angioplasty and stenting of the distal coronary anastomosis for graft failure immediately after coronary artery bypass grafting. Am J Cardiol 2002;90:1009-1011.
Hedman A, Larsson T, Alam M, et al. CRP, IL-6 and endothelin-1 levels in patients undergoing coronary artery bypass grafting. Do preoperative inflammatory parameters predict early graft occlusion and late cardiovascular events? Intern J Cardiol 2007;120:108-114.
Ishida M, Kobayashi J, Tagusari O, et al. Perioperative advantages of off-pump coronary artery bypass grafting. Circ J 2002;66:795-799.
Iskandrian AS, Heo J, Mostel E. The role of radionuclide cardiac imaging in coronary artery bypass surgery. Am Heart J 1987;113:163-170.
Jones RH, Hannan EL, Hammermeister KE, et al. Identification of preoperative variables to risk adjustment of short-term mortality alters coronary artery bypass graft surgery. The Working Group Panel on the Cooperative CABG Database Project. J Am Coll Cardiol 1996;28:1478-1487.
Kahn JK, Rutherford BD, McConahay DR, et al. Early postoperative balloon coronary angioplasty for failed coronary artery bypass grafting. Am J Cardiol 1990;66:943-946.
Klatte K, Chaitman BR, Theroux P, et al. Increased mortality after coronary artery bypass graft surgery is associated with increased levels of postoperative creatine kinase-myocardial band isoenzyme release: results from the GUARDIAN trial.J Am Coll Cardiol 2001;38:1070-1077.
Kolh P, Wijns W, Danchin N, et al. Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur J Cardiothorac Surg 2010;38:S1 S52.
Koolen J, Visser A, Reichert L, et al. Improved monitoring of myocar-dial ischaemia during major vascular surgery using transoesophageal echocardiography. Eur Heart J 1992;13:1028-1033.
Larmann J, Theilmeier G. Inflammatory response to cardiac surgery: cardiopulmonary bypass versus non-cardiopulmonary bypass surgery. Best Pract Res Clin Anaesthesiol 2004;18:425-438.
Lytle BW, Blackstone EH, Loop FD, et al. Two internal thoracic artery grafts are better than one. J Thorac Cardiovasc Surg 1999; 117:855-872.
Marban E. Myocardial stunning and hibernation: The physiology behind the colloquialisms. Circulation 1991;83:681-688.
McGregor C, MacLeod M, Muir A, et al. Myocardial infarction related to valve replacement surgery. Br Heart J 1984;51:612-617.
Muneretto C, Negri A, Manfredi J, et al. Safety and usefulness of composite grafts for total arterial myocardial revascularization: A prospective randomized evaluation. J Thoracic Cardiovasc Surg 2003;125:826-835.
Nalysnyk L, Fahrbach K, Reynoulds M, et al. Adverse events in coronary artery bypass graft (CABG) trials: A systematic review and analysis. Heart 2003;89:767-772.
Nathoe H, Moons K, Van Dijk D, et al. Risk and determinants of myocardial injury during off-pump coronary artery bypass grafting. Am J Cardiol 2006;97:1482-1486.
Obarski T, Loop F, Cosgrove D, et al. Frequency of acute myocardial infarction in valve repairs versus valve replacement for pure mitral regurgitation. Am J Cardiol 1990;65:887-891.
Onorati F, De Feo M, Mastroroberto P, et al. Determinants and prognosis of myocardial damage after coronary artery bypass grafting. Ann Thorac Surg 2005;79: 837-845.
Parang P, Arora R. Coronary veingraft disease: Pathogenesis and prevention. Can J Cardiol 2009;25:e57-e62.
Price MJ, Housman L, Teirstein PS. Rescue percutaneous coronary intervention early after coronary artery bypass grafting in the drug-eluting stent era. Am J Cardiol 2006;97:789-791.
Rasmussen C, Thiis JJ, Clemmensen P, et al. Significance and management of early graft failure after coronary artery bypass grafting. Feasibility and results of acute angiography and re-revascularization. Eur J Cardiothorac Surg 1997;12:847-852.
Reilly J, Tunick P, Timmermans R, et al. Contrast echocardiography clarifies uninterpretable wall motion in intensive care unit patients. J Am Coll Cardiol 2000;35:485-490.
Ribeiro P, Nihoyannopoulos P, Farah S, et al. Role of transient ischaemia and perioperative myocardial infarction in the genesis of new septal wall motion abnormalities after coronary bypass surgery. Br Heart J 1985;54:140-144.
Rubenson DS, Tucker CR, London E, et al. Two-dimensional echocardiographic analysis of segmental left ventricular wall motion before and after coronary artery bypass surgery. Circulation1982;66:1025-1033.
Sergeant P, Blackstone E, Meyns B. Validation and interdependence with patient-variables of the influence of procedural variables on early and late survival after CABG. K.U. Leuven Coronary Surgery Program. Eur J Cardiothorac Surg 1997;12:1-19.
Simon C, Capuano F, Roscitano A, et al. Cardiac troponin I vs euroS-CORE: myocardial infarction and hospital mortality. Asian Cardiovasc Thorac Ann 2008;16:97-102.
Skyschally A, Erbel R, Heusch G. Coronary microembolization. Cir J 2003; 67:279-286.
Smith SC Jr, Feldman TE, Hirshfeld JW Jr, et al. ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention—Summary Article: A Report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (ACC/AHA/SCAI Writing Committee to Update the 2001 Guidelines for Percutaneous Coronary Intervention). Circulation 2006;113:156-175.
Stein PD, Schünemann HJ, Dalen JE, et al. Antithrombotic therapy in patients with saphenous vein and internal mammary artery bypass grafts. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004;126:600S-608S.
Thielmann M, M.P., Beate R, et al. Emergency re-revascularization with percutaneous coronary intervention, reoperation or conservative treatment in patients with acute perioperative graft failure following coronary artery bypass surgery. Eur J Cardiothorac Surg 2006;30:117-125.
Thielmann M, Massoudy P, Marggraf G, et al. Role of troponin I, myoglobin, and creatine kinase for the detection of early graft failure following coronary artery bypass grafting. Eur J Cardiothorac Surg 2004;26:102-109.
Thielmann M, Massoudy P, Schmermund A, et al. Diagnostic discrimination between graft related and non-graft-related perioperative myocardial infarc¬tion with cardiac troponin I after coronary artery bypass surgery. Eur Heart J 2005;26:2440-2447.
Thygesen K, Alpert J, White H, et al. Universal definition of myocar-dial infarction. Circulation 2007;116:2634-2653.
Vanden F, Cartier R, Marcheix B, et al. Prognosis of perioperative myocardial infarction after off-pump coronary artery bypass surgery. Cardiovasc Surg 2009;50:535-543.
Virani SS, Alam M, Mendoza CE, et al. Clinical significance, angiographic characteristics, and short-term outcomes in 30 patients with early coronary artery graft failure. Neth Heart J 2009;17:13-17.
Ward RP, Lang RM. Myocardial contrast echocardiography in acute coronary syndromes. Curr Opin Cardiol 2002;17:455-463.
Yang H, Youn Y, Yoo K, et al. Correlation of akinesia with graft paten-cy and cardiac enzyme after off-pump coronary artery bypass graft surgery. Circ J 2010;74:1564 -1569.
Yau M, Alexander H, Hafley G, et al. Impact of perioperative myocar-dial infarction on angiographic and clinical outcomes following coronary artery bypass grafting (from Project of Ex vivo Vein graft Engineering via Transfection [PREVENT] IV). Am J Cardiol 2008;102:546-551.
Yli-Mtiyry S, Huikuri HV. Clinical and angiographic prediction of myocardial infarction and recurrence of severe angina during a five-year follow-up after coronary artery bypass grafting. Am J Cardiol 1993;72:1371-1375.
Yokoyama Y, Chaitman BR, Hardison RM, et al. Association between new electrocardiographic abnormalities after coronary revascularization and five-year cardiac mortality in BARI randomized and registry patients. Am J Cardiol 2000;86:819-824.
Zhao DX, Leacche M, Balaguer JM, et al. Routine intraoperative completion angiography after coronary artery bypass grafting and 1-stop hybrid revascularization results from a fully integrated hybrid catheterization laboratory/operating room. J Am Coll Cardiol 2009;53:232-241.