Explorar las diferencias segmentarias de los espesores parietales (EP) en las miocardiopatías más prevalentes y en individuos sin cardiopatía estructural por resonancia magnética cardíaca.
MétodoPacientes mayores de 18 años referidos a resonancia magnética cardíaca durante el periodo comprendido entre enero de 2014 y septiembre de 2014, con diagnóstico de miocardiopatía hipertrófica, miocardiopatía dilatada idiopática, miocardiopatía isquémico-necrótica y miocarditis fueron seleccionados retrospectivamente de nuestra base de datos.
ResultadosSe incluyeron 120 pacientes. El grupo control presentó un EP medio de 5.9±1.1mm, con un índice de espesor relativo de 2.9±0.8. Se identificaron EP significativamente menores en los segmentos apicales tanto en el grupo control (basal 6.7±1.3 vs. medio 6±1.3 vs. apical 4.6±1mm, p<0.0001) como en todas las miocardiopatías evaluadas (miocardiopatía hipertrófica: basal 10.5±2.4 vs. medio 10.8±2.7 vs. apical 7.3±3.3mm, p<0.0001; miocardiopatía dilatada idiopática: basal 7.7±1.7 vs. medio 7.6±1.3 vs. apical 5.4±1.3mm, p<0.0001; miocardiopatía isquémico-necrótica: basal 7.4±1.7 vs. medio 7.5±1.9 vs. apical 5.5±1.8mm, p<0.0001; miocarditis: basal 7.1±1.5 vs. medio 6.4±1.1 vs. apical 5.1±0.8, p<0.0001). También se evidenciaron diferencias significativas entre hombres y mujeres respecto al EP tanto en el grupo control (6.5±2.1 vs. 5.2±1.7mm, p<0.0001), como en la miocardiopatía hipertrófica (10.5±5.3 vs. 8.5±5.7mm, p<0.0001) y en la miocarditis (6.6±2 vs. 5.2±1.6mm, p<0.0001).
ConclusionesEn este estudio observacional encontramos un prevalencia relativamente elevada de segmentos comúnmente considerados como adelgazados en individuos sin cardiopatía estructural. Además, observamos una marcada asimetría y gradiente longitudinal en cuanto a EP tanto en controles como en las distintas miocardiopatías evaluadas.
To explore regional differences in myocardial wall thickness (WT) among the most prevalent cardiomyopathies and in individuals without structural heart disease using cardiac magnetic resonance.
MethodsPatients older than 18 years referred to cardiac magnetic resonance during the period between January 2014 and September 2014, with a diagnosis of hypertrophic cardiomyopathy, idiopathic dilated cardiomyopathy, ischemic cardiomyopathy, and myocarditis were retrospectively selected from our database.
ResultsOne hundred twenty patients patients were included. The control group had an average WT of 5.9±1.1mm, with a WT index of 2.9±0.8. Significantly lower mean WT in the apical segments were identified in both the control group (basal 6.7±1.3 vs. mid 6.0±1.3 vs. apical 4.6±1.0mm, P<.0001) and in all evaluated cardiomyopathies (hypertrophic cardiomyopathy: basal 10.5±2.4 vs. mid 10.8±2.7 vs. apical 7.3±3.3mm, P<.0001; idiopathic dilated cardiomyopathy: basal 7.7±1.7 vs. mid 7.6±1.3 vs. apical 5.4±1.3mm, P<.0001; ischemic cardiomyopathy: basal 7.4±1.7 vs. mid 7.5±1.9 vs. apical 5.5±1.8mm, P<.0001; myocarditis: basal 7.1±1.5 vs. mid 6.4±1.1 vs. apical 5.1±0.8, P<.0001). Significant gender differences were also evident regarding the mean WT both in the control group (male 6.5±2.1 vs. female 5.2±1.7mm, P<.0001), as in hypertrophic cardiomyopathy (10.5±5.3 vs. 8.5±5.7mm, P<.0001) and myocarditis (6.6±2.0 vs. 5.2±1.6mm, P<.0001).
ConclusionWe found a relatively high prevalence of segments commonly deemed thinned among patients without structural heart disease. We also observed a marked asymmetry and longitudinal gradient in wall thickness both in controls and in the various cardiomyopathies evaluated.
La resonancia magnética cardíaca (RMC) es actualmente el patrón de oro no invasivo para la caracterización de los tejidos y la evaluación de la anatomía y función ventricular1. Si bien se han realizado estudios que comparan los valores obtenidos por ecocardiografía transtorácica con RMC, existen escasos reportes al respecto de los valores normales de los espesores parietales regionales por RMC en individuos sanos, y particularmente en pacientes con miocardiopatías2–6.
El reconocimiento de dichos valores es de gran importancia puesto que el diagnóstico en determinadas enfermedades se basa en el espesor miocárdico. Un claro ejemplo de ello es el miocardio no viable, el cual ha sido descrito como aquel con un espesor evaluado por ecocardiograma<5mm, o la miocardiopatía hipertrófica (MCH) en la cual el punto de corte por ecocardiograma es≥15mm7.
Una de las fortalezas de la RMC es su capacidad para evaluar de manera precisa los segmentos apicales sin las limitaciones de ventana de la evaluación ecocardiográfica8–12. Esta característica posiciona a la RMC en una situación de ventaja considerando que un porcentaje de pacientes con MCH presentan compromiso exclusivamente apical3,8–12. En la misma línea, hay información controversial acerca de si existe o no un gradiente longitudinal decreciente de espesores parietales de base a ápex13,14. Finalmente, numerosos estudios han demostrado la importancia del índice de espesor parietal relativo (espesor septal/espesor pared libre) calculado por ecocardiograma, mientras que son escasos los estudios que discriminen los espesores parietales regionales por RMC15,16. En la misma línea, no se conocen con exactitud los puntos de corte para determinar la presencia de adelgazamiento parietal.
Por lo tanto, el objetivo de nuestro estudio fue explorar las diferencias regionales de los espesores parietales en las miocardiopatías más prevalentes, y en individuos sin evidencia de cardiopatía estructural.
MétodosEl presente fue un estudio observacional en el que se incluyeron pacientes consecutivos referidos a RMC con contraste intravenoso para la evaluación de morfología y función ventricular con diagnóstico o sospecha de miocardiopatía. Pacientes mayores de 18 años con MCH, miocardiopatía dilatada idiopática (MCD), miocardiopatía de etiología isquémico-necrótica (MIN), miocarditis (MC) y miocardiopatía restrictiva (amiloidosis y/o endomiocardiofibrosis) fueron seleccionados retrospectivamente de nuestra base de datos durante el periodo comprendido entre enero de 2014 y septiembre de 2014. Los pacientes con enfermedad valvular moderada a severa, pericardiopatías, y/o con miocardiopatías que comprendieran menos de 5 sujetos fueron excluidos (cardiopatías congénitas, hemocromatosis, miocardiopatía arritmogénica, amiloidosis, tumores, miocardio no compactado).
El grupo control se constituyó de individuos no diabéticos ni con hipertensión no controlada, con RMC normal, realizada durante el mismo periodo, que habían sido remitidos a RMC para descartar miocardiopatía por presentar arritmia ventricular, síncope, o ecocardiogramas no concluyentes. Se definió RMC normal como la presencia de cavidades de dimensiones y espesores normales, función sistólica global y regional normales, sin incremento patológico de la señal en secuencias ponderadas en T2 ni en secuencias turbo spin eco en densidad protónica, pericardio de espesor y señal normales, grandes vasos de dimensiones normales, ausencia de valvulopatías, cardiopatía congénita y/o masas, y ausencia de realce tardío de contraste en miocardio en el diagnóstico inicial.
El diagnóstico de MCH se basó en la presencia de espesor parietal≥15mm, en ausencia de cardiopatías que se asocien a hipertrofia ventricular o de hipertensión severa; y confirmación por RMC. El diagnóstico de MCD se basó en el hallazgo de volúmenes y diámetros ventriculares aumentados, fracción de expulsión disminuida, cinecoronariografía o angiotomografía computada de arterias coronarias sin lesiones significativas y sin otra causa que justifique el cuadro. El diagnóstico de MIN se basó en la presencia de deterioro de la función ventricular, diámetros y volúmenes ventriculares aumentados y antecedente de infarto de miocardio, confirmando la presencia de fibrosis miocárdica de etiología isquémico-necrótica mediante la identificación de realce tardío de contraste de patrón subendocárdico y/o transmural con una intensidad de la señal mayor a 2 desviaciones estándar que el miocardio remoto, sobre un área con alteraciones regionales de la motilidad. Finalmente, el diagnóstico de MC se basó en la presencia de un cuadro clínico (agudo o subagudo) compatible, coronariografía (invasiva o no invasiva) sin lesiones significativas, y hallazgos compatibles con MC en la RMC (según los criterios de Lake Louis que recomiendan la utilización combinada de los 3 marcadores tisulares derivados de la RMC (T2, densidad protónica-posgadolinio y realce tardío)17.
Adquisición de las imágenes de resonancia magnética cardíacaSe empleó un resonador de 1.5 tesla (Achieva, Philips Medical Systems, Best, Holanda). Se utilizó una antena cardíaca específica de 5 canales y las imágenes se adquirieron con sincronización cardíaca con vectocardiograma. El estudio anatomofuncional se efectuó con secuencia cine balanceada en estado estacionario, aceleración de imagen en paralelo adquirida al final de la espiración empleando un tiempo de repetición de 3.5ms; un tiempo de eco de 1.8ms y un ángulo de 60° en los ejes 2 cámaras; 3 cámaras (tracto de salida); 4 cámaras; eje corto cubriendo toda la extensión del ventrículo izquierdo (VI). También se realizaron secuencias turbo spin eco con sangre negra en densidad protónica con un tiempo de repetición de 1.935ms y un tiempo de eco de 40ms. Las secuencias de realce tardío se realizaron mediante secuencias de phase-sensitive inversion-recovery (PSIR) luego de una espera de 8-10min desde la administración por vía intravenosa de una dosis de gadolinio de 0.2mmol/kg.
Análisis de las imágenes de resonancia magnética cardíacaEl análisis fue realizado por un observador experimentado, ciego a los datos clínicos del paciente; en una estación de trabajo (ViewForum; Philips Medical Systems) con un software dedicado. Se determinaron el volumen de fin de diástole y de sístole del VI, el diámetro de fin de diástole y de sístole, la fracción de expulsión del VI, la masa miocárdica, espesores parietales segmentarios, índice de espesor parietal relativo, y la presencia de realce tardío.
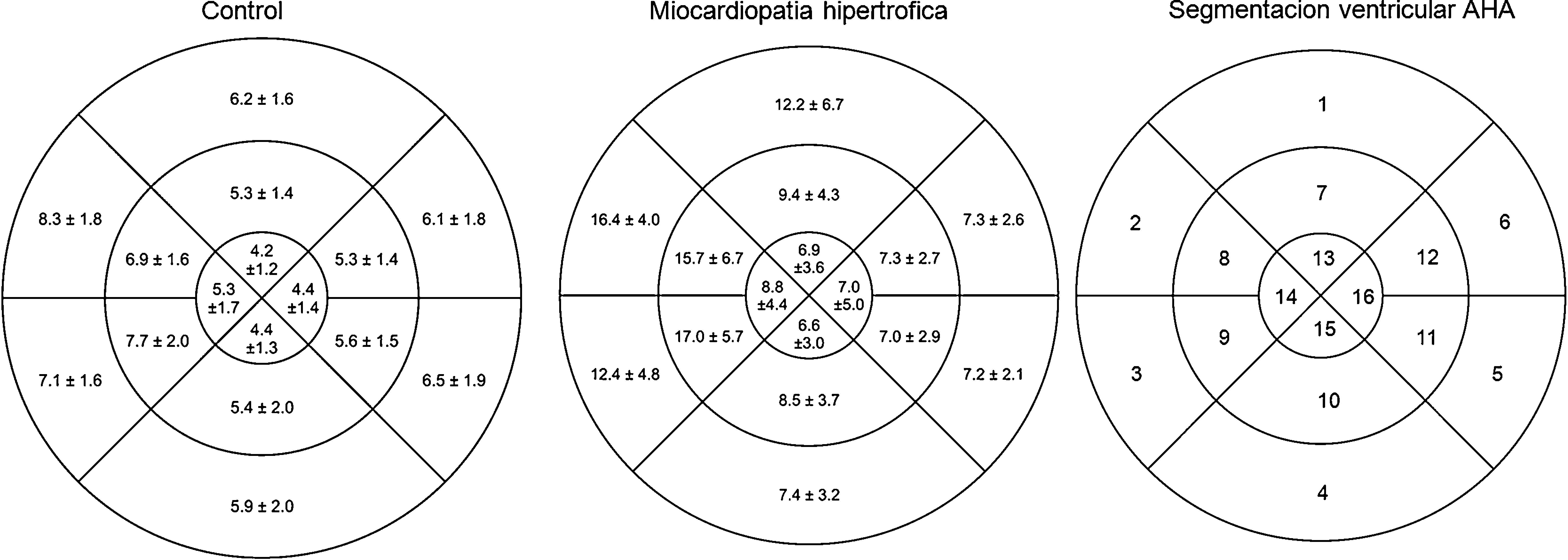
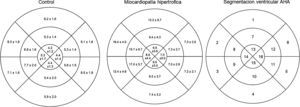
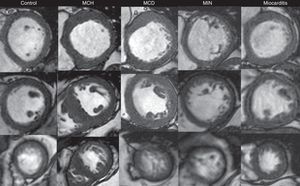
En las secuencias cine en eje corto que abarcaban la totalidad del VI se establecieron las fases de fin de diástole y de fin de sístole; posteriormente se delimitaron en forma semiautomática el epicardio y el endocardio con la exclusión de los músculos papilares. De este modo se calcularon la fracción de expulsión del VI y los volúmenes ventriculares. Se midieron los espesores parietales en fin de diástole en 16 de los 17 segmentos miocárdicos de la clasificación de la American Heart Association (AHA), excluyéndose el ápex propiamente dicho (fig. 1)18. La determinación de la masa miocárdica se efectuó en fin de diástole.
Espesores parietales medios segmentarios según la distribución espacial (segmentación ventricular en «ojo de buey» según la clasificación de la American Heart Association, donde los segmentos basales se observan en la periferia y los segmentos apicales en el centro) en individuos sin cardiopatía estructural (n=736), y en pacientes con miocardiopatía hipertrófica (n=528).
El índice de espesor parietal relativo se calculó en base a la relación entre el espesor anteroseptal dividido el espesor anterolateral, a nivel basal para el índice de espesor relativo basal y a nivel medial para el índice de espesor relativo medial. Se registraron todos los segmentos con espesor parietal<4mm para poder estimar la prevalencia de segmentos adelgazados. Todos los procedimientos fueron realizados acorde a los estándares de ética del comité de investigación institucional, y en cumplimiento con la declaración de Helsinki de 1964 y sus adendas posteriores. Se obtuvo el consentimiento informado escrito de todos los individuos incluidos en el estudio.
Análisis estadísticoLas variables categóricas se expresaron como cuentas y porcentajes y las variables continuas como media±desviación estándar en caso de distribución normal y como mediana con rango intercuartil para las variables de distribución anormal. Las comparaciones paramétricas entre grupos se realizaron mediante ANOVA y chi cuadrado. El nivel de significación estadística se estableció en un valor de p<0.05. Los análisis se realizaron con el software de estadística SPSS, versión 22.0 (Chicago, Illinois, EE: UU.).
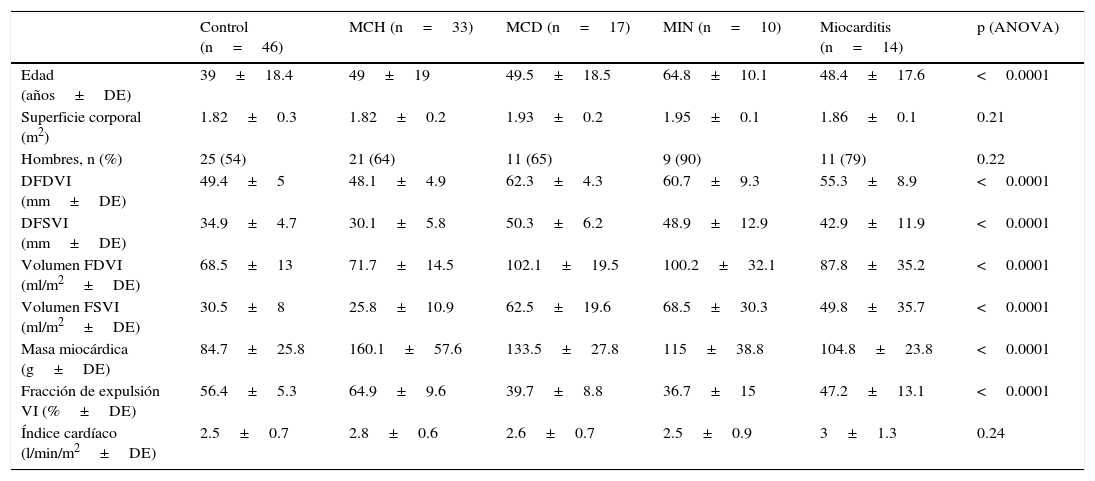
ResultadosMorfología y función ventricularesDe los 149 pacientes evaluados, 29 fueron excluidos por presentar hallazgos mixtos o contar con un n menor de 5. Finalmente fueron incluidos 120 pacientes (1,984 segmentos) en el estudio (control=46, MCH=33, MCD=17, MIN=10 y MC=14). Las diferencias entre grupos respecto a morfología y función ventricular se detallan en la tabla 1. Si bien no fue un dato estadísticamente significativo, se registró una mayor prevalencia del sexo femenino en el grupo control con respecto al resto de los grupos.
Características demográficas, morfología y función ventricular en individuos sin cardiopatía estructural (control) y en pacientes con miocardiopatía hipertrófica, miocardiopatía dilatada idiopática, miocardiopatía isquémico-necrótica y miocarditis
| Control (n=46) | MCH (n=33) | MCD (n=17) | MIN (n=10) | Miocarditis (n=14) | p (ANOVA) | |
|---|---|---|---|---|---|---|
| Edad (años±DE) | 39±18.4 | 49±19 | 49.5±18.5 | 64.8±10.1 | 48.4±17.6 | <0.0001 |
| Superficie corporal (m2) | 1.82±0.3 | 1.82±0.2 | 1.93±0.2 | 1.95±0.1 | 1.86±0.1 | 0.21 |
| Hombres, n (%) | 25 (54) | 21 (64) | 11 (65) | 9 (90) | 11 (79) | 0.22 |
| DFDVI (mm±DE) | 49.4±5 | 48.1±4.9 | 62.3±4.3 | 60.7±9.3 | 55.3±8.9 | <0.0001 |
| DFSVI (mm±DE) | 34.9±4.7 | 30.1±5.8 | 50.3±6.2 | 48.9±12.9 | 42.9±11.9 | <0.0001 |
| Volumen FDVI (ml/m2±DE) | 68.5±13 | 71.7±14.5 | 102.1±19.5 | 100.2±32.1 | 87.8±35.2 | <0.0001 |
| Volumen FSVI (ml/m2±DE) | 30.5±8 | 25.8±10.9 | 62.5±19.6 | 68.5±30.3 | 49.8±35.7 | <0.0001 |
| Masa miocárdica (g±DE) | 84.7±25.8 | 160.1±57.6 | 133.5±27.8 | 115±38.8 | 104.8±23.8 | <0.0001 |
| Fracción de expulsión VI (%±DE) | 56.4±5.3 | 64.9±9.6 | 39.7±8.8 | 36.7±15 | 47.2±13.1 | <0.0001 |
| Índice cardíaco (l/min/m2±DE) | 2.5±0.7 | 2.8±0.6 | 2.6±0.7 | 2.5±0.9 | 3±1.3 | 0.24 |
DFDVI: diámetros de fin de diastole; DFSVI: diámetros de fin de sístole; MCD: miocardiopatía dilatada idiopática; MCH: miocardiopatía hipertrófica; MIN: miocardiopatía isquémico-necrótica.
Se observaron diferencias significativas respecto a la fracción de expulsión del VI, presentando los pacientes con MCH un valor significativamente mayor. No se registraron diferencias significativas en cuanto al índice cardíaco en los distintos grupos. También se observaron diferencias significativas entre grupos respecto a la masa miocárdica, cuyo menor valor se evidenció en el grupo control. Estos resultados se expresan en la tabla 1.
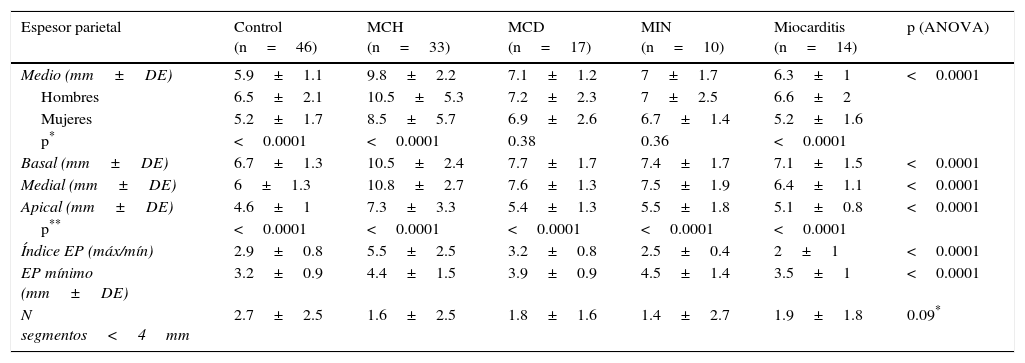
Espesores parietales regionalesLas diferencias entre grupos respecto a los espesores parietales se detallan en la tabla 2. El espesor parietal medio del grupo control fue de 5.9±1.1mm. Al evaluarlo según la distribución espacial categorizando los segmentos en basales (AHA 1 a 6), medios (AHA 7 a 12), y apicales (AHA 13 a 16), observamos espesores parietales medios significativamente menores en los segmentos apicales tanto en el grupo control (6.7±1.3 vs. 6±1.3 vs. 4.6±1mm, p<0.0001) como en todas las miocardiopatías evaluadas (MCH 10.5±2.4 vs. 10.8±2.7 vs. 7.3±3.3mm, p<0.0001; MCD 7.7±1.7 vs. 7.6±1.3 vs. 5.4±1.3mm, p<0.0001; MIN 7.4±1.7 vs. 7.5±1.9 vs. 5.5±1.8mm, p<0.0001; MC 7.1±1.5 vs. 6.4±1.1 vs. 5.1±0.8mm, p<0.0001). También se observaron diferencias significativas entre hombres y mujeres en el grupo control (7.8±2.2 vs. 6.6±2mm, p<0.0001), en la MCH (10.5±5.3 vs. 8.5±5.7mm, p<0.0001), y en la MC (6.6±2 vs. 5.2±1.6mm, p<0.0001).
Espesores parietales regionales en individuos sin cardiopatía estructural (control) y en pacientes con miocardiopatía hipertrófica, miocardiopatía dilatada idiopática, miocardiopatía isquémico-necrótica y miocarditis
| Espesor parietal | Control (n=46) | MCH (n=33) | MCD (n=17) | MIN (n=10) | Miocarditis (n=14) | p (ANOVA) |
|---|---|---|---|---|---|---|
| Medio (mm±DE) | 5.9±1.1 | 9.8±2.2 | 7.1±1.2 | 7±1.7 | 6.3±1 | <0.0001 |
| Hombres | 6.5±2.1 | 10.5±5.3 | 7.2±2.3 | 7±2.5 | 6.6±2 | |
| Mujeres | 5.2±1.7 | 8.5±5.7 | 6.9±2.6 | 6.7±1.4 | 5.2±1.6 | |
| p* | <0.0001 | <0.0001 | 0.38 | 0.36 | <0.0001 | |
| Basal (mm±DE) | 6.7±1.3 | 10.5±2.4 | 7.7±1.7 | 7.4±1.7 | 7.1±1.5 | <0.0001 |
| Medial (mm±DE) | 6±1.3 | 10.8±2.7 | 7.6±1.3 | 7.5±1.9 | 6.4±1.1 | <0.0001 |
| Apical (mm±DE) | 4.6±1 | 7.3±3.3 | 5.4±1.3 | 5.5±1.8 | 5.1±0.8 | <0.0001 |
| p** | <0.0001 | <0.0001 | <0.0001 | <0.0001 | <0.0001 | |
| Índice EP (máx/mín) | 2.9±0.8 | 5.5±2.5 | 3.2±0.8 | 2.5±0.4 | 2±1 | <0.0001 |
| EP mínimo (mm±DE) | 3.2±0.9 | 4.4±1.5 | 3.9±0.9 | 4.5±1.4 | 3.5±1 | <0.0001 |
| N segmentos<4mm | 2.7±2.5 | 1.6±2.5 | 1.8±1.6 | 1.4±2.7 | 1.9±1.8 | 0.09* |
DE: desviación estándar; MCD: miocardiopatía dilatada idiopática; MCH: miocardiopatía hipertrófica; MIN: miocardiopatía isquémico-necrótica.
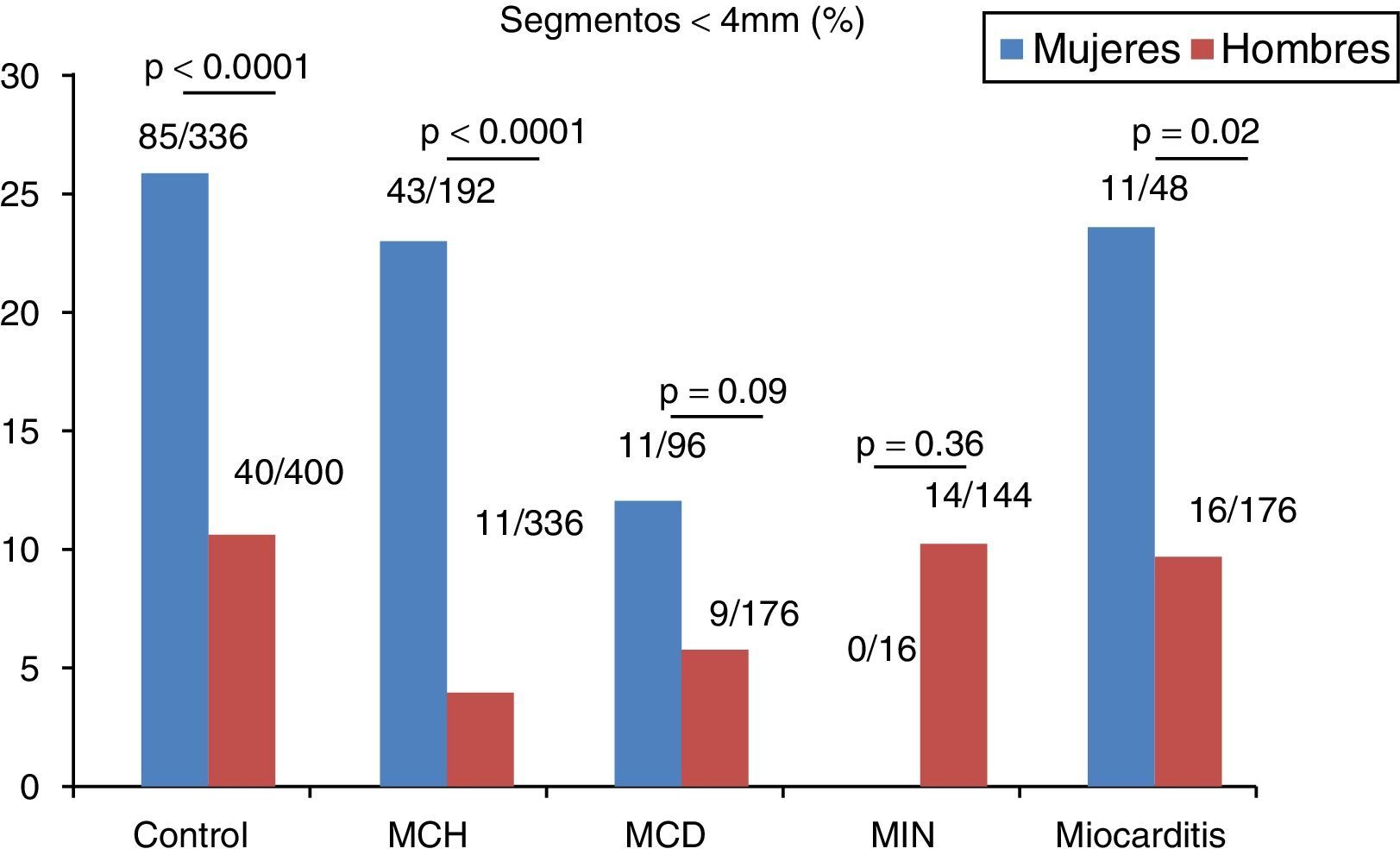
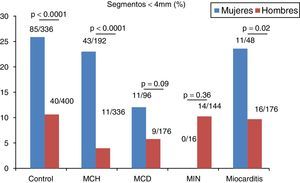
En el grupo control se registró una media de 2.7±2.5 segmentos con espesor<4mm, siendo más prevalente que en el resto de los grupos, aunque sin registrarse diferencias estadísticamente significativas. Al evaluar el número de segmentos con espesor<4mm en cada subgrupo acorde al sexo, observamos una clara diferencia con mayor prevalencia de dichos segmentos en el sexo femenino en todos los grupos excepto en los grupos MIN y MCD (fig. 2). En la misma línea, el espesor parietal medio fue significativamente menor en mujeres (tabla 2).
Tanto en el grupo control como en todas las miocardiopatías se identificaron diferencias significativas entre el espesor del septum interventricular y el de la pared libre del VI (fig. 3), siendo el índice de espesor relativo de 2.9±0.8mm en el grupo control, de 5.5±2.5mm en MCH, de 3.2±0.8mm en MCD, de 2.5±0.4mm en MIN y de 2±1mm en MC (p<0.0001).
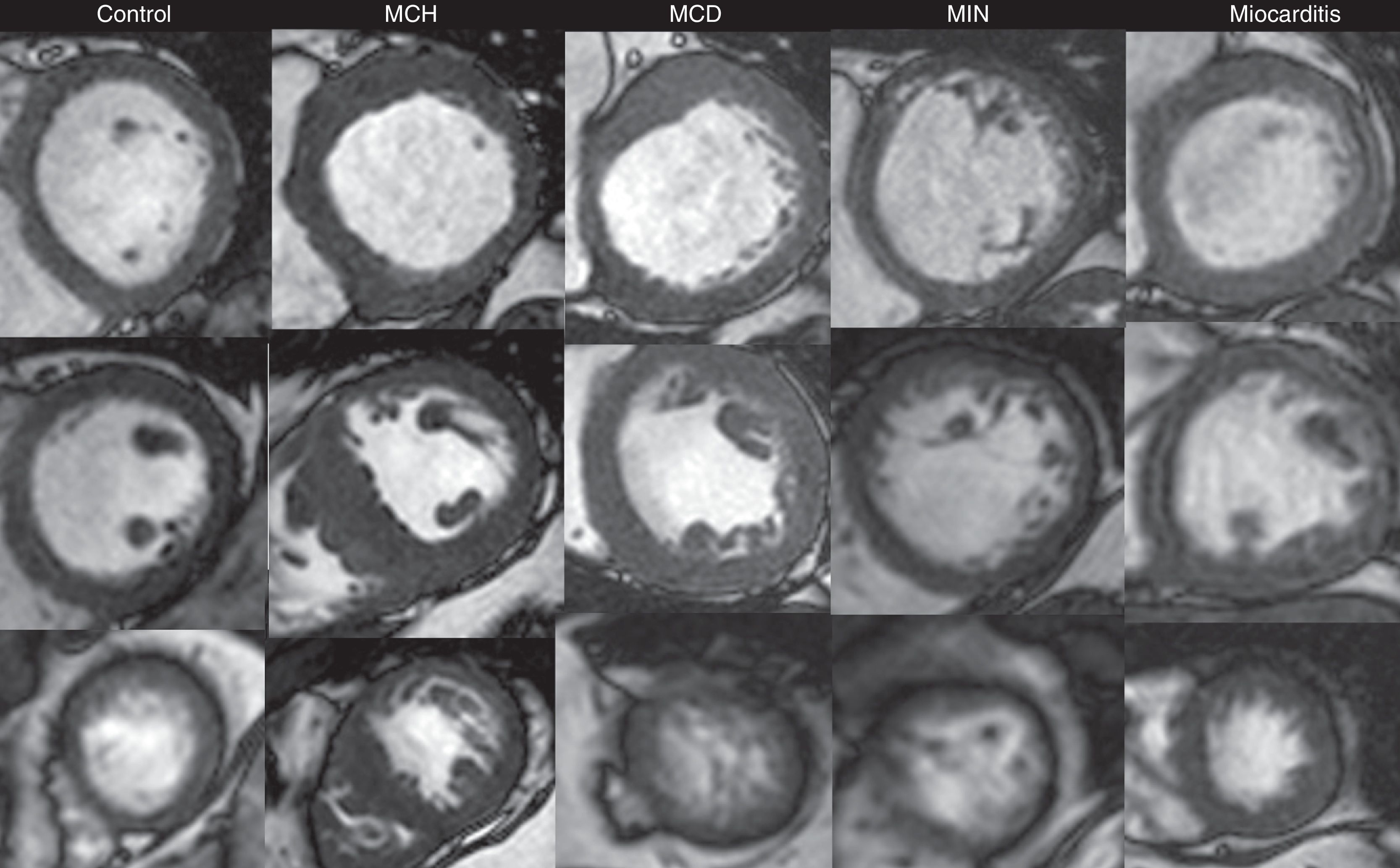
Secuencias de cine en fin de diástole (ejes cortos a nivel basal, medial y apical en filas superior, media, e inferior; respectivamente). Se presentan ejemplos de individuos sin evidencia de cardiopatía estructural (control) y de pacientes con miocardiopatía hipertrófica (MCH), miocardiopatía dilatada idiopática (MCD), miocardiopatía isquémico-necrótica (MIN) y miocarditis.
Nuestros principales hallazgos podrían resumirse de la siguiente manera:
En individuos no diabéticos sin evidencia de cardiopatía estructural observamos un número no despreciable de segmentos comúnmente considerados como adelgazados. Llamativamente, no se registraron diferencias significativas respecto a este hallazgo entre el grupo control y distintas miocardiopatías asociadas a heterogeneidad de espesores parietales (MCH, MIN) y/o a adelgazamiento parietal difuso (MCD). Esto podría asociarse al menos parcialmente a una mayor proporción de mujeres en el grupo control, destacándose diferencias significativas entre sexos en cuanto a la prevalencia de segmentos adelgazados en todo el espectro de los pacientes estudiados.
Además, observamos una marcada asimetría y gradiente longitudinal en cuanto a espesores parietales tanto en controles como en las distintas miocardiopatías evaluadas, con espesores apicales significativamente menores.
Un número de estudios ha descrito como miocardio no viable aquel con un espesor diastólico<5mm19-23. Nuestros hallazgos plantean la eventual necesidad de reevaluar los valores que adoptamos como normales y patológicos, y revisar la definición estrictamente anatómica de miocardio no viable. Más aún, plantean la eventual necesidad de reconsiderar el concepto de adelgazamiento parietal, puesto que los valores que registramos en el grupo control son marcadamente inferiores a los aceptados habitualmente como normales. De hecho, el espesor medio de la pared libre en el grupo control se mantuvo cercano a 5mm; e inclusive en pacientes con MCH raramente el espesor de los segmentos laterales alcanzó los 10mm (valor de referencia máximo normal). Del mismo modo y debido a los hallazgos previamente mencionados, creemos que a la hora de definir dichos valores debería de considerarse además de la superficie corporal y la localización, el sexo del paciente.
En segundo lugar, la media del índice de espesor relativo fue de 2.9, por consiguiente estableciendo un punto de corte superior (media+2 desviaciones estándar) de 4.5. Fácilmente se desprende de esto que los espesores parietales miocárdicos no son simétricos, sino que, por el contrario, hay una clara diferencia entre los valores de cada segmento. Esto cobra importancia a la hora de evaluar a pacientes con sospecha de MCH, particularmente considerando que más del 10% de los pacientes con MCH presentan hipertrofia en solo uno o 2 segmentos. En distintas publicaciones se acepta el diagnóstico de MCH en base a un índice de espesor relativo>1.3 en ausencia de condiciones de carga que lo justifiquen, valor francamente inferior al hallado en nuestro estudio en el grupo control. Nuevamente los hallazgos de nuestro trabajo nos indican que quizá estos parámetros deberían reevaluarse24–27.
En tercer lugar, observamos la presencia de un gradiente longitudinal decreciente de espesor parietal desde la base hasta el ápex. Discriminándolo por sectores, los segmentos apicales del grupo MCH registraron valores ampliamente superiores de espesor parietal que el resto de los grupos pero siempre con valores muy inferiores a 15mm, por consiguiente muchos diagnósticos de MCH estrictamente apical podrían pasarse por alto si no diferenciamos los valores de corte no solo según el sexo sino también según el sector evaluado.
En lo referido al grupo MCH, acorde a lo reportado en distintas publicaciones hasta un 42% de las mismas son concéntricas24. No obstante, en nuestro estudio la media de índice de espesor relativo en este grupo fue de 5.5, de lo cual se podría deducir que la gran mayoría de las MCH tienen un patrón asimétrico. Asimismo, observamos que el espesor parietal máximo se localizó predominantemente en el segmento inferoseptal medio y en segundo lugar anteroseptal basal y medio.
En la misma línea, y como fue previamente mencionado en nuestro estudio, no se registraron diferencias significativas entre los distintos grupos en cuanto al número de segmentos con espesor parietal<4mm. Otro motivo para reevaluar la definición de miocardio no viable en base al espesor del mismo.
Por último, en lo referido a MC, está aceptado que el sector más afectado generalmente es el inferolateral basal. En nuestro estudio no se registraron modificaciones significativas en el espesor de dicho segmento con respecto al resto de los segmentos, confirmando que el daño observado en pacientes con MC no suele conducir a adelgazamiento parietal.
Este es el primer estudio que reportó diferencias segmentarias de espesores parietales en distintas miocardiopatías así como también en individuos sin cardiopatía estructural por medio de RMC. En un estudio previo, Kawel et al. reportaron los espesores parietales regionales normales en individuos sin evidencia de cardiopatía estructural pero con un claro sesgo en cuanto a la edad (edad media 65±8.5 anos) que podría explicar los espesores ligeramente mayores en esa población. En otro estudio europeo que incluyo voluntarios sanos, Dawson et al. también encontraron espesores algo mayores a los que reportamos en nuestro estudio28. No existen reportes a nivel regional de valores normales de espesor parietal, tanto global como segmentario; esto es importante debido a las conocidas diferencias fenotípicas étnicas descriptas en la literatura. La relevancia clínica de nuestros hallazgos radica principalmente en la identificación de una marcada heterogeneidad (transversal y longitudinal) de los espesores parietales tanto en individuos sanos como en pacientes con miocardiopatías, incluyendo una prevalencia relativamente elevada de segmentos generalmente considerados adelgazados en ambos grupos. Si bien exploratorias, nuestras observaciones plantean la eventual necesidad de reconsiderar los valores que adoptamos como patológicos, particularmente en cuanto a la definición anatómica de miocardio viable así como en la evaluación de pacientes con sospecha de MCH.
LimitacionesSe deben mencionar un número de limitaciones. Nuestro estudio incluyó una muestra relativamente pequeña de pacientes, potencialmente conduciendo a un sesgo de selección. En la misma línea, si bien el grupo control estuvo compuesto por pacientes no diabéticos con resonancia magnética normal, no podemos descartar de manera concluyente la existencia de algún grado de fibrosis difusa subyacente detectable quizá con técnicas de T1 mapping, no evaluadas en este estudio; particularmente, por el hecho de haber incluido entre el grupo control a individuos con hipertensión controlada. Además, al desconocerse la edad del infarto en los pacientes con MIN no puede establecerse la relación entre el adelgazamiento parietal y la cronología del mismo. Finalmente, la menor cantidad de hombres con estudios normales en nuestra población comparado con el porcentaje de hombres en las micardiopatías evaluadas podría influir en las diferencias observadas en cuanto a género respecto a los espesores parietales. Por lo tanto, en conjunto con el carácter observacional del mismo, nuestros hallazgos deben ser considerados como generadores de hipótesis.
ConclusionesEn este estudio observacional encontramos una prevalencia relativamente elevada de segmentos comúnmente considerados como adelgazados en individuos no diabéticos sin cardiopatía estructural. Además, observamos una marcada asimetría y gradiente longitudinal de los espesores parietales tanto en controles como en las distintas miocardiopatías evaluadas, así como diferencias significativas entre sexos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.