Realizar una revisión sistemática para conocer el efecto del ejercicio físico sobre el sistema serotoninérgico y la conducta en roedores.
Estrategia de búsquedaSe realizó una revisión bibliográfica en marzo de 2017 en las bases de datos y buscadores: Pubmed, Medline, Cinahl, Sport Discus, Scopus, Web of Science, Cochrane library y Plos One.
Selección de estudiosSe aplicaron los criterios de inclusión (ensayos publicados entre enero de 2012 y febrero 2017) y exclusión (trabajos realizados en humanos, estudios duplicados y que no se ajustases al tema de estudio), obteniéndose un total de 12 artículos.
Síntesis de resultadosEl ejercicio disminuye la conducta ansiosa. En cuanto al neurotransmisor estudiado existen diferentes resultados.
ConclusionesEl ejercicio físico ejerce cambios a nivel conductual y cerebral. El efecto sobre neurotransmisor 5-HT depende de la región o sistema cerebral estudiados. Aumenta los niveles de 5HT1a provocando un efecto ansiolítico y la resistencia a la acción ansiogénica del 5HT2c.
Perform a systematic review to know the effect of physical exercise on the serotoninergic system and behavior in rodents.
Search strategyIn March 2017 the following databases and search engines were used: Pubmed, Medline, Cinahl, Sport Discus, Scopus, Web of Science, Cochrane library and Plos One.
Selection of studiesAfter applying the inclusion (published trials between January 2012 and February 2017) and exclusion criteria (human work, duplicate studies and those not adjusted to the subject of study) 12 articles were analysed.
Synthesis of resultsexercise decreases anxious behavior. As for the neurotransmitter studied, there are different results.
Conclusionsphysical exercise exerts behavioral and cerebral changes. The effect on 5-HT neurotransmitter depends on the region or brain system studied. It increases 5HT1a levels provoking an anxiolytic effect and the resistance to the anxiogenic action of 5HT2c.
Los trastornos de ansiedad constituyen el grupo más numeroso de desórdenes mentales en las sociedades occidentales de Europa y los Estados Unidos (Craske et al., 2017; Metzler, Mahoney y Freedy, 2016). Las características esenciales de éstos son el miedo excesivo y persistente, la ansiedad o la evitación de las amenazas percibidas, ya sea en el entorno externo (por ejemplo, en situaciones sociales) o interno (por ejemplo, sensaciones corporales). Por lo general, son dos veces más frecuentes en mujeres que en hombres y en cuanto a la edad afecta mayoritariamente a niños, adolescentes y adultos jóvenes (Craske et al., 2017). El incremento de la incidencia de estas alteraciones conductuales, ha provocado el aumento de estudios de la fisiología subyacente, para su tratamiento.
Se ha demostrado que estos trastornos están regulados por una serie de mecanismos fisiológicos tales como el eje hipotalámico-pituitario-adrenal, el procesamiento de la amígdala, el sistema opioide, los factores neurotróficos y sistemas monoaminérgicos implicados en los niveles de noradrenalina y serotonina (Anderson y Shivakumar, 2013; Curran y Chalasani, 2012). Estructuralmente, el sistema serotoninérgico está formado por cuerpos celulares de neuronas serotoninérgicas localizados en grupos de células creando el sistema rafe en el sistema nervioso central (SNC). Estas neuronas se proyectan frontalmente y caudalmente originando el núcleo rafe mediano (NRM) y el núcleo rafe dorsal (NRD) (Olivier, 2015).
La serotonina, también llamada 5-hidroxitriptamina (5-HT), es un neurotransmisor ampliamente relacionado con la ansiedad, pero los mecanismos fisiopatológicos por los que influye en estos trastornos sigue siendo un tema importante de investigación (Clark et al., 2015; Greenwood et al., 2012; Lee et al., 2016; Otsuka et al., 2016; Park, Lee, Cho, Park y Kim, 2017; Rogers et al., 2016; Seo, Kim, Kim, Sung y Lee, 2013).
Para que la serotonina realice su acción, precisa receptores que la asimilen. Actualmente se sabe que existen 14 receptores de 5-HT, aunque solamente están descritos algunos de ellos (Millan, Marin, Bockaert y Mannoury la Cour, 2008):
- •
Receptores 5-HT1A, 1B: situados presinápticamente su antagonista provoca un aumento de 5HT libre y son clave en el tratamiento de trastornos depresivos o ansiosos. Sin embargo, la activación del receptor 5-HT1A postsináptico parece mejorar la clínica de éstos.
- •
Receptores 5-HT2: El bloqueo de los receptores 5-HT2A/2C mejora la acción de los inhibidores selectivos de la recaptación de serotonina (ISRS), mientras que la activación del receptor 5-HT2B aumenta la actividad serotoninérgica.
- •
Receptores 5-HT3: El bloqueo de este receptor puede aumentar la acción antidepresiva de la inhibición del transportador de serotonina (SERT).
- •
Receptor 5-HT4: su activación parece mejorar la conducta e incrementa la efectividad de los ISRS.
- •
Receptores 5-HT6, 7: al igual que los receptores 5-HT3, mejora la actuación de la inhibición de SERT en la conducta (Artigas, 2013).
Para evaluar la actividad de 5-HT, en el sistema nervioso central (SNC) de humanos, se debería analizar el líquido cefalorraquídeo (LCR) pero es un proceso arriesgado y laborioso. En los últimos diez años, un pequeño número de estudios analizan los niveles de 5-HT en sangre o en orina, basándose en que los sistemas de transporte expulsan el exceso proteico y de 5-HT del LCR al torrente sanguíneo y que la concentración de 5-HT en orina tiene correlación con el nivel de este neurotransmisor en el LCR (Ohmatsu et al., 2014). No obstante, estas técnicas están en vías de desarrollo y los estudios que las incluyen presentan limitaciones en cuanto a la muestra y la metodología.
Algunas de la funciones mentales superiores humanas, tanto normales como patológicas, pueden ser estudiadas en modelos animales puesto que se ha establecido una clara relación durante el proceso evolutivo entre las diferentes especies de mamíferos. Por ello, son utilizados los modelos animales de ansiedad con los que se obtienen respuestas condicionales o incondicionales. Las primeras involucran procedimientos de castigo, generalmente choque eléctrico (Gómez, Saldívar-González y Rodríguez, 2002), mientras que en los segundos se observan las conductas específicas de los animales ante diferentes situaciones. Dentro de estos últimos los más utilizados son el test de suspensión en cola, y el test de laberinto. El primer procedimiento consiste en suspender en el vacío a los roedores, de forma que si el animal muestra ante esta situación una movilidad reducida se entiende que presenta miedo, ansiedad o estado depresivo. El test de laberinto, por su parte, consta de dos brazos abiertos perpendiculares a dos brazos cerrados, obteniéndose una disposición en cruz. Si los ratones evitan los brazos abiertos se deduce que presentan fobia o ansiedad a un ambiente no familiar, a los espacios abiertos y/o elevados (Cárdenas y Navarro, 2002).
La primera opción de tratamiento con el fin de reestablecer los niveles de 5-HT, es la prescripción de fármacos antidepresivos, a pesar de la existencia de riesgos producidos por sus efectos secundarios para la salud (Metzler et al., 2016; Nevels, Gontkovsky y Williams, 2016; Patki et al., 2014). Esto provoca la búsqueda de otras opciones de tratamiento. Existen datos subjetivos y objetivos sobre los efectos del ejercicio sobre el estado de ánimo y el comportamiento en humanos, pero la mayoría utilizan cuestionarios subjetivos como instrumentos de medida por lo que no se conoce con exactitud cuáles son los mecanismos implicados en este proceso (Fominasa y Orozco, 1988). Por ello, en la presente revisión bibliográfica se analizaron estudios en los que estudiaron los efectos del ejercicio en una muestra de roedores ya que el método más accesible, eficaz, fiable y ampliamente extendido es la medición de los neurotransmisores, extirpando las distintas partes del SNC que se quieran analizar post mortem.
ObjetivoEl objetivo del presente estudio es realizar una revisión sistemática para conocer el efecto del ejercicio físico sobre el sistema serotoninérgico y la conducta en animales.
Estrategia de búsquedaEn esta revisión bibliográfica se realizó una búsqueda de la literatura científica en marzo de 2017, centrándose en el efecto del ejercicio físico sobre el sistema serotoninérgico y su traducción sobre la conducta en roedores. Para su realización, se lanzó la búsqueda en las siguientes bases de datos y buscadores: Pubmed, Medline, Cinahl, Sport Discus, Scopus, Web of Science, Cochrane library y Plos One.
Las búsquedas se realizaron con los términos: “Serotonin”, “Anxiety”, “Exercise” y los descriptores Mesh: “Serotonin”, “Anxiety disorders” y “Exercise” utilizando el operador boleano AND.
También se emplearon las ecuaciones: ((“Serotonin”[Mesh]) AND “Anxiety Disorders”[Mesh]) AND “Exercise”[Mesh] en Pubmed y “Serotonergic system” AND “Anxiety” AND “Exercise” en Medline, Cinahl y Sport Discus sin la obtención de artículos acordes al estudio.
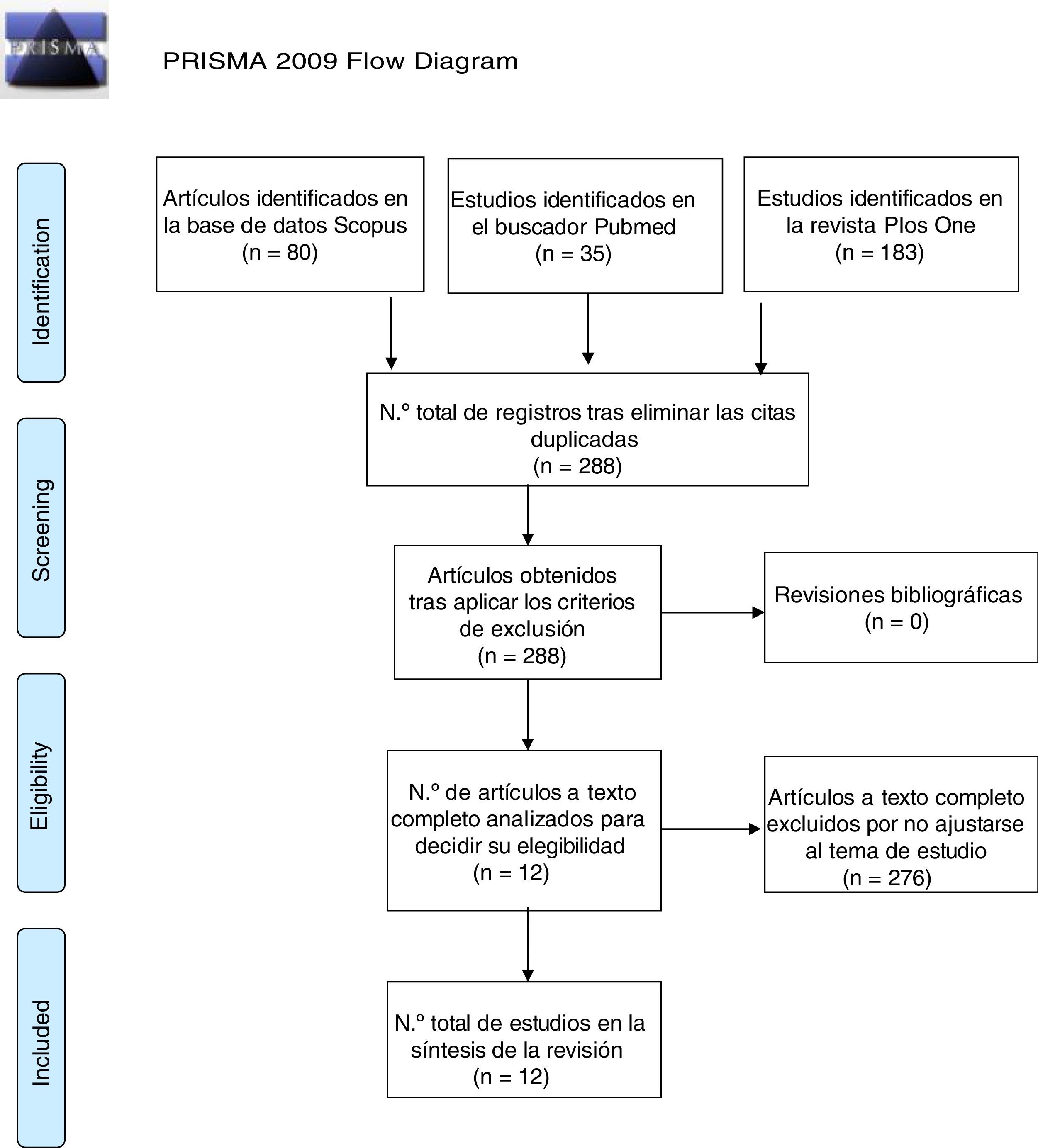
Selección de estudiosTras el lanzamiento de la búsqueda, se establecieron los siguientes criterios: se incluyeron ensayos y estudios de investigación publicados desde enero de 2012 a febrero de 2017, con el fin de recabar la literatura más actual ya que en ciencias de la salud se aconseja que los estudios utilizados no tengan más de 5 años de antigüedad. Asimismo, se excluyeron aquellos cuya muestra fuese humanos, los estudios duplicados y los que no se ajustaban al tema de estudio. Finalmente se obtuvieron un total de 12 artículos válidos para esta revisión, tal como se muestra en la Figura 1.
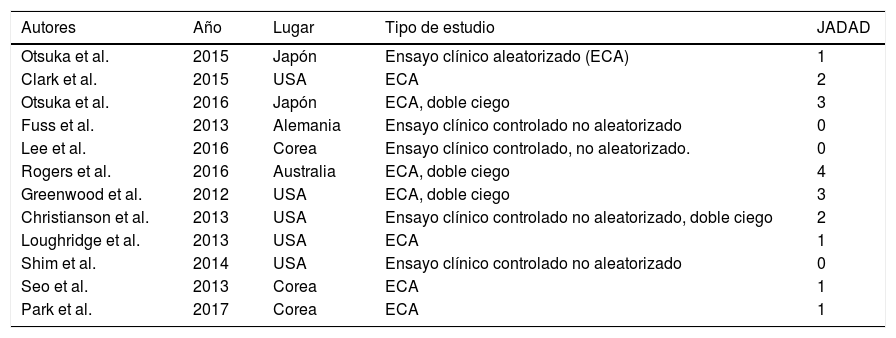
Para evaluar la calidad y validez metodológica de las investigaciones fueron sometidas a la escala JADAD (véase Tabla 1), La escala JADAD evalúa los ensayos clínicos; es sencilla, fácil y rápida con preguntas sobre la aleatorización, el enmascaramiento de los pacientes y del investigador al tratamiento y la descripción de las pérdidas de seguimiento. La puntuación oscila de 0 a 5 puntos, considerándose de baja calidad aquellos estudios que obtienen una puntuación inferior a 3 puntos (Clark et al., 1999).
Características generales de los artículos
| Autores | Año | Lugar | Tipo de estudio | JADAD |
|---|---|---|---|---|
| Otsuka et al. | 2015 | Japón | Ensayo clínico aleatorizado (ECA) | 1 |
| Clark et al. | 2015 | USA | ECA | 2 |
| Otsuka et al. | 2016 | Japón | ECA, doble ciego | 3 |
| Fuss et al. | 2013 | Alemania | Ensayo clínico controlado no aleatorizado | 0 |
| Lee et al. | 2016 | Corea | Ensayo clínico controlado, no aleatorizado. | 0 |
| Rogers et al. | 2016 | Australia | ECA, doble ciego | 4 |
| Greenwood et al. | 2012 | USA | ECA, doble ciego | 3 |
| Christianson et al. | 2013 | USA | Ensayo clínico controlado no aleatorizado, doble ciego | 2 |
| Loughridge et al. | 2013 | USA | ECA | 1 |
| Shim et al. | 2014 | USA | Ensayo clínico controlado no aleatorizado | 0 |
| Seo et al. | 2013 | Corea | ECA | 1 |
| Park et al. | 2017 | Corea | ECA | 1 |
Los 12 artículos que se obtuvieron en esta revisión estudian los efectos del ejercicio en roedores. Para inducir estrés en la muestra se utilizaron descargas eléctricas, la exposición a un elemento agresor, el cambio de entorno o la manipulación sustancias bloqueantes de determinados receptores. Tras la exposición a estas fuentes de estrés, los animales realizaron ejercicio físico y posteriormente se estudiaron los cambios a nivel conductual y a nivel cerebral en función de los diferentes receptores.
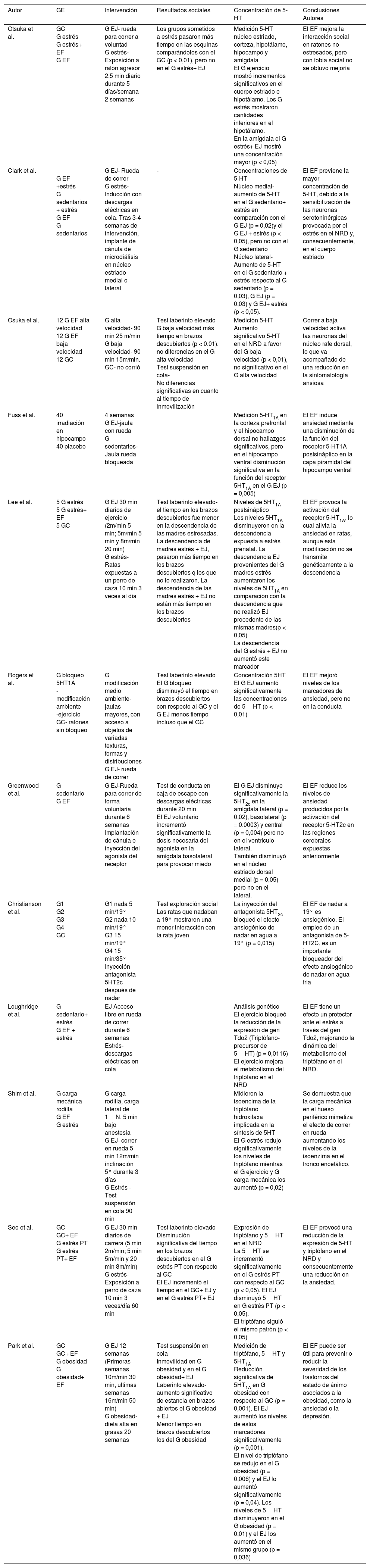
La información más relevante de cada investigación se ha expuesto en la Tabla 2, en ella se muestra el tipo de ejercicio físico realizado, los resultados de cada estudio en cuanto a los cambios en las concentraciones de 5-HT y conductuales, además de las conclusiones de los diferentes autores.
Resultados
| Autor | GE | Intervención | Resultados sociales | Concentración de 5-HT | Conclusiones Autores |
|---|---|---|---|---|---|
| Otsuka et al. | GC G estrés G estrés+ EF G EF | G EJ- rueda para correr a voluntad G estrés- Exposición a ratón agresor 2,5 min diario durante 5 días/semana 2 semanas | Los grupos sometidos a estrés pasaron más tiempo en las esquinas comparándolos con el GC (p < 0,01), pero no en el G estrés+ EJ | Medición 5-HT núcleo estriado, corteza, hipotálamo, hipocampo y amígdala El G ejercicio mostró incrementos significativos en el cuerpo estriado e hipotálamo. Los G estrés mostraron cantidades inferiores en el hipotálamo. En la amígdala el G estrés+ EJ mostró una concentración mayor (p < 0,05) | El EF mejora la interacción social en ratones no estresados, pero con fobia social no se obtuvo mejoría |
| Clark et al. | G EF +estrés G sedentarios + estrés G EF G sedentarios | G EJ- Rueda de correr G estrés- Inducción con descargas eléctricas en cola. Tras 3-4 semanas de intervención, implante de cánula de microdiálisis en núcleo estriado medial o lateral | - | Concentraciones de 5-HT Núcleo medial- aumento de 5-HT en el G sedentario+ estrés en comparación con el G EJ (p = 0,02)y el G EJ + estrés (p < 0,05), pero no con el G sedentario Núcleo lateral- Aumento de 5-HT en el G sedentario + estrés respecto al G sedentario (p = 0,03), G EJ (p = 0,03) y G EJ+ estrés (p < 0,05). | El EF previene la mayor concentración de 5-HT, debido a la sensibilización de las neuronas serotoninérgicas provocada por el estrés en el NRD y, consecuentemente, en el cuerpo estriado |
| Osuka et al. | 12 G EF alta velocidad 12 G EF baja velocidad 12 GC | G alta velocidad- 90 min 25 m/min G baja velocidad- 90 min 15m/min. GC- no corrió | Test laberinto elevado G baja velocidad más tiempo en brazos descubiertos (p < 0,01), no diferencias en el G alta velocidad Test suspensión en cola- No diferencias significativas en cuanto al tiempo de inmovilización | Medición 5-HT Aumento significativo 5-HT en el NRD a favor del G baja velocidad (p < 0,01), no significativo en el G alta velocidad | Correr a baja velocidad activa las neuronas del núcleo rafe dorsal, lo que va acompañado de una reducción en la sintomatología ansiosa |
| Fuss et al. | 40 irradiación en hipocampo 40 placebo | 4 semanas G EJ-jaula con rueda G sedentarios-Jaula rueda bloqueada | Medición 5-HT1A en la corteza prefrontal y el hipocampo dorsal no hallazgos significativos, pero en el hipocampo ventral disminución significativa en la función del receptor 5HT1A en el G EJ (p = 0,005) | El EF induce ansiedad mediante una disminución de la función del receptor 5-HT1A postsináptico en la capa piramidal del hipocampo ventral | |
| Lee et al. | 5 G estrés 5 G estrés+ EF 5 GC | G EJ 30 min diarios de ejercicio (2m/min 5 min; 5m/min 5 min y 8m/min 20 min) G estrés- Ratas expuestas a un perro de caza 10 min 3 veces al día | Test laberinto elevado- el tiempo en los brazos descubiertos fue menor en la descendencia de las madres estresadas. La descendencia de madres estrés + EJ, pasaron más tiempo en los brazos descubiertos q los que no lo realizaron. La descendencia de las madres estrés + EJ no están más tiempo en los brazos descubiertos | Niveles de 5HT1A postsináptico Los niveles 5HT1A disminuyeron en la descendencia expuesta a estrés prenatal. La descendencia EJ provenientes del G madres estrés aumentaron los niveles de 5HT1A en comparación con la descendencia que no realizó EJ procedente de las mismas madres(p < 0,05) La descendencia del G estrés + EJ no aumentó este marcador | El EF provoca la activación del receptor 5-HT1A, lo cual alivia la ansiedad en ratas, aunque esta modificación no se transmite genéticamente a la descendencia |
| Rogers et al. | G bloqueo 5HT1A -modificación ambiente -ejercicio GC- ratones sin bloqueo | G modificación medio ambiente- jaulas mayores, con acceso a objetos de variadas texturas, formas y distribuciones G EJ- rueda de correr | Test laberinto elevado El G bloqueo disminuyó el tiempo en brazos descubiertos con respecto al GC y el G EJ menos tiempo incluso que el GC | Concentración 5HT El G EJ aumentó significativamente las concentraciones de 5HT (p < 0,01) | El EF mejoró niveles de los marcadores de ansiedad, pero no en la conducta |
| Greenwood et al. | G sedentario G EF | G EJ-Rueda para correr de forma voluntaria durante 6 semanas Implantación de cánula e inyección del agonista del receptor | Test de conducta en caja de escape con descargas eléctricas durante 20 min El EJ voluntario incrementó significativamente la dosis necesaria del agonista en la amígdala basolateral para provocar miedo | El G EJ disminuye significativamente la 5HT2c en la amígdala lateral (p = 0,02), basolateral (p = 0,0003) y central (p = 0,004) pero no en el ventrículo lateral. También disminuyó en el núcleo estriado dorsal medial (p = 0,05) pero no en el lateral. | El EF reduce los niveles de ansiedad producidos por la activación del receptor 5-HT2c en las regiones cerebrales expuestas anteriormente |
| Christianson et al. | G1 G2 G3 G4 GC | G1 nada 5 min/19° G2 nada 10 min/19° G3 15 min/19° G4 15 min/35° Inyección antagonista 5HT2c después de nadar | Test exploración social Las ratas que nadaban a 19° mostraron una menor interacción con la rata joven | La inyección del antagonista 5HT2c bloqueó el efecto ansiogénico de nadar en agua a 19° (p = 0,015) | El EF de nadar a 19° es ansiogénico. El empleo de un antagonista de 5-HT2C, es un importante bloqueador del efecto ansiogénico de nadar en agua fría |
| Loughridge et al. | G sedentario+ estrés G EF + estrés | EJ Acceso libre en rueda de correr durante 6 semanas Estrés- descargas eléctricas en cola | Análisis genético El ejercicio bloqueó la reducción de la expresión de gen Tdo2 (Triptófano-precursor de 5HT) (p = 0,0116) El ejercicio mejora el metabolismo del triptófano en el NRD | El EF tiene un efecto un protector ante el estrés a través del gen Tdo2, mejorando la dinámica del metabolismo del triptófano en el NRD. | |
| Shim et al. | G carga mecánica rodilla G EF G estrés | G carga rodilla, carga lateral de 1N, 5 min bajo anestesia G EJ- correr en rueda 5 min 12m/min inclinación 5° durante 3 días G Estrés -Test suspensión en cola 90 min | Midieron la isoencima de la triptófano hidroxilaxa implicada en la síntesis de 5HT El G estrés redujo significativamente los niveles de triptófano mientras el G ejercicio y G carga mecánica los aumentó (p = 0,02) | Se demuestra que la carga mecánica en el hueso periférico mimetiza el efecto de correr en rueda aumentando los niveles de la isoenzima en el tronco encefálico. | |
| Seo et al. | GC GC+ EF G estrés PT G estrés PT+ EF | G EJ 30 min diarios de carrera (5 min 2m/min; 5 min 5m/min y 20 min 8m/min) G estrés- Exposición a perro de caza 10 min 3 veces/día 60 min | Test laberinto elevado Disminución significativa del tiempo en los brazos descubiertos en el G estrés PT con respecto al GC El EJ incrementó el tiempo en el GC+ EJ y en el G estrés PT+ EJ | Expresión de triptófano y 5HT en el NRD La 5HT se incrementó significativamente en el G estrés PT con respecto al GC (p < 0,05). El EJ disminuyó 5HT en G estrés PT (p < 0,05). El triptófano siguió el mismo patrón (p < 0,05) | El EF provocó una reducción de la expresión de 5-HT y triptófano en el NRD y consecuentemente una reducción en la ansiedad. |
| Park et al. | GC GC+ EF G obesidad G obesidad+ EF | G EJ 12 semanas (Primeras semanas 10m/min 30 min, ultimas semanas 16m/min 50 min) G obesidad- dieta alta en grasas 20 semanas | Test suspensión en cola Inmovilidad en G obesidad y en el G obesidad+ EJ Laberinto elevado- aumento significativo de estancia en brazos abiertos el G obesidad + EJ Menor tiempo en brazos descubiertos los del G obesidad | Medición de triptófano, 5HT y 5HT1A Reducción significativa de 5HT1A en G obesidad con respecto al GC (p = 0,001). El EJ aumentó los niveles de estos marcadores significativamente (p = 0,001). El nivel de triptófano se redujo en el G obesidad (p = 0,006) y el EJ lo aumentó significativamente (p = 0,04). Los niveles de 5HT disminuyeron en el G obesidad (p = 0,01) y el EJ los aumentó en el mismo grupo (p = 0,036) | El EF puede ser útil para prevenir o reducir la severidad de los trastornos del estado de ánimo asociados a la obesidad, como la ansiedad o la depresión. |
5HT- serotonina; EF- ejercicio físico; G- grupo; GC- grupo control; m- metro; min- minutos; NRD- núcleo del rafe dorsal; PT- postraumático; Tdo2- triptófano 2, 3 diogenasa.
En primer lugar centrándose en la calidad de los trabajos de esta revisión se observa que todos los estudios son estudios controlados aleatorizados, excepto cuatro que son ensayos clínicos controlados no aleatorizados (Christianson, Drugan, Flyer, Watkins y Maier, 2013; Fuss et al., 2013; Lee et al., 2016; Shim et al., 2014). De los 12 artículos analizados, sólo el de Rogers et al. (2016) no tiene grupo control (GC), y otros como en el de Fuss et al. (2013) y Shim et al. (2014), los roedores controles reciben tratamiento placebo, por lo que deduce que existe validez interna y los resultados pueden ser extrapolables. En la evaluación de la calidad metodológica, solamente un artículo obtuvo la puntuación de 4 (8,33%) (Rogers et al. 2016), dos obtuvieron 3 puntos (16,67%) (Greenwood et al., 2012; Otsuka et al., 2016), dos con 2 puntos (16,67%) (Christianson et al., 2013; Clark et al., 2015), cuatro con 1 punto (33,33%) (Loughridge, Greenwood, Day, McQueen y Fleshner, 2013; Otsuka, Shiuchi, Chikahisa, Shimizu y Séi, 2015; Park, Lee, Cho, Park y Kim, 2017; Seo et al., 2013) y tres con 0 puntos (25%) (Fuss et al., 2013; Lee et al., 2016; Shim et al., 2014). En función de esto, sólo el 25% de los estudios obtendrían una buena calidad metodológica. El tamaño muestral es muy variable, siendo en el 58,3% superior a 40 (Christianson et al., 2013; Clark et al., 2015; Fuss et al., 2013; Greenwood et al., 2012; Loughridge et al., 2013; Park et al., 2017; Shim et al., 2014), el trabajo de Greenwood et al. (2012) el mayor con 165 ratones, lo que favorece su validez externa.
Con respecto al ejercicio realizado en los diferentes artículos analizados, la modalidad utilizada fue correr en rueda en todos ellos, excepto en el trabajo de Christianson et al. (2013) en el cual el método escogido fue la natación.
Atendiendo al tiempo de realización existe una gran heterogeneidad, desde una sola sesión como en los estudios de Otsuka et al. (2016) y Christianson et al. (2013) hasta 12 semanas con sesiones diarias en el caso de Park et al. (2017). Pese a la diversidad temporal, no aparecieron diferencias en los resultados debidas a este aspecto, ya que se obtienen diferencias incluso con una sola sesión. En función de la duración de las sesiones se pueden dividir los estudios en dos grupos; aquellos que dejan correr a los roedores de manera voluntaria (Clark et al., 2015; Fuss et al., 2013; Greenwood et al., 2012; Loughridge et al., 2013; Otsuka et al., 2015; Rogers et al., 2016), y aquellos en donde corren durante 30 minutos (Lee et al., 2016; Otsuka et al., 2016; Seo et al., 2013). Como excepción los trabajos de Park et al. (2017) que no establecen un tiempo fijo, sino que lo incrementan progresivamente desde los 30 a los 50 minutos; Christianson et al. (2013) utilizan tiempos de 5, 10 y 15 minutos y Shim et al. (2014) de 5 minutos. No se encontró relación directa entre la duración de la sesión y los resultados para la ansiedad.
La intensidad del ejercicio también es diversa en los estudios no pudiéndose valorar en la mayoría de ellos debido a la realización voluntaria del mismo. En cambio, en la investigación de Shim et al. (2014), Seo et al. (2013) y Lee et al. (2016) emplearon una intensidad de carrera media-baja, que se correlacionaría con ejercicio de carácter aeróbico. En el trabajo de Otsuka et al. (2016) se centra en el efecto de la intensidad del ejercicio sobre la ansiedad, las ratas corrieron a una intensidad baja o alta y solamente el ejercicio de baja intensidad mejoró la conducta ansiosa. Esto concuerda con el trabajo de Mello-Portugal et al. (2013) en el cual menciona que la intensidad óptima para producir cambios beneficiosos en estos trastornos es aquella que esté cerca del umbral ventilatorio y podría ser que las intensidades mayores sean percibidas como amenazantes, por lo tanto, ansiogénicas. En esta misma línea Barbosa y Lima (2016) concluyeron que el ejercicio físico a intensidad 5% mostró efectos ansiolíticos, mientras que a intensidad 50% ansiogénico.
Siguiendo en la línea de condicionantes del efecto ansiolítico del ejercicio, Park et al. (2017) observaron que las ratas obesas presentaron un grado de ansiedad superior que los controles. Dividiendo las grasas en saturadas e insaturadas, Nemeth, Millesi, Wagner y Wallner, (2014), descubrieron que la dieta alta en ácidos grasos insaturados es ansiogénica en un estudio con muestra animal aunque se trataba de cerdos. Christianson et al. (2013) es el único que escoge la natación como ejercicio en función de las condiciones ambientales, no consiguiendo reducciones de la ansiedad en bajas temperaturas, pero sí en altas temperaturas, por lo que se podría deducir que este ejercicio es ansiolítico, pero en temperaturas medias-cálidas. Por otro lado, solamente en el artículo de Lapmanee, Charoenphandhu, Krishnamra y Charoenphandhu (2012), comparan la efectividad del ejercicio con el tratamiento farmacológico en ratas y descubrieron que el ejercicio obtuvo mejores resultados que el diazepam y la fluoxetina en la conducta ansiosa. Por tanto, podría ser una herramienta complementaria al tratamiento farmacológico.
En relación a la medición de los síntomas de ansiedad, el test más utilizado fue el de laberinto elevado (Lee et al., 2016; Otsuka et al., 2016; Park et al., 2017; Rogers et al., 2016; Seo et al., 2013) por ser el más eficaz para ello. El test de suspensión en cola fue realizado en menor medida (Otsuka et al., 2015; Park et al., 2017; Shim et al., 2014), por no ser tan específico como el anterior.
El primero demostró una conducta menos ansiosa después del ejercicio, con una mayor estancia en los brazos descubiertos en todos los experimentos excepto en el de Rogers et al. (2016) esta diferencia podría estar provocada por el bloqueo del receptor 5HT1A postsináptico de la muestra, lo cual podría explicar la inefectividad a nivel conductual. En el mismo test Lee et al. (2016), observaron que la descendencia del G estrés + EF no presentó una conducta menos ansiosa; deduciéndose que los posibles cambios en la expresión genética de los marcadores no fueron transmitidos a su descendencia.
Adentrándose en la fisiopatología, se analizan distintos marcadores: 5-HT (Clark et al., 2015; Otsuka et al., 2015; Otsuka et al., 2016), receptor 5-HT1A (Fuss et al., 2013; Lee et al., 2016; Rogers et al., 2016), 5-HT2c (Christianson et al., 2013; Greenwood et al., 2012), triptófano (Loughridge et al., 2013; Shim et al., 2014) y Park et al. (2017) y Seo et al. (2013), que miden varios en el mismo estudio. Centrando la atención en 5-HT, existen diferentes premisas: Clark et al. (2015) y Seo et al. (2013) afirman que el ejercicio redujo los niveles de 5-HT en el cuerpo estriado y NRD respectivamente, por lo que tendría un efecto ansiogénico. Sin embargo, Otsuka et al. (2016) y Otsuka et al. (2015) obtuvieron que el ejercicio aumentó dichos niveles en las mismas estructuras anatómicas, por lo que su efecto sería ansiolítico. Estas discrepancias podrían justificarse por la provocación de estrés postraumático al que sometieron a la muestra los primeros autores, lo que provocaría una hipersensibilización de las neuronas serotoninérgicas y en consecuencia, un aumento brusco en los niveles 5-HT de manera compensatoria, tal como ha demostrado Graeff el estrés aumenta la síntesis y liberación de 5-HT. El problema aparece cuando los receptores no consiguen asimilar esas altas cantidades 5-HT, ya que quedaría libre en la hendidura sináptica (Christianson et al., 2013; Clark et al., 2015; Greenwood, Foley, Burhans, Maier y Fleshner, 2005; Seo et al., 2013).
Coppen afirmó que el aumento de serotonina en la hendidura sináptica conlleva una conducta antidepresiva (Olivier, 2015), pero parece que este incremento en el NRD no siempre es ansiolítico, de manera que en la parte medial tendría un efecto ansiogénico y en la parte lateral ansiolítico (Hale et al., 2008; Lowry et al., 2008). También, habría que tener en cuenta las múltiples conexiones del NRD con otras estructuras anatómicas como el hipocampo, cuerpo estriado y amígdala, conocidas a su vez por estar involucradas en la conducta y estados de ánimo (Curran y Chalasani, 2012b; Zangrossi y Graeff, 2014). Las zonas del SNC seleccionadas para la medición de los marcadores fueron principalmente el NRD (Loughridge et al., 2013; Otsuka et al., 2016; Park et al., 2017; Seo et al., 2013) y el hipocampo (Fuss et al., 2013; Lee et al., 2016; Otsuka et al., 2015; Rogers et al., 2016). Curran y Chalasani, (2012) y Zangrossi y Graeff, (2014), argumentaron este hecho porque la mayor parte de la inervación serotoninérgica dirigida hacia el prosencéfalo se origina en el NRD y, en menor medida, en el NRM. Correlacionando los marcadores y las zonas mencionadas se encuentra que los autores que exploraron el hipocampo midieron el receptor 5-HT1A postsináptico, y, los que exploraron el NRD, midieron los niveles de 5-HT o sus precursores y metabolitos. Esto es debido a que el hipocampo es una zona rica en este tipo de receptor (Fuss et al., 2013) y en el NRD se encuentra la gran mayoría de neuronas productoras de 5-HT (Curran y Chalasani, 2012b; Zangrossi y Graeff, 2014).
Fuss et al. (2013), Rogers et al. (2016) y Lee et al. (2016) analizaron el receptor postsináptico 5-HT1A. Todos concluyeron en la necesidad de un buen funcionamiento del mismo en las distintas partes del SNC para no padecer ansiedad. El ejercicio aumentó sus niveles, mejorando su dinámica en los trabajos de Rogers et al. (2016) y Lee et al. (2016) Sin embargo, Fuss et al. (2013) tuvo un efecto contrario disminuyendo el nivel de este receptor en el hipocampo ventral. Esto se pudo deber a que los sujetos corrieron de manera voluntaria, sin testar la intensidad, pues tal como refiere Otsuka et al. (2016) el ejercicio de alta intensidad no obtiene beneficios fisiológicos o conductuales en la ansiedad. Además, la calidad metodológica de este estudio es muy baja. Dos artículos, Greenwood et al. (2012) y Christianson et al. (2013), indagaron sobre los efectos del recetor 5-HT2c. Ambos concluyen que este receptor incrementa la ansiedad provocando crisis de pánico en los sujetos. En el trabajo de Greenwood et al. (2012) el ejercicio aumentó la resistencia a un agonista del receptor, de modo que necesitaron dosis más altas para provocar pánico y el segundo demostró que inyectando en antagonista del 5-HT2c bloqueó el efecto ansiogénico de nadar en agua fría.
ConclusionesConforme a los resultados obtenidos se concluye que el ejercicio físico en modelos animales ejerce cambios a nivel conductual y cerebral.
Con respecto al efecto del ejercicio sobre el neurotransmisor 5-HT no existe unanimidad en los resultados obtenidos en esta revisión, aunque se deduce que su efecto podría depender de la zona, es decir, sería ansiogénico en la parte medial y ansiolítico en la parte lateral del núcleo rafe dorsal. El ejercicio aumenta los niveles de 5HT1a postsináptico, que provocaría un efecto ansiolítico y finalmente parece aumentar la resistencia a la acción ansiogénica del 5HT2c
Tras la revisión se evidencia el efecto positivo del ejercicio, si lo extrapolamos a humanos existen metaanálisis que avalan el beneficio del ejercicio físico en la ansiedad y depresión (Rethorst y Trivedi, 2013; Wipfli, Rethorst y Landers, 2008). Lo que prueba que puede ser una alternativa coadyuvante para el tratamiento de estos trastornos psicológicos con reducidos costes y sin efectos colaterales (Lapmanee, Charoenphandhu, Krishnamra y Charoenphandhu, 2012; Nevels et al., 2016). Parece que el ejercicio podría conseguir niveles óptimos de serotonina asegurando un correcto metabolismo de ésta, aunque no queda claro su mecanismo cabría la posibilidad de su inclusión en el abanico de herramientas para el tratamiento de este tipo de desórdenes.
Como limitaciones de este trabajo destacan la baja calidad metodológica de algunos de los estudios. Además el sistema serotoninérgico destaca por su complejidad, y tal y como se ha hecho referencia anteriormente, se han descrito 14 receptores de 5-HT. Sin embargo, en los estudios examinados tan solo se estudian tres de ellos, lo que ya por sí mismo podría ser una limitación para comprender el funcionamiento de este sistema. Esto muestra que, a pesar de los numerosos avances y descubrimientos científicos, son necesarios más estudios para comprender exactamente su fisiología y funcionamiento y, de este modo, mejorar el tratamiento de estos trastornos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.