El síndrome isquémico de la mano inducido por un acceso vascular para hemodiálisis es una complicación poco frecuente, pero que en los casos invalidantes requiere tratamiento quirúrgico. Los síntomas isquémicos serán importantes solo si la perfusión distal es insuficiente para mantener los requerimientos metabólicos básicos. Esta perfusión es dependiente de la resistencias vasculares periféricas y de la circulación colateral con sus mecanismos de autorregulación. Porque muchos de los signos y síntomas son inespecíficos, la confirmación diagnóstica debe venir mediante la realización de pruebas no invasivas. Un índice digital/braquial < 0,45 es sugestivo de un síndrome isquémico grave y suele estar asociado a dolor de reposo o a lesiones tróficas en los dedos. El objetivo inicial del tratamiento es conservar el acceso vascular, del que depende la hemodiálisis del paciente, y corregir la situación isquémica de la mano. Una variedad de técnicas han sido descritas en la literatura que incluyen la corrección de lesiones arteriales proximales, la ligadura simple, la plicatura o banding de la fístula, el distal revascularization-interval ligation (DRIL), el revascularization using distal insertion (RUDI) o el proximalization of the arterial inflow (PAI). La elección de la técnica más apropiada debería basarse en los mecanismos hemodinámicos que determinaron la isquemia, la gravedad de los síntomas, la morbilidad del paciente y la localización de la fístula arteriovenosa. En este artículo de revisión se analiza la fisiopatología y se discuten las distintas opciones quirúrgicas. Aunque el DRIL aparece como el procedimiento más efectivo y duradero en el seguimiento a largo plazo, las circunstancias particulares de cada caso hacen necesaria una individualización del tratamiento.
Access-induced ischemia is an uncommon but devastating complication for patients maintained on hemodialysis. The construction of an arteriovenous access results in a predictable decrease in the perfusion pressure distal to the anastomosis, which can result in ischemia if the compensatory mechanisms are inadequate. Because many of the signs and symptoms are nonspecific, the diagnosis can be aided in equivocal cases with non-invasive vascular laboratory studies. A digital/brachial index < 0.45 is suggestive of severe ischemic syndrome, and is usually associated with pain at rest and/or trophic lesions on the fingers. The aims of the treatments are to reverse the hand ischemia and to preserve the access. There are a variety of treatments, including correction of the inflow lesion, access ligation, limiting the flow through the access (banding), distal revascularization with interval ligation (DRIL), revision using distal inflow (RUDI), or proximalization of arterial inflow (PAI). The optimal choice should be based on hemodynamic mechanisms and severity of symptoms, in conjunction with the access type and patient comorbidities. A review of the underlying pathophysiology and treatment options will be presented. To date, the DRIL procedure has been the most consistently successful strategy. However, the particular circumstances of each case demand an individualization of treatment.
Según el último informe de la Sociedad Española de Nefrología1 la prevalencia de pacientes que precisan tratamiento renal sustitutivo ha alcanzado 1.034 pacientes por millón de habitantes y, de estos, casi la mitad están en programas de hemodiálisis. El grupo de edad que ha registrado un mayor incremento porcentual es el de pacientes mayores de 75 años (de un 8,5% de pacientes prevalentes en 1992 a un 40% en la actualidad). En este grupo, la mayoría de ellos se trata mediante hemodiálisis y pocos cambian de técnica a lo largo de su vida. Estos pacientes precisan de un acceso vascular adecuado para realizar el procedimiento. Sin embargo, el acceso es la causa fundamental de morbilidad e ingresos, existiendo una relación clara con el tipo de fístula arteriovenosa (FAV) realizada2.
El síndrome isquémico de la mano (SIM) asociado a pacientes en hemodiálisis es una complicación poco frecuente (1-8%), aunque su incidencia se está elevando en los últimos años como consecuencia del tratamiento de pacientes cada vez más envejecidos, habitualmente diabéticos, con múltiples accesos vasculares previos fallidos y con algún grado de arteriopatía periférica en otros territorios3. Su importancia reside en las devastadoras consecuencias que conlleva, ya que a menudo precisan de amputaciones que producen una grave limitación funcional, al tratarse del miembro superior. El manejo terapéutico es difícil, dado que inicialmente se pretende el doble objetivo de conservar el acceso (del que depende que el paciente pueda seguir en hemodiálisis) y corregir la situación de isquemia de la extremidad4–8. La elección de la técnica más apropiada debería basarse en los mecanismos hemodinámicos que determinaron la isquemia y la localización de la FAV.
FisiopatologíaLa fisiopatología de la isquemia de la mano secundaria a un acceso vascular es multifactorial9. El «robo vascular» ha sido considerado el resultado del alto flujo en la fístula, con el consiguiente flujo retrógrado distal a la anastomosis arteriovenosa y la disminución de la presión de perfusión en las arterias distales. Para muchos, ese flujo invertido en las arterias ha sido considerado crucial en la patogénesis de la isquemia, pero hoy día se conoce que ese teórico «robo» es un proceso fisiológico asociado a la comunicación arteriovenosa10. Además, conviene recordar que no todas las isquemias están producidas por fístulas de alto flujo, ni todos los accesos con un flujo elevado condicionan una mano isquémica.
La creación de una FAV produce importantes cambios hemodinámicos que deben considerarse normales4–9. Así, el flujo sanguíneo arterial es preferentemente dirigido hacia el sistema venoso como resultado de la presión diferencial entre uno y otro sistema, lo que genera un alto flujo de retorno en un circuito de baja resistencia. Ese flujo elevado causa una caída transitoria proximal de la presión arterial que es rápidamente compensada por un incremento del ritmo y el gasto cardíaco. El incremento de la velocidad de flujo tanto en la arteria dadora como en el conducto venoso de drenaje sirve como un potente estímulo para que estos vasos se dilaten con objeto de normalizar el estrés parietal transmural.
De cualquier manera, la dirección del flujo en la arteria proximal siempre permanecerá centrífugo hacia la periferia y la dirección del flujo venoso se hará centrípeto hacia el corazón. Por el contrario, la dirección del flujo en la arteria distal a la fístula es variable y puede ser anterógrado, retrógrado o bidireccional dependiendo del gradiente de presión y de las resistencias periféricas. En realidad, una frontera exacta entre el flujo anterógrado y retrógrado no existe, lo que llega a presentarse en la arteria distal a la fístula es un flujo bidireccional con cada sístole y diástole, cuya localización es arbitraria y depende de las resistencias4,5,10.
La presencia de una FAV, por otra parte, siempre reduce inicialmente la presión de perfusión distal de la mano, que progresivamente en el tiempo tenderá a normalizarse como consecuencia de los mecanismos compensatorios de vasodilatación arterial periférica y desarrollo de una rica red de vasos colaterales11. En circunstancias normales estos mecanismos son suficientes para mantener la perfusión periférica en niveles adecuados, pero la presencia de lesiones estenooclusivas arteriales proximales (arteria subclavia o axilar) o distales a la fístula (ateromatosis radiocubital) pueden exacerbar los cambios hemodinámicos que conducen a la isquemia. Además, la calcificación arterial, típica de pacientes diabéticos, merma la capacidad compensadora de respuesta vasodilatadora debido a la disfunción celular endotelial, lo que puede implicar un mayor riesgo isquémico. La relevancia de los síntomas isquémicos llegará a ser importante solo si la perfusión distal es insuficiente para mantener los requerimientos metabólicos básicos4,5,9.
Por tanto, la hemodinámica de la isquemia secundaria a un acceso vascular comprende la compleja interacción de un alto flujo en un sistema venoso de baja resistencia, un flujo invertido o retrógrado proximal a la zona anastomótica, una elevada resistencia del lecho distal y una circulación colateral de la que dependerán los mecanismos distales de autorregulación4–10. Este síndrome suele producirse a nivel braquial, pero excepcionalmente puede también ocurrir en accesos vasculares de la arteria radial. Cuando esto sucede, suele deberse a un mecanismo hemodinámico de flujo invertido a través del arco palmar, que es fácilmente reversible mediante la oclusión de la arteria radial distal a la fístula4,9,12.
Presentación clínicaEl SIM típicamente se presenta en pacientes ancianos, diabéticos, preferentemente mujeres, con múltiples accesos vasculares previos y una fístula humeral funcionante que de alguna manera es la desencadenante del cuadro3.
El desarrollo de síntomas puede ocurrir en el postoperatorio inmediato o en el seguimiento posterior (tabla 1). Aunque muchos de los síntomas agudos suelen ser autolimitantes y se resuelven con la instauración de los mecanismos de compensación, los síntomas que aparecen tardíamente son frecuentemente progresivos y demandan una atención médica más importante4,8.
Clasificación clínica del síndrome isquémico de mano secundario a acceso vascular
| Grado | Síntomas | Tratamiento |
|---|---|---|
| Grado-0 | Normal | Ninguno |
| Grado-1 (medio) | Mano fría con escasos síntomas. Demostrable por aumento del flujo con la oclusión del acceso | Ninguno |
| Grado-2 (moderado) | Isquemia durante hemodiálisis/claudicación con parestesias | Expectante. Modificar parámetros de diálisis y fármacos antihipertensivos |
| Grado-3 (severo) | Dolor de reposo o lesiones tróficas | Intervención quirúrgica obligatoria |
La sintomatología clínica de este síndrome es la habitual de la isquemia arterial en otros territorios3–9. Los síntomas más leves consisten en palidez y frialdad de la extremidad. El dolor de reposo está asociado en la mayoría de los casos con sintomatología relevante, muchas veces impidiendo el descanso nocturno del paciente y con una respuesta a analgésicos bastante limitada. En casos más avanzados, la afectación nerviosa produce parestesias, déficit sensitivo y déficit motor, con atrofia de los músculos de la mano. Los casos más graves cursan con pérdida de sustancia y ulceración de los dedos de la mano, pudiéndose producir gangrena isquémica que requiere la amputación.
Un escenario particular de este síndrome es la aparición en algunos pacientes de síntomas isquémicos solo durante las sesiones de hemodiálisis, estando el resto del tiempo asintomáticos. Durante la hemodiálisis se produce, generalmente, un descenso de la precarga cardiaca y de la tensión arterial y, de manera refleja, una vasoconstricción periférica4,9. Esta alteración de la hemodinámica circulatoria supera los mecanismos de compensación del lecho vascular distal, lo que condiciona la aparición de síntomas que se resuelven al terminar la diálisis. En estos individuos con una isquemia subclínica, la primera medida terapéutica es suprimir la medicación antihipertensiva la mañana de la diálisis con objeto de que la hipotensión generada no suponga una reducción significativa de la perfusión periférica.
DiagnósticoPorque muchos de los signos y síntomas son inespecíficos, los clínicos deben mantener un alto grado de sospecha en aquellos pacientes con FAV funcionantes que comienzan a presentar molestias en los dedos y manos (tabla 2). La evaluación de estos pacientes comienza con una simple exploración clínica, en la que se pondrá de manifiesto la ausencia de pulsos, la frialdad, palidez o lesiones tróficas de los dedos. Frecuentemente, el dolor isquémico tiende a desaparecer con la compresión manual y cierre de la FAV3-9.
Valoración diagnóstica del síndrome isquémico de mano
| • Exploración física: inspección y palpación de pulsos |
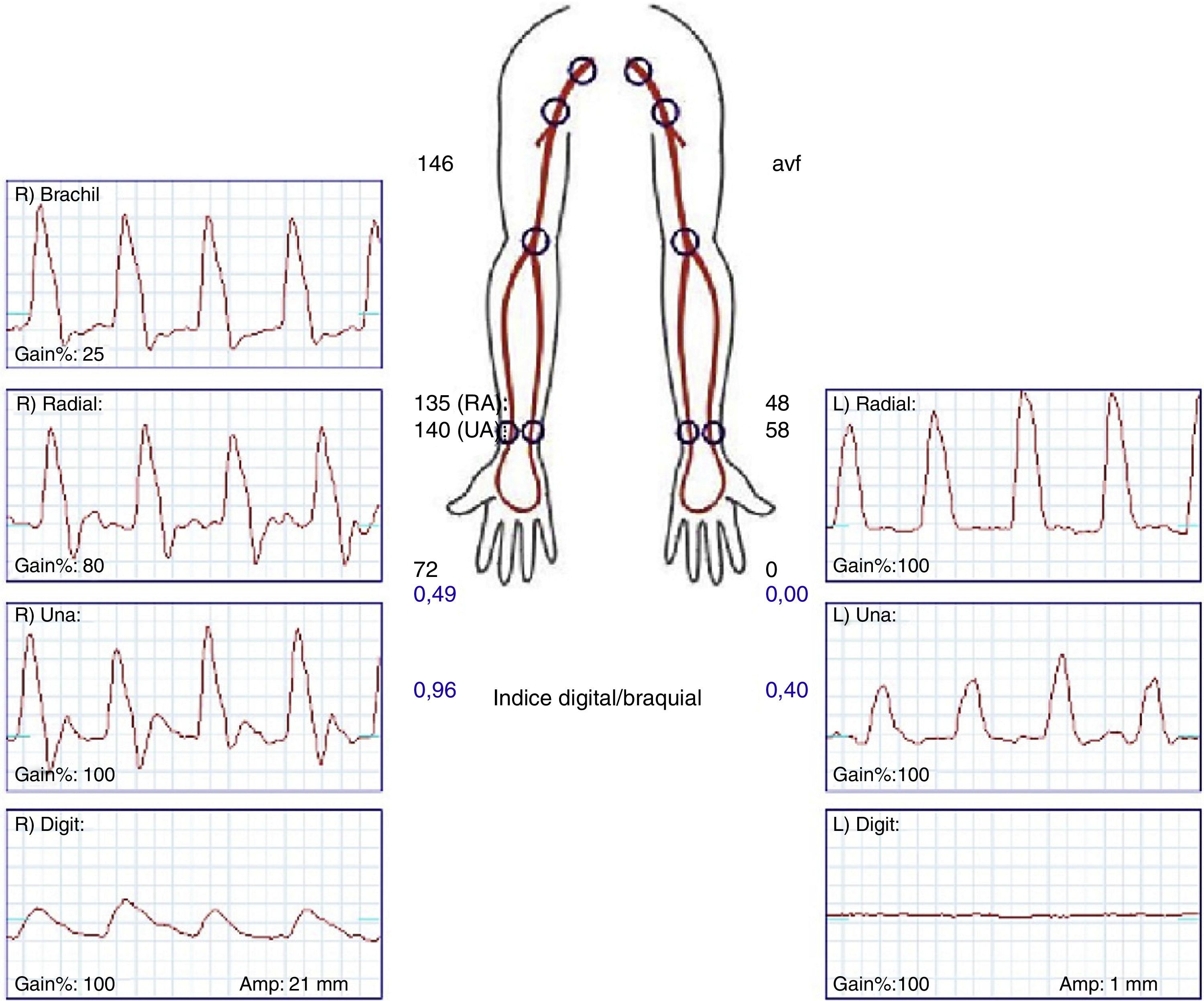
| • Determinación de presión digital (PPG) y análisis de onda de flujo con y sin compresión manual del acceso vascular. Cálculo del índice digital/braquial |
| • Eco-doppler: determinación del flujo braquial y del acceso vascular (mL/min) |
| • Arteriografía del miembro superior |
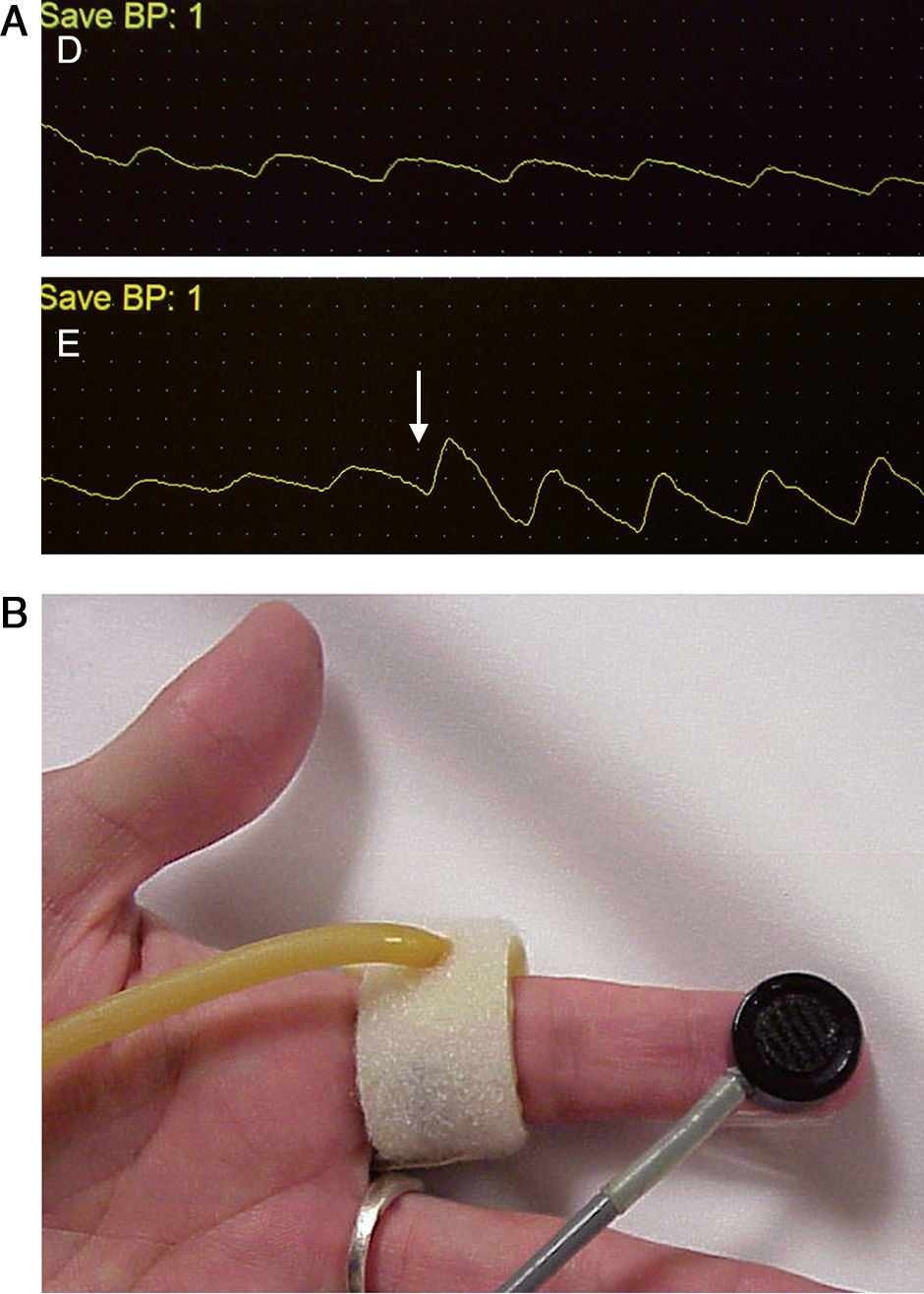
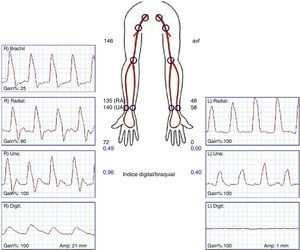
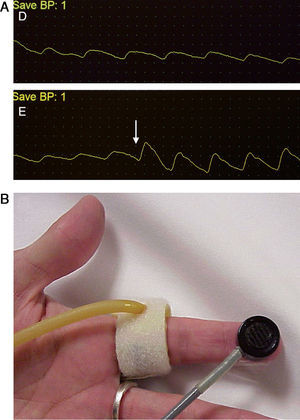
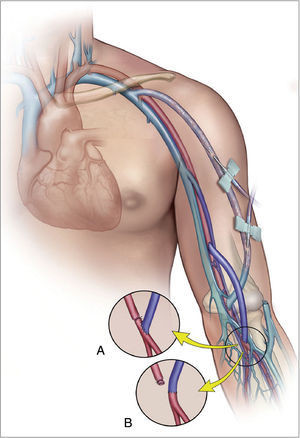
La confirmación diagnóstica debe venir mediante la realización de pruebas no invasivas (fig. 1), tales como un doppler palmar o un estudio de fotopletismografía digital (PPG)4–10. Aunque es bastante normal tener una onda de amplitud digital reducida, los pacientes isquémicos muestran una onda plana, monofásica y cuyo contorno aumenta con la compresión y cierre de la fístula (fig. 2). El cálculo del índice digital/braquial (IDB) puede ayudar a identificar pacientes con riesgo de isquemia. Para la realización de este índice se requiere de la presión sistólica braquial del miembro contralateral a la fístula y un sensor de PPG con un manguito de compresión neumática apropiado para su colocación en la falange proximal del 3.er dedo de la mano afectada5.
Los métodos de laboratorio vascular no invasivo son esenciales en el diagnóstico. A) Registro de fotopletismografía (PPG) con onda monoplana y como la compresión y cierre de la fístula arteriovenosa (flecha) restituye la amplitud de onda digital. B) Colocación de sonda de PPG y manguito de compresión para determinación del índice digital/braquial o monitorización de la perfusión distal durante cirugía.
Aunque Goff et al.13 señalaron que un IDB < 0,6 identificaba los pacientes con riesgo de isquemia durante su seguimiento, Tynan y Berman5 estudiaron prospectivamente con fotopletismografía el IDB de 100 pacientes, antes y después de la realización de la FAVI, y durante el seguimiento con o sin compresión manual del acceso. Su estudio determinó que un IDB ≤ 0,45 fue el valor con mayor capacidad predictiva de isquemia, con una sensibilidad del 80% y una especificidad del 70%.
La oximetría tomada en un dedo de la mano puede ayudar también a descartar una mano isquémica de otros síndromes dolorosos. Dado que el oxímetro es un aparato disponible en todos los centros, la medida de la pulsioximetría puede ser considerada un método simple para evaluar el grado de isquemia. Una pulsioximetría normal descarta completamente este síndrome en un paciente con FAV para diálisis2.
Si se demuestra la presencia de un SIM, todos los pacientes precisarían de un estudio arteriográfico de la extremidad isquémica para descartar lesiones arteriales proximales subsidiarias de tratamiento quirúrgico endovascular y para mostrar la circulación distal del antebrazo y de la mano, de cara a una posible cirugía de revascularización4–9.
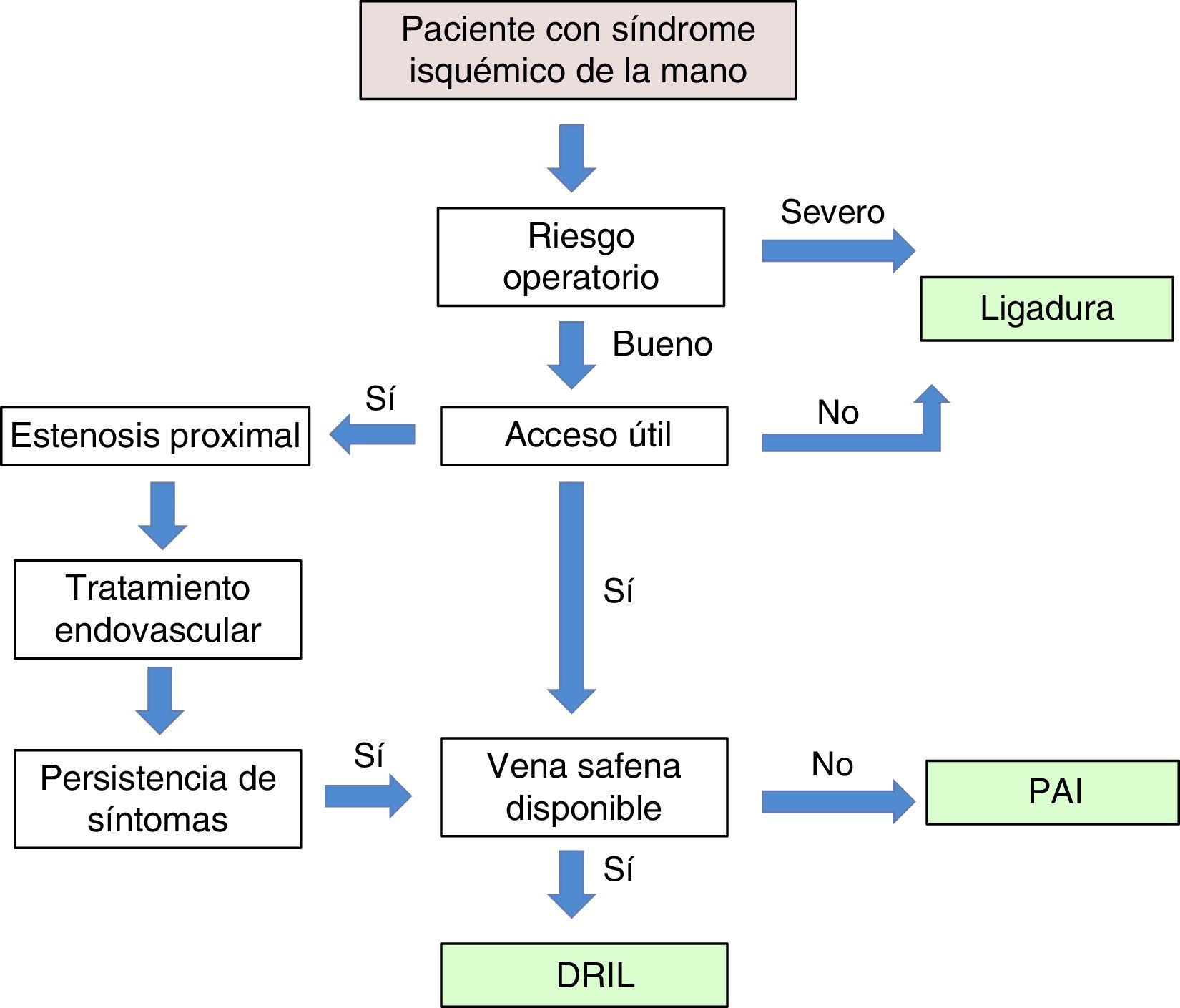
TratamientoSe estima que aproximadamente el 80% de los pacientes con una FAV presentará algún grado de isquemia postoperatoria que suele compensarse a lo largo del tiempo11. En la mayoría de los casos esa hipoperfusión periférica no produce sintomatología clínica. Cuando los mecanismos de compensación hemodinámica son inadecuados, puede generarse lo que se conoce como un SIM. El tratamiento quirúrgico queda, por tanto, reservado para este grupo de pacientes sintomáticos, con clínica invalidante o con amenaza de pérdida digital de la mano14. Para el óptimo tratamiento del SIM es obligatorio que el cirujano comprenda la causa fisiopatológica que lo produce y la disparidad de resistencias entre el lecho vascular distal y la fístula.
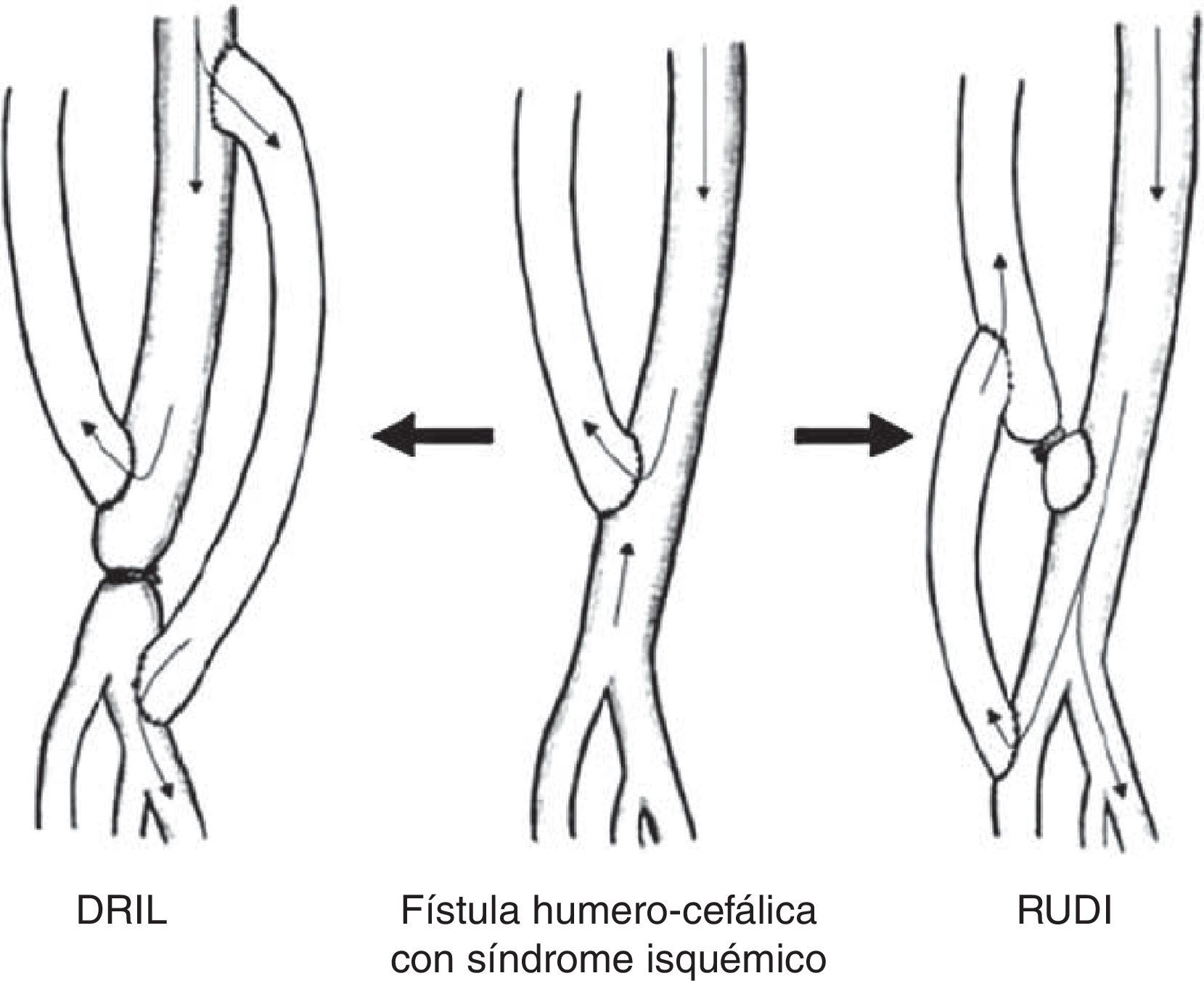
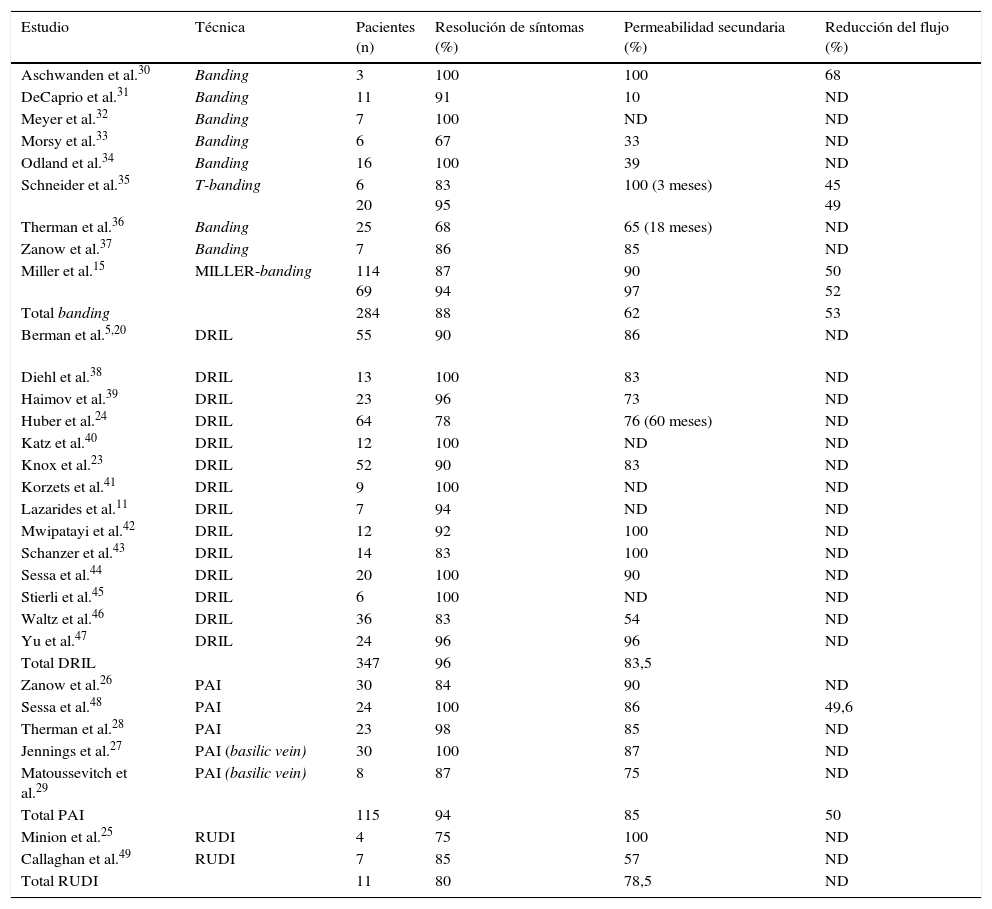
Las técnicas quirúrgicas descritas para resolver este cuadro clínico incluyen la corrección de lesiones arteriales proximales con procedimientos endovasculares, la ligadura simple, la plicatura o banding de la fístula, la distal revascularization-interval ligation (DRIL), el revascularization using distal insertion (RUDI) o el proximalization of the arterial inflow (PAI) (tabla 3).
Resultados publicados de las diferentes técnicas quirúrgicas
| Estudio | Técnica | Pacientes (n) | Resolución de síntomas (%) | Permeabilidad secundaria (%) | Reducción del flujo (%) |
|---|---|---|---|---|---|
| Aschwanden et al.30 | Banding | 3 | 100 | 100 | 68 |
| DeCaprio et al.31 | Banding | 11 | 91 | 10 | ND |
| Meyer et al.32 | Banding | 7 | 100 | ND | ND |
| Morsy et al.33 | Banding | 6 | 67 | 33 | ND |
| Odland et al.34 | Banding | 16 | 100 | 39 | ND |
| Schneider et al.35 | T-banding | 6 20 | 83 95 | 100 (3 meses) | 45 49 |
| Therman et al.36 | Banding | 25 | 68 | 65 (18 meses) | ND |
| Zanow et al.37 | Banding | 7 | 86 | 85 | ND |
| Miller et al.15 | MILLER-banding | 114 69 | 87 94 | 90 97 | 50 52 |
| Total banding | 284 | 88 | 62 | 53 | |
| Berman et al.5,20 | DRIL | 55 | 90 | 86 | ND |
| Diehl et al.38 | DRIL | 13 | 100 | 83 | ND |
| Haimov et al.39 | DRIL | 23 | 96 | 73 | ND |
| Huber et al.24 | DRIL | 64 | 78 | 76 (60 meses) | ND |
| Katz et al.40 | DRIL | 12 | 100 | ND | ND |
| Knox et al.23 | DRIL | 52 | 90 | 83 | ND |
| Korzets et al.41 | DRIL | 9 | 100 | ND | ND |
| Lazarides et al.11 | DRIL | 7 | 94 | ND | ND |
| Mwipatayi et al.42 | DRIL | 12 | 92 | 100 | ND |
| Schanzer et al.43 | DRIL | 14 | 83 | 100 | ND |
| Sessa et al.44 | DRIL | 20 | 100 | 90 | ND |
| Stierli et al.45 | DRIL | 6 | 100 | ND | ND |
| Waltz et al.46 | DRIL | 36 | 83 | 54 | ND |
| Yu et al.47 | DRIL | 24 | 96 | 96 | ND |
| Total DRIL | 347 | 96 | 83,5 | ||
| Zanow et al.26 | PAI | 30 | 84 | 90 | ND |
| Sessa et al.48 | PAI | 24 | 100 | 86 | 49,6 |
| Therman et al.28 | PAI | 23 | 98 | 85 | ND |
| Jennings et al.27 | PAI (basilic vein) | 30 | 100 | 87 | ND |
| Matoussevitch et al.29 | PAI (basilic vein) | 8 | 87 | 75 | ND |
| Total PAI | 115 | 94 | 85 | 50 | |
| Minion et al.25 | RUDI | 4 | 75 | 100 | ND |
| Callaghan et al.49 | RUDI | 7 | 85 | 57 | ND |
| Total RUDI | 11 | 80 | 78,5 | ND |
La ligadura simple de la fístula está especialmente indicada en 3 situaciones clínicas: cuando el acceso es malfuncionante, cuando este ya no se usa (caso de trasplante renal) y en pacientes con lesiones severas de mano e importantes comorbilidades que limitan el empleo de otros procedimientos quirúrgicos de salvamento9. En nuestra experiencia, algunos pacientes, pese al cierre de la fístula, no revierten completamente a la situación clínica de partida y pueden continuar refiriendo algún grado de parestesias de tipo neuropático como consecuencia del sufrimiento isquémico4,8.
Este procedimiento, sin embargo, puede ser especialmente útil en fístulas radiocefálicas asociadas a isquemia severa de mano, donde la ligadura u oclusión distal de la arteria radial es efectiva en la medida que elimina el robo hemodinámico de flujo retrógrado12. No obstante, se hace imprescindible comprobar antes la permeabilidad compensatoria de la arteria cubital.
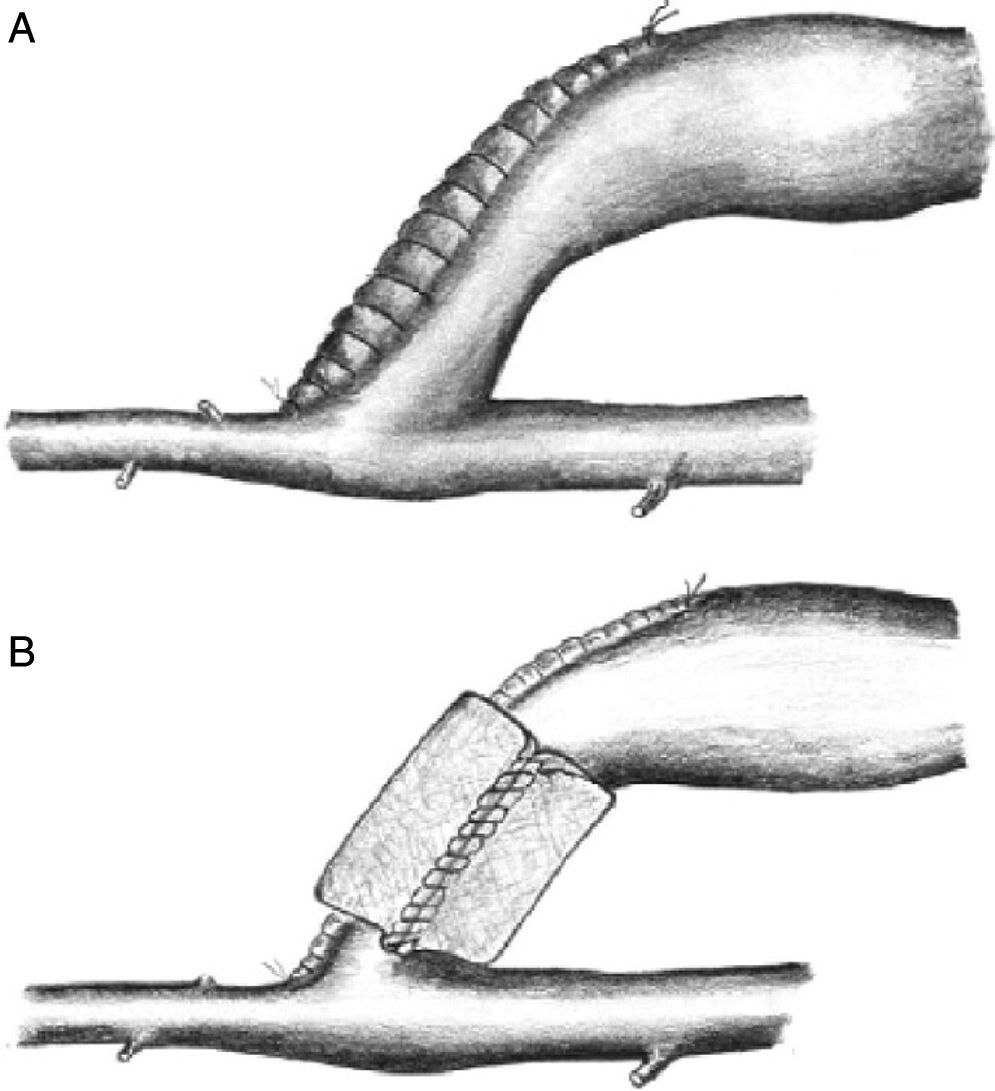
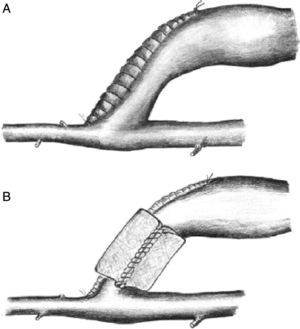
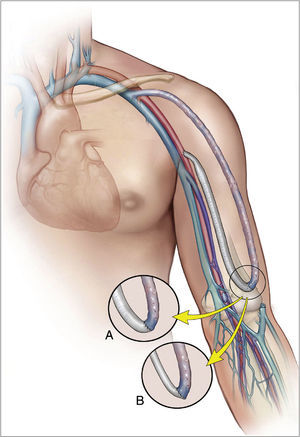
BandingEsta técnica clásica consiste en crear una estenosis en el segmento de drenaje venoso del acceso vascular, inmediatamente después de la anastomosis arteriovenosa (fig. 3). Tiene por objeto reducir el radio de la vena lo suficiente como para convertir el acceso vascular en una fístula de pequeño tamaño, con mayor resistencia y con un menor flujo, que será dependiente de la reducción de su diámetro15–18. Aunque esta medida inicialmente es suficiente para mejorar la perfusión periférica, el aumento de la resistencia de drenaje incrementa la resistencia total del circuito, con lo que a una misma presión de entrada el flujo sanguíneo se reduce, con el consiguiente riesgo potencial de trombosis4,5,8.
En general, este procedimiento ha obtenido malos e irregulares resultados porque se asocia a una alta tasa de recurrencia de los síntomas isquémicos de la mano o de oclusión trombótica del acceso9. Se constata que es difícil establecer el grado de estenosis preciso para mantener el acceso funcionante y aumentar el flujo arterial digital. El uso intraoperatorio de fotopletismografía o la medición del IDB se han propuesto como medidas para monitorizar el grado exacto de estenosis necesario. Recientemente, la técnica Minimally Invasive Limited Ligation Endoluminal-Assisted Revision (MILLER)12, basada en una ligadura del tracto venoso proximal sobre un balón de angioplastia de tamaño igual o menor al diámetro arterial, parece obtener unas tasas de permeabilidad y resolución de síntomas sorprendentemente buenas; no obstante estos resultados no han sido corroborados por otros grupos. Por tanto, la aparición de otras alternativas quirúrgicas más efectivas y seguras han hecho que el banding se realice cada vez con menos frecuencia5,8,9.
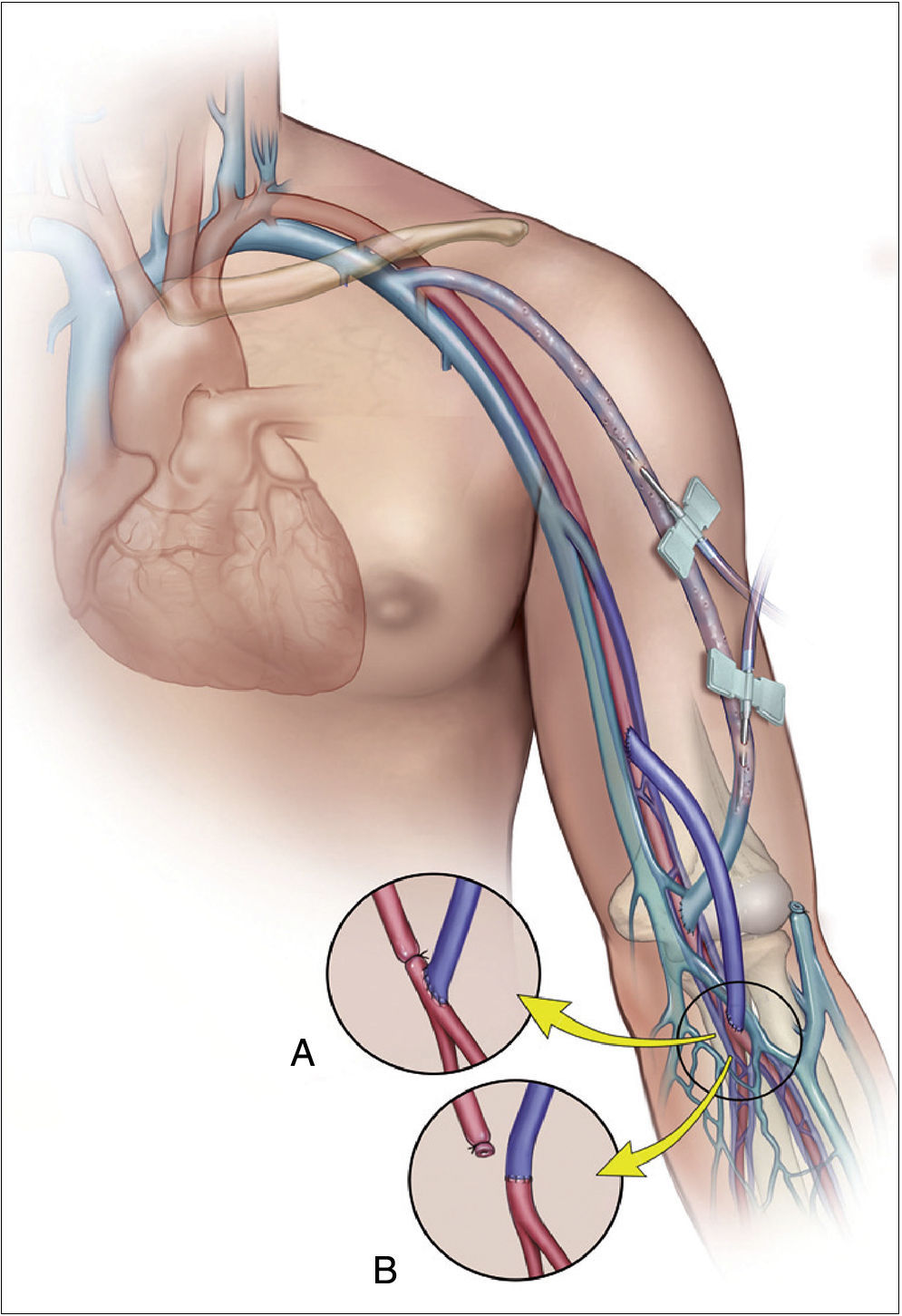
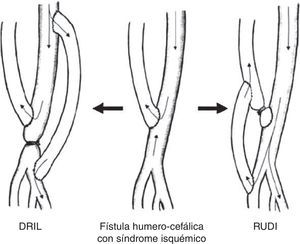
Distal revascularization with interval ligationCuando Schanzer et al. en 1988 propusieron lo que se conoce como técnica DRIL19, ellos creyeron que el mecanismo potencial de inadecuada perfusión periférica resultaba de una pobre red colateral. En un intento de reducir la resistencia periférica, la creación de un bypass entre la arteria proximal a la fístula y la arteria distal (en esencia, una colateral de baja resistencia) incrementaría el flujo hacia el lecho distal a la vez que reduciría la fracción de flujo braquial derivado por la fístula. Para prevenir el flujo retrógrado, la arteria nativa distal a la fístula debía ser ligada (fig. 4). En 1997, Berman et al.20 publicaron la serie más larga con este procedimiento y acuñaron el acrónimo de DRIL para describir los componentes esenciales de esta técnica: revascularización distal con ligadura intermedia.
Desde esa publicación, la superioridad del DRIL sobre la ligadura o banding ha quedado reiteradamente demostrada5,8,9. La durabilidad de la técnica es manifiesta con un 96% de pacientes a largo plazo con una mejoría clínica significativa, una permeabilidad del acceso vascular del 83 y del 71% a 12 y 36 meses, y una permeabilidad del bypass del 86 y 80% a 12 y 48 meses (tabla 3).
La técnica DRIL ofrece importantes ventajas sobre el banding. Aunque ambos procedimientos intentan modificar y corregir la disparidad de resistencias entre la fístula y el lecho arterial periférico, lo hacen desde lugares distintos de la ecuación hemodinámica5,21,22. La técnica DRIL reduce la resistencia no solo a nivel periférico sino en todo el sistema. De la manera más simple, el bypass actúa como una colateral de baja resistencia. La reducción de las resistencias periféricas aumenta el flujo total de la extremidad de modo que el flujo a través de la fístula se mantiene. La ligadura de la arteria braquial en esta técnica condiciona 2 fenómenos hemodinámicos: de un lado, elimina el flujo invertido y garantiza el flujo anterógrado a través del puente venoso creado; y por otro, la eliminación del flujo retrógrado potencia el flujo anterógrado de la circulación colateral. La ligadura arterial debe realizarse, por tanto, lo más inmediatamente posible al acceso AV para garantizar el mayor flujo anterógrado posible a través de las colaterales. Esto explica por qué algunos pacientes no empeoran sus síntomas o permanecen asintomáticos después de la oclusión de un bypass del DRIL debido a la persistencia de flujo anterógrado por las colaterales.
La realización de un bypass venoso sin ligadura arterial ha sido propuesto por van der Meer9 en 2 casos tratados que evolucionaron satisfactoriamente. Esta modificación técnica puede ser válida en aquellos casos en los que la arteria inmediatamente distal a la fístula presenta lesiones estenooclusivas que evitan el fenómeno de flujo retrógrado.
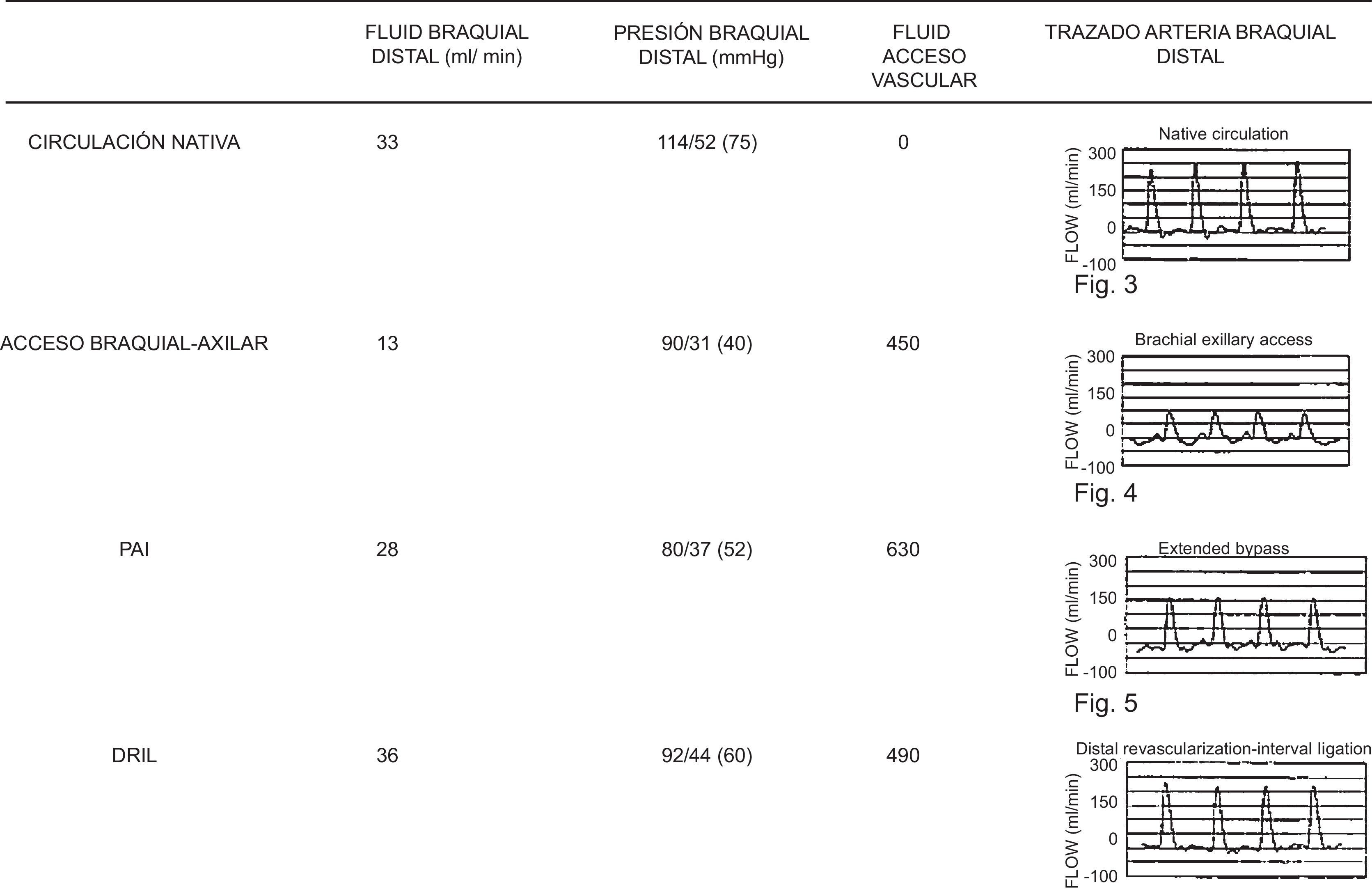
Illig et al.21 estudiaron hemodinámicamente esta técnica mediante la medición de la presión y del flujo antes y después de la realización del procedimiento. El flujo distal a la anastomosis arteriovenosa era inicialmente retrógrado con la fístula abierta (<22 cc/min) y llegó a ser anterógrado con la aplicación del DRIL (>55 cc/min). La presión anterior y posterior al bypass no cambió, lo que implica que su resistencia es extremadamente baja. De acuerdo con un sofisticado análisis de flujos, Gradman et al.22 compararon los cambios hemodinámicos asociados con las diferentes técnicas quirúrgicas (tabla 4), concluyendo que la técnica DRIL era la más efectiva en la reducción del flujo del acceso y en el incremento de la presión y del flujo arterial distal.
Valoración hemodinámica de distintas configuraciones vasculares
Fuente: Gradman y Pozrikidis22.
El material de elección de la técnica DRIL es la vena safena interna, aunque otros conductos han sido usados en caso de ausencia con buenos resultados (PTFE, safena externa, injertos arteriales criopreservados…).
A pesar del buen funcionamiento de este procedimiento, algunos cirujanos son reacios a la ligadura de una arteria braquial sana por el riesgo de isquemia aguda en caso de trombosis del bypass venoso5,8,9. Esta posibilidad, sin embargo, no ha sido descrita en la literatura probablemente por la compensación hemodinámica de las colaterales del hombro y el codo.
Preocupación también ha existido en relación con la durabilidad y efectividad de esta técnica en una población con severa arteriopatía periférica, numerosas comorbilidades y una esperanza de vida limitada. Varios trabajos recientes de Knox et al.23, Huber et al.24 y Tynan-Berman5 con las series más largas publicadas de procedimientos DRIL han confirmado su larga durabilidad con un seguimiento medio de 5 años.
Otras alternativas técnicas: revascularization using distal insertion y proximalization of the arterial inflow/proximalization of arteriovenous anastomosisLa ligadura de una arteria permeable y muchas veces sana es el elemento clave y controvertido del DRIL3,8. Los cirujanos que han sido renuentes a hacerlo desarrollaron otras alternativas como RUDI, PAI o proximalization of arteriovenous anastomosis (PAVA). Todas ellas han sido descritas en la literatura con resultados satisfactorios, pero limitados a series cortas (tabla 3).
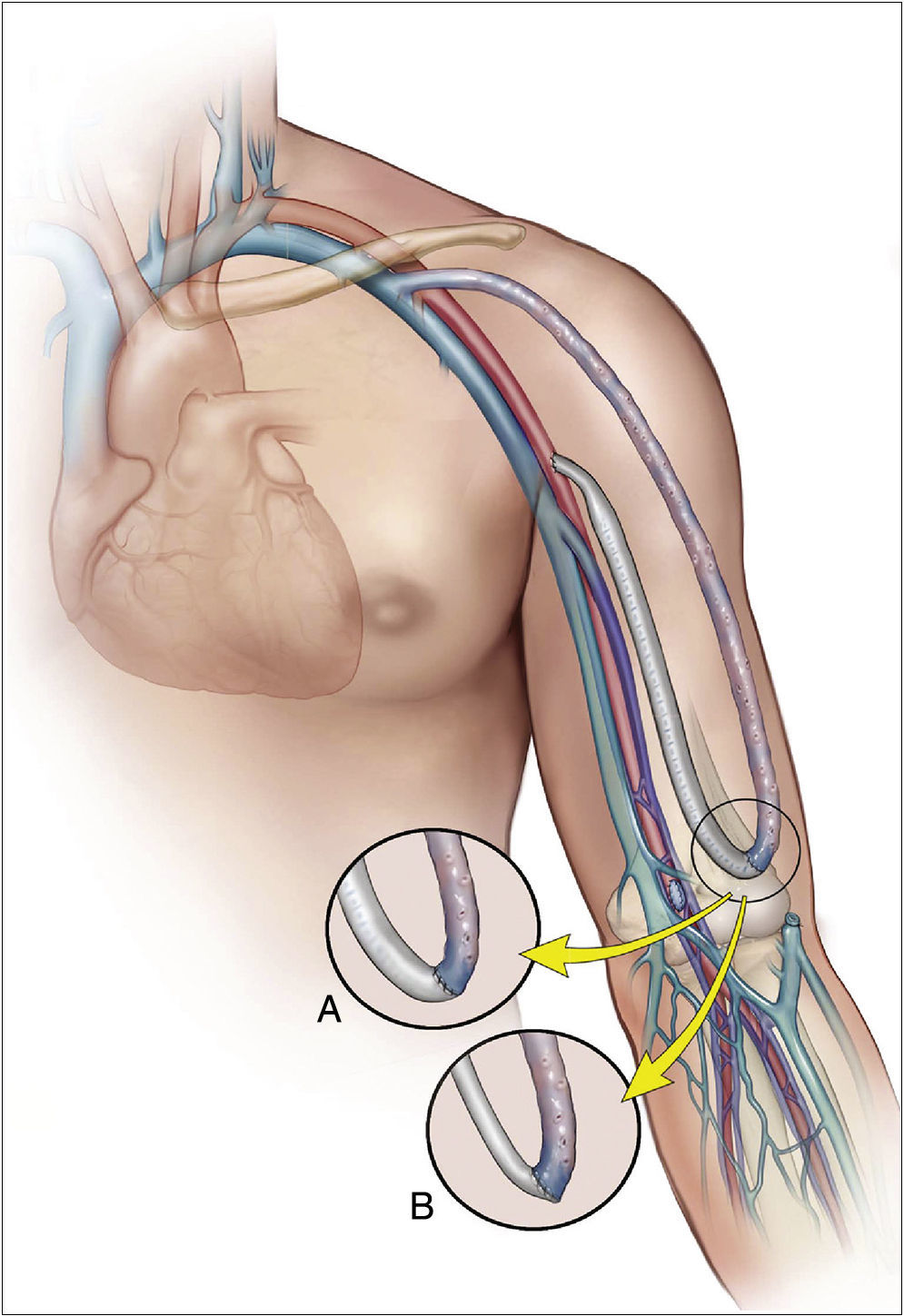
Revascularization using distal insertionEsta técnica, RUDI, fue descrita en 2005 por Minion mediante la comunicación de 4 casos con fístulas autólogas braquiocefálicas25. Consiste en ligar la vena justo distal a la anastomosis arteriovenosa y el restablecimiento de la fístula a través de un bypass venoso desde una arteria distal (radial o cubital) (fig. 5). Se fundamenta en que mantiene el flujo anterógrado a través de la arteria braquial mientras que el acceso es alimentado por una arteria de menor calibre. Se trata, en definitiva, de convertir una fístula braquiocefálica en una fístula radiocefálica o cubitocefálica. De la serie de 4 pacientes con un seguimiento medio de 4-14 meses, 3 pacientes resolvieron completamente los síntomas, pero uno de ellos experimentó una parestesia residual sin mejoría de la presión digital. El éxito de esta técnica es especialmente pobre en pacientes ancianos y diabéticos, muchos de los cuales asocian una importante calcinosis de las arterias radial y cubital9. No obstante, se ha propuesto como un procedimiento válido para la reducción del flujo en aquellos accesos vasculares sintomáticos con flujo elevado (>2L/min)10,17.
Proximalization of the arterial inflow o proximalization of arteriovenous anastomosisLa técnica de PAI o PAVA fue descrita por Zanow en 2006, comunicando los resultados de 30 pacientes26. Consiste en desconectar la anastomosis arteriovenosa del acceso y realizar un bypass de PTFE de pequeño calibre desde un sector arterial más proximal hasta el cabo venoso (fig. 6). Su fundamento hemodinámico es la ley de Poiseuille, según la cual la resistencia ofrecida por un conducto (R) es directamente proporcional a su longitud (L) e inversamente a la cuarta potencia del radio (r) (R= 8ηL/πr4). La aproximación de la arteria donante incrementa la resistencia del circuito en cuanto que aumenta la longitud del conducto y reduce el radio del injerto. Este aumento de resistencia hace que significativamente disminuya el flujo arterial de la fístula y, por el contrario, se incremente la presión arterial colateral hacia la mano9.
Las ventajas respecto al DRIL son que preserva la colateralidad, no requiere la ligadura de una arteria axial de la extremidad y no hay riesgo de isquemia si se trombosa el bypass26,27. Hasta ahora la experiencia clínica ha sido limitada, pero los buenos resultados comunicados en cuanto a mejoría clínica (94%), hemodinámica (incremento del IDB de 0,40 a 0,83) y permeabilidad del acceso (85% a 12 meses) hacen de esta técnica una alternativa válida y eficaz.
Thermann et al.28 recientemente publicaron su experiencia con 23 casos (18 fístulas AV en codo y 5 en muñeca). Los síntomas persistieron en 2 pacientes (9%) con severa pérdida tisular en los dedos, lo que les hizo concluir que este procedimiento no es recomendable para pacientes con lesiones isquémicas mayores de 1cm. Sessa et al.9 han mostrado como la interposición de un segmento protésico de PTFE de 5mm permite reducir de forma significativa (media del 49,6%) el flujo sintomático elevado de 24 accesos vasculares.
La permeabilidad y éxito de esta técnica es similar al DRIL. De hecho, en el estudio hemodinámico de Grandman22 apareció como la segunda técnica más efectiva para el tratamiento del SIM. Sin embargo, su mayor inconveniente es el empleo de una prótesis de PTFE con un riesgo elevado de trombosis a largo plazo. Otras alternativas propuestas ha sido el empleo de la vena basílica como conducto para la aproximación anastomótica27,29.
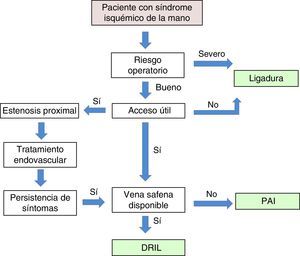
ConclusionesLas denominaciones propuestas como «síndrome de robo» o «síndrome isquémico de robo» para definir la isquemia de mano secundaria a un acceso vascular son incorrectas, ya que, como hemos visto, el «robo vascular» es un proceso fisiológico asociado a la creación de toda FAV10. Los síntomas isquémicos serán importantes solo si la perfusión distal es insuficiente para mantener los requerimientos metabólicos básicos. Esta perfusión es dependiente de la resistencias vasculares periféricas y de la circulación colateral con sus mecanismos de autorregulación. Un IDB < 0,45 es sugestivo de un síndrome isquémico grave y suele estar asociado a dolor de reposo o a lesiones tróficas en los dedos. El objetivo inicial del tratamiento es conservar el acceso vascular, del que depende la hemodiálisis del paciente, y corregir la situación isquémica de la mano. En nuestra experiencia, la técnica DRIL es el procedimiento de elección. Existe en la literatura suficiente evidencia clínica y hemodinámica que apoya este procedimiento como el más efectivo y duradero en el seguimiento a largo plazo. No obstante, las circunstancias particulares de cada caso hacen necesaria una individualización del tratamiento (fig. 7).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.