Nuestro objetivo es medir la incidencia del síndrome de respuesta inflamatoria sistémica (SIRS) y la liberación de citoquinas en pacientes intervenidos de cirugía abierta de aorta abdominal con medidas perioperatorias fast-track en comparación con las convencionales.
Material y métodosEstudio prospectivo aleatorizado unicéntrico de octubre de 2015 a noviembre de 2017. Incluimos pacientes consecutivos intervenidos de cirugía abierta de aorta abdominal. Establecimos un grupo fast-track (GFT) y un grupo convencional (GC). El manejo fast-track consistió en: ingesta de bebida carbohidratada 2h preoperatorias, analgesia con elastómero preperitoneal, movilización y dieta temprana. Registramos variables demográficas y perioperatorias, concentraciones de citoquinas séricas (TNFα, IL-1ß, IL-6, IL-8, IL-10 e IL-12p70) basales, a las 8, 24 y 48 h postoperatorias, incidencia de SIRS en las primeras 72h postoperatorias y complicaciones en el ingreso.
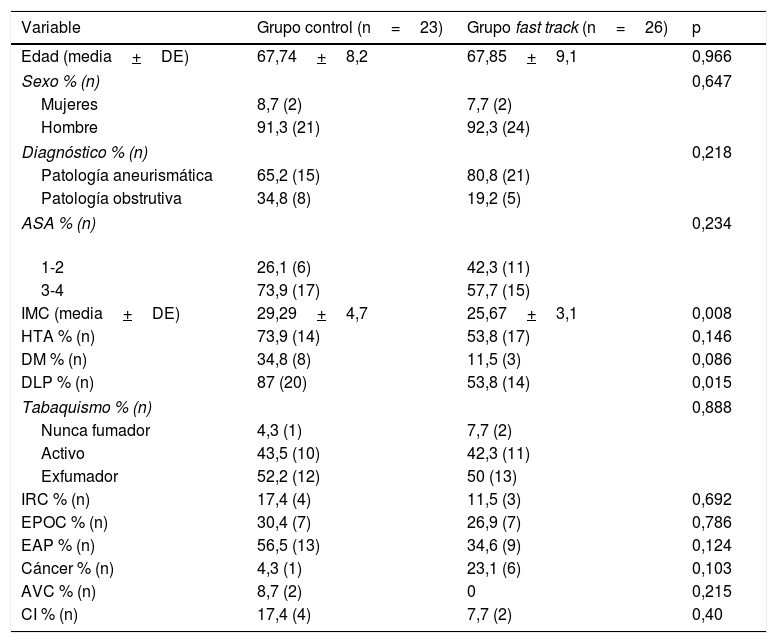
ResultadosSe incluyeron 49 pacientes (GFT: 26, GC: 23) con edad media de 67,8±8,6 años, 91,8% hombres. Ambos grupos fueron comparables en variables demográficas y perioperatorias, excepto en índice de masa corporal (GFT: 25,67±3,07 vs. GC: 29,29±4,66 [p=0,008]) y tiempo de clampaje (FT:52,4±12,63 vs. GC: 63,91±14,34min [p=0,005]).
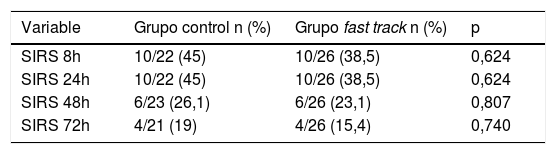
La incidencia de SIRS en GFT vs. GC fue 38,5% vs. 45,5%, 38,5% vs. 45,5%, 23,1% vs. 26,1%, 15,4% vs. 19% (p>0,05) a las 8, 24, 48 y 72 h postoperatorias respectivamente. Evidenciamos una mayor liberación de IL-6, IL-8, IL-10 y TNFα en GC en comparación con GFT. A las 8h, IL-6 alcanzó un aumento estadísticamente significativo respecto al valor basal en GC (p=0,045). A las 24h, la IL-10 aumentó respecto al valor inicial, siendo estadísticamente más elevada en GC en comparación con GFT (p=0,024). En GC 6/23 (26,1%) presentaron insuficiencia renal aguda y en GFT 1/26 (3,8%) (p=0,041).
ConclusionesLa CA de aorta abdominal implica una elevada incidencia de SIRS. Aunque IL-6, IL-8, IL-10 y TNFα aumentan después de la cirugía en ambos grupos, el manejo perioperatorio fast-track pareció modular solo la liberación de IL-6 e IL-10. Necesitamos más estudios para valorar las citoquinas como biomarcadores de pronóstico.
The aim of this study was to determine the incidence of systemic inflammatory response syndrome (SIRS) and cytokines release in patients after open abdominal aortic surgery with fast-track compared to those with conventional peri-operative management.
Material and methodsA prospective, single centre, randomised study was conducted from October 2015-November 2017 that included consecutive patients undergoing open abdominal aortic surgery. Two groups were established: fast-track group (GFT) and conventional group (GC) depending on the peri-operative management. GFT peri-operative management consisted of: a carbohydrate drink 2hours before surgery, analgesia using pre-peritoneal elastomer, mobilisation, and early diet. The main demographic and perioperative variables were collected, and the levels of serum cytokines (TNFα, IL-1ß, IL-6, IL-8, IL-10, and IL-12p70) were analysed at baseline, 8, 24, and 48hours, post-operatively. The SIRS incidence was recorded in the first 72hours after surgery, as well as the mortality and complications rate during admission.
ResultsA total of 49 patients were included (GFT: 26, GC: 23) with a mean age of 67.8±8.6 years, of whom 91.8% were men. Both groups were comparable in demographic and perioperative variables, except in terms of the pre-operative body mass index: GFT: 25.67±3.07 vs. GC: 29.29±4.66 (P=.008) and total clamping time: GFT: 52.4±12.63 vs. GC: 63.91±14.34min (P=.005). The incidence of SIRS in GFT vs. GC was 38.5% vs. 45.5%, 38.5% vs. 45.5%, 23.1% vs. 26.1%, 15.4% vs. 19% (P>.05) at 8, 24, 48, and 72h postoperatively, respectively. As regards serum cytokines, a higher release of IL-6, IL-8, IL-10 and TNFα in GC was observed compared to GFT. At 8h, IL-6 reached a statistically significant increase compared to baseline in GC (P=.045). At 24h, the IL-10 increased compared to the baseline, and was statistically higher in GC compared to GFT (P=.024). Acute renal failure was observed in the GC (6/23, 26.1%) and 1/26 (3.8%) in GFT (P=.041).
ConclusionsOpen abdominal aortic surgery showed a high incidence of SIRS. Although IL-6, IL-8, IL-10, and TNFα serum increased after open abdominal aortic surgery in both groups, fast-track peri-operative management seemed to modulate only IL-6 and IL-10 release. More studies are required to evaluate cytokines as biomarkers to measure outcome.
La cirugía abierta (CA) de aorta abdominal sigue siendo una de las opciones terapéuticas en el tratamiento de los aneurismas de aorta abdominal (AAA) y de la patología obstructiva aortoilíaca1–4. Los estudios más recientes han demostrado una mortalidad a los 30 días de la cirugía entre el 3% y el 4,7%5.
Tanto la agresión quirúrgica, como los efectos del clampaje y la posterior reperfusión desencadenan una fase de inflamación aguda similar a los efectos de un gran traumatismo o de una sepsis. Las citoquinas son mediadores necesarios que dirigen la respuesta inflamatoria al lugar de la infección o lesión, y son promotores esenciales de la cicatrización adecuada de la herida. Sin embargo, la producción exagerada de citoquinas proinflamatorias puede contribuir a la lesión de órganos. Una respuesta desequilibrada puede desencadenar el síndrome de respuesta inflamatoria sistémica (SIRS) que se caracteriza por taquicardia, fiebre o hipotermia, leucocitosis y/o leucopenia6–11.
Numerosos equipos quirúrgicos han aplicado diferentes medidas para agilizar el proceso quirúrgico y mejorar los resultados en la CA de aorta abdominal10,12–15. Nuestro grupo, estableció un protocolo de optimización perioperatorio tipo fast-track para paciente intervenidos de AAA con bypass recto aorto-aórtico por vía retroperitoneal. Este conjunto de medidas perioperatorias (ausencia de preparación intestinal, reducción del ayuno preoperatorio, administración de bebida carbohidratada 2h antes de la intervención, control del dolor con elastómero preperitoneal, movilización y dieta precoces) fue seguro y consiguió la reducción de la incidencia de SIRS postoperatorio y de los días de ingreso16.
ObjetivosNuestro objetivo es medir la incidencia del SIRS y la secreción de citoquinas en los pacientes intervenidos de CA de aorta abdominal a los que se les aplican medidas fast-track frente a un grupo control (GC).
Material y métodosSe trata de un estudio prospectivo de intervención, unicéntrico y aleatorizado, aprobado por el comité de ética de nuestra institución y realizado de acuerdo con las normas de la declaración del Helsinki para la valoración de la reacción inflamatoria o SIRS y la activación de citoquinas en los pacientes intervenidos de CA de aorta abdominal a los que se les aplican medidas fast-track frente a un GC.
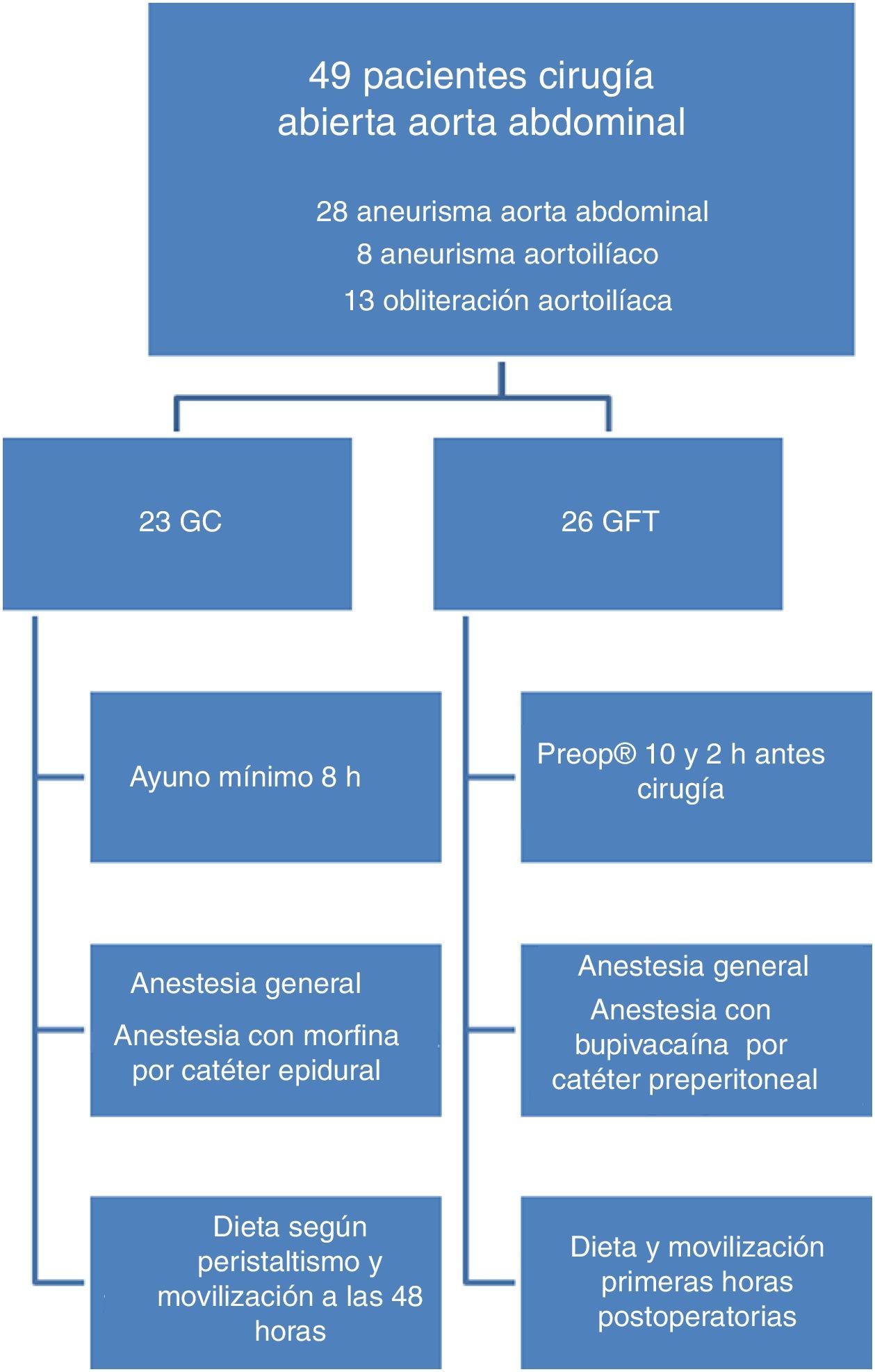
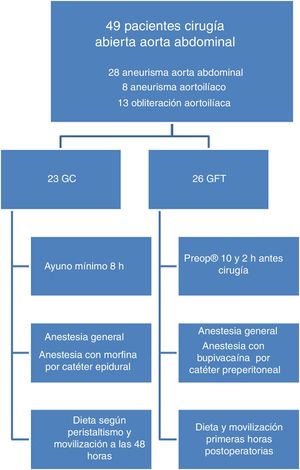
Desde octubre de 2015 hasta noviembre de 2017 se incluyeron, de forma consecutiva, pacientes intervenidos de CA de aorta abdominal por patología aneurismática u obstructiva del sector aortoilíaco. Se establecieron dos grupos de tratamiento (fig. 1). El grupo fast-track (GFT), con las medidas de optimización perioperatorias y un GC. Los pacientes se asignaron a los diferentes grupos mediante aleatorización con una secuencia obtenida por el programa informático «true number random service». Se han seguido las recomendaciones «Consolidated Standards of Reporting Trials» (CONSORT) para este tipo de estudios17.
Todos los pacientes fueron intervenidos de forma electiva por abordaje retroperitoneal mediante bypass aorto-aórtico, aortoilíaco o aortofemoral. En ambos grupos de pacientes se realizó una profilaxis antibiótica con 3 dosis de 1 gramo de cefazolina, la primera 30 min antes de la incisión y el resto cada 8 h. Posteriormente, se realizó una anestesia general balanceada.
En los pacientes GFT se redujo el ayuno preoperatorio añadiendo la ingesta de una bebida rica en hidratos de carbono (Preop®) 100ml 10 h y 50ml 2 h antes de la cirugía. Se minimizaron las incisiones. La analgesia de las primeras 48 h postoperatorias se realizó con un catéter preperitoneal entre los músculos oblicuos con un elastómero de infusión continua de bupivacaína 0,25%. En el postoperatorio inmediato, se incentivó la movilización precoz del paciente con la sedestación en cama. La primera noche después de la cirugía se inició la ingesta hídrica (zumo de frutas). El primer día postoperatorio se progresó con la dieta y el paciente inició la deambulación. El tercer día el paciente debería haber tenido una movilización completa para ir a su domicilio.
Los pacientes del GC ayunaron un mínimo de 8 h antes de la intervención. La analgesia postoperatoria se llevó a cabo con mórficos a través de catéter epidural. Se inició la dieta a partir del primer día postoperatorio según la presencia de peristaltismo. El tercer día se inició la deambulación y se planificó el alta para el cuarto día.
En ambos grupos, como analgesia de rescate (escala visual analógica del dolor>3), se usaron AINE y/o mórficos.
VariablesDe cada grupo, se registraron las variables demográficas (edad y sexo), el diagnóstico, el riesgo anestésico y los siguientes factores de riesgo cardiovasculares (tabla 1):
- -
Tabaquismo: aquellos pacientes que presentan un hábito tabáquico activo.
- -
Hipertensión arterial: pacientes ya diagnosticados previamente y que están siendo tratados con una dieta o una medicación específicas.
- -
Diabetes mellitus: pacientes con glucemias basales>127mg/dl o en tratamiento con dieta, antidiabéticos orales o insulina.
- -
Dislipemia: pacientes con valores séricos de colesterol total>200mg/dl o colesterol LDL>100, o que se encuentran en tratamiento dietético o farmacológico.
- -
Insuficiencia renal crónica: paciente con niveles basales de creatinina sérica de>1,5mg/dl.
- -
Cardiopatía isquémica: pacientes con antecedentes de síndrome coronario agudo.
- -
Enfermedad pulmonar obstructiva crónica: paciente diagnosticado por pruebas funcionales respiratorias.
Diagnóstico, riesgo anestésico y comorbilidades de los pacientes de ambos grupos
| Variable | Grupo control (n=23) | Grupo fast track (n=26) | p |
|---|---|---|---|
| Edad (media+DE) | 67,74+8,2 | 67,85+9,1 | 0,966 |
| Sexo % (n) | 0,647 | ||
| Mujeres | 8,7 (2) | 7,7 (2) | |
| Hombre | 91,3 (21) | 92,3 (24) | |
| Diagnóstico % (n) | 0,218 | ||
| Patología aneurismática | 65,2 (15) | 80,8 (21) | |
| Patología obstrutiva | 34,8 (8) | 19,2 (5) | |
| ASA % (n) | 0,234 | ||
| 1-2 | 26,1 (6) | 42,3 (11) | |
| 3-4 | 73,9 (17) | 57,7 (15) | |
| IMC (media+DE) | 29,29+4,7 | 25,67+3,1 | 0,008 |
| HTA % (n) | 73,9 (14) | 53,8 (17) | 0,146 |
| DM % (n) | 34,8 (8) | 11,5 (3) | 0,086 |
| DLP % (n) | 87 (20) | 53,8 (14) | 0,015 |
| Tabaquismo % (n) | 0,888 | ||
| Nunca fumador | 4,3 (1) | 7,7 (2) | |
| Activo | 43,5 (10) | 42,3 (11) | |
| Exfumador | 52,2 (12) | 50 (13) | |
| IRC % (n) | 17,4 (4) | 11,5 (3) | 0,692 |
| EPOC % (n) | 30,4 (7) | 26,9 (7) | 0,786 |
| EAP % (n) | 56,5 (13) | 34,6 (9) | 0,124 |
| Cáncer % (n) | 4,3 (1) | 23,1 (6) | 0,103 |
| AVC % (n) | 8,7 (2) | 0 | 0,215 |
| CI % (n) | 17,4 (4) | 7,7 (2) | 0,40 |
ASA: American Society of Anesthesiologists; AVC: accidente cerebrovascular; CI: cardiopatía isquémica; DE: desviación estándar; DLP: dislipemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EPOC: enfermedad obstructiva crónica; HTA: hipertensión arterial; IMC: índice de masa corporal; IRC: insuficiencia renal crónica.
Se registró el antecedente cáncer si el paciente había sido diagnosticado de alguna neoplasia en los 5 últimos años.
Se registró la valoración anestésica con la escala de riesgo preoperatorio de la American Society of Anesthesiologists así como las siguientes variables intraoperatorias: sangrado total, volumen autotrasfundido, tiempo de clampaje y tiempo quirúrgico total.
Se registró la incidencia de SIRS a las 8, 24 y 48 h postoperatoria. Bown et al.6 definen SIRS al darse dos o más de los siguientes criterios:
- -
Temperatura de>38° o<36°.
- -
Frecuencia cardíaca de>90 latidos/minuto.
- -
Frecuencia respiratoria de>20 respiraciones/minuto o ventilación mecánica asistida.
- -
Leucocitosis de>12 G/l o de leucopenia de<4 G/l.
Se analizaron los niveles de citoquinas (TNFα, IL-1ß, IL-6, IL-8, IL-10 y IL-12p70) basales, a las 8, 24 y 48h postoperatorias de cada paciente. Estas determinaciones se realizaron mediante citometría de flujo en un panel de anticuerpos multiplex (Kit Human Cytokine MAG BEADS PANEL; MILLIPORE / MILLIPLEX®) y se midieron en el sistema Luminex-200 que utiliza una tecnología flexible basada en los principios de la microscopía de fluorescencia cuantitativa o de la citometría de flujo con detección fluorimétrica.
Registramos también las complicaciones postoperatorias (infección de herida quirúrgica, arritmia o infarto agudo de miocardio, infección urinaria, infección respiratoria o insuficiencia renal aguda según ARISe18) y la mortalidad durante el ingreso.
Análisis estadísticoEl procesamiento de datos se realizó con el programa IBM SPSS Statistics® (versión 15) y mediante análisis estadístico con el test de t de Student o U de Mann-Whitney para la comparación de medias de muestras independientes, chi cuadrado de Pearson o el test exacto de Fisher para el contraste de proporciones, según fuesen paramétricas o no y con tablas de contingencia para las variables dicotómicas. Se realizó el análisis de correlación entre variables cuantitativas mediante el test no paramétrico de Pearson. Se realiza un análisis de regresión logística univariante y multivariante. Se consideró significación estadística una p<0,05.
ResultadosVariables intraoperatoriasEn cuanto a las variables intraoperatorias no hubo diferencias significativas en los grupos de tratamiento en el volumen de sangrado (GFT: 1227ml vs. GC: 1072ml [p=0,461]), el volumen autotrasfundido (GFT: 452ml vs. GC: 411ml [p=0,912]), el tiempo quirúrgico total (GFT: 188min vs. GC: 210min [p=0,079]) ni en la transfusión sanguínea (GFT: 34,6% vs. GC: 17,4% [0,209]).
Si encontramos diferencias en el tiempo de clampaje total (GFT: 52,4min vs. GC: 63,91min [p=0,005]). Se realizaron 10 clampajes suprarrenales en cada grupo.
SIRSA las 8 y 24 h postoperatorias el 38,5% de los pacientes del GFT presentaron SIRS, mientras en el GC fueron el 45,5%. Sin embargo, a las 48 h postoperatorias, el 23,1% en GFT presentaron SIRS frente al 26,1% en el GC. Finalmente, a las 72 h postoperatorias la incidencia de SIRS en los grupos GFT y GC fue del 15,4% y 19% respectivamente. Ninguna de estas diferencias fue estadísticamente significativa (tabla 2).
Complicaciones postoperatorias durante el ingresoUn paciente del GC presentó un infarto agudo de miocardio (p=0,47). Se diagnosticaron 6 infecciones respiratorias en el GC y 3 en GFT (p=0,273). En GFT, hubo 2 casos de infección urinaria (p=0,491). Encontramos diferencias estadísticamente significativas en relación con la presencia de insuficiencia renal aguda transitoria (p=0,041), 6 casos se dieron en el GC y 1 en GFT.
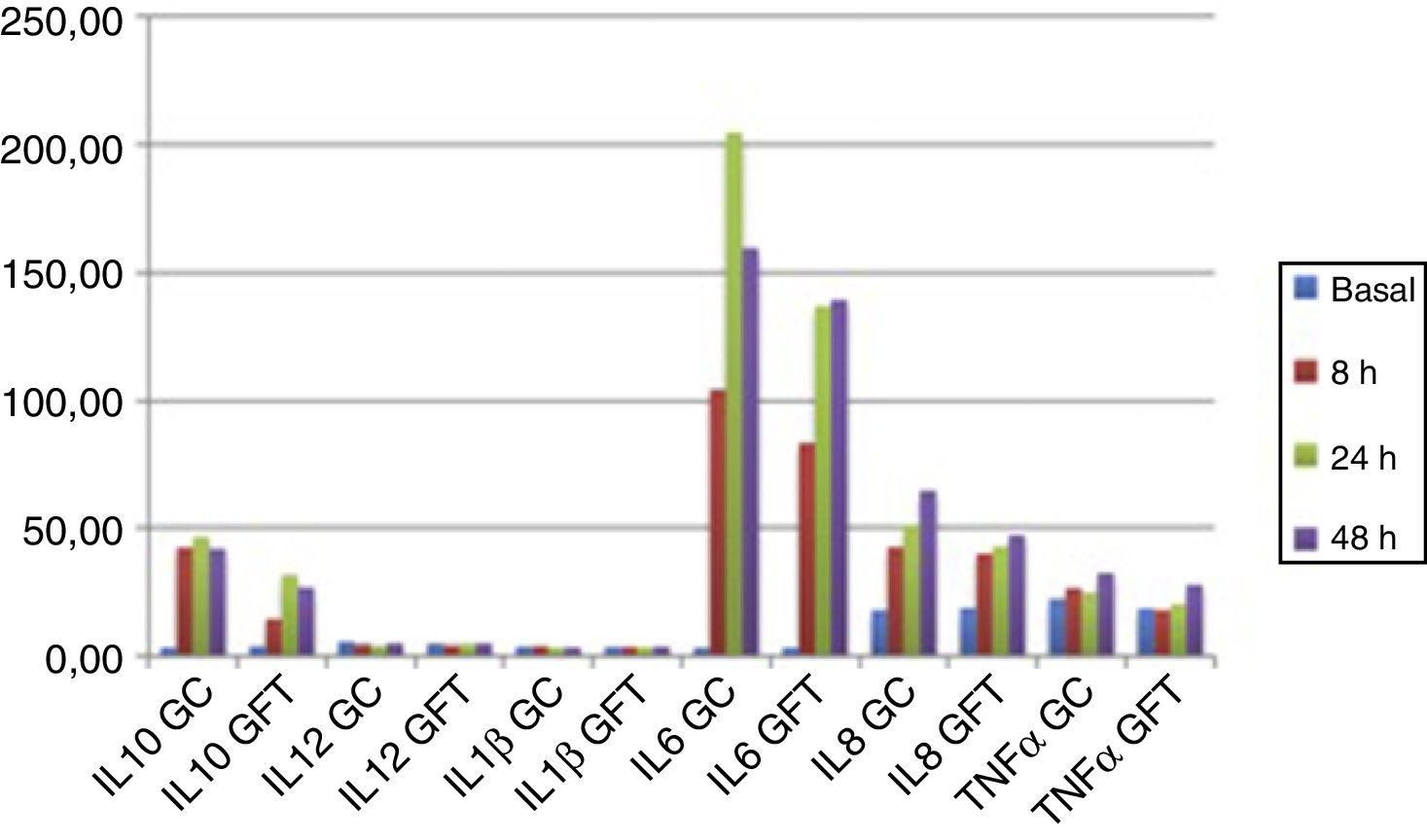
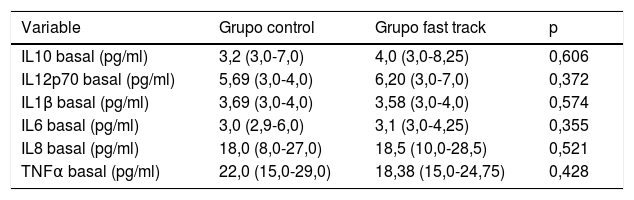
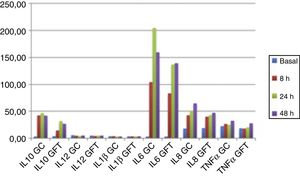
CitoquinasNo se observan diferencias significativas en las citoquinas basales de cada paciente en los dos grupos de tratamiento como puede observarse en la tabla 3. En los gráficos (fig. 2) ilustramos la evolución de los niveles plasmáticos de citoquinas en el postoperatorio según el grupo de tratamiento. Las variaciones en la IL-12p70 y en la IL-1ß son poco perceptibles en nuestras determinaciones. En cambio, percibimos variaciones en las citoquinas IL-10, IL-6, IL-8 y TNFα durante el postoperatorio en ambos grupos. La concentración de estas citoquinas en suero a las 8, 24 y 48 h postoperatorias se encuentra más elevada en el GC respecto al GFT, aunque las diferencias no son estadísticamente significativas.
Mediana y rango intercuartil de las citoquinas basales en ambos grupos
| Variable | Grupo control | Grupo fast track | p |
|---|---|---|---|
| IL10 basal (pg/ml) | 3,2 (3,0-7,0) | 4,0 (3,0-8,25) | 0,606 |
| IL12p70 basal (pg/ml) | 5,69 (3,0-4,0) | 6,20 (3,0-7,0) | 0,372 |
| IL1β basal (pg/ml) | 3,69 (3,0-4,0) | 3,58 (3,0-4,0) | 0,574 |
| IL6 basal (pg/ml) | 3,0 (2,9-6,0) | 3,1 (3,0-4,25) | 0,355 |
| IL8 basal (pg/ml) | 18,0 (8,0-27,0) | 18,5 (10,0-28,5) | 0,521 |
| TNFα basal (pg/ml) | 22,0 (15,0-29,0) | 18,38 (15,0-24,75) | 0,428 |
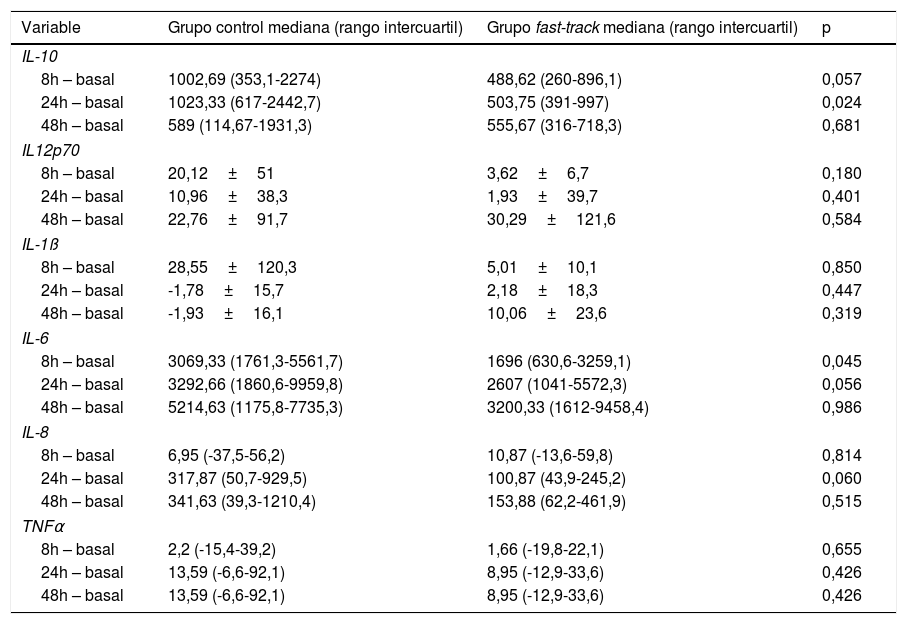
Si analizamos el incremento en porcentaje de las citoquinas a las 8, 24 y 48 h postoperatorias respecto a las concentraciones basales en suero, se observa un incremento estadísticamente significativo a las 8 h postoperatorias en la IL-6 (p=0,045) y una tendencia en la IL-10 (p=0,057) en el GC respecto al GFT. A las 24 h se observan incrementos, respecto al valor basal, estadísticamente significativos en la IL-10 (p=0,024) y una tendencia en la IL-8 (p=0,06) e IL-6 (p=0,056) en el GC respecto al GFT. Las diferencias observadas a las 48 h no son estadísticamente significativas como puede observarse en la tabla 4.
Incremento en porcentajes de las citoquinas a las 8, 24 y 48 h postoperatorias respecto al valor basal en ambos grupos
| Variable | Grupo control mediana (rango intercuartil) | Grupo fast-track mediana (rango intercuartil) | p |
|---|---|---|---|
| IL-10 | |||
| 8h – basal | 1002,69 (353,1-2274) | 488,62 (260-896,1) | 0,057 |
| 24h – basal | 1023,33 (617-2442,7) | 503,75 (391-997) | 0,024 |
| 48h – basal | 589 (114,67-1931,3) | 555,67 (316-718,3) | 0,681 |
| IL12p70 | |||
| 8h – basal | 20,12±51 | 3,62±6,7 | 0,180 |
| 24h – basal | 10,96±38,3 | 1,93±39,7 | 0,401 |
| 48h – basal | 22,76±91,7 | 30,29±121,6 | 0,584 |
| IL-1ß | |||
| 8h – basal | 28,55±120,3 | 5,01±10,1 | 0,850 |
| 24h – basal | -1,78±15,7 | 2,18±18,3 | 0,447 |
| 48h – basal | -1,93±16,1 | 10,06±23,6 | 0,319 |
| IL-6 | |||
| 8h – basal | 3069,33 (1761,3-5561,7) | 1696 (630,6-3259,1) | 0,045 |
| 24h – basal | 3292,66 (1860,6-9959,8) | 2607 (1041-5572,3) | 0,056 |
| 48h – basal | 5214,63 (1175,8-7735,3) | 3200,33 (1612-9458,4) | 0,986 |
| IL-8 | |||
| 8h – basal | 6,95 (-37,5-56,2) | 10,87 (-13,6-59,8) | 0,814 |
| 24h – basal | 317,87 (50,7-929,5) | 100,87 (43,9-245,2) | 0,060 |
| 48h – basal | 341,63 (39,3-1210,4) | 153,88 (62,2-461,9) | 0,515 |
| TNFα | |||
| 8h – basal | 2,2 (-15,4-39,2) | 1,66 (-19,8-22,1) | 0,655 |
| 24h – basal | 13,59 (-6,6-92,1) | 8,95 (-12,9-33,6) | 0,426 |
| 48h – basal | 13,59 (-6,6-92,1) | 8,95 (-12,9-33,6) | 0,426 |
Los valores de la IL-10, IL-6, IL-8 y TNFα están expresados como mediana y rango intercuartil y los resultados de la IL12p70 e IL1β como media±desviación estándar.
En relación a los incrementos de citoquinas en función del tipo de patología aórtica de los pacientes incluidos en el estudio hemos encontrado diferencias estadísticamente significativas en el incremento de IL-6 a las 48h respecto al basal.
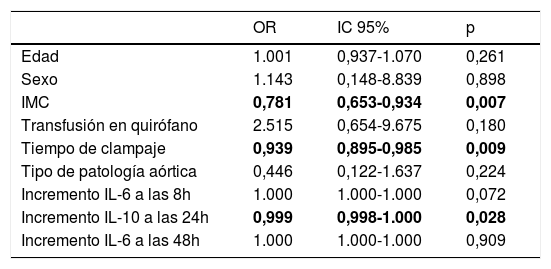
Se realiza un análisis de regresión logística univariante utilizando como variable dependiente el grupo de estudio (GC y GFT) y como covariables: edad, sexo, IMC, transfusión en quirófano, tiempo de clampaje, tipo de patología aórtica y los incrementos de IL-6 a las 8 h, IL-10 a las 24 h e IL-6 a las 48 h. Como podemos observar en la tabla 5 hemos encontrado diferencias en relación con el grupo en las variables IMC, en el tiempo de clampaje y en el incremento de IL-10 a las 24 h respecto al basal.
Análisis univariante con la variable dependiente el grupo de estudio (GFT y GC) y las covariables edad, sexo, IMC, transfusión en quirófano, tiempo de clampaje, patología aórtica que presentaban los pacientes y los incrementos de IL-6 a las 8 h, IL-10 a las 24 h e IL-6 a las 48 h
| OR | IC 95% | p | |
|---|---|---|---|
| Edad | 1.001 | 0,937-1.070 | 0,261 |
| Sexo | 1.143 | 0,148-8.839 | 0,898 |
| IMC | 0,781 | 0,653-0,934 | 0,007 |
| Transfusión en quirófano | 2.515 | 0,654-9.675 | 0,180 |
| Tiempo de clampaje | 0,939 | 0,895-0,985 | 0,009 |
| Tipo de patología aórtica | 0,446 | 0,122-1.637 | 0,224 |
| Incremento IL-6 a las 8h | 1.000 | 1.000-1.000 | 0,072 |
| Incremento IL-10 a las 24h | 0,999 | 0,998-1.000 | 0,028 |
| Incremento IL-6 a las 48h | 1.000 | 1.000-1.000 | 0,909 |
Los valores resaltados en negrita indican resultados con significación estadística.
En un análisis multivariante con las variables previamente citadas, hemos encontrado que tanto el tiempo de clampaje como el incremento de IL-10 a las 24 h se relacionan de manera independiente con el grupo de estudio, siendo menores en los pacientes del grupo GFT.
DiscusiónLos pacientes intervenidos de CA de la aorta abdominal representan un modelo de secreción de citoquinas. Estas se elevan tanto por la agresión tisular de la exposición quirúrgica como por la isquemia y reperfusión secundaria al clampaje. Las citoquinas que hemos analizado se diferencian en proinflamatorias y antinflamatorias. Las principales citoquinas proinflamatorias son TNFα (altamente relacionado con la instauración de SIRS), IL-1β (aunque valores anormalmente bajos también se relacionan con el SIRS), IL-6 (mediador de la fiebre) e IL-8. Como citoquinas antiinflamatorias hemos analizado la IL-10 (antagonista del TNFα, atenúa la respuesta del SIRS) y la IL-12p7019,20. La elevación sérica de citoquinas posterior a la cirugía ha sido anteriormente descrita21,22 y es esperable como reacción fisiológica para promover la curación después de una agresión tisular7. Como en nuestro caso, algunas citoquinas (IL-1β) pueden ser difíciles de detectar en sangre debido a su tiempo de vida media corto (6 min)23. Sin embargo, los niveles de IL-6 son detectables durante 60 min y pueden persistir hasta 10 días tras la agresión quirúrgica. La evidencia reciente ha demostrado que los niveles circulantes de IL-6 son proporcionales al grado de lesión tisular durante la cirugía y se le otorga un papel tanto proinflamatorio como antiinflamatorio, atenuando la actividad del TNFα e IL-124.
Las citoquinas más estudiadas en relación con la reparación de AAA son TNFα, IL-6 y con menor frecuencia, IL-8, IL-10, IL-16,8,25. En los pacientes intervenidos de aneurisma de aorta abdominal, el fallo multiorgánico está relacionado con niveles elevados de IL-6 y TNFα y una mayor mortalidad con niveles elevados de TNFα25–27. Niveles elevados de IL-10 están relacionados con estancias prolongadas en unidad de críticos después de la CA de AAA6.
En nuestro estudio, además de los parámetros clínicos, hemos utilizado IL-6, IL-8, IL-10, IL-12p70 y TNFα como biomarcadores para valorar el impacto de las medidas fast-track sobre la reacción inflamatoria de los pacientes intervenidos de CA de la aorta abdominal.
Nuestras gráficas muestran una modulación de la secreción de IL-6, IL-8, IL-10 y TNFα en el GFT. Es difícil valorar el valor pronóstico del aumento de citoquinas tanto proinflamatorias (IL-6, IL-8 y TNFα) como antiinflamatorias (IL-10). Una respuesta inflamatoria debe estar seguida por una regulación antiinflamatoria balanceada. Parece lógico pensar que una reacción inflamatoria más atenuada será más fácilmente regulada.
Los grupos de tratamiento GFT y GC han sido homogéneos en todas las variables excepto en el IMC y el tiempo de clampaje aórtico. Ciertamente, un mayor IMC dificulta la cirugía y puede estar en relación con una mayor duración del tiempo para la realización de la anastomosis proximal en los pacientes del GC, aumentando la agresividad quirúrgica sobre este grupo. Estas diferencias en los grupos hacen que debamos ser prudentes en la interpretación de los resultados obtenidos y suponen una limitación para extraer conclusiones.
Con la intención de hacer extrapolables los resultados obtenidos a todos los pacientes intervenidos de cirugía aórtica abdominal, hemos incluido tanto pacientes isquémicos como aneurismáticos. Ciertamente los fenómenos de isquemia y reperfusión son menores en los pacientes isquémicos. Aun así, la distribución de pacientes isquémicos y aneurismáticos ha sido similar en ambos grupos de tratamiento. En el análisis univariante, el diagnóstico tampoco ha sido una covariable significativa.
Nuestro estudio tiene una muestra demasiado pequeña para poder relacionar las concentraciones plasmáticas de las diferentes citoquinas con la evolución clínica postoperatoria. Por ello, creemos que se necesitan más estudios con mayor tamaño muestral para poder establecer con mayor precisión su papel como biomarcadores de pronóstico en estos pacientes.
A pesar de las limitaciones, hemos objetivado cierta modulación de las citoquinas en el postoperatorio de los pacientes intervenidos de CA de aorta abdominal con las medidas fast-track. Esta modulación podría tener implicaciones clínicas.
ConclusionesLa CA de aorta abdominal implica una elevada incidencia de SIRS postoperatorio a pesar del manejo perioperatorio. Aunque encontramos que las IL-6, IL-8, IL-10 y TNFα aumentan después de la cirugía en ambos grupos, el manejo perioperatorio fast-track parece modular la liberación de IL-6 e IL-10. Necesitamos más estudios para evaluar las citoquinas como biomarcadores de pronóstico.
FinanciaciónEste trabajo ha recibido una beca de la Fundación de la Sociedad Española de Cirugía Vascular (SEACV).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.