Analizar la experiencia en la valoración diagnóstica y terapéutica de las malformaciones vasculares periféricas (MVP) sintomáticas.
Material y métodosEstudio observacional descriptivo retrospectivo tipo serie de casos de pacientes tratados entre 2003 y 2010. Se analizó la metodología diagnóstica, estrategia terapéutica, complicaciones y resultado clínico percibido por el propio paciente.
ResultadosEn el período analizado se incluyen 43 pacientes, la mayor parte varones 27 (62%), y con localización preferente en el miembro inferior 17 (39%), miembro superior 14 (32%), abdomen 5 (11%) y región facial 3 (7%). El tipo de MVP fue activa (MVPHA) en 16 (37%) e inactiva (MVPHI) en 27 (63%). En el estudio diagnóstico se utilizaron la resonancia magnética (RM) 40 (93%), la eco-doppler en 39 (91%), la arteriografía en 27 (63%) y la tomografía computarizada en 3 (7%). Se realizaron un total de 97 procedimientos embolizadores (2,2 por paciente), siendo el material embolizador único en 62 (65%) y múltiple en 33 (35%). Se obtuvo un éxito técnico del 98%. Se presentaron complicaciones en 6 (6%) de 97 técnicas de embolización. Se intervino quirúrgicamente a 13 pacientes (30%).
El tiempo mediano de seguimiento fue de 24 meses (RIC: 3,6-84,2). El resultado clínico, teniendo en cuenta una valoración subjetiva del estado del propio paciente, fue asintomático en 15 (35%), mejoría clínica en 24 (56%), igual en 3 (7%) y peor en uno (2%).
ConclusiónesEl diagnóstico de las MVP se basa en la RM y la eco-doppler utilizando la arteriografía, preferentemente en la MVPHA. Una técnica de embolización asociada o no a cirugía es la primera opción terapéutica en el tratamiento de MVPHI y MVPHA con un resultado clínico satisfactorio.
To analyse the experience in the diagnostic evaluation and treatment of symptomatic peripheral vascular malformations (PVM).
Material and methodsA retrospective observational study of a case series of patients treated between 2003 and 2010. The diagnostic procedures, therapeutic approach, complications and clinical outcome perceived by the patient, were analysed.
ResultsA total of 43 patients were included in the period studied, with a majority 27(62%) of males. The most frequent locations were: lower limbs found in 17 (39%), upper limbs 14 (32%), abdomen 5 (11%) and facial region 3 (7%). The type of MVP was active in 16 (37%) and inactive 27(63%). The diagnostic study used was: magnetic resonance imaging (MRI),40 (93%), echo-Doppler, 39 (91%), angiography 27(63%), and CT 3 (7%). A total of 97 embolisation procedures (2.2 per patient) were performed, a single embolisation material being used in 62 (65%) and multiple in 33 (35%). A 98% technical success was achieved. Complications occurred in 6 (6%) of 97 embolisation techniques, and 13 (30%) underwent surgery. Median follow-up was 24 months (IQR 3.6-84.2). The clinical outcome, using a self-assessment by the patient, was asymptomatic in 15 (35%), a clinical improvement in 24 (56%), equal in 3 (7%) and worse in 1 (2%).
ConclusionsThe diagnosis of PVM is based on MRI and Doppler ultrasound using angiography preferably in active PVM. An embolisation technique with or without surgery is the first therapeutic option in treating active and inactive PVM with a satisfactory clinical outcome.
Las malformaciones vasculares periféricas (MVP) presentan con frecuencia dificultades de clasificación diagnóstica y estrategia terapéutica. El cuadro clínico varía desde el paciente asintomático hasta situaciones que alteran la calidad de vida o de riesgo vital1,2. La resección quirúrgica completa del nidus de la MVP es rara vez posible, excepto cuando la MVP es pequeña, localizada y accesible. Hace años la cirugía era el tratamiento estándar, pero déficits funcionales, estéticos y los malos resultados evolutivos con altas tasas de recurrencia3,4 han hecho que los procedimientos de embolización, sobre todo del nidus de la MVP, hayan mejorado los resultados. El objetivo de una embolización es producir una oclusión vascular mediante la administración intravascular de una sustancia biocompatible, con la consiguiente reducción del volumen de la MVP y una mejoría clínica. Las MVP son sensibles a diversos estímulos, así una indicación terapéutica inadecuada como una intervención quirúrgica o un fallido intento embolizador puede estimular la actividad y el crecimiento de la MVP, con el consiguiente empeoramiento clínico5; por lo tanto, la destrucción completa del nidus de una malformación vascular es la única posibilidad de curación o de mejoría clínica en MVP. La selección de la técnica de embolización y el agente esclerosante se realiza en función de la extensión, la localización y el tipo de MVP6–8. Mulliken y Glowacki9, en 1982, establecen una primera clasificación histopatológica, y Jackson10 una hemodinámica. La Sociedad Internacional para el Estudio de la Anomalías Vasculares recomienda una clasificación sobre la base de las características celulares, clínicas y hemodinámicas11, y Kawanabe12 aporta una clasificación práctica de indicación terapéutica en función del flujo de la MVP (tabla 1).
ISSVA: clasificación de malformaciones vasculares periféricas
| Tumor vascular | Malformación vascular | |
| Simple | Combinada | |
| Hemangioma | Malformación capilar | Fístula arteriovenosa, malformación a-v |
| Malformación capilar-venosa | ||
| Malformación capilar-linfática-venosa | ||
| Otras | Malformación linfática | Malformación linfática-venosa |
| Malformación arteriovenosa capilar-linfática | ||
| Malformación venosa | ||
| Clasificación de Jackson et al10 | ||
| Hemangioma | ||
| Malformación vascular | ||
| Bajo flujo | ||
| Alto flujo | ||
| Malformaciones linfáticas | ||
| Indicación terapéutica y hemodinámica de MVP (Kawanabe et al.b) | ||
| MVP bajo flujo: escleroterapia o embolización nidus | ||
| MVP de flujo intermedio: escleroterapia (+ embolización arterial) | ||
| MVP de alto flujo: embolización arterial (+ escleroterapia) | ||
ISSVA: International Society for the Study of Vascular Anomalies.
bKawanabe et al12.
El objetivo es evaluar retrospectivamente el diagnóstico, el tratamiento realizado y los resultados en las MVP. Se describe nuestro enfoque actual en el diagnóstico y las alternativas terapéuticas en el manejo de esta patología.
Pacientes y métodosSe analiza de forma retrospectiva a 43 pacientes consecutivos tratados por MVP sintomáticas desde enero de 2003 hasta diciembre 2010.
La MVP fue evaluada inicialmente mediante criterios clínicos y hemodinámicos con estudio eco-doppler; se valoraron las dimensiones y los patrones de flujo de la malformación cuando fue posible para determinar exploraciones diagnósticas posteriores. Para un estudio completo anatómico y hemodinámico de la MVP se utilizaron la resonancia magnética (RM), la tomografía computarizada (TC) si era aportada por el paciente y daba una información necesaria, y la angiografía, que se realizó como estudio selectivo de la MVP con el fin de definir con la mayor precisión posible las arterias aferentes al nido, el nidus de la malformación y venas de drenaje para un correcto diseño de la estrategia terapéutica. La flebografía se utilizó para la valoración del volumen y el patrón de flujo del nidus, y siempre asociada a un procedimiento embolizador13.
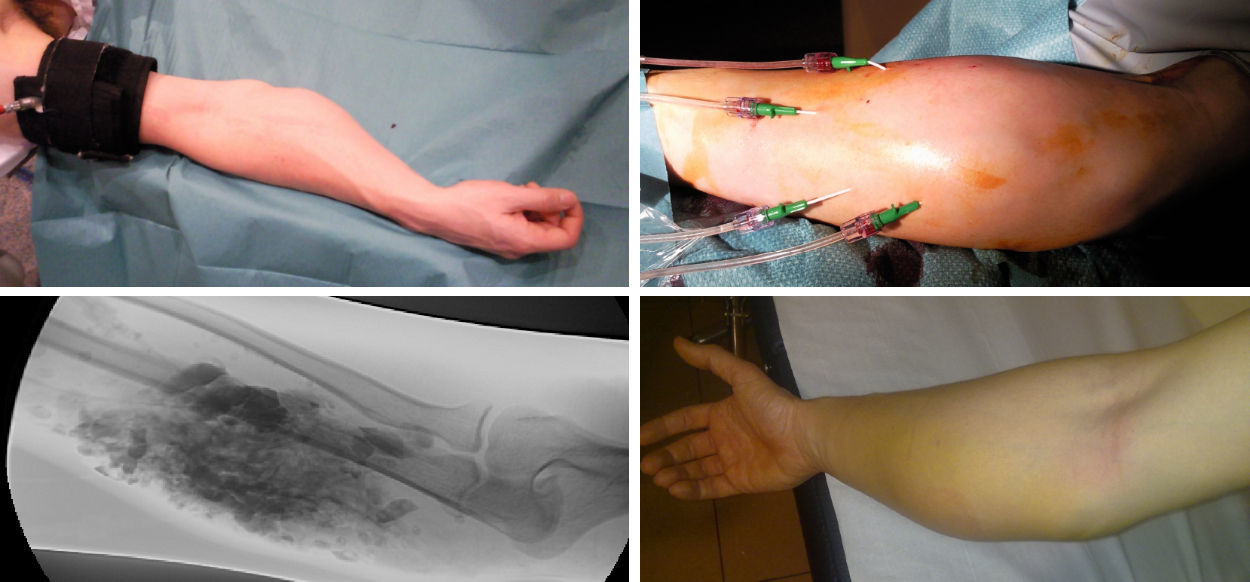
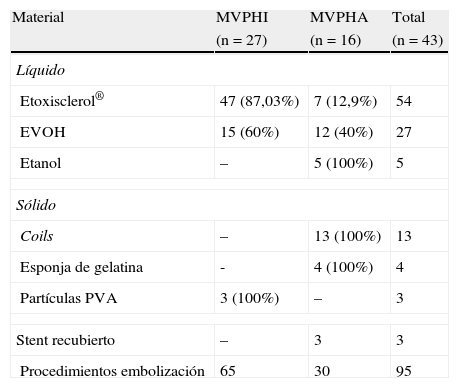
Las embolizaciones fueron realizadas por cirujanos vasculares con experiencia en técnicas endovasculares. El tipo de anestesia utilizada local, locorregional y general se indicó en función de la localización y el tipo de MAV, la técnica y el agente embolizador utilizado. Las técnicas embolizadoras realizadas fueron la anterógrada (arterial) en caso de MVPHA o MVPHI con aferencias arteriales significativas, y la punción transcutánea del nidus (venosa) en MVPHI o aquellas MVP tratadas con embolización arterial previa y en la mayor parte de los casos de forma secuencial (fig. 1).
Se utilizó la técnica coaxial en MVP que precisaron cateterización de arterias de anatomía compleja, pequeño calibre o si el material de embolización lo requirió en su utilización, como los coils de liberación controlada, partículas de PVA o agente embólico líquido tipo EVOH: copolímero alcohol vinil-etileno. El objetivo de la técnica embolizadora fue terapéutico en la mayoría de los casos y prequirúrgico en aquellas MVP que precisaron un procedimiento quirúrgico de resección asociado.
Los materiales sólidos de embolización utilizados fueron reabsorbibles (esponja de gelatina) si la técnica fue prequirúrgica, no reabsorbibles de gran tamaño (coils) en técnicas prequirúrgica o terapéutica y de pequeño tamaño (partículas de PVA) en técnicas terapéuticas.
Los materiales líquidos fueron esclerosantes como Etoxisclerol® (0,5-2%) utilizado como espuma, mezclado con un gas no tóxico en una dilución 6:1/4:1/2:1 y, en ocasiones, añadiendo contraste para un mejor control de la técnica embolizadora que fué por punción transcutánea del nidus en todos los casos; se utilizó en MVHI o MVPHA con exclusión arterial previa. El etanol al 95-98% con una dosis máxima de 1 cc/kg de peso se inyectó realizando una flebografía del nidus previa a su utilización para el cálculo del volumen que se debía utilizar; se utilizó la técnica de punción transcutanéa del nidus en MVPHA previa exclusión arterial.
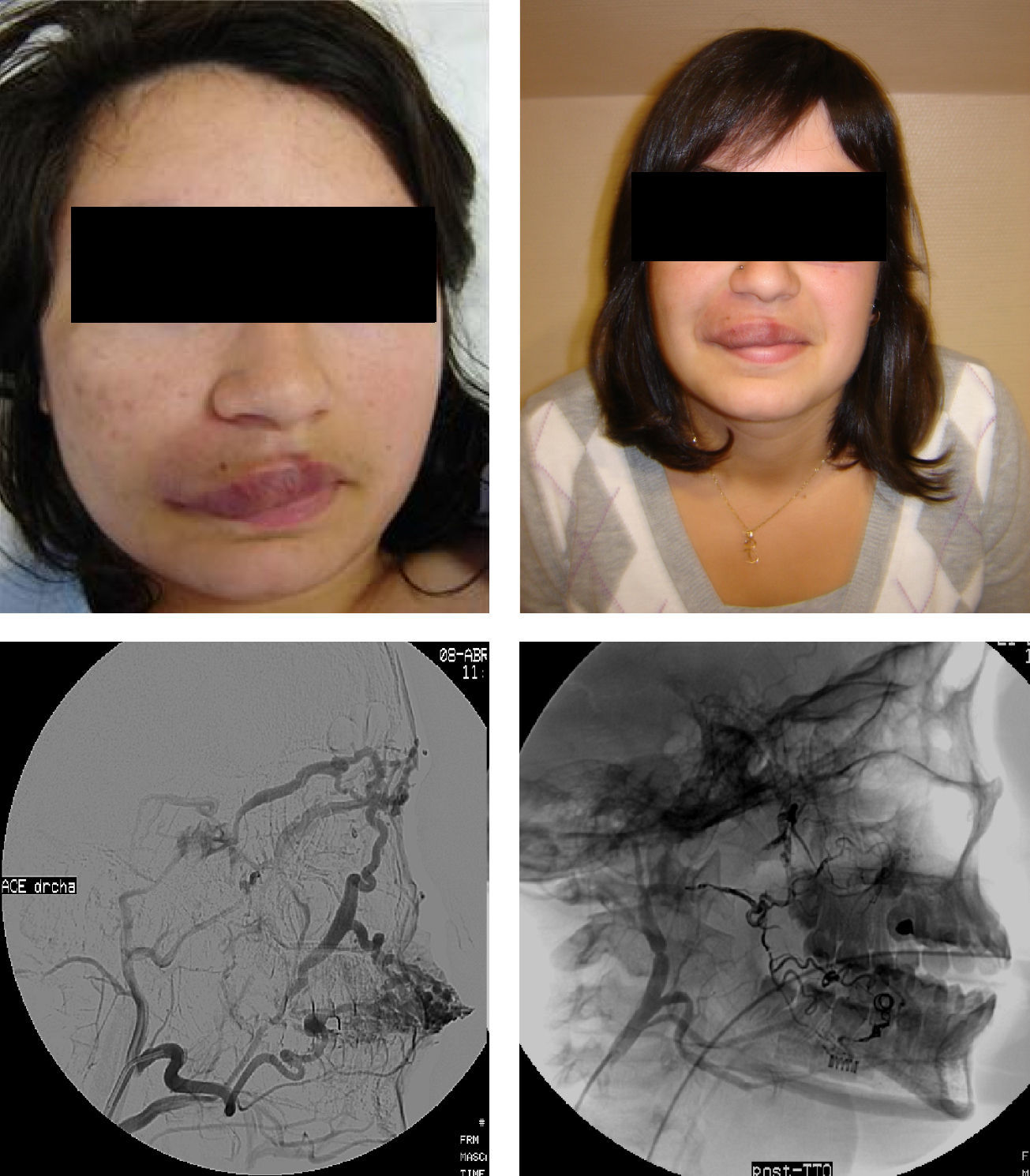
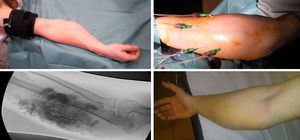
El EVOH, copolímero alcohol vinil-etileno, se usó mediante técnica coaxial anterógrada como procedimiento prequirúrgico si la MVP era accesible, terapéutico en MVPHI y asociado a punción del nidus en MVPHA (fig. 2).
Se utilizó compresión venosa proximal con manguito si la localización de la MVP permitió su uso en las técnicas de punción directa del nidus con material embólico líquido.
Un stent recubierto se utilizó en FAV de gran tamaño y trayecto corto de forma primaria, o previa embolización del nidus.
En las 24horas post-tratamiento se realizó estudio eco-doppler si técnicamente fue posible, efectuado por un facultativo no involucrado con la técnica realizada para una valoración terapéutica.
Se utilizó un protocolo de tratamiento médico posprocedimiento basado en antibioterapia e hidratación por vía intravenosa, una heparina de bajo peso molecular a dosis tromboprofilácticas, control del dolor y la inflamación con antiinflamatorios y un corticoide (0,1mg/kg de dexametasona) si se utilizó etanol y EVOH. Se evaluó la función renal (urea y creatinina sérica) antes del alta clínica.
El seguimiento fue clínico —eco-doppler y RM— con dos revisiones en el primer año y posteriormente anuales. Se utilizó un cuestionario simple de valoración clínica subjetiva del propio paciente de estado clínico pre y post-tratamiento: peor, igual, mejor o asintomático, que fue recogido en el historial del paciente y en algún caso requerido telefónicamente. No hubo pérdidas en el seguimiento.
El análisis estadístico se llevó a cabo con el programa SPSS Statistics 15.0.
ResultadosSe revisó a 43 pacientes consecutivos tratados por MVP sintomáticas con una edad media de 24,8±9,3 años; 27 (63%) eran varones y con localización preferente en los miembros inferior y superior (tabla 2). El tipo de MVP fue MVPHA en 16 (37%) y MVPHI en 27(63%); de estas, 25 (97%) venosas y 2 (3%) linfáticas.
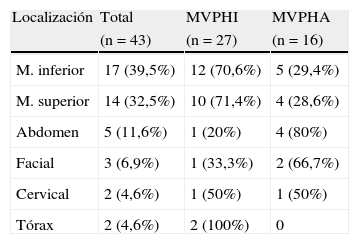
MVP: tipos y localización
| Localización | Total | MVPHI | MVPHA |
| (n = 43) | (n = 27) | (n = 16) | |
| M. inferior | 17 (39,5%) | 12 (70,6%) | 5 (29,4%) |
| M. superior | 14 (32,5%) | 10 (71,4%) | 4 (28,6%) |
| Abdomen | 5 (11,6%) | 1 (20%) | 4 (80%) |
| Facial | 3 (6,9%) | 1 (33,3%) | 2 (66,7%) |
| Cervical | 2 (4,6%) | 1 (50%) | 1 (50%) |
| Tórax | 2 (4,6%) | 2 (100%) | 0 |
El estudio diagnóstico para valoración de las MVP se realizó con la RM en 40 (93%) de 43 pacientes, 26 (96%) en MVPHI y 14 (87%) en MVPHA, eco-doppler en 39 (90%) de 43, 27 (100%) de MVPHI y 12 (75%) de MVPHA, y no hubo diferencias significativas entre los diferentes tipos de MVP (p>0,05). El estudio angiográfico se realizó en 27 (63%) de 43 casos, 11 (40%) de MVPHI y 16 (100%) de MVPHA, y hubo diferencia significativa (p<0,05)
Se realizó un total de 95 procedimientos embolizadores (2,2 por paciente). El tipo de anestesia utilizada fue locorregional en 68 (72%) casos, local en 19 (20%) y general en 8 (8%). La técnica de embolización fue anterógrada (arterial) en 36 (38%) y punción venosa transcutánea del nidus en 59 (62%) casos; no se utilizó la punción venosa retrógrada. El procedimiento embolizador fue terapéutico en 74 (78%) y prequirúrgico en 21 (22%) al precisar algún caso de MVP más de una sesión antes de la resección. El material de embolización utilizado fue único en 62 (65%) y múltiple en 33 casos (35%).
En la indicación de materiales se utilizaron con mayor frecuencia líquidos en la MVPHI, siendo el más utilizado el Etoxisclerol® en 54 (57%), y sólidos en MVPHA, con mayor frecuencia coils en 13 (14%). En 3 (18%) pacientes con MVPHA se utilizó un stent recubierto tipo Viabahn® (tabla 3).
MVP: tipos y material de embolización utilizado
| Material | MVPHI | MVPHA | Total |
| (n = 27) | (n = 16) | (n = 43) | |
| Líquido | |||
| Etoxisclerol® | 47 (87,03%) | 7 (12,9%) | 54 |
| EVOH | 15 (60%) | 12 (40%) | 27 |
| Etanol | – | 5 (100%) | 5 |
| Sólido | |||
| Coils | – | 13 (100%) | 13 |
| Esponja de gelatina | - | 4 (100%) | 4 |
| Partículas PVA | 3 (100%) | – | 3 |
| Stent recubierto | – | 3 | 3 |
| Procedimientos embolización | 65 | 30 | 95 |
Se realizó la extirpación de la MVP residual tras su exclusión endovascular en 13 casos (30%).
Se consideró éxito técnico la finalización del procedimiento embolizador indicado y se obtuvo en 95 (98%) de las 97 técnicas realizadas.
Hubo 6 (6%) complicaciones y 4 (4%) estuvieron relacionadas con el procedimiento, con 3 necrosis cutáneas y una embolización distal de material en el tratamiento de una MVPHA pélvica que, pese al intento de trombólisis farmacológica, requirió una amputación menor de pie, 2 (2%) no relacionadas con el procedimiento, un síndrome vagal severo y un síndrome febril que obligaron a la suspensión del mismo. No hubo defunciones ni complicaciones cardiológicas-renales relacionadas con el procedimiento ni en el seguimiento.
El seguimiento medio fue de 24 meses (RIC: 3,6-84,2). Como prueba de imagen de control se realizó al menos una RM en 37 (86%) pacientes. No hubo pérdidas de seguimiento.
Como resultados clínicos, se encuentran de los 43 pacientes: asintomáticos 15 (35%), 9 (33%) de MVPHI y 6 (40%) de MVPHA; con mejoría clínica 24 (56%), 15 (63%) de MVPHI y 9 (37%) de MVPHA; igual 3 (7%), todos del grupo MVPHI, y peor uno (2%), 1 MVPHA. No hubo diferencias significativas en los resultados entre ambos grupos (p<0,05).
DiscusiónLas MVP son una alteración en el desarrollo vascular en el período embriológico y se han descrito varias clasificaciones9–11. Las malformaciones vasculares que aumentan de tamaño proporcionalmente con el crecimiento del niño y no involucionan espontáneamente se clasifican por su actividad en MVPHI o de «bajo flujo» y MVPHA o de «alto flujo»10,12. La morfología del nidus es variada, y por su localización puede involucrar vasos superficiales y profundos, haciendo más complejo su tratamiento. La región de la cabeza y el cuello representa aproximadamente un 40% de la ubicación de las MVP del adulto14; en nuestra serie es menor al no tratar las MV intracraneales.
El diagnóstico de las MVP está basado en la historia clínica y la exploración física15; pueden no ser evidentes en el nacimiento, y cuando no pasan a una fase involutiva suelen crecer con el desarrollo del niño. Los síntomas varían en función de su tamaño y localización, pudiendo originar déficits funcionales, sobre todo cuando afectan a la vía aérea o digestiva.
La eco-doppler y la RM son las exploraciones básicas para el diagnóstico de las MVP. La eco-doppler es de utilidad para diferenciar las MVP activas e inactivas, con limitaciones en función de la localización de la lesión o en MVP complicadas en el caso de hemorragias previas o infecciones cutáneas. La RM es la prueba de imagen de elección, que en imágenes T2 aporta información hemodinámica y anatómica de la malformación, su relación con tejidos y órganos adyacentes. La RM también es útil en el seguimiento para la evaluación de los resultados del tratamiento.
La elección del tratamiento depende del tipo, la profundidad, la extensión y la localización anatómica de la MVP y de la experiencia del clínico. Opciones de tratamiento son la terapia con láser, la resección quirúrgica y los procedimientos de embolización, así como combinaciones entre las diferentes técnicas16.
Una MVP de pequeño tamaño y superficial puede tratarse con cualquiera de las diferentes técnicas descritas; sin embargo, el láser no puede aplicarse si las lesiones afectan a la mucosa oral, o cuando la MVP es extensa o voluminosa y la cirugía rara vez consigue la extirpación completa. El nidus de la MVP puede infiltrar tejidos blandos, como el muscular, los nervios periféricos y los órganos, por lo que la cirugía convencional, basada en la extirpación y la ligadura proximal de los vasos aferentes a la MVP, puede ocasionar déficits funcionales y deformidades estéticas, con una alta tasa de recurrencia, y en el futuro una dificultad de acceso endovascular añadido, por lo que se han desarrollado diferentes técnicas de embolización para un abordaje más correcto de las MVP.
La embolización consiste en la introducción de una sustancia biocompatible dentro de la luz del vaso o directamente en el nidus de la MVP, causando trombosis y posterior fibrosis. Una variedad de diferentes agentes esclerosantes líquidos, como el sulfato tetradecil de sodio, bleomicina, cianocrilatos o pegamentos y alcohol polivinilo se han utilizado en el tratamiento de las MVP17, pero se ha descrito una tasa alta de recanalizaciones en el seguimiento, así como complicaciones generales y locales18.
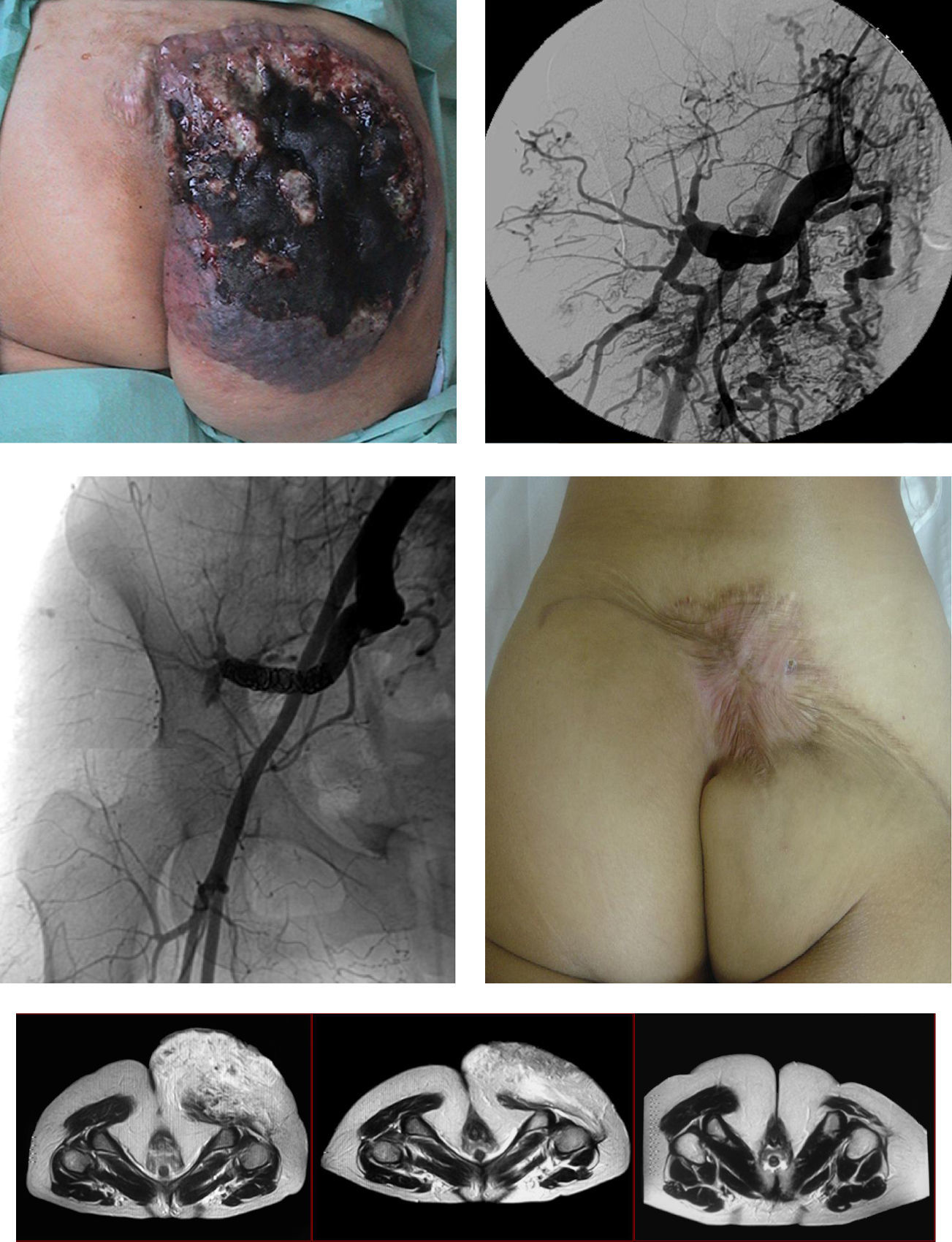
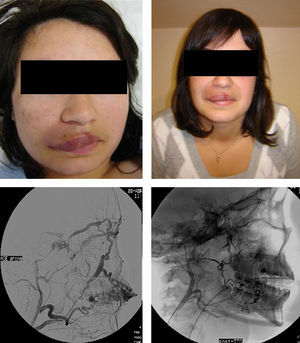
Una alternativa ha sido el uso de etanol absoluto, que es uno de los principales agentes utilizados en el tratamiento de las MVP quirúrgicamente inaccesibles. Se administra por vía transarterial o transvenosa, o mediante la punción directa del nidus, dependiendo del tipo hemodinámico y la localización anatómica de la MVP. El etanol produce daño endotelial, desnaturalización de las proteínas sanguíneas, formación de trombos y oclusión vascular19. Una buena respuesta terapéutica, definida como mejoría de los síntomas o la reducción en el tamaño de la lesión, se ha reportado en un 64-96% de las MVP tratadas con etanol20,21, pero también tiene, además de su difícil manejo que puede precisar monitorización invasiva de la presión en arteria pulmonar, altas tasas de complicaciones (7,5-27,9%)22. Las complicaciones pueden ser menores, cutáneas y neurológicas con más frecuencia, o mayores como el desarrollo de insuficiencia renal, embolia pulmonar, arritmia cardíaca, colapso cardiopulmonar y toxicidad sistémica, que puede producir fallo hepático23. En nuestra serie el etanol se ha utilizado en todos los casos en MVPHA para esclerosis del nidus con punción transcutánea y en un caso transarterial con buenos resultados; en 2 casos se produjo necrosis cutánea resuelta con resección posterior de la MVP y tratamiento tópico en otro (fig. 3).
El oleato de etanolamina es un agente líquido que, en comparación con el etanol, tiene menor capacidad de penetración en la pared vascular y efectos secundarios neurológicos24.
El polidocanol (Etoxisclerol®) es utilizado en escleroterapia de varices esofágicas y de miembros inferiores25, produce una hiperhidratación rápida de las células endoteliales que conduce a una lesión vascular y trombosis; es un procedimiento casi indoloro porque tiene un efecto anestésico, y una anestesia local o locorregional es suficiente para realizar la técnica embolizadora26. La incidencia de complicaciones menores es baja, aunque se han reportado casos de bradicardia sinusal progresiva y eventual paro sinusal27. En nuestro estudio el polidocanol en forma de espuma mediante punción directa transcutánea del nidus en MVPHI o en MVPHA, tras exclusión arterial efectiva, es el material líquido de elección y con una tasa baja de complicaciones.
El EVOH es un agente líquido no adhesivo que difunde y precipita, y no produce reacción inflamatoria. Se utiliza mezclado con tantalio para un mejor control fluoroscópico. Requiere anestesia locorregional y en algunos casos general, al precisar purgado previo del microcatéter con dimetilsulfóxido (DMSO) que produce dolor. Ha demostrado su utilidad en MV intracraneales y en nuestra serie se ha utilizado para la oclusión de aferencias arteriales significativas en MVPHI y asociado a materiales sólidos tipo coils en MVPHA.
En nuestro estudio, en los procedimientos embolizadores de MVP se utilizó la técnica arterial anterógrada para la administración de materiales embólicos sólidos para oclusión arterial en MVPHA y líquidos en MVPHI con arterias de calibre significativo, y la punción directa transcutánea del nidus en MVPHI y la MVPHA con exclusión arterial previa, utilizando la compresión venosa proximal siempre que fue posible para un uso más efectivo del material embólico líquido, siendo la espuma de polidocanol el de elección.
Las limitaciones del estudio son que es retrospectivo, con un número limitado de casos, y la falta de cuestionarios adecuados para monitorizar los resultados, teniendo que utilizar criterios propios de evaluación terapéutica, y con la dificultad para poder comparar los resultados con otros estudios similares.
ConclusionesLas malformaciones vasculares representan uno de los mayores desafíos de la especialidad de Angiología y Cirugía Vascular. El diagnóstico y la estrategia terapéutica de las MVP se basan en la RM y el estudio angiográfico. Una técnica de embolización asociada o no a cirugía convencional es la primera opción terapéutica en el tratamiento de MVPHI y MVPHA sintomáticas, con una buena percepción clínica del resultado por parte del paciente.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado como comunicación en el 57.° Congreso Nacional de Angiología y Cirugía Vascular el día 4 de julio de 2011, por la que se obtuvo el Premio Martorell.