La isquemia mesentérica crónica (IMC) es una entidad poco frecuente. Se presenta con síntomas inespecíficos como dolor abdominal posprandial, miedo a comer, disminución de peso y diarrea. Los pacientes sintomáticos no tratados evolucionan hacia una desnutrición severa y muerte debido a las complicaciones sépticas de la isquemia mesentérica.
La causa más frecuente es la aterosclerosis, aunque se han descrito otras causas como la displasia fibromuscular, traumatismos, disección, rotura de aneurisma mesentérico, poliarteritis nodosa y la enfermedad de Takayasu.
El diagnóstico de IMC se basa en la sospecha clínica y el diagnóstico diferencial con otras causas de dolor abdominal. El ecodoppler es el estudio inicial de elección para la evaluación de la enfermedad arterial oclusiva del tronco celíaco (TC) y arteria mesentérica superior (AMS), con sensibilidad y especificidad superiores al 80% en equipos expertos. La arteriografía, sin embargo, es el estudio definitivo para detallar las lesiones y planificar la cirugía. Se ha descrito estenosis significativa en 2 vasos mesentéricos en el 91% de los pacientes y en 3 arterias en el 55%. La angiotomografía axial computarizada ha demostrado ser efectiva en describir la anatomía de los vasos digestivos. Además, es útil para detectar otras enfermedades abdominales, causas extravasculares compresivas y para el control de la permeabilidad después del tratamiento quirúrgico abierto o endovascular.
Los objetivos del tratamiento son aliviar los síntomas de forma permanente, modificar los factores de riesgo cardiovascular, mejorar el estado nutricional y prevenir el infarto mesentérico, lo cual se logra mediante revascularización mesentérica (cirugía abierta o endovascular) y apoyo multidisciplinario.
Chronic mesenteric ischemia (CMI) is a rare condition that presents with non-specific symptoms such as postprandial abdominal pain, fear of eating, weight loss and diarrhea. Untreated symptomatic patients progress to severe malnutrition, and death due to septic complications of acute mesenteric ischemia.
The most common cause is atherosclerosis, although other causes have been described, such as fibromuscular dysplasia, trauma, dissection, ruptured mesenteric aneurysm, polyarteritis nodosa, and Takayasu's disease.
The diagnosis of CMI is based on clinical suspicion and differential diagnosis of other causes of abdominal pain. Doppler ultrasound is the initial method of study for evaluation of arterial occlusive disease of the celiac trunk (CT) and superior mesenteric artery (SMA), with sensitivity and specificity greater than 80% by expert teams. Angiography is the definitive study to show the lesions and for surgical planning. Significant stenosis has been described in two mesenteric vessels in 91% of patients, and of three arteries in 55%. The computed tomography angiography has shown to be effective in describing the anatomy of the SMA and CT. In addition, it is useful to detect other abdominal conditions, extravascular compressive causes and monitoring of patency after open or endovascular surgery.
The aims of the treatment are to relieve symptoms, modify cardiovascular risk factors, improve nutritional status, and prevent mesenteric infarction, which is achieved by mesenteric revascularization and multidisciplinary support.
La isquemia mesentérica crónica (IMC) se caracteriza típicamente por una clínica de dolor abdominal posprandial, pérdida de peso y fobia a la comida, todo ello en el contexto de un paciente arteriosclerótico. Sin embargo, no es infrecuente encontrar pacientes asintomáticos con estenosis significativas de las arterias digestivas principales (tronco celíaco [TC], arteria mesentérica superior [AMS] y arteria mesentérica inferior [AMI])1.
A pesar del interés del tema, en la literatura médica solo se observan series clínicas con número reducido de pacientes, y sin casos control. No constan estudios a gran escala de la historia natural de la enfermedad, ni estudios prospectivos aleatorizados, ni estudios comparativos de cohortes concurrentes y modalidades de tratamiento. Este hecho y la variación de procedimientos terapéuticos dificultan el obtener datos fiables que orienten sobre el diagnóstico y tratamiento de pacientes con esta enfermedad2.
EpidemiologíaLa epidemiología de la IMC puede ser dividida en la prevalencia radiológica de la enfermedad y la prevalencia de los pacientes con sintomatología. En 1969, un estudio retrospectivo mostró que, de 713 angiografías revisadas, 55 presentaban alguno de los 3 vasos mesentéricos ocluidos: TC, AMS o AMI. El 70% de estas oclusiones afectaban a la AMI3. Posteriormente, un estudio realizado en 1998 reveló que, de 980 pacientes asintomáticos, el 8% (82 pacientes) tuvieron una estenosis igual o superior al 50% en al menos una arteria mesentérica y en el 3,9% (38 pacientes) se demostró oclusión en, al menos, una arteria digestiva4. De estos 82 pacientes, el 58% fueron varones, con una media de edad de 67,5 años y el 72% asociaban arteriopatía periférica, el 66% hipertensión arterial y el 58%, coronariopatía. La distribución anatómica de las lesiones de estos 82 pacientes fueron afectación del TC en un 90%, de la AMS en un 43% y de la AMI en un 56%.
Sin embargo, a pesar del exhaustivo estudio radiográfico de estos pacientes, la mayoría de ellos no presentaban sintomatología.
Por ello, es difícil estimar la prevalencia real de IMC. Aun así, supone <2% de todos los ingresos hospitalarios por dolor abdominal.
EtiologíaLa estenosis u obstrucción de los vasos mesentéricos puede ser debida a diferentes causas tales como la aterosclerosis, fibrodisplasia, compresión de pilares diafragmáticos y otras más raras, como son las vasculitis, la enfermedad de Takayasu, arteritis por radiación y arteritis autoinmune.
La aterosclerosis es la causa más frecuente, siendo esta la etiología en más del 95% de los casos. Estas lesiones, al igual que la de otros vasos viscerales, se localizan con mayor frecuencia en el origen de la arteria (lesiones ostiales) y son causadas por un proceso progresivo en la pared anterior de la aorta abdominal. Esto explica por qué las lesiones aisladas o las oclusiones del ostium de un único vaso visceral son infrecuentes.
La lesión aislada del TC puede ser causada también por la compresión del ligamento arcuato del diafragma. Esta entidad recibe el nombre de síndrome compresivo del eje celíaco o síndrome del ligamento arcuato. La existencia de ese síndrome es controvertida ya que se admite la necesidad de enfermedad en, al menos, 2 de las 3 arterias digestivas para producir sintomatología5,6 (fig. 1).
ClínicaLos pacientes con IMC son predominantemente mujeres en la séptima-octava década de la vida. Las 2 características clínicas más frecuentes son el dolor abdominal posprandial y una pérdida de peso no intencionada7. El dolor se asocia a la ingesta de comida. Este dolor clásicamente comienza a los 15 o 30 min después de la ingesta y persiste durante 5 o 6 h después de que la ingesta haya concluido. Se localiza en el epigastrio y, a veces, se irradia a la espalda, lo cual puede ser debido a la isquemia gástrica que experimentan los pacientes con IMC8. Los pacientes modifican sus hábitos alimenticios, realizando pequeñas ingestas frecuentes con el fin de minimizar la clínica. Como consecuencia de este rechazo a la comida, se produce una pérdida de peso entre 10 y 15 kg. Esta pérdida de peso suele estar más asociada con la disminución de las ingestas que con una posible malabsorción intestinal.
Sin embargo, ya hemos comentado que la mayoría de estos pacientes pueden no presentar sintomatología, lo cual es debido a la extensa colateralidad que conecta el territorio visceral. Para que exista clínica se necesita que al menos 2 de las 3 arterias digestivas se encuentren significativamente afectadas. En estos casos, generalmente, son la AMS y el TC las arterias lesionadas2.
DiagnósticoLos métodos diagnósticos para la IMC pueden ser no invasivos, como el ecodoppler, la angiotomografía computarizada (angio-TAC), la angiografía por resonancia magnética (angio-RMN), o invasivos, tales como la arteriografía.
Hay que tener presente que no existe una prueba o combinación de pruebas que confirmen o rechacen el diagnóstico de esta entidad. Mientras tanto, podemos realizar un diagnóstico probable a partir de la sospecha clínica y después de la exclusión de otras causas de dolor abdominal. Las exploraciones complementarias, finalmente, ayudarán a definir esta enfermedad9.
EcodopplerEl ecodoppler mesentérico es el estudio inicial de elección para la evaluación de la enfermedad arterial oclusiva del TC y AMS, con sensibilidad y especificidad superiores al 80% en equipos expertos. También es una herramienta útil en el control postoperatorio de la cirugía de revascularización.
Los criterios aceptados comúnmente para diagnosticar una estenosis hemodinámicamente significativa del TC es presentar una velocidad picosistólica mayor de 200cm/s y una velocidad telediastólica de más de 55cm/s.
Para la AMS, estos umbrales son de más de 275-300cm/s para la velocidad picosistólica y de más de 45cm/s para la velocidad telediastólica.
Las limitaciones de este método son ser operador-dependiente, ser técnicamente laborioso por los movimientos respiratorios, encontrar presencia de obesidad y aire abdominal10.
ArteriografíaLa arteriografía es el estudio definitivo para detallar las lesiones y planificar la cirugía. Se requieren proyecciones anteroposteriores y laterales y, en ocasiones, arteriografías selectivas.
La arteriografía no solo cuantifica fielmente las lesiones de las arterias digestivas sino que también proporciona información sobre las vías de circulación colateral, y sobre el estado de la aorta, los ejes ilíacos y las arterias renales, información que es básica para seleccionar la técnica de revascularización a utilizar.
Antes de realizar un estudio angiográfico se recomienda tener una prueba complementaria no invasiva sugestiva de esta enfermedad (ecodoppler, angio-TAC o angio-RMN).
Las imágenes arteriográficas precoces nos permiten ver el origen del TC y de la AMS, y las imágenes tardías evalúan el flujo retrógrado y la colateralidad entre el TC, AMS y la AMI. En ocasiones, es necesario realizar imágenes adicionales durante la espiración y la inspiración para evaluar la compresión del TC, en el caso de que exista la sospecha de síndrome del ligamento arcuato.
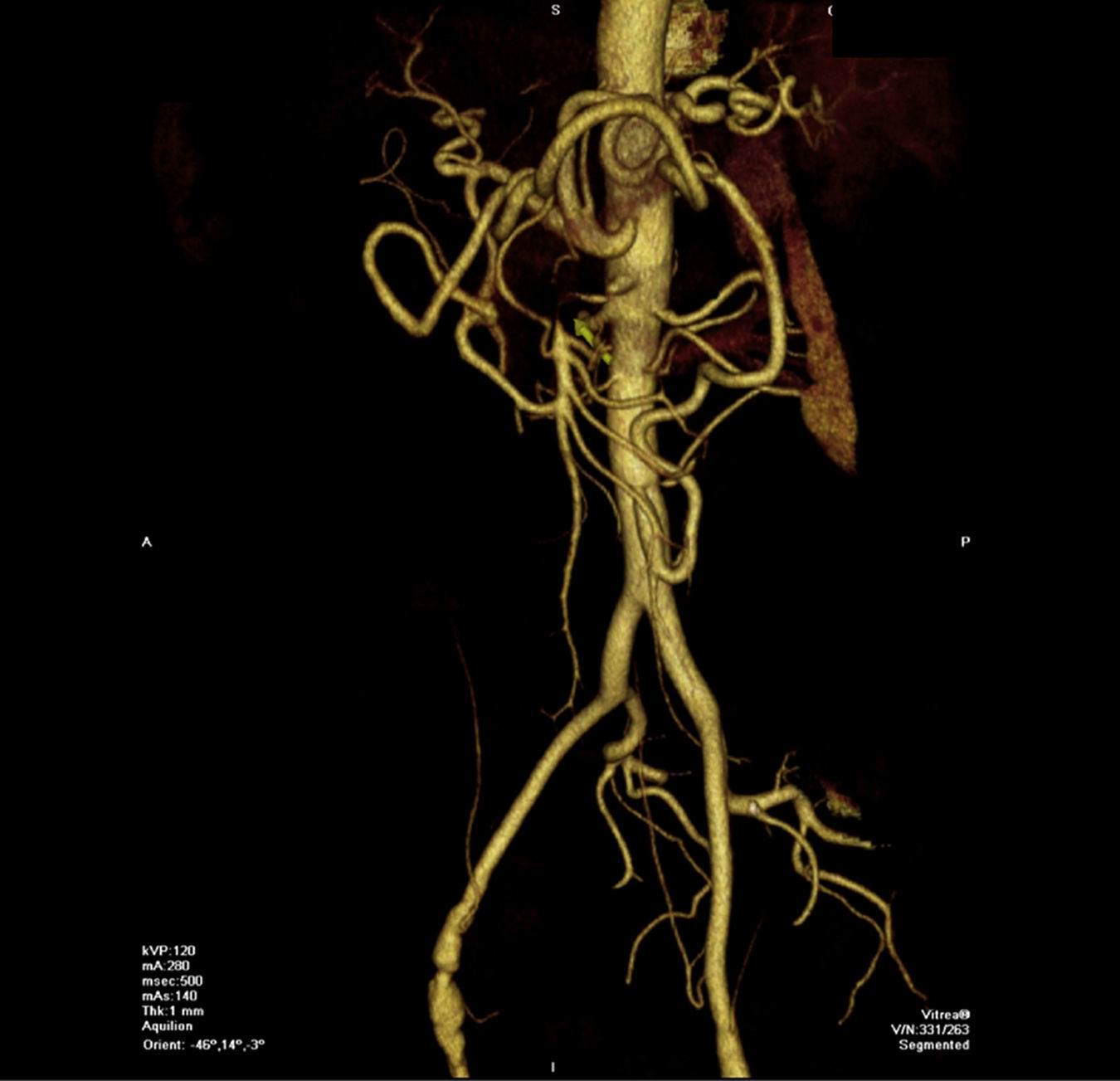
Uno de los signos clásicos radiológicos es la hipertrofia de la arteria marginal del colon izquierdo (arcada de Drummond). Sin embargo, este vaso aporta una adecuada colateralidad para suplir la estenosis de la AMS desde la IMA, y no debe ser utilizado para confirmar la existencia de una isquemia mesentérica. Podemos encontrar otras arterias colaterales cólicas formando un arco anastomótico denominado arco de Riolano. También existe colateralidad procedente de las arterias hipogástricas y esófago, y que probablemente también contribuyan a irrigar el intestino11,12 (fig. 2).
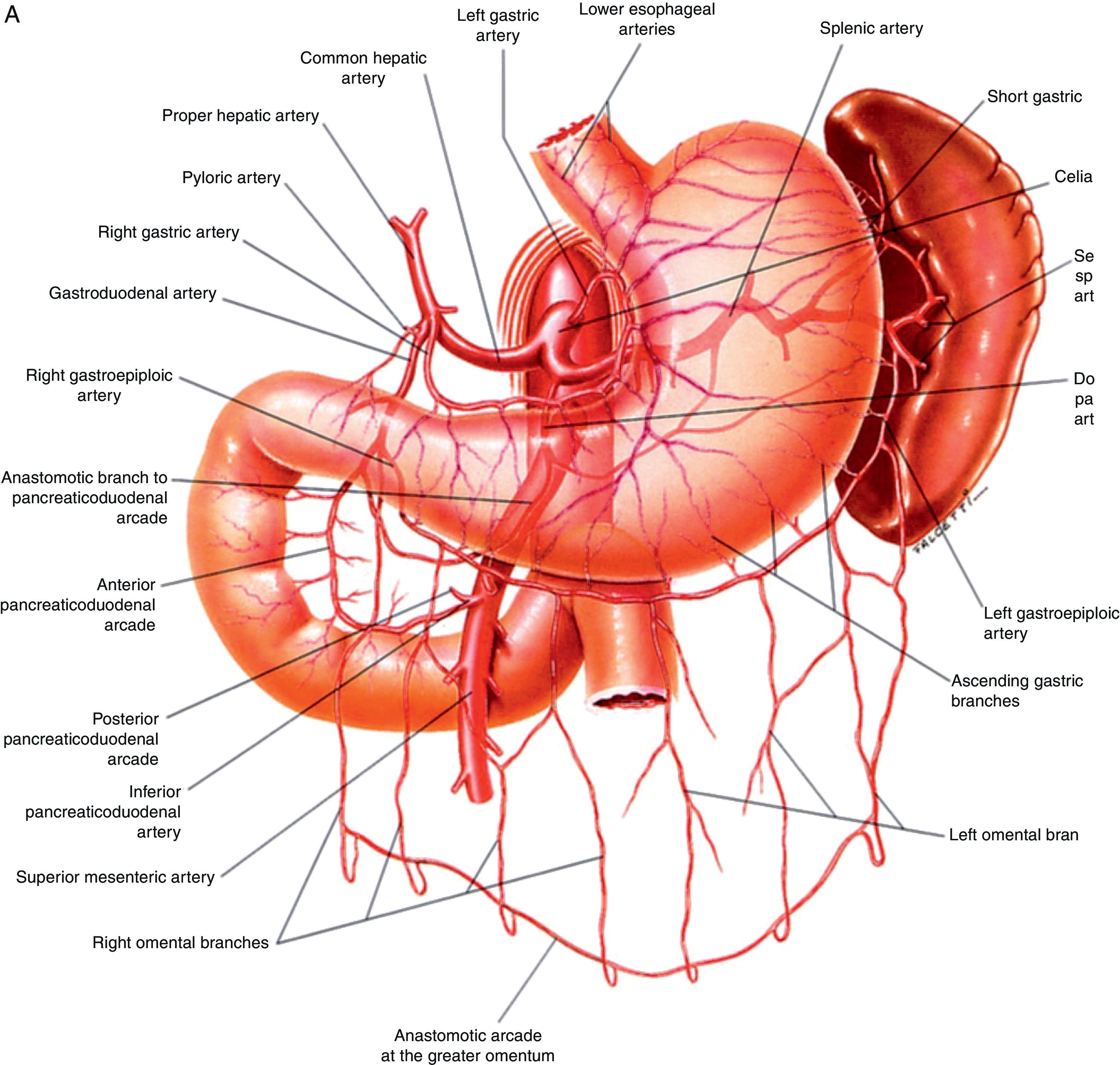
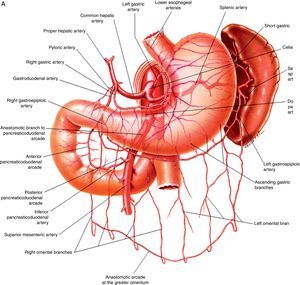
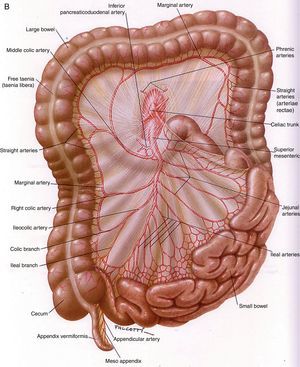
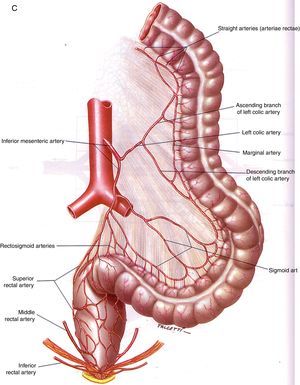
Anatomía vascular de los troncos digestivos y sus ramas colaterales. A) Tronco celíaco y sus ramas digestivas. B) Arteria mesentérica superior y circulación anastomótica intestinal. C) Arteria mesentérica inferior y colaterales.Fuente: Atlas of Vascular Anatomy. Uflacker R, editor. Baltimore, EE. UU.; Williams & Wilkins: 1997.
La angio-TAC con multidetector de imagen ha mejorado significativamente el diagnóstico de la IMC ya que proporciona información detallada de la vascularización abdominal, del grado de estenosis de arterias mesentéricas, del estado clínico del intestino y de la perfusión de los órganos sólidos. Además, las reconstrucciones nos permiten obtener una imagen similar a una arteriografía y, lo que puede ser más importante, descartar otras causas de dolor abdominal con pérdida de peso como son los procesos neoplásicos. Aunque todavía se requiere la administración intravenosa de contraste, se elimina el riesgo de la punción arterial asociada. La sensibilidad y la especificidad en la IMC son del 95 al 100%13. Los inconvenientes de esta prueba diagnóstica son la administración de un volumen de contraste superior al empleado en la arteriografía, lo cual excluye la posibilidad de realizar estos estudios en pacientes con insuficiencia renal. Además, solo es una prueba diagnóstica sin opción a realizar ningún tratamiento endovascular durante el procedimiento y, a veces, los pacientes pueden necesitar también la realización de un arteriografía, lo cual supone exponer 2 veces al paciente a pruebas diagnósticas que emplean contrastes yodados. Por todo ello, se suele realizar la angio-TAC en pacientes con sospecha de enfermedad abdominal y baja sospecha clínica de IMC, al igual que en pacientes con enfermedad aórtica asociada, como aneurisma aórtico o disección.
Angiorresonancia magnética nuclearLa angio-RMN ha avanzado en los últimos años, proporcionando una buena calidad de imagen con tiempos de adquisición más cortos. La contraindicación del empleo de gadolinium intravenoso en pacientes con fallo renal debido a la posibilidad de desarrollar una fibrosis sistémica ha disminuido de forma importante el empleo de este medio de contraste en determinados pacientes. La angio-RMN con gadolinium en el estudio de las arterias digestivas proporciona sensibilidad y una especificidad del 95 al 100% cuando las comparamos con la arteriografía14. Los estudios sin gadolinium no estiman la estenosis mesentérica de forma adecuada.
TonometríaLas alteraciones de la perfusión digestiva ponen en riesgo la mucosa del intestino, lo que produce repercusiones en el metabolismo anaerobio. Por ello, se puede utilizar un tonómetro para medir la PCO2 gástrica, del intestino delgado y del colon sigmoide de forma indirecta.
El principio de la tonometría fue publicado por primera vez en 1965. Una revisión reciente realizada por Kolkman et al.15 concluyó que la tonometría gastrointestinal permite medir el gradiente PCO2 de la luz intestinal a la sangre y puede ser utilizado para saber si la perfusión de la mucosa intestinal es correcta.
TratamientoLa indicación de un procedimiento quirúrgico resulta de contraponer la historia natural de la enfermedad con el riesgo de la intervención. Se sabe que la IMC sintomática suele evolucionar hacia la muerte del paciente, bien por inanición o por infarto intestinal, lo que hace recomendable la revascularización de estos pacientes16.
No ocurre lo mismo para la oclusión asintomática de las arterias viscerales. El único trabajo publicado reporta que solo 4 de 15 pacientes que presentaban lesiones graves en las 3 arterias viscerales desarrollaron IMC o fallecieron de infarto intestinal4. Basados en la historia natural de la isquemia mesentérica crónica, Connolly et al.17 defendieron una reconstrucción profiláctica para prevenir la isquemia aguda y el infarto intestinal. Esta postura estaba avalada por un estudio con 25 pacientes con isquemia mesentérica aguda secundaria a oclusiones ateroscleróticas que precisaron exploración quirúrgica. Estos pacientes presentaron síntomas anodinos pero significativos desde el punto de vista diagnóstico, incluyendo la pérdida de peso, y clínica que simulan la úlcera péptica o la colecistitis. La demora del diagnóstico ocasionó un 80% de la mortalidad.
Thomas et al.4 evaluaron 980 arteriografías consecutivas con proyección anteroposterior y lateral para identificar pacientes con IMC asintomáticos. De ellos, 15 pacientes presentaron alteración significativa de 3 vasos y después de 1-6 años, el 86% tuvieron isquemia digestiva, sintomatología abdominal anodina o fallecimiento. Estos autores concluyeron que aquellos pacientes con estenosis significativas de las 3 arterias digestivas deben ser considerados para reconstrucción arterial profiláctica, aunque la incidencia de isquemia aguda y fatal fue solo del 6%, lo cual es, aproximadamente, la tasa de mortalidad de la reconstrucción electiva.
Tratamiento médicoNo se ha descrito ninguna medida distinta de la revascularización que permita tratar esta enfermedad. El dolor abdominal posprandial que presentan los enfermos de IMC condiciona distintos grados de adelgazamiento y desnutrición; la nutrición parenteral permite solventar la situación mientras se completan los estudios preoperatorios, a la vez que mejora el estado general del paciente, y aunque no está sustentado por estudios prospectivos, probablemente disminuya el riesgo quirúrgico. La nutrición parenteral se debe mantener en el postoperatorio, hasta que el enfermo recupere la capacidad de nutrición por vía oral2.
Tratamiento quirúrgicoTécnicas quirúrgicas abiertasLos objetivos de la cirugía son disminuir los síntomas y el riesgo de infarto mesentérico, y optimizar el estado nutricional.
Actualmente se recomienda la cirugía abierta en los casos de isquemia crónica, ya que presenta del 2 al 11% de mortalidad quirúrgica18, del 33 al 66% de complicaciones y del 90 al 100% de mejoría de los síntomas19.
Existen diferentes técnicas quirúrgicas como son: la derivación anterógrada; la derivación retrógrada; la endarterectomía aórtica y visceral, con reimplante visceral o sin él; y la endarterectomía visceral aislada.
En general, la mortalidad con estos procedimientos oscila entre el 5 y el 7%, con complicaciones cardiovasculares y pulmonares posquirúrgicas, infarto agudo de miocardio, fallo renal, insuficiencia respiratoria, disfunción multiorgánica o infarto mesentérico. También se han descrito diarrea postoperatoria y síndrome de reperfusión20,21.
El material más recomendado para las reconstrucciones es el dacron y luego el PTFEe. El uso de vena autóloga solo se recomienda en caso de contaminación peritoneal o reconstrucciones a ramas muy distales, como los arcos de anastomosis, pues tiene mayor riesgo de oclusión por acodadura por la disposición espacial de los injertos viscerales. Si la vena es la única opción, se recomienda la vena safena interna21.
Derivación anterógradaIntroducida por Morris et al.22, en 1961, es la más recomendada ya que toma la aferencia de la porción supracelíaca de la aorta, segmento generalmente respetado por la aterosclerosis. Además, no tiene el riesgo de acodadura de la derivación retrógrada y el puente no está en contacto con las asas. El lugar de anastomosis más recomendado es la AMS a la altura de la cuarta porción duodenal, por su fácil acceso y su mayor diámetro. Si el TC y la AMS están ocluidos, se recomienda hacer una derivación bifurcada en dacron de 12 × 6cm a las 2 ramas con aferencia de la aorta supracelíaca. Cuando no se puede anastomosar cómodamente el TC, se lleva el injerto a la arteria hepática común. El trayecto es retropancréatico: tunelizando manualmente con los dedos a través de ligamento de Treitz, por detrás del cuerpo del páncreas.
Derivación retrógradaSe recomienda cuando no puede obtenerse aferencia de la aorta supracelíaca. La arteria donante, en estos casos, suele ser la arteria ilíaca o la propia aorta abdominal infrarrenal, lo que obliga a construir un injerto que tiene riesgo de acodadura o torsión por los movimientos intestinales, por ello su configuración suele ser elongada. Se utiliza con mayor frecuencia en los casos de oclusión aguda, cuando la tromboendarterectomía no ha funcionado y no se obtiene flujo proximal. Son injertos cortos curvados habitualmente protésicos (PTFE-anillado o dacron) para evitar el colapso de los injertos venosos. Con esta técnica se puede lograr hasta el 79% de permeabilidad a los 9 años22.
Endarterectomía aórtica y visceralLos 2 procedimientos se llevan a cabo de forma conjunta cuando existe una estenosis aórtica asociada22. Son técnicas clásicas que requieren de un gran adiestramiento quirúrgico, razón por la que han quedado en desuso frente a otras alternativas menos agresivas.
Endarterectomía visceralFue el primer procedimiento descrito por Shaw y Maynard en 1958, para el tratamiento de la oclusión mesentérica crónica. Consiste en la exéresis de la placa aterosclerótica de la arteria enferma y el cierre en angioplastia con un parche de dacron o de vena autóloga. No se han descrito buenas permeabilidades a largo plazo22.
Tratamiento del síndrome compresivo del tronco celíacoEl tratamiento del síndrome compresivo del tronco celíaco consiste en la descompresión del tronco celíaco del diafragma con la separación cuidadosa de las fibras musculares, tendinosas y del tejido nervioso. Recientemente, se han introducido las técnicas laparoscópicas23 por su menor agresividad. Si después de haberlo liberado, persiste la estenosis, se debe realizar una reconstrucción arterial. Los resultados del tratamiento quirúrgico de este síndrome son controvertidos10.
Tratamiento endovascular. AngioplastiaEl tratamiento endovascular es una alternativa terapéutica eficaz en enfermos con serias comorbilidades que contraindiquen una cirugía abierta. También es útil en pacientes con severa malnutrición, donde la angioplastia puede ser curativa u optimizar la nutrición.
Cuando 2 o más arterias digestivas presentan una estenosis significativa (>70%) o están ocluidas, la recanalización de la AMS es prioritaria debido al beneficio posterior. Si la AMS no puede ser tratada de forma endovascular, se intentará recanalizar el TC. A ser posible, se intentará revascularizar más de una arteria, para disminuir la probabilidad de recurrencia de los síntomas24.
PreparaciónLo primero que realizaremos será un buen diagnóstico diferencial. Solicitaremos un estudio analítico para descartar la existencia de malnutrición y alteración de la función renal, ya que muchos pacientes asocian estenosis en las arterias renales. Todos los pacientes deberán estar tratados con antiagregantes, aspirina o clopidogrel, y estatinas25.
TécnicasEn la mayoría de los casos, se utiliza un abordaje femoral bajo anestesia local, aunque a veces se requiere el abordaje de la arteria humeral, en el caso de una aorta de pequeño diámetro o con gran angulación del origen de la AMS.
Se realizarán proyecciones en anteroposterior y lateral para visualizar la estenosis, la vascularización distal y la colateralidad. A veces, también son necesarias proyecciones oblicuas, dependiendo de la variabilidad anatómica de las arterias digestivas.
Las estenosis cortas focales no-ostiales están asociadas a buen resultado después del tratamiento endovascular, mientras que las estenosis largas y las oclusiones son más difíciles de tratar. Tanto las lesiones ostiales calcificadas como las oclusiones requieren la utilización de un stent, que suele ser balón-expandible debido a su mayor fuerza radial. Para otras lesiones, se recomienda la angioplastia y, únicamente en el caso de estenosis residual o complicación, se añade la colocación de stent.
Después de realizar la arteriografía, se administrarán 5.000 unidades de heparina sódica y, posteriormente, procederemos a tratar la lesión. Se suelen utilizar guías hidrofílicas; catéteres preformados, tales como el Cobra-2, Simmons-2, Sos-Omi; y catéteres guía (introductor largo) como el Destination (Terumo, Tokyo, Japón) o Flexor Side Arm Intruducer (Cook Medical Inc). Habitualmente se emplea una guía de 0,035 in aunque a veces necesitaremos guías más finas como la de 0,014 in. Una vez que hayamos conseguido llevar la guía a la parte distal, avanzaremos el catéter, confirmaremos que estamos en la luz y podemos cambiar la guía por una más rígida, como una guía de Rosen. La guía Rosen se prefiere a la guía Amplatz por tener menor riesgo de disección arterial. A veces necesitaremos predilatar con un balón de menor calibre. Después del procedimiento realizaremos una arteriografía de control24.
ComplicacionesLa mayoría de las complicaciones inmediatas se pueden resolver mediante técnicas endovasculares, así la embolización distal y la trombosis requieren trombectomía y fibrinólisis; la disección arterial puede ser tratada mediante un stent; en caso de rotura puede ser necesaria la colocación de un stent recubierto.
La complicación más seria es la precipitación de una isquemia aguda por una trombosis completa sin adecuadas colaterales. En esta situación es necesario realizar un bypass urgente, aunque los resultados reportados no suelen ser buenos.
También se han descrito la existencia de infartos esplénicos, disección aórtica, embolización a miembros inferiores, fallo renal, hemorragia intestinal de reperfusión.
A largo plazo, la complicación más importante es la restenosis o la oclusión, la cual ocurre en un tercio de los casos y, con frecuencia, estos pacientes vuelven a tener recurrencia de la sintomatología o infarto mesentérico agudo26.
ResultadosSe estima una tasa de fallo precoz del tratamiento endovascular de un 5-10%. La mortalidad a los 30 días o intrahospitalaria es del 0-16% en diferentes series, pero en la mayoría es <5%27.
La permeabilidad primaria a los 12 meses es del 65-85%. En un estudio reciente realizado por Kouglas et al.28, de 328 pacientes sometidos a tratamiento endovascular por isquemia mesentérica crónica, obtuvieron un éxito técnico del 91%, éxito clínico del 82%, éxito clínico tardío del 76%. El 9% sufrieron complicaciones, el 3% murieron. Hubo 28% de restenosis y un 27% necesitaron reintervención en los primeros 26 meses.
El principal inconveniente del tratamiento endovascular es la elevada tasa de restenosis que conducen a recidiva de los síntomas o incluso a una isquemia aguda, los cuales asocian elevada mortalidad24.
ControversiasA) Angioplastia o stent primario: en principio, parece que el stent primario tiene mejores resultados en arterias ocluidas y estenosis recurrentes y, a pesar de la escasa evidencia, en la mayoría de los centros se realiza stent primario.
B) Cirugía abierta o endovascular: el tratamiento endovascular asocia una morbimortalidad inicial y una estancia hospitalaria menores, y además presenta buenos resultados a largo plazo. La mortalidad, después del tratamiento endovascular, es del 3,7% en comparación con el 15,4% de la cirugía abierta. Sin embargo, la permeabilidad a largo plazo y el periodo libre de sintomatología fue del 69% a los 5 años para el bypass en comparación con el 32% para el tratamiento endovascular, y el 25% de los pacientes tratados con angioplastia primaria o stent con bypass posterior24.
PronósticoDebido a que solo unos pocos pacientes con estenosis de la AMS desarrollan sintomatología, existe muy poca información del pronóstico de la enfermedad crónica no tratada. Sin embargo, muchos pacientes con esta enfermedad podrían progresar hacia un cuadro agudo y necrosis intestinal en el supuesto caso de que no recibieran tratamiento. La progresión de la sintomatología posprandial a un dolor abdominal constante, junto con una elevación de leucocitos, sugiere un infarto intestinal y demanda tratamiento urgente con cirugía o angioplastia, aunque la cirugía tiene la ventaja de poder inspeccionar el intestino24.
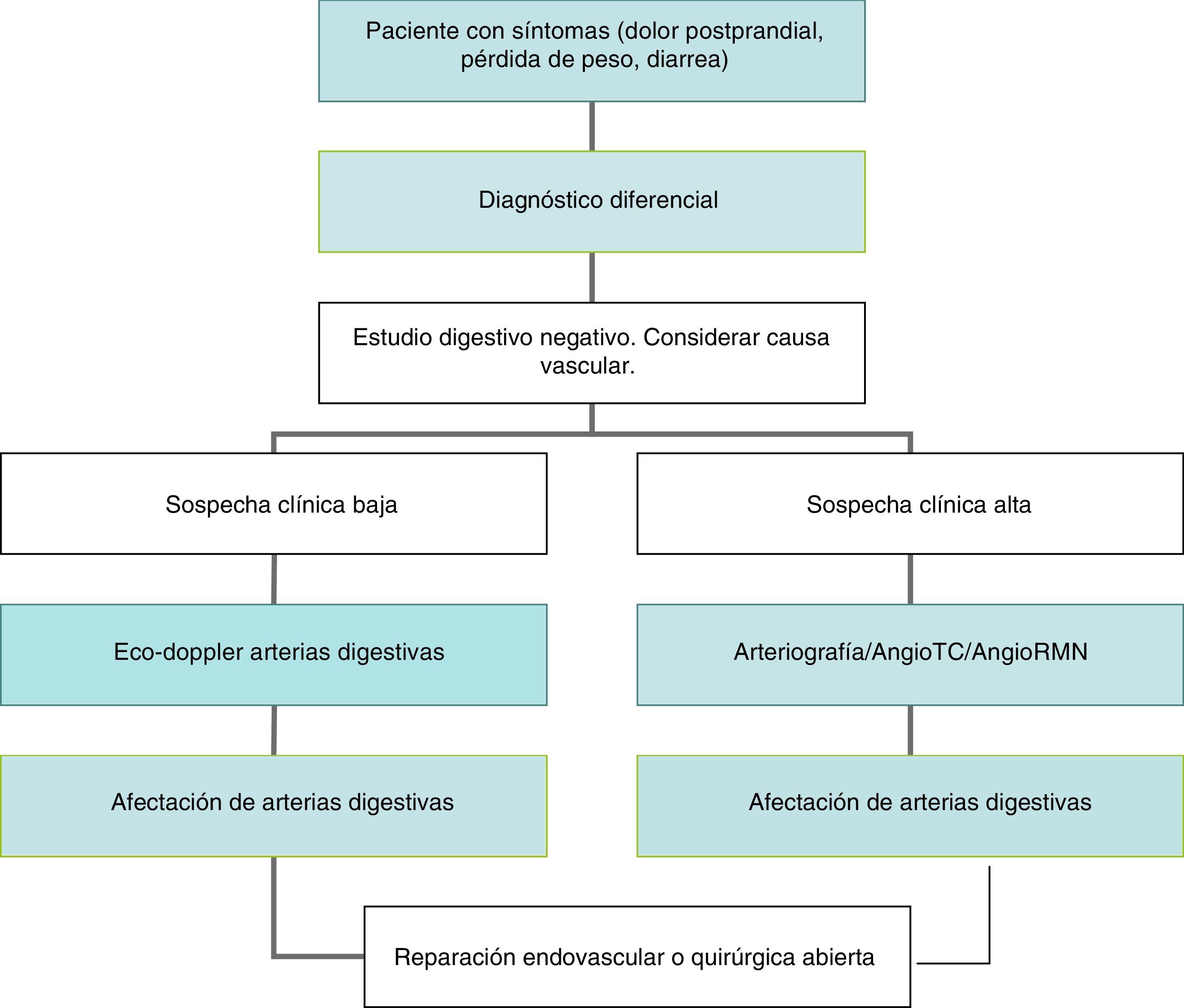
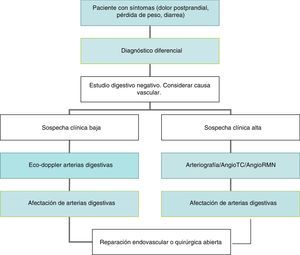
ConclusionesLa IMC es una enfermedad infrecuente pero de consecuencias muy graves. Desde su descripción inicial, hace más de un siglo, se han aplicado diferentes modalidades diagnósticas y terapéuticas para paliar esta enfermedad, aunque la mayoría de los afectados no presentan sintomatología. A pesar de la pequeña prevalencia, el impacto económico es importante. La principal etiología es la aterosclerosis que afecta al origen de la AMS. El diagnóstico se basa en una elevada sospecha clínica, hallazgos en la exploración física y los resultados de las pruebas de imagen. Los pacientes asintomáticos no deben recibir tratamiento quirúrgico. El tratamiento endovascular está emergiendo como una alternativa eficaz al tratamiento quirúrgico abierto, sobre todo en pacientes mayores o con elevada comorbilidad. No obstante, la alta tasa de recidiva hace que la cirugía arterial siga ofreciendo los mejores resultados a largo plazo. El algoritmo diagnóstico y terapéutico de la enfermedad oclusiva del tronco celíaco y la arteria mesentérica superior se expone en la figura 3.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.