La cirugía abierta de los aneurismas toracoabdominales (ATA) aún hoy presenta una alta morbimortalidad, habiendo surgido distintas alternativas. El tratamiento híbrido renovisceral, rodeado de controversia, es una de ellas. Los datos disponibles en la bibliografía con respecto a morbimortalidad muestran gran disparidad. Sin embargo, la mayoría de las series incluyen un elevado porcentaje de pacientes de alto riesgo y de ATA extensos, considerando por ello que los procedimientos híbridos renoviscerales todavía juegan un papel en el tratamiento de los ATA.
Abdominal hybrid procedures have arisen as an alternative to conventional open surgery for thoracoabdominal aortic aneurysms (TAA), although they are surrounded by controversy. Data available in the literature about morbidity and mortality show a great disparity. However, most series include a large number of high risk patients and of extensive TAA. Considering this, renovisceral debranching still has a role in the treatment of TAA.
Desde la primera reparación quirúrgica documentada, realizada por Etheredge1 en 1955, y el posterior perfeccionamiento de la técnica en la década de los 80 por Crawford et al.2, la cirugía abierta de los aneurismas toracoabdominales (ATA) mediante toracofrenolaparotomía ha sido el tratamiento de referencia. A lo largo del tiempo se han introducido continuos avances tanto en la técnica quirúrgica como en el manejo anestésico y postoperatorio para reducir los tiempos de isquemia visceral y de miembros inferiores, así como las complicaciones derivadas de la isquemia medular. A pesar de ello, la cirugía convencional de los ATA está asociada a cifras de morbimortalidad elevadas incluso en centros de referencia. El panorama es más sombrío cuando contemplamos los resultados en estudios poblacionales, donde las cifras de mortalidad inmediata llegan al 20% dentro del primer mes y hasta al 30% al cabo del primer año3, sin olvidar otros tipos de complicaciones devastadoras como la insuficiencia renal o la paraplejía. Grupos como el de Coselli4 representan la excelencia con más de 2.200 pacientes operados y una incidencia de paraplejía o paraparesia entre el 2,7 y el 13,2%, dependiendo de la extensión del aneurisma, con fracaso renal que requiere diálisis entre el 4,6 y el 5,6% y con mortalidad a 30 días entre el 5 y el 19%. Por estas razones, y dado que el tratamiento endovascular ha disminuido la mortalidad inmediata, tanto en los aneurismas de aorta abdominal como en los de aorta torácica, surgió el tratamiento híbrido renovisceral para los ATA (revascularización retrógrada de las arterias renales y viscerales, seguida por la exclusión endovascular), descrito por primera vez por Quiñones-Baldrich et al. en 19995, como una alternativa frente a la reparación abierta tradicional o a las técnicas endovasculares puras.
Los procedimientos híbridos fueron inicialmente indicados en pacientes de alto riesgo quirúrgico, desechados para cirugía abierta, ya que entre las ventajas esgrimidas con respecto a esta destacan: a) la escasa repercusión hemodinámica, al no ser preciso un pinzamiento total aórtico alto; b) el evitar un insulto isquémico prolongado y simultáneo renovisceral; c) menor agresión quirúrgica, evitando un abordaje toracoabdominal y el colapso pulmonar izquierdo; d) pérdidas hemáticas escasas, con ausencia de coagulopatía, y d) una menor incidencia de paraplejía6–8. Sin embargo, mientras los procedimientos híbridos fueron mejor aceptados en los troncos supraórticos, su indicación a nivel renovisceral siempre estuvo rodeada de controversia.
El objetivo de este trabajo es analizar los resultados de los procedimientos híbridos renoviscerales y comentar los aspectos técnicos que podrían condicionar su uso, con intención de conocer el papel actual de estos procedimientos en el tratamiento de los ATA.
Estado actualLos procedimientos híbridos a nivel renovisceral para tratamiento de ATA deben responder a las críticas, principalmente frente a 3 cuestiones fundamentales.
MorbimortalidadEn la literatura no abundan las series individuales de procedimientos híbridos abdominales que incluyan más de una veintena de casos. Una de las primeras es la del año 2006 publicada por el grupo del St. Mary's Hospital con 29 pacientes (10% eran urgentes) portadores de ATA extensos, donde se excluían los tipo IV, que mostró una mortalidad inmediata del 13% y ausencia de paraplejía. Sin embargo, cuando los autores ampliaron su experiencia, revelaron que aquellos resultados iniciales, considerados prometedores teniendo en cuenta el tipo de pacientes tratados, habían empeorado7.
Posteriormente, el grupo del Massachusetts General Hospital9 realizó una severa crítica del tratamiento híbrido, tras comparar los resultados en un grupo de pacientes de alto riesgo, desechado para cirugía clásica, con otro grupo de pacientes intervenido mediante cirugía convencional y encontrar que la tasa combinada de mortalidad-paraplejía era 2 veces mayor en el grupo en que se había practicado tratamiento híbrido (21,7 vs. 11,7%). La interpretación de dicho estudio se hace difícil, advirtiéndose un importante sesgo al comparar, por un lado, pacientes que presentan ATA extensos en el grupo híbrido (61% son tipo I o tipo II y no incluye ningún ATA tipo IV), con otro grupo de pacientes completamente diferentes, en el cual, los ATA tipo IV suponen el 34%, y los aneurismas tipo I y II el 28%.
Así mismo, resultan reveladores los resultados de un metaanálisis llevado a cabo por Moulakakis et al. en el año 201210, que incluye un total de 528 pacientes (11% con intervención urgente por ATA rotos o sintomáticos): en 3 casos la intervención no se completó por inestabilidad intraoperatoria, 12 pacientes murieron por complicaciones relacionadas con el procedimiento de revascularización visceral, 6 fallecieron por rotura aórtica mientras esperaban la exclusión endovascular y 4 rechazaron la segunda etapa del tratamiento. La mortalidad acumulada a 30 días fue del 14% (68 pacientes) y la isquemia medular estuvo presente en el 7%, de los casos, con un 4,5% de paraplejía irreversible. El registro North American Complex Abdominal Aortic Debranching Registry (NACAAD) arroja cifras de mortalidad a 30 días del 16% y de paraplejía del 14%11.
Por el contrario, no faltan series individuales en las que se han obtenido excelentes resultados con los procedimiento híbridos a nivel renovisceral, con cifras de mortalidad intrahospitalaria a 30 días del 2 al 4%12,13. Nuestra experiencia inicial en aneurismas toracoabdominales extensos, incluyendo pacientes de riesgo, fue publicada en 2010 con ausencia de mortalidad inmediata y sin paraplejía14. Hughes et al.15, indicando dichos procedimientos en 47 pacientes de elevado riesgo quirúrgico, presentan una mortalidad a 30 días del 8,5% y una tasa de isquemia medular del 4,3%, sin que se registrase mortalidad ni paraplejía o paresia, en un subgrupo de 14 pacientes en los que la intervención se realizó en 2 tiempos.
Un reciente metaanálisis con 660 pacientes16 propone que llevar a cabo los procedimientos en 2 etapas resulta ventajoso, aunque sin significación estadística, al resultar los datos actuales insuficientes (muchos de los estudios no contemplan esta diferenciación en sus resultados) para recomendar con certeza la realización del procedimiento en uno o 2 tiempos. Los defensores de un solo tiempo apelan al riesgo de rotura aórtica durante la espera o a la posible negativa del paciente a realizar el tiempo endovascular, así como la posibilidad de usar la vía transabdominal para la liberación de la endoprótesis en el caso de que los ejes ilíacos no sean adecuados, o al posible daño de las anastomosis de los bypass retrógrados durante el acceso transfemoral. Sin embargo, la realización en 2 tiempos significa menor duración de la intervención, menor insulto renal, permite la estabilización hemodinámica del paciente, disminuyendo el riesgo de isquemia medular al evitar la hipotensión y permitir realizar una rápida valoración de la isquemia medular tras la cobertura aórtica. Además, en caso de mala evolución, se podría evitar el gasto asociado a las endoprótesis.
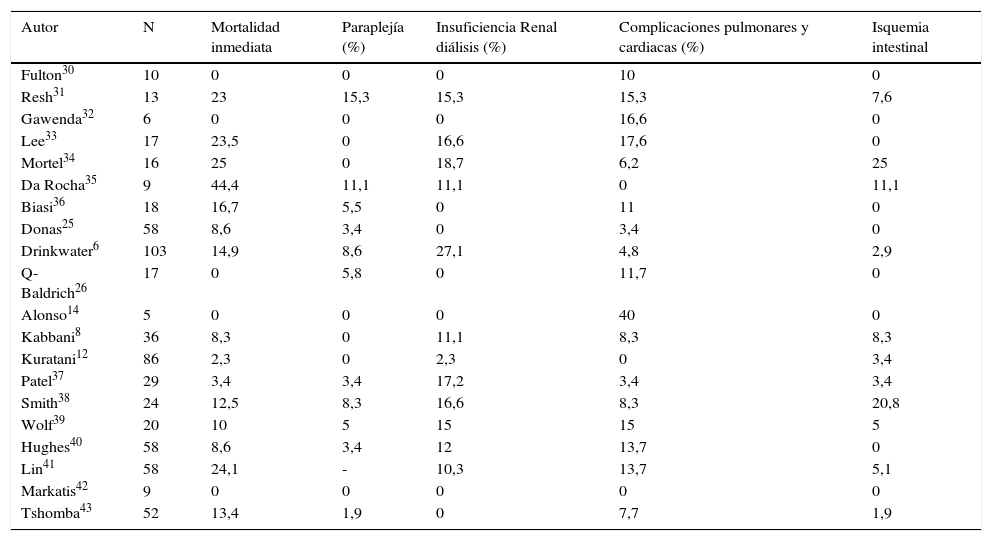
Por otra parte, en la citada recopilación16, la mortalidad operatoria se sitúa en el 12,6% (0-44%), la incidencia de paraplejía en el 3,4% (0-15,3%) y la tasa de insuficiencia renal permanente, isquemia mesentérica y complicaciones cardiopulmonares severas en el 10,4% (0-27,1%), 4,6% (0-20,8%) y 7,8% (0-17,6%), respectivamente.
Aunque varios estudios de seguridad sobre endoprótesis torácicas comprobaron una menor incidencia de isquemia medular y paraplejía comparada con la cirugía abierta (6 versus 10%)17–19, la reparación endovascular de la aorta torácica y de los ATA todavía se asocia con una incidencia de paraplejía no despreciable, alcanzando hasta un 13% en un metaanálisis realizado al respecto20.
El tratamiento híbrido, en cuanto riesgo de paraplejía o paraparesia permanente, ofrece mejores resultados que la media de las grandes series de la cirugía abierta (solo comparable a la mejor serie presentada por Coselli et al.4 con el 3,8%), ya que con frecuencia los pacientes tratados mediante procedimientos híbridos corresponden a ATA tipos I y II, donde la cirugía convencional ofrece tasas de paraplejía de hasta el 16%21.
La menor incidencia de isquemia medular para los procedimientos híbridos podría ser explicable a partir de su etiología multifactorial22, en la que resultan determinantes la hipotensión perioperatoria y la isquemia prolongada en la mitad inferior del cuerpo, ambas evitables mediante el tratamiento híbrido. La transcendencia que tiene el restablecimiento de una rápida perfusión de la pelvis y de los miembros inferiores para disminuir la incidencia de isquemia medular ha sido infraestimada. Su importancia acaba de ser resaltada por Haulon et al.23 durante la reparación endovascular de ATA tipo I, II y III (excluidos ATA IV), al conseguir reducir la tasa de isquemia medular del 25 al 2% cuando se adoptaba esta medida junto con el drenaje de LCR, la transfusión agresiva y el mantenimiento de una tensión arterial media por encima de 85mmHg.
En todo caso, debido a la ausencia de homogeneidad en los datos disponibles, no es posible sostener con certeza que la incidencia de isquemia medular sea realmente menor con los procedimientos híbridos que con la cirugía convencional.
Permeabilidad de las reconstrucciones realizadasRepresenta otro de los aspectos que preocupa en este tipo de procedimientos. Tenemos pocos datos sobre los resultados actuales de la cirugía de revascularización renal, ya que la mayoría de estas arterias se revascularizan hoy en día mediante técnicas endovasculares. En términos generales, la permeabilidad a largo plazo de los pontajes a las arterias renales y a los troncos digestivos se sitúa en torno al 90%24.
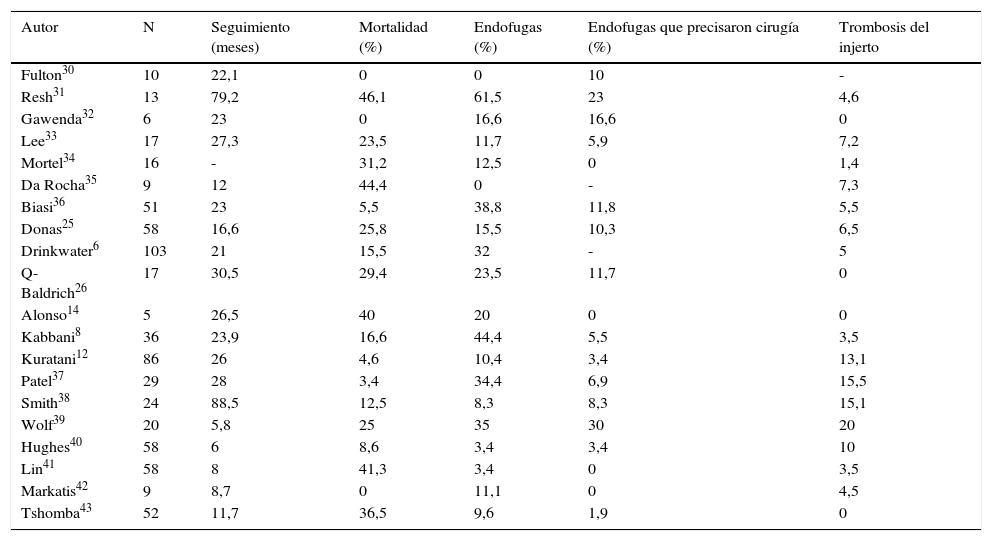
Por otro lado, la literatura existente referida específicamente a los procedimientos híbridos, aunque dispar en cuanto a la duración del seguimiento, aporta cifras de permeabilidad primaria superiores al 95%10,25,26. El metaanálisis llevado a cabo por Canaud et al.16 demuestra una excelente permeabilidad (94,7%) para las reconstrucciones realizadas, durante un seguimiento medio de 26,2 meses (6-88,5 meses). Del mismo modo, Shahverdyan et al.27 mencionan buenas cifras de permeabilidad primaria a 5 años en 46 pacientes que son menores para la arteria renal derecha (permeabilidad global 86,1±3,1%, permeabilidad hepática 100%, mesentérica superior 88,8 ± 4,8%, arteria renal izquierda 87,2±6%, y 69,6 ± 8,8% para arteria renal derecha). La realización de la anastomosis en la arteria renal derecha generalmente entraña mayor dificultad, lo que exigiría extremar la meticulosidad a la hora de realizarla, o bien, el empleo de técnicas alternativas. En este sentido, Lachat et al.28 en el año 2008 describieron la técnica Viabahn Open Rebranching TEChnique (VORTEC) para la revascularización de las arterias renales. Como ventajas fundamentales tiene que se trata de una técnica rápida y sencilla, con un buen comportamiento hemodinámico a nivel experimental y que ha conseguido una importante mejoría con los nuevos injertos Gore hybrid vascular graft (W.L. Gore and Associates, Flagstaff, Ariz, USA). También cabe mencionar que, con el objeto de facilitar la técnica endovascular durante la reparación de ATA complejos, ocasionalmente sería posible llevar a cabo un procedimiento VORTEC en las arterias renales, acompañado de una reparación endovascular complementaria que incluya ramas para los troncos digestivos.
Como inconvenientes de la técnica VORTEC se puede decir que conlleva un encarecimiento del procedimiento en unos 7.000 € (en caso de emplear 4 dispositivos) y que se trata de injertos largos que cuentan con un diámetro fijo pequeño (6mm) en la parte protésica sin stent, lo cual puede ser motivo de estenosis en caso de mínima hiperplasia. Por otro lado, no se dispone de evidencia sobre los mejores resultados con esta técnica.
EndofugasConstituyen el tercer punto crítico a considerar cuando nos referimos a los procedimientos híbridos renoviscerales, que merman la eficiencia del tratamiento. En el metaanálisis de Moulakakis et al.10, de 502 pacientes en los que se completó el procedimiento, durante un seguimiento medio de 34,2 meses, el 21% experimentó una endofuga (59% tipo II, un 29% tipo I y un 11% tipo III). La cuarta parte de ellos precisó reintervención. Sin embargo, el problema de las endofugas es común a todas las modalidades de tratamiento endovascular, variando su frecuencia en la literatura entre el 5 y el 26% a nivel de la aorta torácica a los 30 días (media 10%) y entre el 4 y el 28% al cabo del año (media 10%)29. Además, si tenemos en cuenta que en el tratamiento híbrido no se precisa la implantación de ramas para arterias renales y viscerales, se evitarían posibles problemas en este sentido. Para minimizar el riesgo de endofugas tipo I y tipo III (las consideradas como fracaso del procedimiento) en los procedimientos híbridos, basta con conseguir unas adecuadas zonas de sellado proximal y distal, así como un amplio solapamiento entre los dispositivos.
En las tablas 1 y 2 se representan, en términos generales, los resultados inmediatos y tardíos en cirugía híbrida renovisceral. Queda patente que estos procedimientos deben considerarse cirugía compleja acompañada de morbimortalidad no despreciable, si bien es probablemente menor que si se llevara a cabo cirugía convencional en los mismos pacientes, aunque se carece de evidencia científica al respecto.
Procedimientos híbridos renoviscerales: resultados inmediatos
| Autor | N | Mortalidad inmediata | Paraplejía (%) | Insuficiencia Renal diálisis (%) | Complicaciones pulmonares y cardiacas (%) | Isquemia intestinal |
|---|---|---|---|---|---|---|
| Fulton30 | 10 | 0 | 0 | 0 | 10 | 0 |
| Resh31 | 13 | 23 | 15,3 | 15,3 | 15,3 | 7,6 |
| Gawenda32 | 6 | 0 | 0 | 0 | 16,6 | 0 |
| Lee33 | 17 | 23,5 | 0 | 16,6 | 17,6 | 0 |
| Mortel34 | 16 | 25 | 0 | 18,7 | 6,2 | 25 |
| Da Rocha35 | 9 | 44,4 | 11,1 | 11,1 | 0 | 11,1 |
| Biasi36 | 18 | 16,7 | 5,5 | 0 | 11 | 0 |
| Donas25 | 58 | 8,6 | 3,4 | 0 | 3,4 | 0 |
| Drinkwater6 | 103 | 14,9 | 8,6 | 27,1 | 4,8 | 2,9 |
| Q-Baldrich26 | 17 | 0 | 5,8 | 0 | 11,7 | 0 |
| Alonso14 | 5 | 0 | 0 | 0 | 40 | 0 |
| Kabbani8 | 36 | 8,3 | 0 | 11,1 | 8,3 | 8,3 |
| Kuratani12 | 86 | 2,3 | 0 | 2,3 | 0 | 3,4 |
| Patel37 | 29 | 3,4 | 3,4 | 17,2 | 3,4 | 3,4 |
| Smith38 | 24 | 12,5 | 8,3 | 16,6 | 8,3 | 20,8 |
| Wolf39 | 20 | 10 | 5 | 15 | 15 | 5 |
| Hughes40 | 58 | 8,6 | 3,4 | 12 | 13,7 | 0 |
| Lin41 | 58 | 24,1 | - | 10,3 | 13,7 | 5,1 |
| Markatis42 | 9 | 0 | 0 | 0 | 0 | 0 |
| Tshomba43 | 52 | 13,4 | 1,9 | 0 | 7,7 | 1,9 |
Procedimientos híbridos renoviscerales: seguimiento
| Autor | N | Seguimiento (meses) | Mortalidad (%) | Endofugas (%) | Endofugas que precisaron cirugía (%) | Trombosis del injerto |
|---|---|---|---|---|---|---|
| Fulton30 | 10 | 22,1 | 0 | 0 | 10 | - |
| Resh31 | 13 | 79,2 | 46,1 | 61,5 | 23 | 4,6 |
| Gawenda32 | 6 | 23 | 0 | 16,6 | 16,6 | 0 |
| Lee33 | 17 | 27,3 | 23,5 | 11,7 | 5,9 | 7,2 |
| Mortel34 | 16 | - | 31,2 | 12,5 | 0 | 1,4 |
| Da Rocha35 | 9 | 12 | 44,4 | 0 | - | 7,3 |
| Biasi36 | 51 | 23 | 5,5 | 38,8 | 11,8 | 5,5 |
| Donas25 | 58 | 16,6 | 25,8 | 15,5 | 10,3 | 6,5 |
| Drinkwater6 | 103 | 21 | 15,5 | 32 | - | 5 |
| Q-Baldrich26 | 17 | 30,5 | 29,4 | 23,5 | 11,7 | 0 |
| Alonso14 | 5 | 26,5 | 40 | 20 | 0 | 0 |
| Kabbani8 | 36 | 23,9 | 16,6 | 44,4 | 5,5 | 3,5 |
| Kuratani12 | 86 | 26 | 4,6 | 10,4 | 3,4 | 13,1 |
| Patel37 | 29 | 28 | 3,4 | 34,4 | 6,9 | 15,5 |
| Smith38 | 24 | 88,5 | 12,5 | 8,3 | 8,3 | 15,1 |
| Wolf39 | 20 | 5,8 | 25 | 35 | 30 | 20 |
| Hughes40 | 58 | 6 | 8,6 | 3,4 | 3,4 | 10 |
| Lin41 | 58 | 8 | 41,3 | 3,4 | 0 | 3,5 |
| Markatis42 | 9 | 8,7 | 0 | 11,1 | 0 | 4,5 |
| Tshomba43 | 52 | 11,7 | 36,5 | 9,6 | 1,9 | 0 |
Otro planteamiento sería si todavía está justificado realizar la cirugía híbrida tras el avance experimentado durante la última década en el tratamiento endovascular de los ATA, con el desarrollo de endoprótesis fenestradas y con ramas diseñadas para tal fin y la aparición de endoprótesis estandarizadas (off-the-shelf). Los estudios preliminares ofrecen resultados prometedores a corto plazo44,45, si bien la mayoría de estas series incluyen un elevado porcentaje de ATA IV. Recientemente, Verhoeven et al.46 publicaron su experiencia en 166 pacientes con una mortalidad hospitalaria del 9% y unas tasas de isquemia medular perioperatoria también del 9% con paraplejía en el 1%. Durante un seguimiento medio de 29 ± 21 meses, 2 de las muertes acontecidas estuvieron relacionadas con el aneurisma y la reintervención fue necesaria en el 24% de los pacientes. Austermann et al., durante un seguimiento de poco más de un año en 107 pacientes (aneurismas pararrenales y toracoabdominales), describieron complicaciones en 28 (26%), precisando 34 reintervenciones (6 trombosis/estenosis de ramas, 8 oclusiones/estenosis en stent viscerales, 8 endofugas tipo I y 12 tipo III)47.
La permeabilidad de los vasos renales y viscerales para las endoprótesis fenestradas y con ramas es buena: Verhoeven et al.48 mencionan permeabilidades a 5 años del 93%. La mayoría de las oclusiones ocurren en los 2 primeros años y los eventos renales tardíos son la principal preocupación, con un deterioro significativo de la función renal en hasta el 25% de los casos.
Una reciente revisión del tratamiento endovascular en los ATA muestra una mortalidad inmediata del 0 al 21%, isquemia medular entre 0 y 33%, con una tasa de reintervención entre 3 y 25%49.
Se puede afirmar que el tratamiento endovascular de los ATA, al igual que el resto de las modalidades de tratamiento para esta dolencia, muestra resultados dispares, aunque prometedores, a corto plazo y en centros seleccionados. Sin embargo, cabe esperar una tasa de reintervención significativa que va a incrementándose a medida que aumenta el seguimiento y aún se carece de resultados consistentes a largo plazo. Además, se trata de procedimientos complejos, de coste elevado, que todavía no están ampliamente difundidos, y con evidentes inconvenientes logísticos. Al margen de esto, también existen limitaciones anatómicas que impiden llevarlos a cabo, como sería el caso de luces aórticas estrechas, que podrían comprometer la permeabilidad de las ramas, angulaciones o tortuosidades severas, enfermedad oclusiva ilíaca, etc.
En un intento de paliar parte de estos problemas, están desarrollándose endoprótesis estandarizadas (off-the-shelf), que permitirían tratar entre el 60 y el 80% de los ATA. Empleando la Zenith t-Branch (Cook Incorporated, Bloomington, IN, EE. UU.) Bisdas et al. muestran resultados preliminares comparables a los obtenidos con los dispositivos personalizados, aunque con obstrucción del stent renal en el 13,6% de los casos (3/22)50.
También han sido empleadas otras técnicas de recurso para el tratamiento de ATA; principalmente las técnicas de parallel endograft (chimeneas, periscopios, sandwich), con frecuencia usadas en aneurismas yuxta o pararrenales con aparentes buenos resultados51, aunque su utilización en el caso de los ATA es muy limitado. Sus principales ventajas son el usar dispositivos convencionales y permitir la canulación de las ramas viscerales antes de desplegar la endoprótesis; pero para los ATA su mayor inconveniente sería la aposición defectuosa o incompleta entre el stent recubierto y la endoprótesis aórtica con la presencia de endofugas. Para tratar de evitarlo, se recurre a la sobredimensión excesiva de la endoprótesis aórtica con el subsiguiente riesgo de pliegues (infolding) y al solapado extenso, con mayor riesgo de trombosis de las reconstrucciones y oclusión involuntaria de arterias lumbares e intercostales. El uso de dichas técnicas en ATA está muy poco documentada (escaso número de pacientes y grupos muy heterogéneos que mezclan aneurismas yuxta o pararrenales con ATA). Una de las series más largas es la publicada por Lachat et al.52 con 77 pacientes incluidos, de los que solo 20 eran ATA (6 tipo I). Con un seguimiento medio de 24 meses (9 muertes por causas desconocidas) existe un 26% de endofugas tipo I/III, un 10% de reintervenciones por problemas con los stents viscerales y un 4% de trombosis. En general, existe consenso en que estos procedimientos deben limitarse a casos de urgencia o anatomía desfavorable, en los cuales no se pueden usar otras técnicas.
Aspectos técnicosSiempre que sea posible, es recomendable llevar a cabo el procedimiento en 2 tiempos; aunque, la decisión final se tomará basada en la urgencia, el tamaño del aneurisma, la complejidad, la duración estimada de la cirugía y la función renal preoperatoria. En cualquier caso, no conviene «demorar demasiado» la segunda intervención por el riesgo de rotura del aneurisma a la espera de completar el tratamiento.
Se emplea un abordaje transperitoneal mediante laparotomía xifopúbica, si bien, en nuestro caso, preferimos un abordaje subcostal bilateral, con o sin ampliación a xifoides, ya que permite una excelente exposición de la aorta pararrenal sin necesidad de usar separador abdominal. El principal inconveniente de este abordaje es una mayor frecuencia de eventraciones.
Como donante (inflow) se debe garantizar una zona sana lo más proximal posible, que permita realizar posteriormente el tiempo endovascular de forma cómoda y segura, con una adecuada zona de sellado. Generalmente, esto se consigue originando la revascularización desde la aorta infrarrenal, desde un injerto aórtico (antiguo o realizado a tal efecto) o desde la arteria ilíaca común.
La técnica de revascularización a emplear es variable. La preferida por nuestro grupo consiste en un injerto bifurcado retrógrado de dacron (12×6mm, 12×7mm o 14×7mm) para ambas arterias renales, y sobre cuyo cuerpo se sutura un injerto de dacron de 7 u 8mm, el cual, siguiendo un trayecto retrógrado retropancreático o por delante del páncreas, es anastomosado en término lateral a nivel del tronco celíaco, la arteria hepática común o la arteria esplénica. Para evitar la aparición de endofugas tipo II conviene realizar la ligadura del tronco celíaco próximo a la aorta (antes del origen de la arteria gástrica izquierda u otras ramas esofágicas o diafragmáticas). Sobre este último injerto, se reimplantará la arteria mesentérica superior (evitando la tracción excesiva en la raíz del meso y la tensión en la arteria en el momento de la sección para evitar una disección iatrogénica). La principal crítica al reimplante de la arteria mesentérica superior sería que toda la vascularización visceral depende de un solo injerto que, en caso de obstrucción, provocará una isquemia digestiva extensa y severa. Siendo esto cierto, sabemos que los principales factores condicionantes de la permeabilidad son: inflow, outflow, calidad del injerto, técnica quirúrgica, adecuado tratamiento médico y control de los factores de riesgo. Por otro lado, dicho reimplante permite realizar menos suturas y menos injertos en el retroperitoneo, facilitando el aislamiento y cierre retroperitoneal, además de conseguir una mejor disposición anatómica, evitando largos injertos retrógrados con riesgo de acodaduras. Se considera aconsejable revascularizar el tronco celíaco: estudios recientes muestran una incidencia de isquemia visceral de aproximadamente el 6% con su cobertura53.
La duración de estas intervenciones es larga. Con el objeto de facilitar las anastomosis y minimizar el tiempo de isquemia renal y visceral, Lachat et al. describieron la técnica VORTEC28.
Antes de dar por finalizada la parte abierta del procedimiento, es recomendable prestar atención a varios aspectos:
1) Garantizar que los injertos queden adecuadamente protegidos en el retroperitoneo: si la cobertura directa no es factible, se realizará una omentoplastia y, en caso de no ser posible, se pueden emplear para el cierre retroperitonel parches de material biológico o una malla de polipropileno y celulosa oxigenada regenerada (usada para la corrección de eventraciones).
2) Asegurar un acceso vascular que permita un tiempo endovascular sin complicaciones. En caso necesario, se efectuaría un injerto aorto- o iliofemoral de 8-10mm.
3) Marcar con hilo plomado (extraído de una compresa) el origen de los injertos renoviscerales facilita y ofrece seguridad durante el posterior tiempo endovascular.
Experiencia personalDesde el año 2006, uno de los firmantes (MAP) ha tenido la oportunidad de participar en 17 procedimiento de debranching renovisceral, 10 realizados en el Hospital Universitario Central de Asturias y el resto en distintos centros del país. Se trata de un grupo heterogéneo de pacientes con ATA extensa (excluidos ATA tipo IV), en el cual la mortalidad intrahospitalaria fue del 5,9% (una muerte por pancreatitis con isquemia de colon). Se registró un caso de paresia de miembros inferiores con buena recuperación funcional y ninguna paraplejía. Una paciente presentó un hematoma subdural agudo, en probable relación con el drenaje de líquido cefalorraquídeo, que precisó intervención quirúrgica por neurocirugía, recuperándose sin déficit. La permeabilidad inmediata de las reconstrucciones realizadas fue del 97%, habiéndose trombosado la arteria renal derecha en 2 pacientes (permeabilidad: 15/15 tronco celíaco, 16/16 AMS, 32/34 renales y 1/1 hipogástricas). Se identificaron 2 (12%) endofugas en el postoperatorio inmediato (una tipo II y una tipo III). En total, 4 (24%) pacientes fueron reintervenidos durante el postoperatorio inmediato: uno por sangrado intraabdominal, uno por endofuga tipo III, uno con hematoma subdural agudo y otro por isquemia de colon).
En cuanto a los resultados tardíos (seguimiento entre 98-3 meses, mediana 45 meses): se produjeron 4 (25%) fallecimientos, ninguno en relación con el tratamiento realizado (2 hemorragias cerebrales, una endocarditis, una sepsis urinaria). Se registraron 6 endofugas (37%): 2 tipo I (se intervino a un paciente: Bentall y debranching de troncos suspraóarticos); 2 tipo II (sin tratamiento) y 2 pacientes con endofuga tipo III precisaron corrección endovascular. Se constató estenosis en 3 (19%) de los injertos realizados: una estenosis a nivel del reimplante de una arteria mesentérica superior (tratada mediante stent) y 2 estenosis renales que no precisaron tratamiento. Otros 3 (19%) pacientes presentaron eventración incisional; precisaron reparación quirúrgica 2 casos.
ConclusiónEl tratamiento de los ATA continúa representando un reto, que está rodeado de controversia al observarse una gran disparidad en los resultados dentro de las distintas modalidades terapéuticas. El debranching renovisceral es un procedimiento cuya complejidad no debe ser infraestimada, que demanda una meticulosa planificación y técnica quirúrgica para disminuir la mortalidad y las complicaciones. No cabe duda de que el desarrollo de nuevos dispositivos y técnicas endovasculares, paralelamente con una mayor experiencia adquirida por el operador, permitirán tratar cada vez un mayor número de casos de ATA de forma puramente endovascular. Sin embargo, los procedimientos híbridos a nivel renovisceral todavía constituyen una alternativa útil para el tratamiento de ATA, fundamentalmente cuando otros procedimientos endovasculares menos invasivos no son posibles por limitaciones anatómicas (luz vascular estrecha, disección de vasos renales y digestivos, angulaciones y tortuosidades severas que dificulten el preciso posicionamiento de la endoprótesis, accesos vasculares limitados, etc.) o no están disponibles en casos que no admiten demora.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo conflictos interés.