El presente estudio investigó el efecto de la oclusión temporal de la aorta sobre el desarrollo de una lesión por isquemia-reperfusión (I/R) de los órganos viscerales, el momento óptimo de administración de resveratrol y su mecanismo de protección a través de la liberación de óxido nítrico (NO) con un inhibidor de la NO sintetasa.
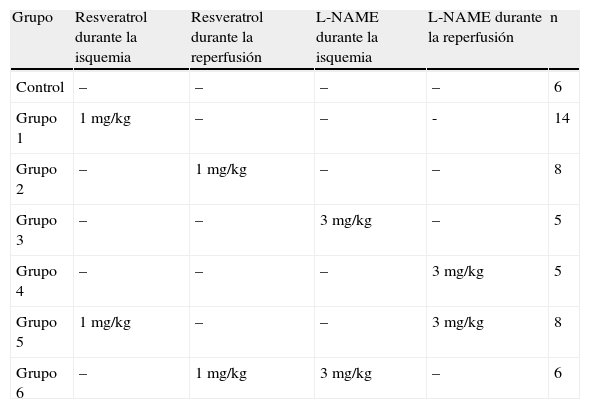
MétodosLos conejos se dividieron en siete grupos de acuerdo con el período de administración de resveratrol y/o NG-nitro-L-arginina-metil-éster (L-NAME): grupo de control; grupo 1, resveratrol durante el período isquémico; grupo 2, resveratrol durante el período de reperfusión; grupo 3, L-NAME durante el período isquémico; grupo 4, L-NAME durante el período de reperfusión; grupo 5, resveratrol durante el período isquémico y L-NAME durante el período de reperfusión; y grupo 6, L-NAME durante el período isquémico y resveratrol durante el período de reperfusión. La aorta infrarrenal se clampó durante 30 min. Se obtuvieron muestras de sangre para evaluación bioquímica, y muestras de órganos para evaluación anatomopatológica a las 24 h de la reperfusión.
ResultadosEn los grupos 5 y 6 la lesión renal de I/R fue comparativamente más leve (puntuación de la lesión I/R 1,04 ± 0,29 en el grupo de control, 0,25 ± 0,17 en el grupo 5 y 0,33 ± 0,13 en el grupo 6 [p < 0,05]). La lesión intestinal I/R fue más leve en el grupo 5 (puntuación de la lesión I/R 1,8 ± 0,80 en el grupo de control frente a 0,0 ± 0,0 en el grupo 5 [p < 0,05]).
ConclusiónSe demostraron histopatológicamente los efectos protectores del resveratrol sobre los órganos con un índice metabólico elevado como el riñón y el intestino. Podría ser beneficioso usar diferentes fármacos en los distintos períodos de la lesión I/R ya que representan diferentes características con y sin oxígeno. La combinación de resveratrol y L-NAME frente a la lesión de I/R parece ser una opción eficaz en un futuro inmediato.
A pesar de los progresos recientes en las técnicas operatorias, en los procedimientos anestésicos y cuidados postoperatorios, la disfunción de los órganos viscerales sigue asociándose con un riesgo significativo de mortalidad o morbilidad postoperatoria tras la corrección de un aneurisma aórtico toracoabdominal (AATA). Los riesgos de mortalidad y disfunción orgánica después de la corrección de un aneurisma suprarrenal o AATA son significativamente mayores que los afrontados tras la corrección de los aórticos abdominales infrarrenales1. Durante la corrección de los AATA, el clampaje de la aorta provoca una disminución temporal del flujo sanguíneo esplácnico, renal y de la médula espinal y una agresión isquémica de los órganos viscerales.
Los estudios efectuados en animales han demostrado que la isquemia-reperfusión (I/R) visceral se asocia con una importante respuesta proinflamatoria sistémica2,3. Esta respuesta aumenta el grado de lesión tisular local que se produce durante la reperfusión de los órganos que han permanecido isquémicos y produce una lesión de los órganos a distancia (es decir, el pulmón), no sometidos a isquemia1. Además de estos factores, el óxido nítrico (NO) juega un papel controvertido en la lesión I/R puesto que el NO podría actuar como un mediador de la lesión tisular y al mismo tiempo como potente vasodilatador endógeno4,5.
El resveratrol (3,5,4′-trihidroxiestilbeno), un antioxidante polifenólico natural, presente en la uva y el componente activo del vino tinto, se ha asociado causalmente con los beneficios cardiovasculares del consumo moderado de vino; se hace referencia a este fenómeno como la “paradoja francesa”4,6,7. Además de sus efectos vasodilatadores6, el resveratrol posee propiedades antioxidantes8, antiagregantes plaquetarias9 y antiinflamatorias10. Por otra parte, se ha demostrado que inhibe la peroxidación lipídica de los lípidos de membrana y las interacciones de los neutrófilos y las células endoteliales, elimina los radicales libres del oxígeno (ROL), y aumenta la producción de NO, lo que, en consecuencia, confiere efectos beneficiosos sobre diversos órganos en la lesión I/R6,8-11. El resveratrol produce sus efectos vasculares a través de un mecanismo tanto dependiente del endotelio (que puede ser antagonizado mediante inhibidores de la NO sintasa) como no dependiente12 (no puede ser antagonizado con estos inhibidores o a través de una lesión endotelial).
Previamente investigamos los efectos del resveratrol sobre la protección de la médula espinal utilizando el mismo modelo de I/R con la misma organización experimental para examinar el resultado funcional y patológico de la médula espinal13. Este modelo experimental de isquemia de la médula espinal en conejos es válido y se ha usado previamente13,14. Puesto que se afirma que la lesión I/R es una reacción sistémica, investigamos los efectos de la oclusión temporal de la perfusión de la médula espinal sobre el desarrollo de esta lesión en los órganos viscerales (efectos indirectos de la lesión I/R remota) mediante el clampaje de la aorta infrarrenal; así mismo, tratamos de encontrar el momento óptimo del tratamiento con este fármaco, con independencia de que fuera protector durante el período de isquemia o el de reperfusión, y el mecanismo de la protección utilizando NG-nitro-L-arginina-metil-éster (L-NAME), un inhibidor de la NO sintasa.
Materiales y métodosEl estudio se llevó a cabo de acuerdo con los Principles of Laboratory Animal Care and Guide for the Care Use of Laboratory Animals (NIH Publication 80-23, revisada en 1985) y fue aprobado por el comité de investigación de la Gazi University (16/1/2004, protocolo 015-545). En el estudio se usaron 52 conejos blancos de Nueva Zelanda y el peso medio de los animales fue de 3,6 ± 0,4 kg. Los animales tuvieron acceso libre al pienso y al agua. Se dividieron en siete grupos de acuerdo con el período de administración de resveratrol y/o L-NAME (isquemia o reperfusión): grupo de control que no recibió medicación; grupo 1, resveratrol durante el período isquémico; grupo 2, resveratrol durante el período de reperfusión; grupo 3, L-NAME durante el período isquémico; grupo 4, L-NAME durante el período de reperfusión; grupo 5, resveratrol durante el período isquémico y L-NAME durante el período de reperfusión; y grupo 6, L-NAME durante el período isquémico y resveratrol durante el período de reperfusión. El resveratrol (1 mg/kg) y/o L-NAME (3 mg/kg) se infundieron por vía intravenosa en los 5 primeros min de isquemia y/o reperfusión, y todos los grupos recibieron una cantidad idéntica de líquidos durante el estudio. Las dosis de los fármacos fueron idénticas a las utilizadas en nuestro estudio previo, donde investigamos los efectos protectores del resveratol y el L-NAME sobre la médula espinal13. El resveratrol y el L-NAME se obtuvieron a partir de Sigma (Sant Louis, Estados Unidos).
Procedimiento quirúrgicoLos animales recibieron ketamina (50 mg/kg) y xilacina (10 mg/kg) por vía intravenosa para la inducción anestésica y se les permitió la respiración espontánea sin ventilación mecánica. Durante todos los experimentos, se administraron dosis intravenosas adicionales de ketamina según las necesidades. La temperatura rectal se mantuvo a 38°C por medio de una lámpara de calor. Tras garantizar que la profundidad de la anestesia era adecuada, se insertó un catéter de calibre 24 en la vena auricular para la administración de líquidos intravenosos y medicación adicional. Se insertó un catéter arterial auricular para monitorizar la presión arterial y obtener muestras sanguíneas.
Tras la preparación quirúrgica estéril, se abrió el abdomen con un abordaje de laparotomía en la línea media y se expuso la aorta abdominal retroperitoneal. Se prestó especial atención en evitar una lesión del conducto linfático mesentérico, asociado íntimamente con la aorta abdominal. Tras obtener el control de la aorta abdominal con esparadrapo, se administraron por vía intravenosa 50 UI/kg de heparina sódica y se clampó la aorta colocando un clampaje vascular atraumático inmediatamente caudal al origen de la arteria renal izquierda y por encima de la bifurcación aórtica. La aplicación de 30 min de agresión isquémica se basa en los resultados de los experimentos previos que han usado este modelo4,7,13,14. Tras la oclusión de la aorta, el abdomen se cerró provisionalmente para evitar una pérdida excesiva de calor o líquidos. Después de la retirada del clampaje, se observó visualmente la reperfusión distal. El período de reperfusión fue de 30 min para cada animal. Al completar el procedimiento, se retiraron todos los catéteres y se cerraron los abordajes con suturas. Se permitió a los animales que se restablecieran de la anestesia antes de devolverlos al animalario, donde pudieron moverse libremente en sus jaulas y se les proporcionó comida y agua a voluntad.
A las 24 h postoperatorias, se anestesió a los animales con pentobarbital sódico (50 mg/kg). Tras obtener una profundidad adecuada de la anestesia, se sacrificó a todos los animales y se obtuvieron muestras del hígado, pulmón, corazón, intestino delgado y riñón para su evaluación anatomopatológica. Este modelo experimental se efectuó de acuerdo con los estudios experimentales publicados que han investigado la lesión de la médula espinal y órganos viscerales después de clampaje de la aorta4,13-17.
Histopatología y análisis de los marcadores bioquímicosSe obtuvieron muestras de sangre arterial en los tiempos siguientes: antes de la laparotomía, 30 min antes del período isquémico, y 5 y 30 min antes del período de reperfusión. Las muestras de sangre se mantuvieron a temperatura ambiente durante 30 min y se centrifugaron a una tasa de 3.000 ciclos/min durante 5 min; acto seguido, el plasma obtenido se introdujo en un tubo de Eppendorf y se almacenó a –40°C. El mismo técnico determinó las concentraciones plasmáticas de urea, creatinina, creatincinasa con la subunidad muscular y cerebral (CKMB), aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), lactatodeshidrogenasa (LDH), gamma-glutamiltranspeptidasa (GGT), amilasa y lipasa.
La evaluación histopatológica de las muestras de tejido se efectuó con técnicas histológicas de referencia, incluida la fijación con formol, deshidratación, inclusión en bloques de parafina, obtención de secciones transversales seriadas (de 4 μm) y tinción con hematoxilina-eosina18-19. El mismo anatomopatólogo efectuó la investigación histopatológica utilizando un microscopio óptico. Los parámetros histopatológicos de la lesión I/R se definieron del modo siguiente: para el riñón como lesión tubular, congestión y recuento de leucocitos polimorfonucleares (PMN); para el corazón como recuento de leucocitos PMN, edema y congestión; para el pulmón como infiltración neumónica, edema y congestión y para el hígado, necrosis, congestión y degeneración vacuolar. El anatomopatólogo clasificó y expresó el grado de lesión I/R como +, ++, +++ o ++++. En la evaluación de la lesión del intestino delgado, tuvimos en cuenta la clasificación de Park-Chiu19 (tabla II).
Análisis estadísticoTodos los valores se presentan como medias ± desviación estándar (DE); se consideró estadísticamente significativo un valor de p < 0,05. El análisis estadístico de las comparaciones de los hallazgos histopatológicos y los resultados del análisis bioquímico entre grupos se efectuó con un análisis de la varianza de una vía. Las alteraciones de los valores bioquímicos por el tiempo se analizaron con la prueba t para muestras emparejadas.
ResultadosComo se muestra en la tabla I, los grupos de estudio se dividieron en seis de acuerdo con el período de administración de resveratrol (1 mg/kg) y/o L-NAME (3 mg/kg). En la tabla II se muestran los parámetros histopatológicos de la lesión I/R según lo definido para el riñón, corazón, pulmón e hígado. El anatomopatólogo clasificó y expresó el grado de lesión I/R como +, ++, +++, ++++. En la evaluación de la lesión del intestino delgado, tuvimos en cuenta la clasificación de Park-Chiu19 (tabla II). En la Fig 1 se muestran la evaluación histopatológica de las muestras de tejido y las puntuaciones I/R. En la Fig 2 se muestran los resultados de la evaluación bioquímica de las muestras sanguíneas.
Grupo de control y grupos de estudio
| Grupo | Resveratrol durante la isquemia | Resveratrol durante la reperfusión | L-NAME durante la isquemia | L-NAME durante la reperfusión | n |
| Control | – | – | – | – | 6 |
| Grupo 1 | 1 mg/kg | – | – | - | 14 |
| Grupo 2 | – | 1 mg/kg | – | – | 8 |
| Grupo 3 | – | – | 3 mg/kg | – | 5 |
| Grupo 4 | – | – | – | 3 mg/kg | 5 |
| Grupo 5 | 1 mg/kg | – | – | 3 mg/kg | 8 |
| Grupo 6 | – | 1 mg/kg | 3 mg/kg | – | 6 |
L-NAME: NG-nitro-L-arginina-metil-éster.
Parámetros histopatológicos de la lesión de isquemia reperfusión
| Órgano | Parámetro histopatológico |
| Riñón | Lesión tubular, congestión, recuento de leucocitos PMN |
| Corazón | Recuento de leucocitos PMN, edema, congestión |
| Pulmón | Infiltración neumónica, edema, congestión |
| Hígado | Necrosis, congestión, degeneración vacuolar |
| Intestino | Grado 0-8∗ |
PMN: polimorfonucleares.
Clasificación de Park-Chiu: 0, mucosa sana; 1, espacio subepitelial en puntas de las vellosidades; 2, extensión del espacio subepitelial con elevación moderada; 3, elevación masiva a los lados de las vellosidades, algunas puntas denudadas; 4, vellosidades denudadas, capilares dilatados; 5, desintegración de la lámina propia; 6, lesión de las criptas; 7, infarto transmucoso; 8, infarto transmural.
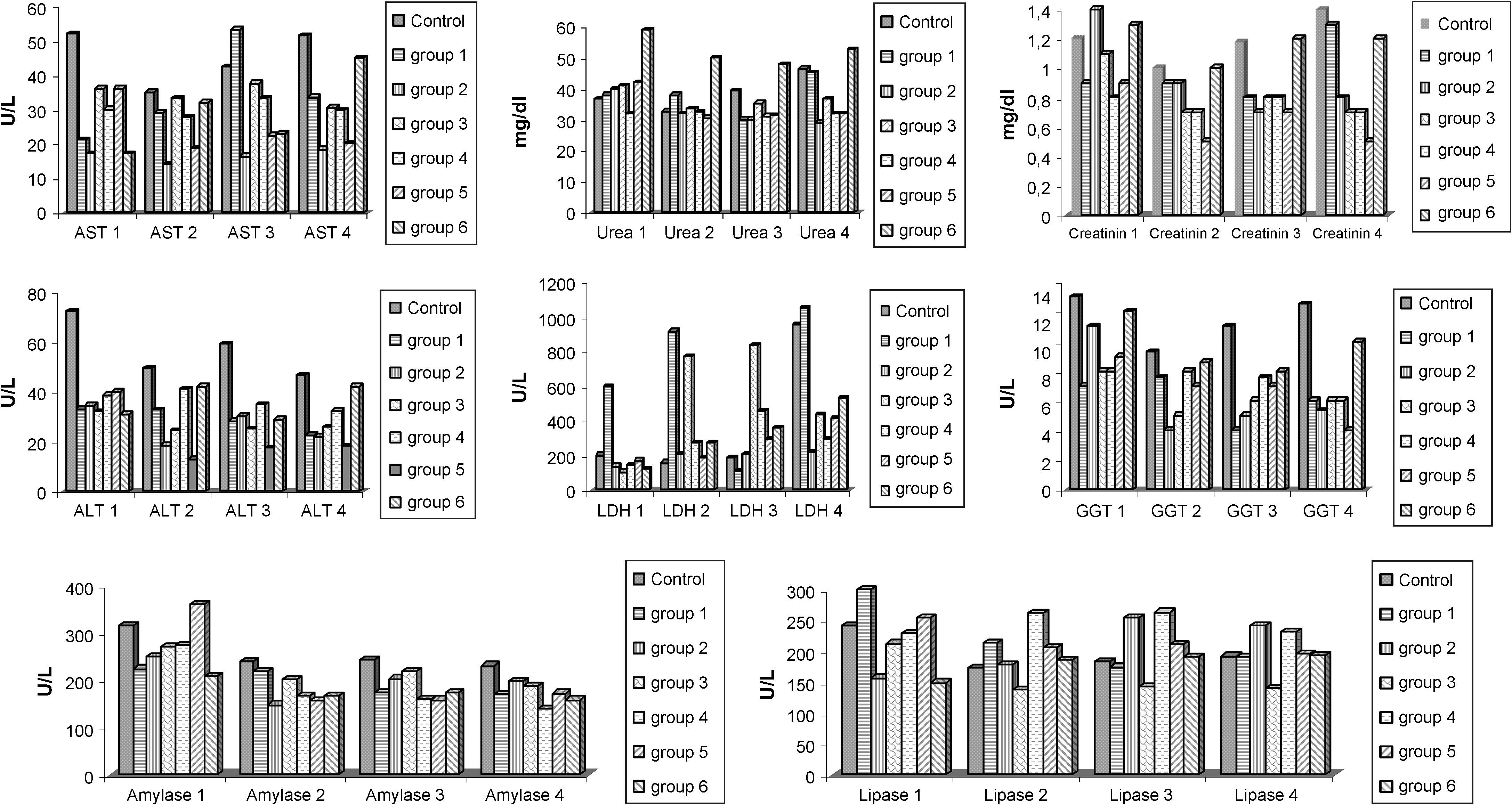
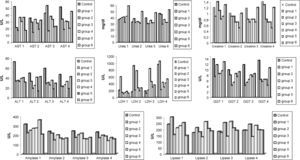
Resultados de la evaluación bioquímica de las muestras sanguíneas. Los número 1 a 4 reflejan el momento de obtención de las muestras durante el procedimiento: 1, antes de la laparotomía; 2, a los 30 min de isquemia; 3, a los 5 min de reperfusión; 4, a los 30 min de reperfusión. ALT: alanina aminotransferasa; Amylase: amilasa; AST: aspartato aminotransferasa; Creatinin: creatinina; GGT: gamma-glutamiltranspeptidasa; group: grupo; LDH: lactatodeshidrogenasa; Lipase: lipasa; U/L: U/l.
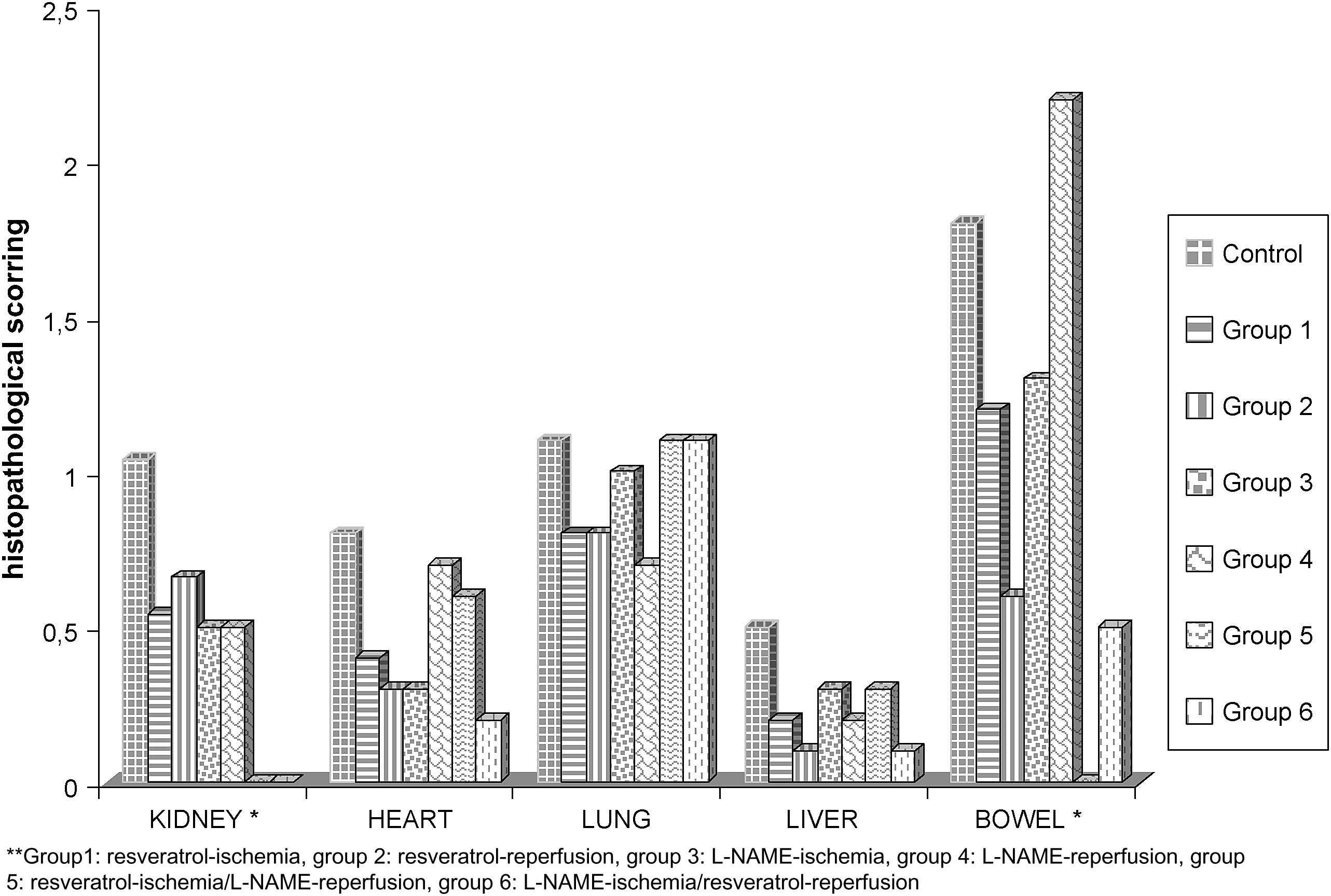
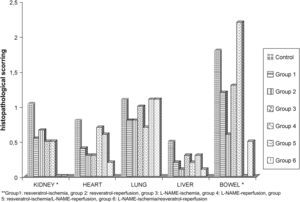
Evaluación histopatológica de las muestras de tejido y de las puntuaciones de isquemia/reperfusión (∗p < 0,05 entre grupos). ∗∗Group1: resveratrol-ischemia, group 2: resveratrol-reperfusion, group 3: L-NAME-ischemia, group 4: L-NAME-reperfusion, group 5: resveratrol-ischemia/L-NAME-reperfusion, group 6: L-NAME-ischemia/resveratrol-reperfusion: ∗grupo 1, resveratrol durante el período isquémico; grupo 2, resveratrol durante el período de reperfusión; grupo 3, L-NAME durante el período isquémico; grupo 4, L-NAME durante el período de reperfusión; grupo 5, resveratrol durante el período isquémico y L-NAME durante el período de reperfusión; y grupo 6, L-NAME durante el período isquémico y resveratrol durante el período de reperfusión; BOWEL∗: intestino delgado∗; Group: grupo; HEART: corazón; histopathological scoring: puntuación histopatológica; KIDNEY∗: riñón∗; LIVER: hígado; LUNG: pulmón.
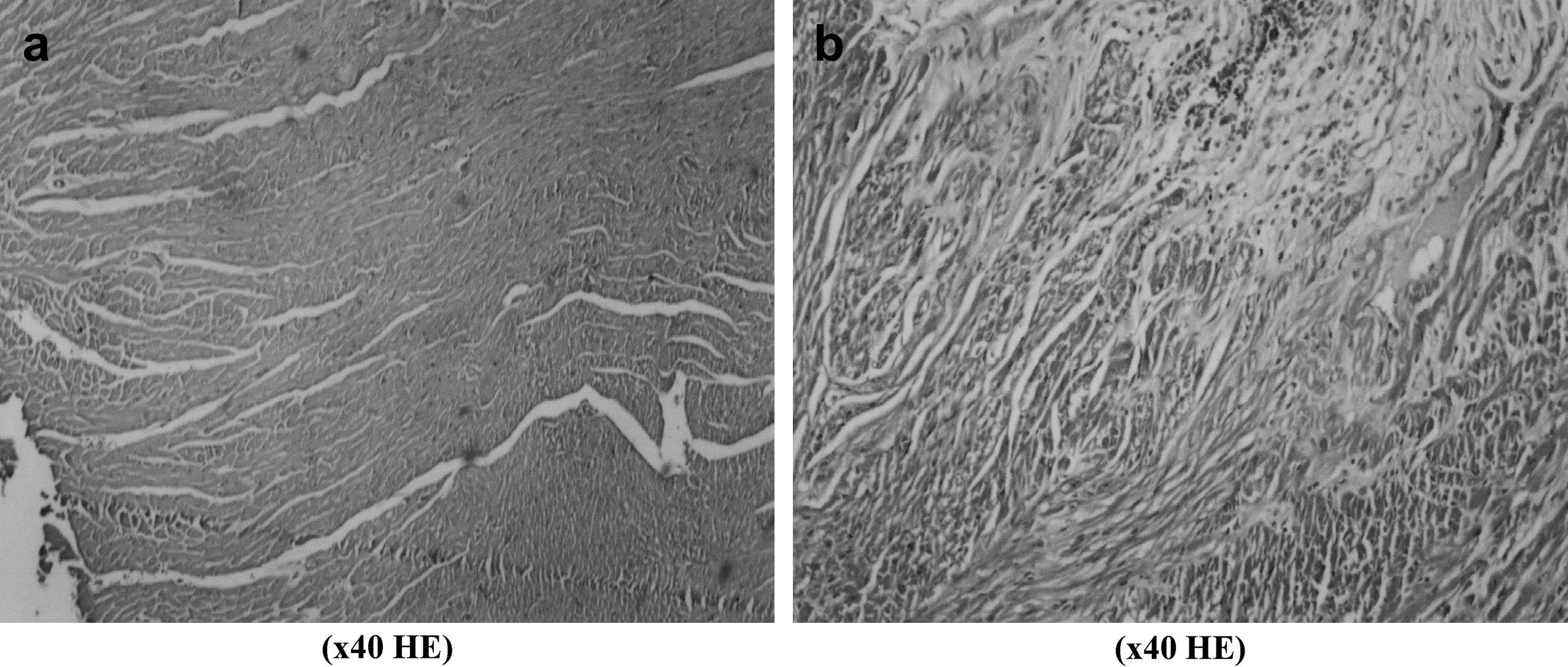
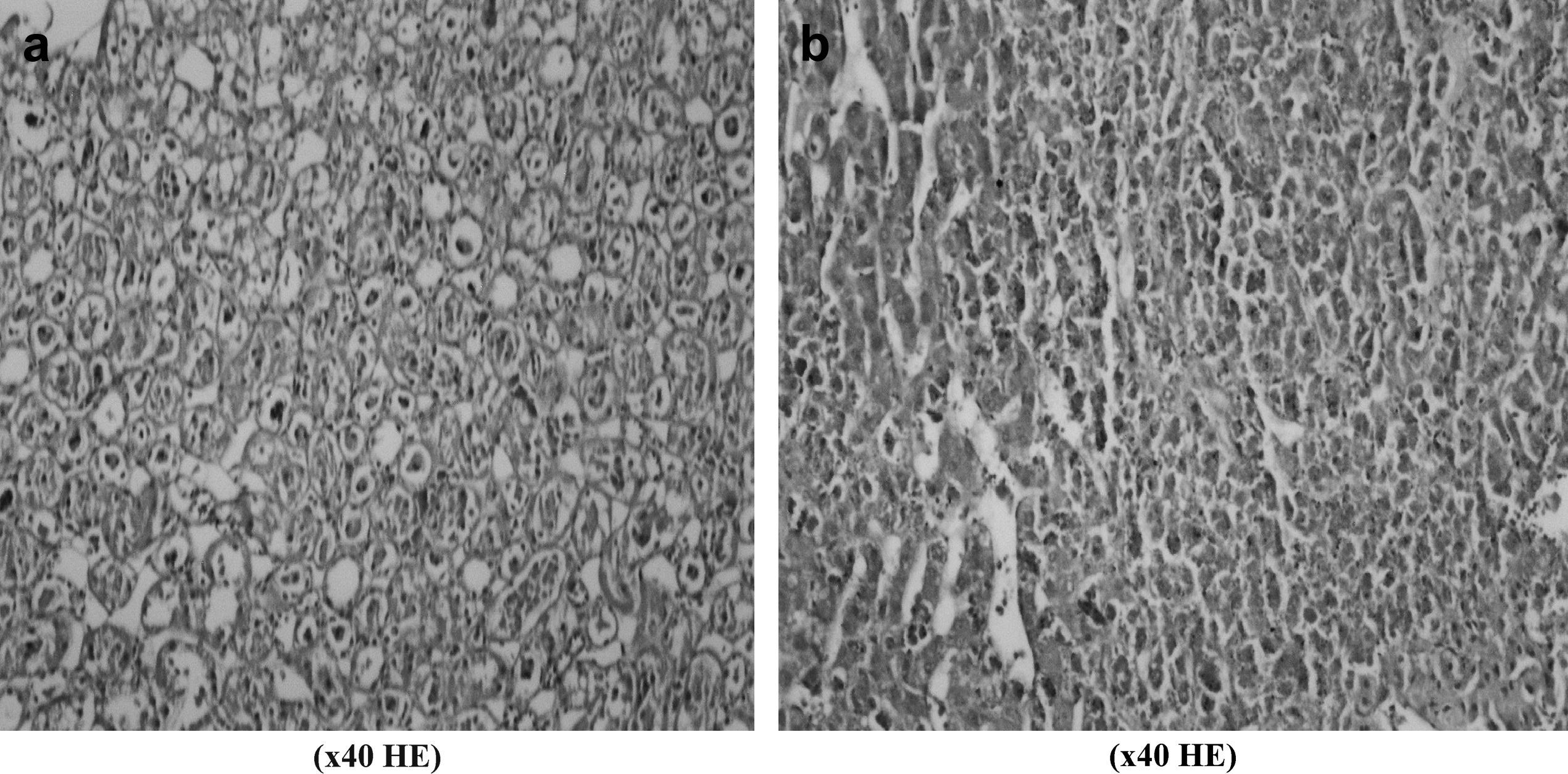
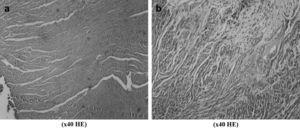
La evaluación histopatológica de las muestras de tejido obtenidas del corazón no demostró diferencias intergrupales significativas por lo que respecta al grado de edema, congestión e infiltración de leucocitos PMN. La puntuación I/R en el grupo de control fue de 0,8 ± 0,57. Según lo ilustrado en la Fig 2, comparado con el grupo de control, en todos los grupos de estudio las puntuaciones de la lesión I/R fueron más bajas, en particular en los grupos 1, 2, 3 y 6. La puntuación más baja se detectó en el grupo 6 (0,2 ± 0,10). Aunque la diferencia no fue estadísticamente significativa, como se muestra en la figura 3, se observa claramente un incremento de la congestión miocárdica en la biopsia miocárdica obtenida de un animal del grupo de control, comparado con el material biópsico de uno del grupo 6. Los valores de AST variaron en unos límites entre 53,3 ± 19,3 mg/dl (grupo 1 a los 5 min de reperfusión) y 14,0 ± 3,7 mg/dl (grupo 2 a los 30 min de la isquemia) y no fueron comparables desde un punto de vista estadístico por lo que respecta a los tiempos de determinación y entre grupos, como se muestra en la figura 1. Los valores de LDH variaron en unos límites entre 101,0 ± 211,0 mg/dl (grupo 3 antes de la laparotomía) y 1.045,3 ± 193,5 mg/dl (grupo 1 a los 30 min de la reperfusión). De forma parecida, no se identificó una diferencia significativa por lo que respecta a los tiempos de determinación y entre grupos.
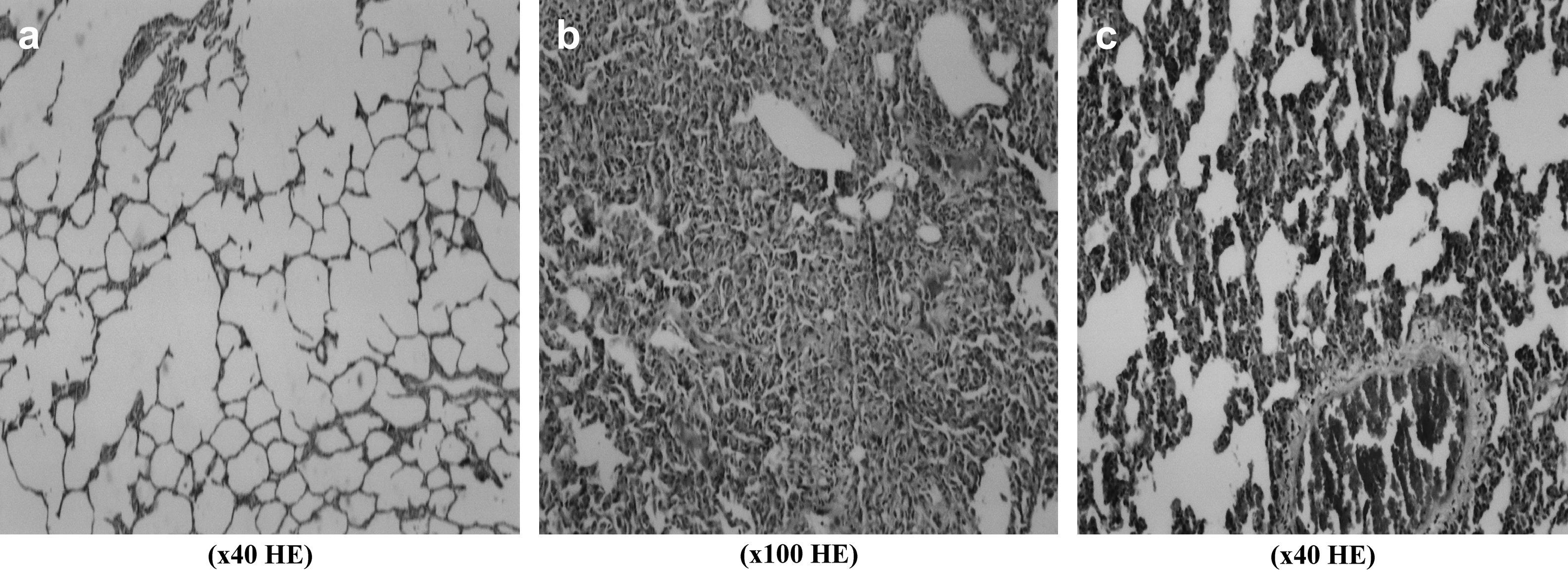
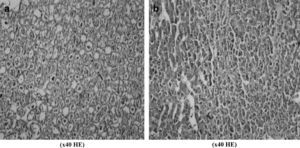
Teniendo en cuenta los parámetros histológicos de la lesión I/R del pulmón, nivel de infiltración neumónica, edema y congestión, no encontramos diferencias estadísticamente significativas entre grupos. Comparado con el grupo de control, las puntuaciones de la lesión I/R fueron más bajas en todos los grupos de estudio, en especial en los grupos 1, 2 y 4. La más baja se detectó en el grupo 4 (0,7 ± 0,13). Aunque la diferencia no fue estadísticamente significativa, la infiltración neumónica (Fig. 4b) y la congestión pulmonar (fig. 4c) fueron más evidentes en las muestras obtenidas de los animales del grupo de control comparado con los grupos de estudio. En la Fig 4 se muestran las biopsias pulmonares obtenidas del grupo de control y del grupo 5.
En las muestras de hígado no se observó una lesión grave, pero la presencia y el grado de degeneración vacuolar, congestión y necrosis indicativos de la gravedad de la lesión I/R del órgano fueron más leves en los grupos de estudio comparados con el de control. Aunque en éste observamos degeneración vacuolar en un animal (Fig. 5a) y necrosis (Fig. 5b), en otro, la diferencia no fue significativa entre grupos. La puntuación I/R del grupo de control fue de 0,5 ± 0,41. La más baja se obtuvo en el grupo 6 (0,1 ± 0,07). El análisis bioquímico de las muestras sanguíneas obtenidas de los grupos no demostró diferencias significativas para los valores de AST, ALT, GGT y LDH, como se ilustra en la figura 1. En las muestras sanguíneas los valores de ALT variaron en unos límites entre 13,0 ± 2,0 mg/dl (grupo 5 a los 30 min de isquemia) y 72,0 ± 28,0 mg/dl (grupo de control antes de la laparotomía). Los valores de GGT obtenidos a partir de las muestras sanguíneas variaron entre 4,0 ± 1,0 mg/dl (grupo 5 a los 30 min de reperfusión) y 13,0 ± 4,5 mg/dl (grupo de control antes de la laparotomía).
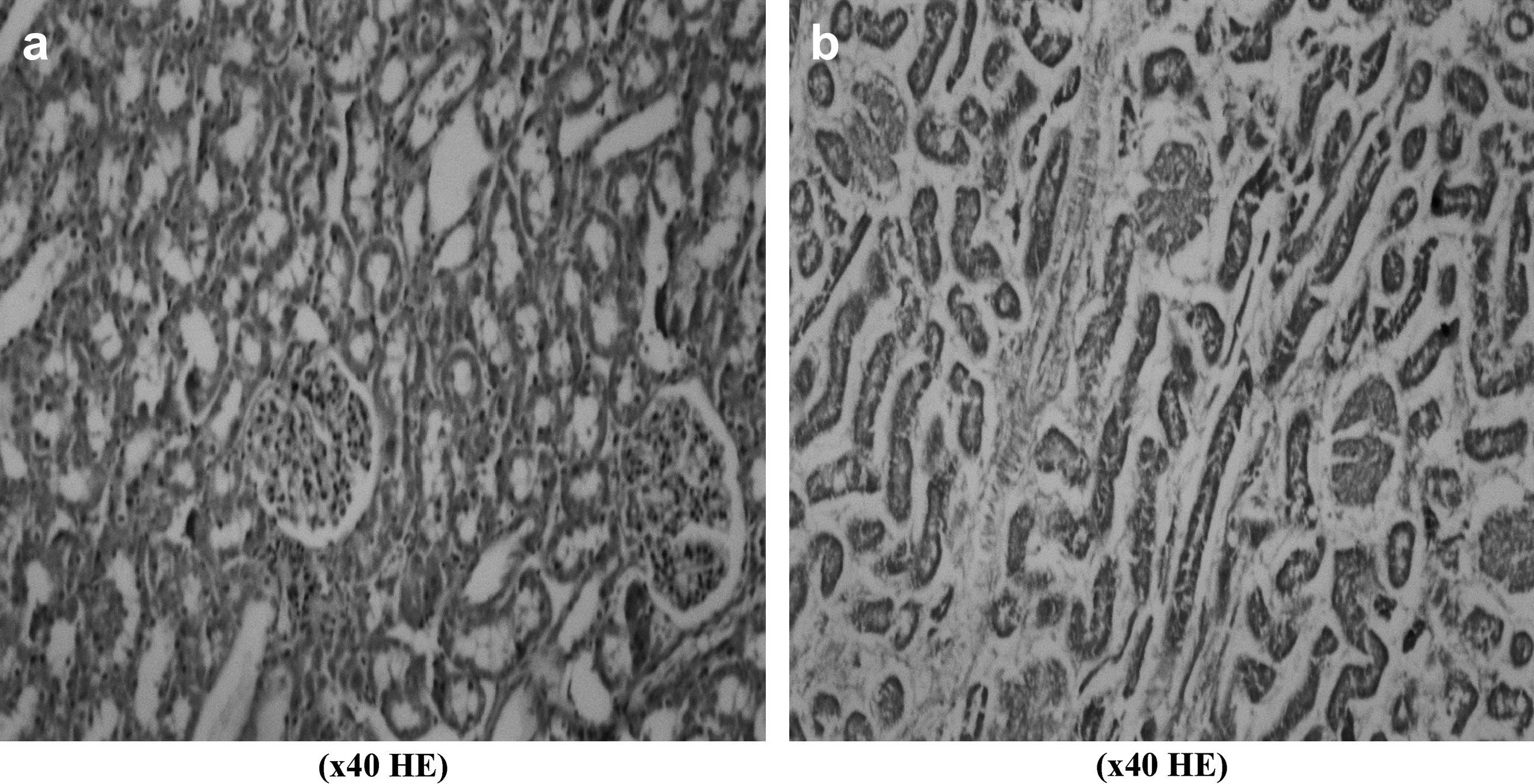
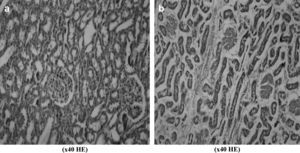
Durante la evaluación de la lesión renal de I/R, encontramos que en los grupos 5 y 6 el grado de lesión tubular, congestión y recuento de leucocitos PMN fue significativamente menor comparado con los otros grupos. Para el grupo de control se calcularon puntuaciones medias de la lesión de 1,04 ± 0,29, para el grupo 5, de 0,25 ± 0,17 y para el grupo 6, de 0,33 ± 0,13 (p < 0,05). En la figura 2 se ilustra la diferencia significativa de las puntuaciones medias de la lesión. En la Fig 6 se muestra un ejemplo de necrosis tubular aguda detectada en una muestra renal obtenida de un animal del grupo de control. No obstante, no pudimos encontrar diferencias estadísticamente significativas entre grupos por lo que respecta a la concentración de urea y creatinina, como se ilustra en la fig 1. La concentración de urea se encontró en unos límites entre 29,0 ± 3,7 mg/dl (grupo 2 a los 30 min de reperfusión) y 52,6 ± 6,0 mg/dl (grupo 6 a los 30 min de reperfusión). La concentración de creatinina varió entre 0,5 ± 0,1 mg/dl (grupo 5 a los 30 min de reperfusión) y 1,4 ± 0,5 mg/dl (grupo 2 antes de la laparotomía).
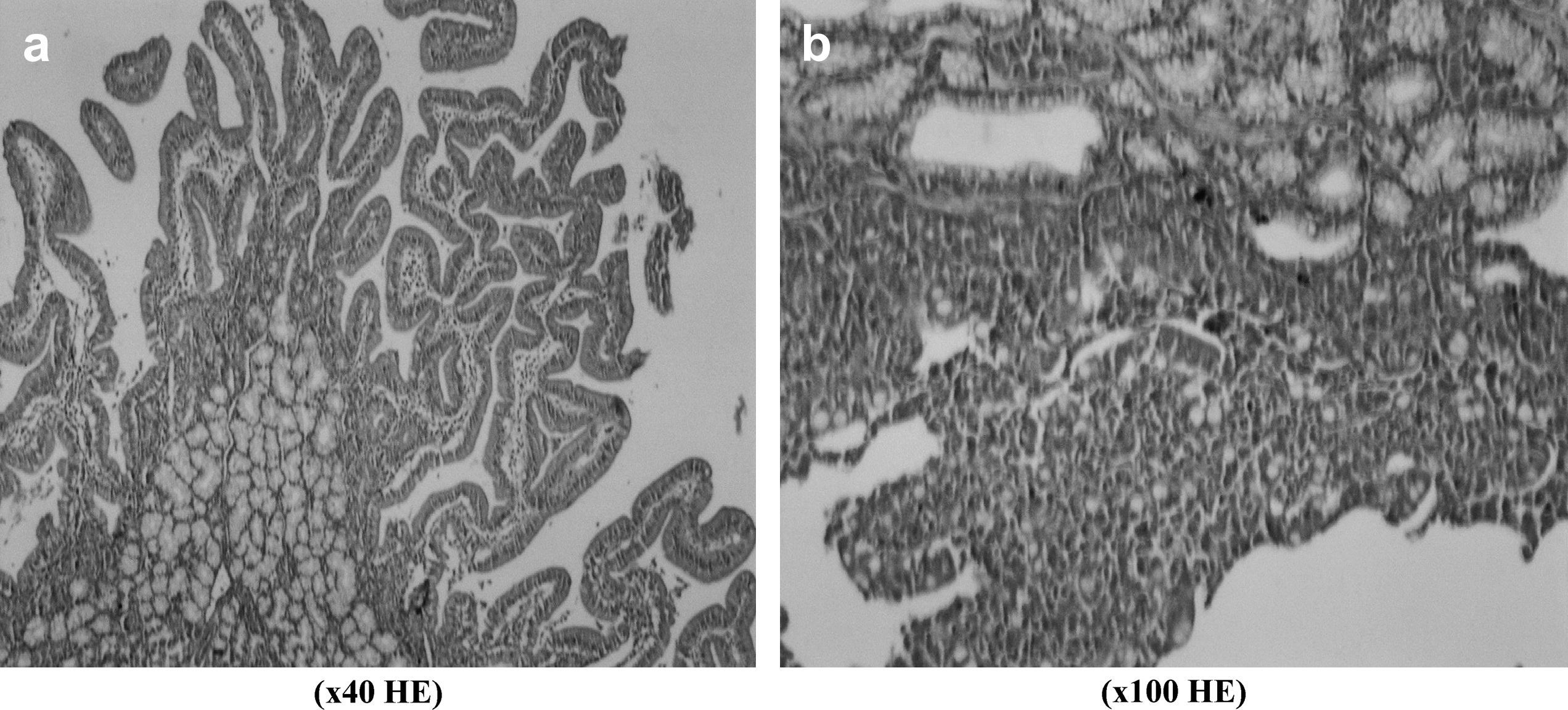
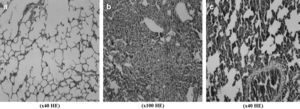
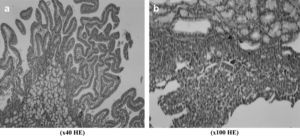
Teniendo en cuenta la clasificación de Park-Chiu, la evaluación de las muestras de tejido del intestino delgado reveló una diferencia significativa en el grupo 5: puntuación de la lesión I/R 1,8 ± 0,80 en el grupo de control frente a 0,0 ± 0,0 en el grupo 5 (p < 0,05). Las puntuaciones I/R de los otros grupos variaron entre 0,5 ± 0,51 y 2,2 ± 0,91. Como se muestra en la Fig 7, comparado con una muestra de intestino delgado sano obtenida de un animal del grupo 5, en la obtenida de un animal del grupo de control pudieron observarse fácilmente las vellosidades denudadas y los capilares dilatados. Los valores de amilasa y lipasa fueron más altos que el intervalo normal, pero no se identificaron diferencias estadísticamente significativas entre grupos. La concentración de amilasa de las muestras sanguíneas varió entre 146,6 ± 33,5 mg/dl (grupo 2 a los 30 min de isquemia) y 359,0 ± 20,7 mg/dl (grupo 5 antes de la laparotomía). Los valores de lipasa fueron de 138,0 ± 23,6 mg/dl (grupo 3 los 30 min de isquemia) y 299,0 ± 51,6 mg/dl (grupo 1 antes de la laparotomía).
Biopsias de intestino delgado obtenidas del grupo 5 (a) y el grupo de control (b). Se observan vellosidades denudadas y capilares dilatados (grado 4 de Park-Chiu) en b. (x40 HE): magnificación x 40, tinción con hematoxilina-eosina; (x100 HE): magnificación x 100, tinción con hematoxilina-eosina.
Investigamos las potenciales propiedades protectoras del resveratrol, un antioxidante polifenólico natural presente en la uva y el componente activo del vino tinto, que recientemente se ha estudiado como antioxidante eficaz6,9. En diversos modelos de isquemia/reperfusión, se ha señalado que esta fitoalexina inhibe la peroxidación lipídica y la adhesión de los leucocitos, elimina los radicales libres, produce efectos antiinflamatorios/antioxidantes y estimula la liberación de NO a partir del endotelio8. Esta sustancia manifiesta efectos vasculares a través de mecanismos tanto dependientes del endotelio (que pueden bloquearse con inhibidores de la NO sintasa) como no dependientes12 (no pueden bloquearse con estos inhibidores o una lesión endotelial). Se ha documentado que induce relajación del músculo liso vascular a través de la inhibición de la destrucción del adenosín monofosfato cíclico (AMPc) vasodilatador y del guanosín monofosfato cíclico (GMPc) y la activación de la guanilciclasa20,21. El NO puede actuar como mediador de la lesión tisular al igual que como un potente vasodilatador endógeno5. En condiciones fisiológicas, el NO mantiene el tono vascular, inhibe la agregación plaquetaria e impide la adhesión de los neutrófilos22. Sin embargo, en los estados fisiopatológicos, la producción excesiva de NO inducida por las citocinas desempeña un papel decisivo en la lesión tisular23.
En nuestro estudio experimental, investigamos los efectos beneficiosos potenciales del resveratrol en la lesión visceral de I/R. En primer lugar, investigamos en qué período –la isquemia o la reperfusión– fue más eficaz frente a dicha lesión. En segundo lugar, investigamos los resultados bioquímicos e histopatológicos cuando el resveratrol se combinó con L-NAME, un inhibidor de la NO sintasa. Este estudio es una continuación de los experimentos en los que nuestro grupo ha prestado atención a los efectos protectores de estos dos compuestos frente a la lesión I/R de la médula espinal. En un modelo experimental, estudiamos la protección de este órgano, y por lo que concierne a los parámetros histopatológicos y bioquímicos, obtuvimos los mejores resultados cuando administramos el resveratrol en el período de isquemia y el L-NAME en el de reperfusión13.
La disfunción multiorgánica, una complicación grave de la lesión visceral de I/R tras la corrección de un AATA, es una situación que amenaza la vida del paciente. Harward et al24 estudiaron a 29 pacientes sometidos a tratamiento de AATA, y, en su estudio, la tasa de disfunción multiorgánica fue del 34,5%. Durante la corrección de estos aneurismas, el corazón debe afrontar tanto el aumento súbito de la poscarga debida al clampaje de la aorta como la respuesta inflamatoria causada por la lesión visceral de I/R. Estos investigadores describieron una tasa de infarto de miocardio del 6,9%. En un estudio en el que Cambria et al25 evaluaron a 337 pacientes sometidos a corrección quirúrgica de AATA en un intervalo de 15 años, se describió una incidencia de complicaciones cardíacas del 13,8%. El resveratrol produce sus efectos cardioprotectores a través de la inhibición de la oxidación de las lipoproteínas de baja densidad, agregación plaquetaria, síntesis de las moléculas de adhesión, expresión del factor tisular procoagulante, y proliferación celular; estimulando la vasorrelajación y la regulación al alza de la NO sintasa y eliminando los radicales hidroxilo y peroxilo26,27. En nuestro estudio, la evaluación histopatológica de las muestras tisulares obtenidas del corazón no demostró diferencias estadísticamente significativas entre grupos por lo que respecta a la gravedad del edema, congestión e infiltración de leucocitos PMN. Comparado con el grupo de control, las puntuaciones de la lesión I/R fueron más bajas en todos los grupos de estudio, en especial en los grupos 1, 2, 3 y 6 (Fig. 2). Los efectos cardioprotectores del resveratrol26,27 y de la combinación resveratrol/L-NAME pudieron observarse en las muestras tisulares con parámetros histopatológicos de la lesión I/R, es decir, congestión miocárdica, edema e infiltración de leucocitos PMN, que fueron más pronunciados en el grupo de control pero no pudimos encontrar una diferencia estadísticamente significativa (Fig. 3). Al igual que en el corazón, aunque proximal al clampaje, la disfunción pulmonar tras corrección de un AATA se asocia estrechamente con la lesión de I/R y un síndrome de respuesta inflamatoria sistémica. La distensibilidad pulmonar disminuye y el trabajo respiratorio aumenta. La comprensión de la compleja fisiopatología de la lesión pulmonar de I/R sigue siendo incompleta28. A diferencia de otros órganos del cuerpo humano, el pulmón posee dos redes de circulación sanguínea con extensas conexiones anastomóticas y un total de tres posibles fuentes de oxigenación del tejido pulmonar, y esto ha dado lugar a extensas investigaciones que prestan atención al papel de los neutrófilos, ROL, y otros mediadores inflamatorios28. No obstante, estos mediadores sólo contribuyen parcialmente a la lesión pulmonar de I/R28,29 y empiezan a aparecer estudios sobre la compleja relación entre la lesión I/R y la apoptosis pulmonar, el sistema renina-angiotensina y la activación génica. En otro estudio, tras la corrección de un AATA se describió una incidencia de disfunción pulmonar del 44,8%: del 25% cuando el tiempo de clampaje fue < 40 min y del 59% cuando fue ≥ 40 min24. Así mismo, Cambria et al25 describieron una incidencia del 44%, y Rectenwald et al30 documentaron una tasa del 41%. Tras cirugía aórtica, se describió una respuesta inflamatoria sistémica caracterizada por un aumento constante de la concentración plasmática de citocinas (factor alfa de necrosis tumoral e interleucina 6); no obstante, no se observó una relación clara entre las concentraciones plasmáticas de citocinas y el desenlace clínico después de la intervención quirúrgica aórtica; por esta razón, siguen por dilucidar los efectos clínicos de la respuesta inflamatoria sistémica transitoria31. Teniendo en cuenta los parámetros histológicos de la lesión de I/R, grado de infiltración neumónica, edema y congestión, no pudimos identificar diferencias estadísticamente significativas entre grupos. Comparado con el grupo de control, las puntuaciones de lesión I/R fueron más bajas en todos los grupos de estudio, en especial el 1, 2 y 4 (Fig. 2). Aunque no alcanzaron significación, la infiltración neumónica, edema y congestión pulmonares fueron más evidentes en las muestras obtenidas de los animales del grupo de control (Fig. 4). No obstante, como se ha mencionado previamente, la lesión I/R del pulmón sigue siendo un enigma, y es posible que esta estrategia farmacológica no baste para resolver el problema por completo; además, se requiere una mejora con estudios experimentales adicionales.
Durante la corrección de un AATA, en el sistema gastrointestinal se produce un traumatismo tanto mecánico como isquémico. A pesar de la circulación colateral entre las arterias mesentéricas y vasos próximos, en casi todos los pacientes se descubrió una permeabilidad intestinal anormal32,33. Como consecuencia de la agresión isquémica, las enzimas de la cadena respiratoria mitocondrial y otras diversas enzimas, incluida la nicotinamida adenina dinucleótido fosfato (NADPH) oxidasa, xantina oxidasa (XO) y NO sintasa (NOS). La producción excesiva de NO a través de la NOS inducida contribuye a la fisiopatología de la lesión de I/R en el intestino delgado34,35. Naito et al36 observaron que la inflamación inducida por la reperfusión mesentérica en ratas dio lugar a estrés oxidativo y nitrosativo, caracterizado por una producción elevada de NO, aumento de la expresión de NOS inducible, y una expresión excesiva de peróxidos lipídicos. Además, en el período isquémico, la conversión de xantina deshidrogenasa a XO es más rápida en el tejido intestinal y la liberación exagerada de moléculas de adhesión induce la adhesión y migración de los leucocitos, lo que provoca una oclusión microcirculatoria37-39. La lesión I/R da lugar a la rotura de la barrera mucosa, translocación bacteriana y activación de las respuestas inflamatorias, lo que se traduce en una sepsis y disfunción multiorgánica40. Estos factores podrían explicar la razón de que el intestino responda de manera diferente de los otros tejidos a la inhibición de NO. Achouh et al39 estudiaron a 101 pacientes que se sometieron a corrección quirúrgica de AATA en un intervalo de 14 años y documentaron una incidencia de complicaciones gastrointestinales del 7%. Cambria et al25 describieron una incidencia de isquemia intestinal del 2%. En su estudio el 1,5% de todos los pacientes requirieron una nueva intervención para esta complicación. En el presente estudio, teniendo en cuenta la clasificación de Park-Chiu, la evaluación de las muestras tisulares de tejido intestinal reveló una diferencia significativa en el grupo 5 (Fig. 2). Estos resultados sugieren que la liberación de NO inducida por el resveratrol durante la isquemia produjo efectos antioxidantes sobre el tejido intestinal, mientras que, durante la reperfusión, la inhibición por L-NAME de los radicales libres característicos de un exceso de NO previno una lesión intestinal grave. Por lo que respecta a los valores de amilasa y lipasa no se observaron diferencias significativas entre grupos, pero en todos fueron más altos que el intervalo normal (Fig. 1). Adam et al41 describieron que en la rotura de aneurismas aórticos abdominales la concentración postoperatoria de amilasa pancreática fue significativamente más baja y sugirieron que la hiperamilasemia no se asocia a un peor desenlace después de cirugía aórtica. Los parámetros histopatológicos de la lesión hepática de I/R son necrosis, congestión y degeneración vacuolar42. La destrucción microcirculatoria que disminuye la perfusión hepática tiene lugar especialmente al término de las 48 h de reperfusión43. Puesto que obtuvimos las biopsias a las 24 h de la intervención, no encontramos una lesión grave en los tejidos hepáticos y, aunque en un animal del grupo 3 se detectó degeneración vacuolar (fig. 5), no identificamos diferencias estadísticamente significativas entre grupos en lo referente a los parámetros bioquímicos o histopatológicos (Figs. 1 y 2).
La insuficiencia renal aguda (IRA) es la complicación más frecuente de la cirugía aórtica44. Su incidencia descrita varía entre el 3 y el 34,5%24,25,30,44,45. Se ha mencionado que, a pesar del clampaje aórtico infrarrenal, el patrón del flujo renal se invierte hacia las neuronas corticales46. Con independencia de la posición del clampaje, la perfusión renal disminuye y la liberación de mediadores da lugar a vasoconstricción, redistribución del patrón de flujo y aumento de la permeabilidad vascular46. Los neutrófilos activados liberan citocinas, ROL, proteasas, mieloperoxidasa y otras enzimas, lo que agrava la lesión47,48. Durante la valoración de la lesión renal de I/R, el grado de lesión tubular, congestión y recuento de leucocitos PMN fue significativamente menor en los grupos 5 y 6 comparado con los otros (fig. 2). Al igual que en el intestino, una vez más, encontramos los efectos benéficos del tratamiento combinado.
Como limitación del presente estudio, no examinamos las muestras sanguíneas a las 24 h justo antes de sacrificar a los animales. El examen de los parámetros sanguíneos a las 24 h probablemente habría reflejado con más exactitud los cambios que observamos en los tejidos. Tampoco examinamos los marcadores de inflamación sistémica. Para investigar las diferencias será beneficioso aumentar la población de los grupos de estudio o efectuar estudios clínicos.
En conclusión, la disminución de las puntuaciones de I/R y las correspondientes muestras histopatológicas sugirieron un efecto protector del resveratrol sobre los órganos con una elevada capacidad de regeneración, como el riñón y el intestino delgado. En el presente estudio, no se observaron alteraciones significativas de los marcadores bioquímicos. Esto puede explicarse por el hecho de que los cambios histopatológicos que influyen en ellos se producen más precozmente. Con respecto a los otros órganos, también se identificaron algunas diferencias en los grupos de estudio pero no fueron estadísticamente significativas. En el intestino delgado, el resveratrol manifestó un efecto protector cuando se administró en el período de isquemia, a través de la inducción de la liberación de NO y sus propiedades antioxidantes, y la administración de L-NAME en el período de reperfusión inhibió los efectos tóxicos de un exceso de NO como en el grupo 5. Los períodos de administración de resveratrol y L-NAME no difirieron para el riñón, pero, una vez más, la estrategia de combinación atrajo la atención. Las acciones tanto NO-dependientes como independientes del resveratrol pueden mejorar la perfusión tisular a través de una vasorrelajación11. Los efectos del NO sobre los tejidos son motivo de controversia y su acción podría ser doble. En los diferentes períodos de la lesión I/R podría ser útil administrar diferentes mediadores farmacológicos ya que representan características distintas con y sin oxígeno. La combinación de resveratrol y L-NAME frente a la lesión de isquemia-reperfusión parece ser una opción eficaz en los estudios futuros.