La utilización de colgajos libres microvascularizados (CLM) se ha convertido en un método de reconstrucción frecuente en el área de cabeza y cuello debido a sus elevadas tasas de éxito y a sus mejores resultados funcionales. Presentamos nuestra experiencia en la reconstrucción de defectos complejos con CLM.
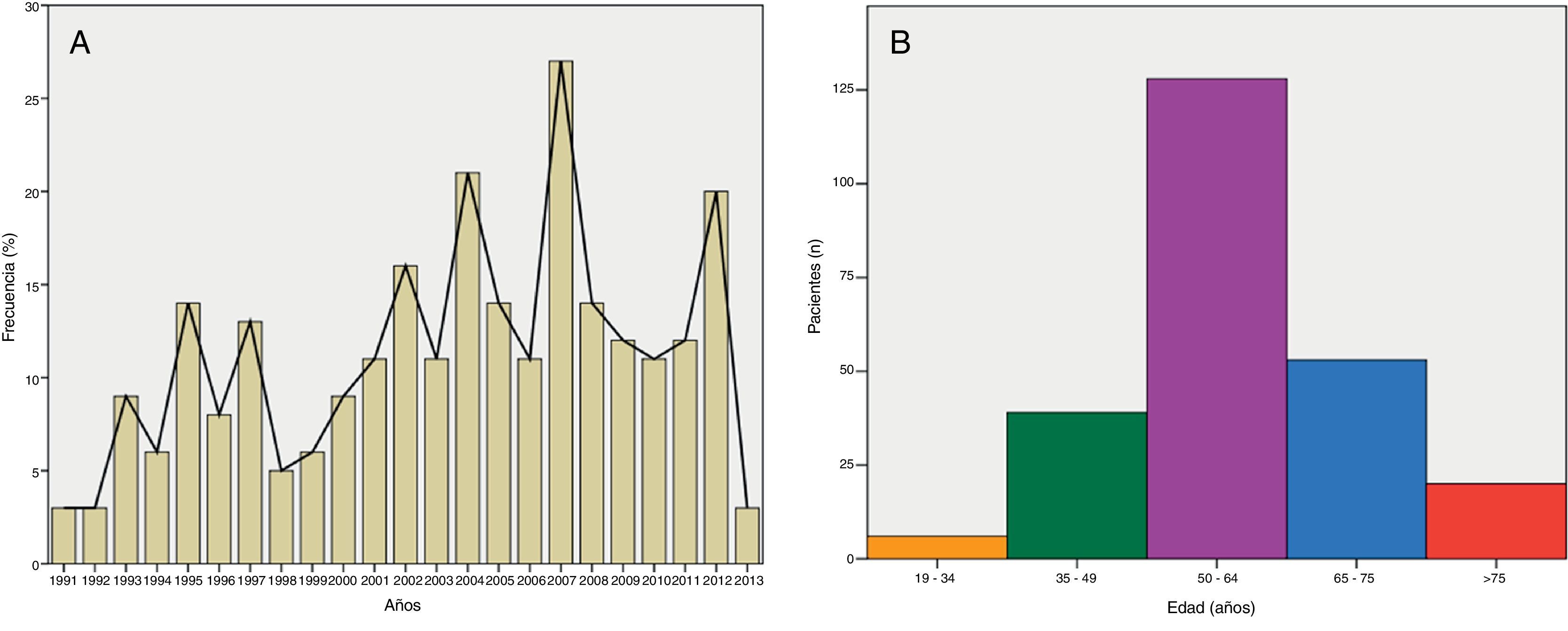
MétodosSe presenta una serie de 246 pacientes que requirieron una reconstrucción con CLM entre 1991 y 2013.
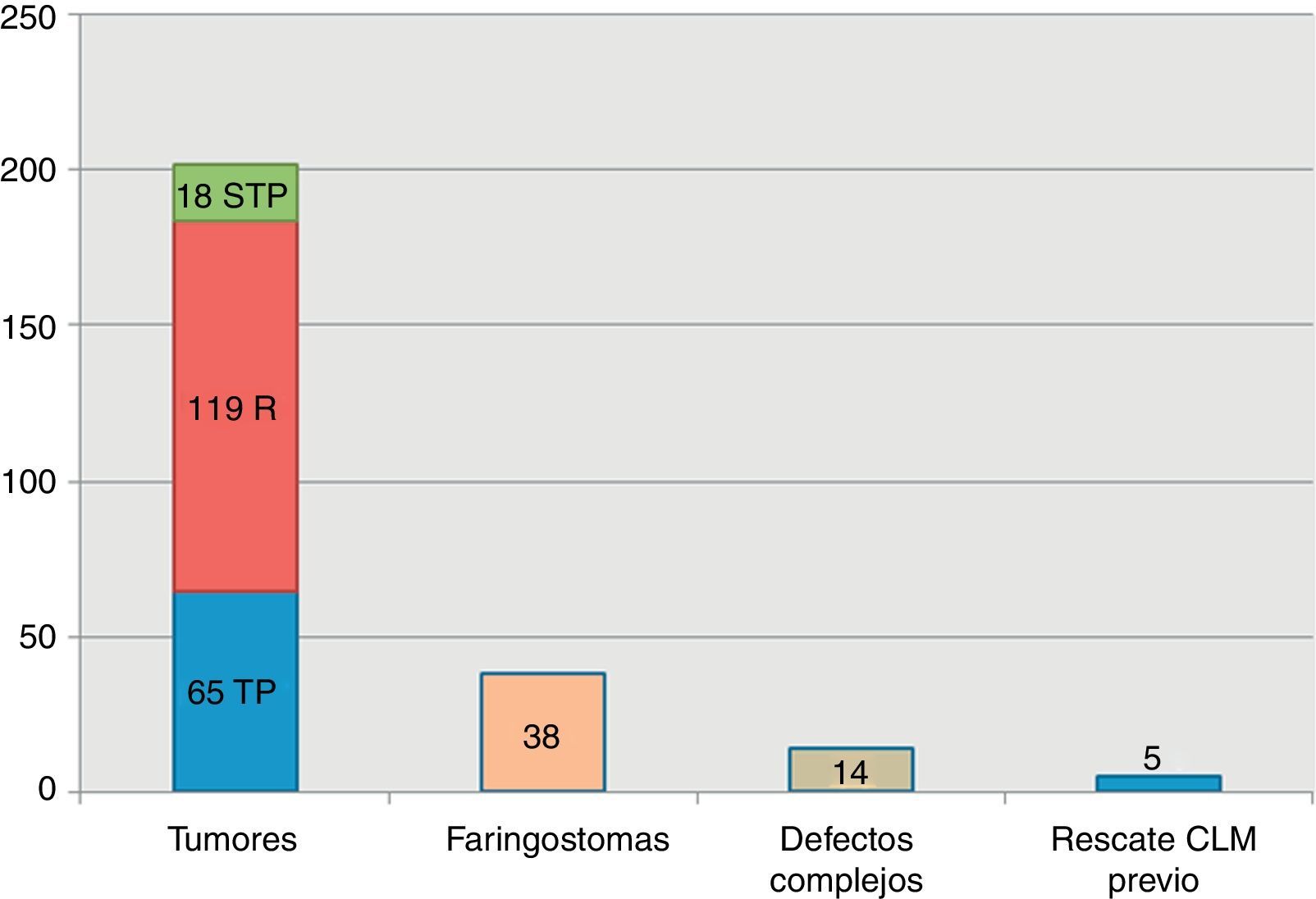
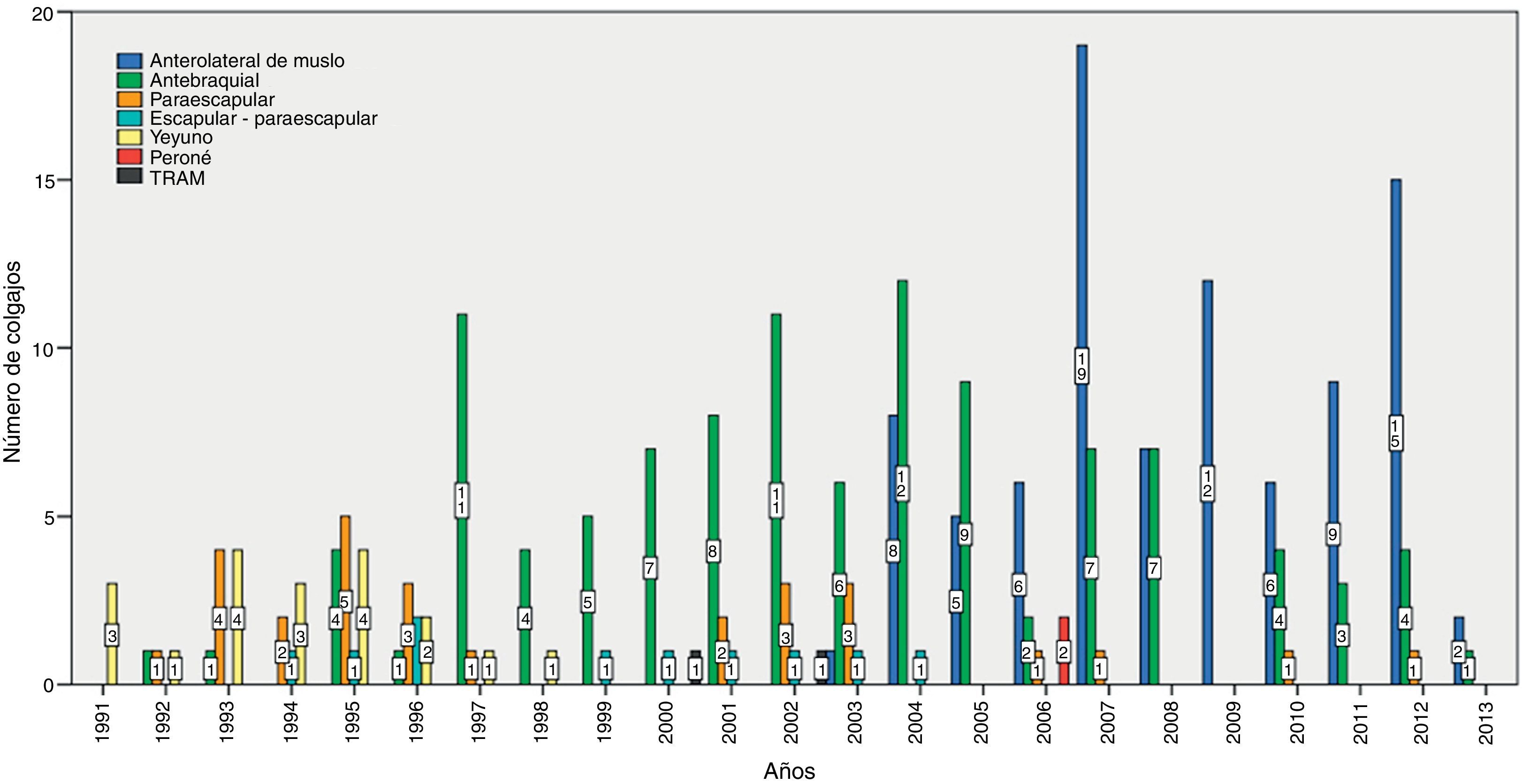
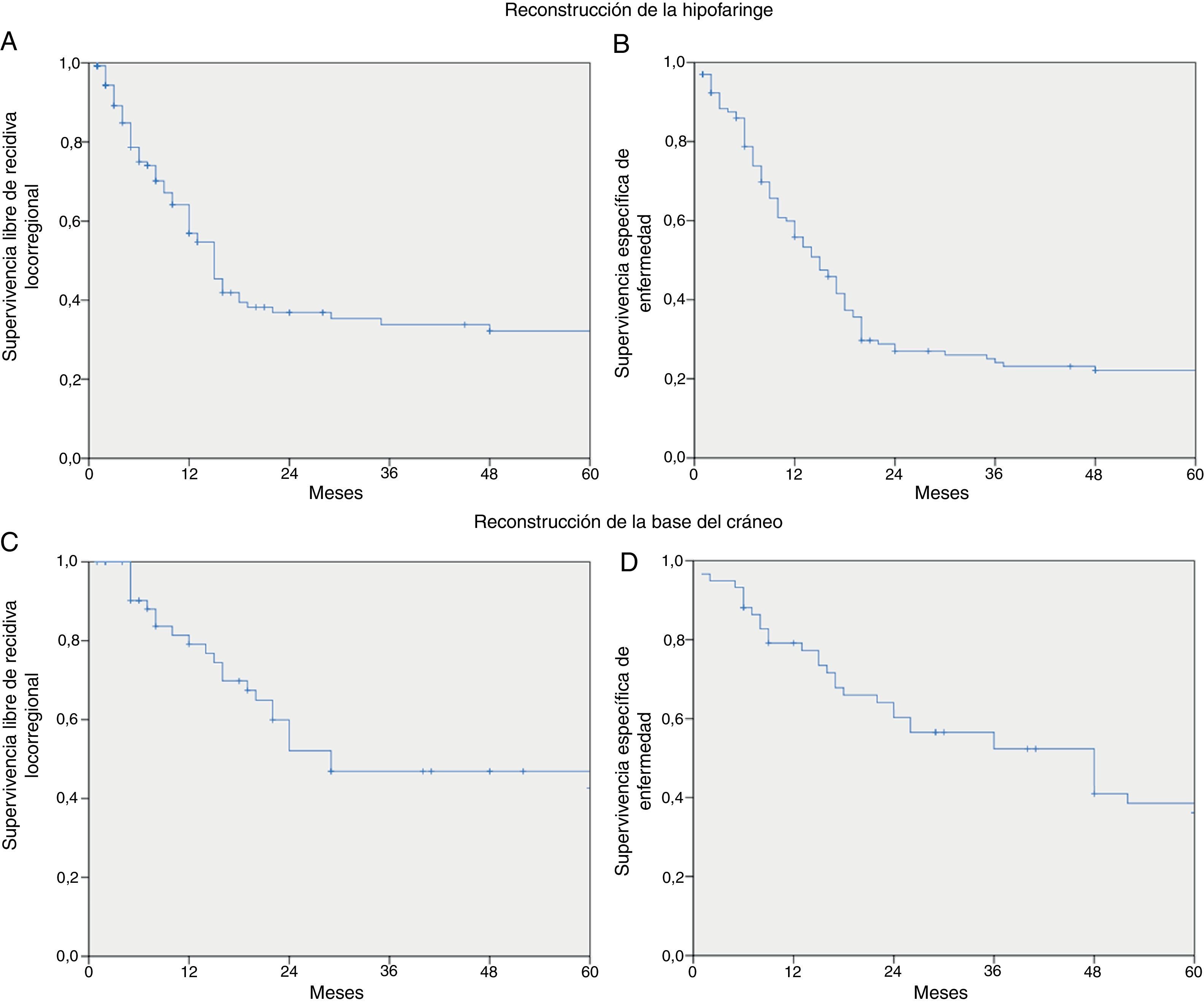
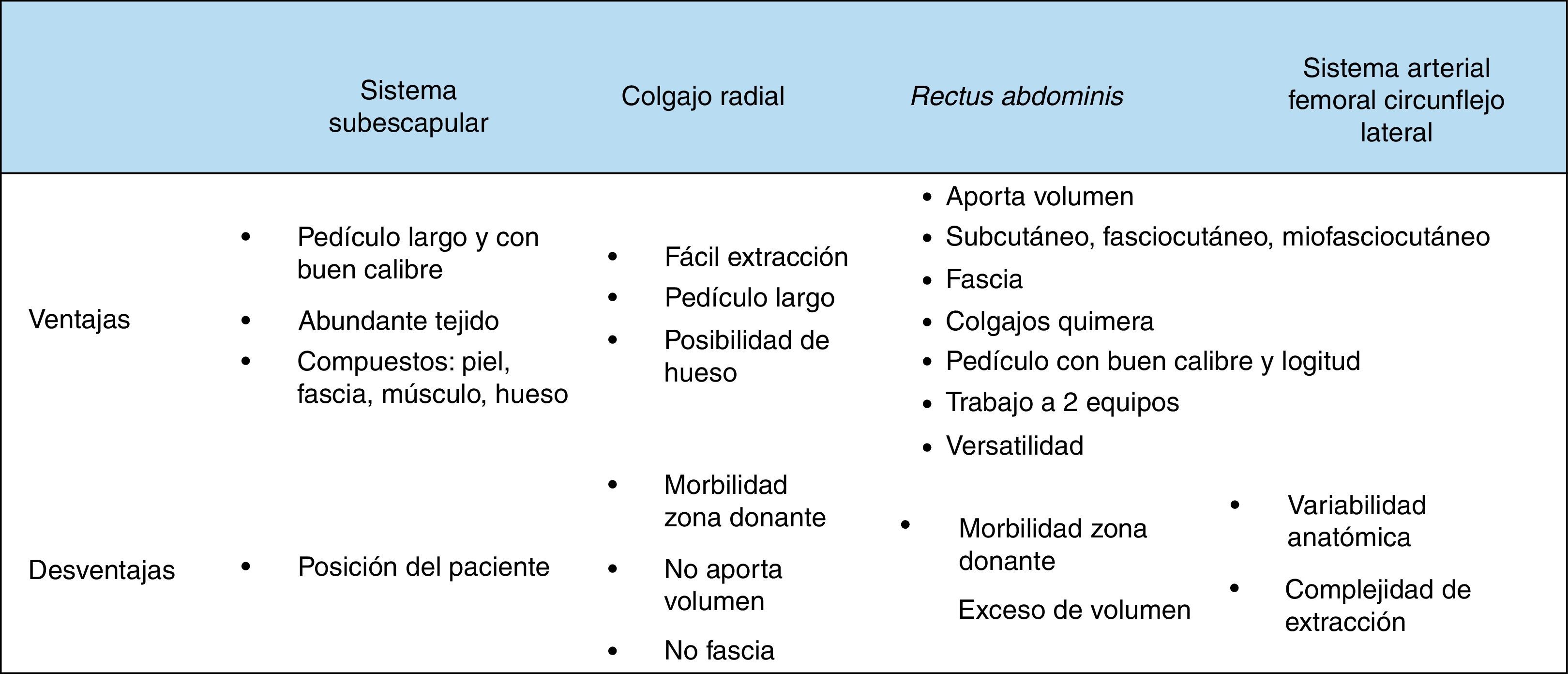
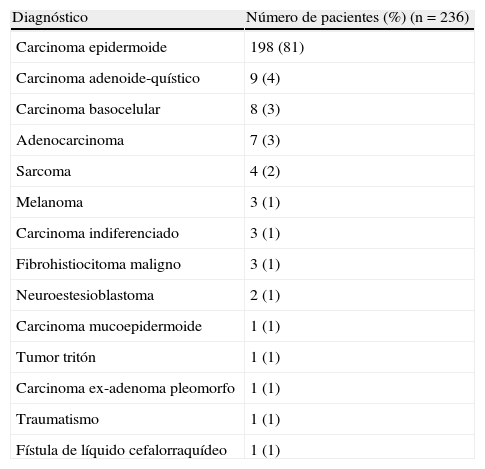
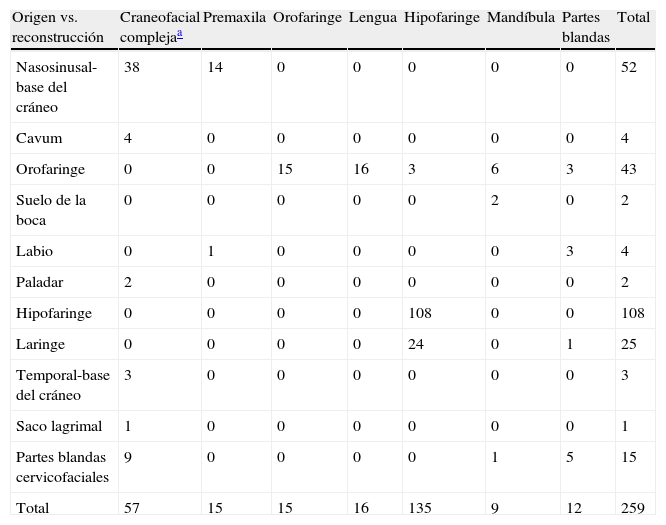
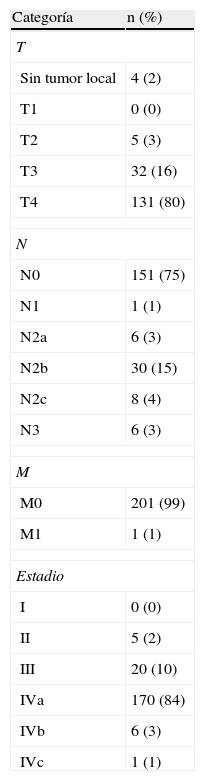
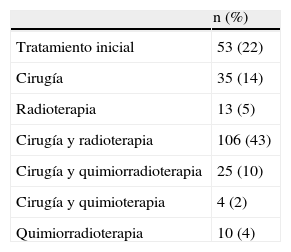
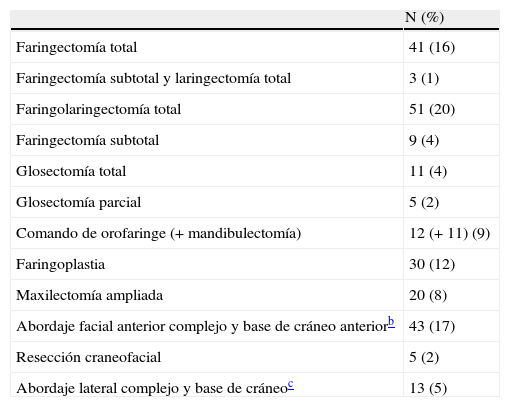
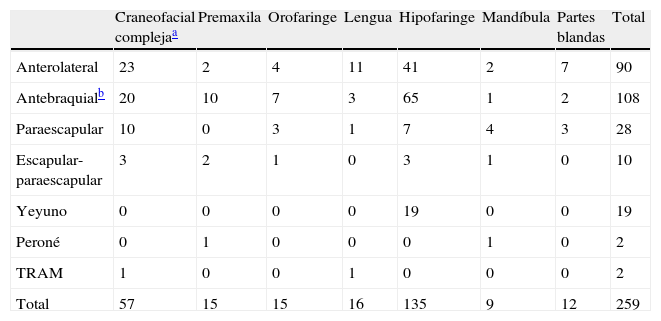
ResultadosSe realizaron 259 intervenciones en 246 pacientes. El motivo más frecuente para la realización de la cirugía fue la presencia de una recidiva tumoral (46%), seguido de la resección primaria del tumor (25%). Las regiones más frecuentemente reconstruidas fueron la hipofaringe (52%) y la región craneofacial (22%). Los CLM más usados fueron el colgajo antebraquial radial (41%) y el anterolateral de muslo (35%). El 92% de los CLM fue un éxito y la tasa de complicaciones fue del 20%.
ConclusionesLa utilización de CLM es un método fiable y útil para la reconstrucción de defectos complejos de cabeza y cuello, y su uso sigue siendo la modalidad reconstructiva de elección en estos casos.
The use of microvascular free flaps (MFF) has become a common method of head and neck reconstruction because of its high success rates and better functional results. We report our experience in reconstructing complex defects with MFF.
MethodsWe analysed a series of 246 patients that underwent reconstruction using MFF in our Department from 1991 to 2013.
ResultsThere were 259 interventions performed in 246 patients. The most common reason for surgery was tumour recurrence (46%), followed by primary tumour resection (25%). The hypopharynx (52%) and the craniofacial region (22%) were the most frequently reconstructed sites. The free flaps most commonly used were the radial forearm free flap (41%) and the anterolateral thigh free flap (35%). Overall success and complication rates of 92% and 20% respectively were reported.
ConclusionsThe microvascular free flap is a reliable and useful tool for reconstructing complex head and neck defects and continues to be the reconstructive modality of choice for these defects.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora