Os tumores neuroendócrinos distribuem‐se sobretudo pelo trato gastrointestinal e respiratório, podendo ser funcionantes ou não funcionantes. Os que são produtores de serotonina habitualmente causam uma síndrome carcinoide. Os de localização pancreática produtores de serotonina são raros.
Reporta‐se o caso de uma mulher de 23 anos, que foi ao serviço de urgência por um quadro com 3 meses de evolução de enfartamento, náuseas e vómitos, diarreia aquosa, perda ponderal e agravamento na véspera, com vómitos incoercíveis e dor abdominal após primeira toma de escitalopram. Imagiologicamente destacava‐se uma exuberante metastização hepática. A biópsia hepática revelou tratar‐se de tumor neuroendócrino. O estudo analítico reforçou a hipótese de uma síndrome carcinoide. A identificação do foco primário pancreático só foi conseguida mais tarde, após início de quimioterapia. Apesar da remoção tumoral cirúrgica e transplantação hepática, verificou‐se recidiva ganglionar pélvica, peritoneal e ovárica.
Este caso ilustra a apresentação exuberante de um tumor raro, para o qual ainda não existe terapêutica eficaz.
Neuroendocrine tumors are distributed primarily for gastrointestinal and respiratory tract and may produce several substances responsible for the clinical hypersecretion associated syndromes. Those who are producers of serotonin usually cause a carcinoid syndrome. The pancreatic localization of these serotonin producers is rare.
We report the case of a 23‐year‐old woman who went to the emergency department due to three months symptoms of fullness, nausea and vomiting, watery diarrhea, weight loss and worsening with uncontrollable vomiting and abdominal pain after first dose of escitalopram. Imaging stood out exuberant liver metastasis. Liver biopsy revealed a neuroendocrine tumor. The analytical study supported the hypothesis of a carcinoid syndrome. Identification of pancreatic primary focus was only achieved after initiation of chemotherapy. Despite surgical removal of the tumor and liver transplantation, it has been found pelvic lymph node, peritoneal and ovarian recurrence.
This case illustrates the exuberant presentation of a rare tumor, for which there is no effective therapy.
Os tumores neuroendócrinos (TNE) são um grupo heterogéneo de neoplasias que se desenvolvem a partir de células do sistema neuroendócrino difuso. Podem ser benignos ou malignos, agressivos ou indolentes, e dividem‐se em não funcionantes e funcionantes, estes quando surgem sintomas resultantes da hipersecreção hormonal1,2. Têm uma incidência anual de 3,8‐8,4 casos/100.000 habitantes e distribuem‐se, sobretudo, pelo trato gastrointestinal e respiratório3.
No caso dos TNE funcionantes do pâncreas, os mais frequentes são o gastrinoma e insulinoma. Outros, mais raros (<10%), produzem hormonas como: glucagina, hormona de crescimento, somatostatina, péptido intestinal vasoativo e serotonina. A maioria destes doentes (55‐90%) apresenta‐se inicialmente com metastização hepática (MH). A idade média de diagnóstico é entre os 50‐55 anos, com idêntica distribuição por género. A sobrevida a 5 anos deste grupo é de 29‐45%. Pode haver associação com condições familiares, sendo a mais frequente a neoplasias endócrinas múltiplas tipo 1 (MEN‐1)4.
O TNE do pâncreas produtor de serotonina, manifestando‐se como síndrome carcinoide, é muito raro (<1%). A síndrome carcinoide está mais frequentemente associada ao TNE de localização jejuno‐ileal4. A raridade da síndrome carcinoide, associada a este TNE do pâncreas com uma apresentação exuberante, torna pertinente a divulgação deste caso.
A sobreprodução hormonal, a multiplicidade de lesões hepáticas e o compromisso da função hepática agravam o prognóstico5.
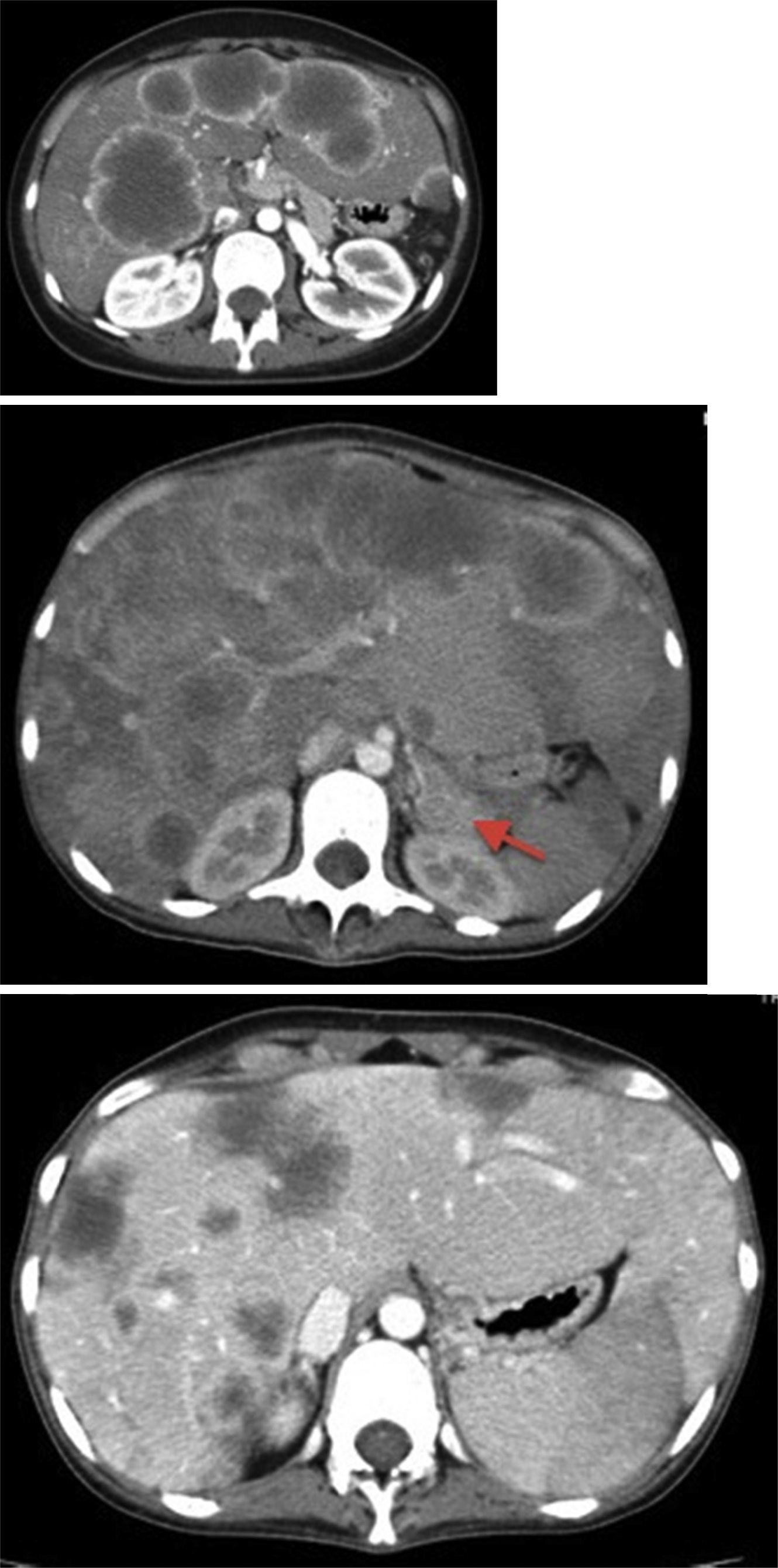
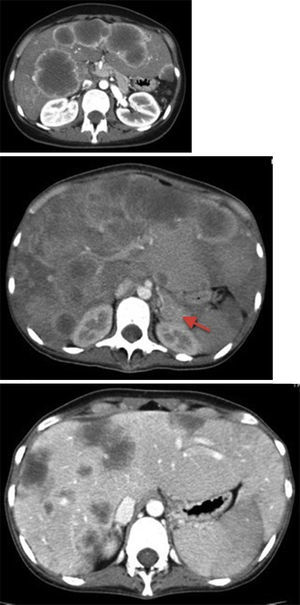
Descrição do casoDoente do género feminino, 23 anos, com antecedentes de carcinoma in situ do colo do útero, removido e sob controlo anual. Em saúde aparente até ao início de quadro, com 3 meses de evolução caracterizado por enfartamento, náuseas e vómitos ocasionais, a que se seguiu diarreia aquosa e perda ponderal de 10kg num mês. Por lombalgias esporádicas que relacionava com esforço foi diversas vezes medicada com anti‐inflamatórios. Por presunção de quadro psiquiátrico subjacente, foi medicada pelo médico assistente com escitalopram e, após toma de um comprimido de 10mg deste fármaco, desenvolveu um quadro de vómitos incoercíveis e dor abdominal que motivou a ida ao serviço de urgência. A ecografia abdominal mostrou múltiplos nódulos hepáticos, que a tomografia computorizada (TC) toracoabdominopélvica caracterizou como nódulos hipodensos, de diâmetro variável até 75mm, com anel de hipercaptação periférico, sugestivos de MH e sem evidência de lesões extra‐hepáticas – figura 1.
Imagens de TC toracoabdominopélvico com contraste endovenoso, mostrando metastização hepática exuberante – nódulos espontaneamente hipodensos, de diâmetro variável até 75mm, com anel de hipercaptação periférico sugestivo de necrose central. A seta aponta para o tumor primário a nível da cauda do pâncreas. A última imagem mostra a regressão das lesões em fase pós‐quimioterapia.
No internamento, teve um episódio de flushing facial e cervical, acompanhado de taquicardia, náuseas, vómitos e diarreia. Inicialmente, foi efetuado despiste do tumor primário e de outros focos de metastização, sendo que a endoscopia digestiva alta e baixa, a cintigrafia óssea, a ecografia mamária, ginecológica e tiroideia, a broncofibroscopia, a TC cranioencefálica e o ecocardiograma não apresentaram alterações relevantes. As serologias para VIH, VHB e VHC foram negativas.
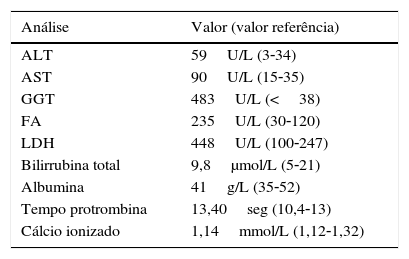
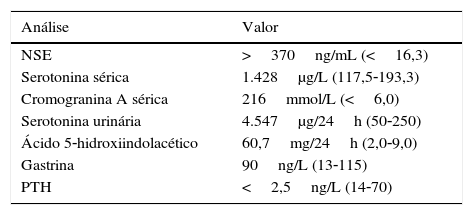
Na biópsia hepática estereotáxica observava‐se proliferação de características neoplásicas, em cordões, pequenos maciços ou pequenas estruturas esboçando lúmen central glanduliforme, constituída por células relativamente pouco volumosas, de núcleo fusiforme, de citoplasma ou de limites mal definidos, com positividade para a sinaptofisina e positividade ligeira e focal para a cromogranina, com Ki67 4%. Analiticamente destacava‐se um padrão de cito‐colestase, alteração da coagulação e níveis séricos elevados de enolase neuro‐específica (NSE) e cromogranina A, que reforçava a hipótese colocada pela biópsia – ver tabelas 1 e 2. Níveis urinários elevados de ácido 5‐hidroxiindolacético (5‐HIAA), associados a níveis elevados séricos e urinários de serotonina, confirmaram a hipótese de uma síndrome carcinoide. O octreoscan e o cintigrama com gálio/tomografia emissora de positrões (PET)‐68Ga‐SRP mostraram igualmente MH de TNE, sem evidência de lesões extra‐hepáticas. Foi excluída associação com MEN‐1 por apresentar níveis normais de PTH e TC cranioencefálica sem alterações visíveis a nível da hipófise.
Após transferência para o serviço de Oncologia Médica do Instituto Português de Oncologia de Coimbra, a doente iniciou tratamento com octreótido 20mg subcutâneo e interferon alfa 2b com controlo parcial dos sintomas hormonais, mas mantendo contínuo agravamento do padrão de citólise hepática. Iniciou tratamento com quimioterapia (capecitabina e temozolamida), com melhoria clínica e analítica significativa. Em TC pancreática foi identificada lesão de 23mm na porção caudal e metastização esplénica. Seis meses após o diagnóstico, face à satisfatória resposta terapêutica, à MH maciça, metastização esplénica e suspeita de neoplasia primária na cauda pancreática, a doente foi submetida a transplante hepático ortotópico isogrupal, pancreatectomia corpo‐caudal e esplenectomia. A histologia veio confirmar TNE da cauda do pâncreas com 27×15mm, com células tumorais que co‐expressam cromogranina A e sinaptofisina e Ki67<2%, com infiltração local e metástases hepáticas maciças. Manteve imunossupressão de indução com basiliximab e metilprednisolona; posteriormente, com micofenolato de mofetil e tacrolimus e, finalmente, com everolimus.
Treze meses após o transplante hepático, surgem sinais de metastização ganglionar, peritoneal e ovárica. Retomou o mesmo esquema de quimioterapia com nova melhoria clínica e analítica, encontrando‐se atualmente assintomática.
ComentárioAs manifestações habituais da síndrome carcinoide provocadas pela hipersecreção de serotonina são diarreia secretora (60‐80%), flushing (60‐85%), pieira intermitente (<10%) e fibrose cardíaca direita (até 20% casos)7. Mas, tal como neste caso, estas manifestações surgem em fase tardia, associadas à MH por esta condicionar uma diminuição da clearance hepática de serotonina7. Neste caso houve um fator precipitante para as manifestações iniciais: a inibição seletiva da recaptação da serotonina pelo escitalopram. A fonte mais frequente de MH é o intestino delgado (80‐90%), seguida pelo pâncreas (60‐70%)8. Neste sentido, foi importante o despiste do tumor primário a nível intestinal. O ecocardiograma ajudou a excluir a presença de coração carcinoide, secundário aos níveis elevados de serotonina.
O diagnóstico destes tumores implica um estudo patológico compatível, suportado pela imuno‐histoquímica com expressão das respetivas hormonas, ao qual se poderá associar a presença de uma síndrome funcional resultante da hipersecreção hormonal e localização do tumor primário. A localização pancreática não apresenta características histológicas específicas que a distinga das restantes4.
Considerando que o achado inicial foi a MH, o estudo começou por TC toracoabdominopélvica e biópsia estereotáxica da lesão tumoral hepática, o que está de acordo com a literatura8. O restante estudo de localização (endoscopia digestiva alta e baixa, a ecografia mamária, ginecológica e tiroideia, e a broncofibroscopia) serviu para despiste de focos primários, enquanto a cintigrafia óssea e a TC cranioencefálica serviram para despiste de outras metástases. O octreoscan é um dos exames recomendados para identificação do foco primário4, sendo que neste caso permitiu apenas reforçar a informação prévia, apesar de ter uma sensibilidade de 90% e especificidade de 80% para TNE pancreáticos6.
O uso do cintigrama com gálio/PET‐68Ga‐SRP não trouxe informação acrescida, apesar de ser recomendado sempre que os outros métodos de diagnóstico, incluindo o octreoscan, tenham falhado na identificação do foco primário6. Esta falha na deteção do foco primário a nível pancreático com octreoscan e PET poderá ser explicada pela MH maciça que incluía o lobo esquerdo, limitando a destrinça entre o tecido pancreático e o tecido hepático.
O diagnóstico histológico deve implicar a caracterização histológica e a marcação imuno‐histoquímica com cromogranina A e sinaptofisina, bem como a avaliação do índex mitótico usando a contagem mitótica ou o índex Ki‐67 (marca todas as fases do ciclo celular, exceto a fase G0), para ser estadiado de acordo com a nova classificação da Organização Mundial de Saúde4,6, como aconteceu neste caso. A biópsia hepática estereotáxica foi compatível com TNE grau 2 (Ki67 4%).
O estudo analítico específico requer, no mínimo, o doseamento de cromogranina A sérica; o 5‐HIAA urinário em 24h deve ser doseado sempre que haja suspeita de síndrome carcinoide, com sensibilidade 100% e especificidade 85‐90%6. Os doseamentos séricos e urinários de serotonina são menos sensíveis e específicos, embora neste caso estivessem também muito elevados. O padrão de cito‐colestase associada à alteração da coagulação vem comprovar o compromisso hepático que a doente apresentava.
O uso de terapêutica médica com análogos da somatostatina‐octreótido‐e interferão‐α mostrou ser eficaz no controlo sintomático deste grupo de doentes. Esta ação aparenta estar relacionada com um efeito direto a nível dos recetores dos órgãos‐alvo4. O octreótido mostrou também efeito no controlo do crescimento tumoral. Regimes de quimioterapia mais recentes, como o usado (capecitabina com temozolamida), reportaram taxas de resposta superiores a 40%4. Embora não comparados diretamente com os esquemas clássicos à base da estreptozocina, a associação usada é melhor tolerada. Novas terapêuticas como o sunitinib9 e o everolimus10 mostraram, até agora, que podem promover o aumento da sobrevivência livre de progressão, não sendo ainda evidente que possam aumentar a sobrevivência global. A utilização de análogos da somatostatina marcados com peptídeos radionuclídeos (177Lu DOTATOC, 90Y DOTATATE) são ainda opções promissoras11.
A terapêutica cirúrgica deve ser ambicionada sempre que possível, mesmo na presença de metástases, desde que seja ressecável pelo menos 90% do tumor visível e após controlo sintomático com terapêutica médica4. A transplantação hepática perante MH maciça, como no caso em questão, é uma opção terapêutica sobretudo para os TNE não funcionantes6. Foi assumida esta opção para melhor controlo sintomático e considerando que uma grande extensão do fígado se encontrava invadida.
A presença de recidiva tumoral apesar da quimioterapia e terapêutica cirúrgica, incluindo transplantação hepática, vem mostrar a dificuldade no tratamento destes tumores.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.