Este artículo revisa las intervenciones terapéuticas no farmacológicas que pueden ser implementadas para prevenir el desarrollo de hipertensión arterial (HTA), contribuir a su tratamiento y ayudar a disminuir las complicaciones cardiovasculares que pueden presentarse en pacientes que tienen el diagnóstico de HTA, señalándose la evidencia que sustenta su utilidad. Se especifica qué pacientes hipertensos son candidatos a una prueba de tratamiento no farmacológico inicial y qué pacientes requieren, además, tratamiento farmacológico desde el diagnóstico. Se analizan los beneficios de la dieta DASH (dietary approaches to stop hypertension) y de la dieta mediterránea. Se expone la controversia referente a la restricción moderada de sodio en la dieta a nivel poblacional y en sujetos que tienen HTA, discutiéndose el tópico de la sensibilidad al sodio y su beneficio potenciador sobre la terapia farmacológica. Se describe el efecto positivo de una dieta rica en potasio y la cautela que ha de tenerse respecto de la ingesta exagerada de calcio. Se analiza el efecto beneficioso de lograr un peso corporal adecuado y del ejercicio físico regular. Se abordan los efectos adversos del tabaquismo y del consumo exagerado de alcohol. Por último, se mencionan los efectos neutros del consumo de café y té.
This article reviews the non-pharmacological therapeutic interventions that can be implemented to prevent the development of hypertension (HTN), contribute to its treatment and help reduce cardiovascular complications that may occur in patients diagnosed with HTN, addressing the evidence that support them. It is specified which hypertensive patients are candidates for an initial non-pharmacological treatment trial and which patients also require pharmacological treatment since diagnosis. The benefits of the DASH diet (dietary approaches to stop hypertension) and the Mediterranean diet are analyzed. The controversy about the usefulness of moderate sodium restriction in the diet at the population level and in subjects with hypertension is discussed, as well as the topic of sodium sensitivity and its enhancement benefit on pharmacological therapy. Furthermore, the positive effect of a diet rich in potassium and the caution that should be taken with regard to the exaggerated intake of calcium. The beneficial effects of achieving an adequate body weight and of regular physical exercise are established. It addresses the adverse effects of smoking and excessive consumption of alcohol. Finally, the neutral effects of coffee and tea consumption are mentioned.
Las intervenciones terapéuticas no farmacológicas (ITNF) para tratar la hipertensión arterial (HTA) suelen ser difíciles de implementar. Esto obedece a que implican cambios de hábitos y de conductas que, generalmente, están profundamente enraizados en los individuos de una determinada comunidad o sociedad. Aún más difícil, es mantener estos cambios de hábitos y conductas a través del tiempo. En ocasiones, ciertas estructuras de la propia sociedad o comunidad son las que se resisten a los cambios y a su permanencia en el tiempo (1,2).
Este artículo de opinión experta intenta dar respuesta a dos interrogantes, a saber:
- –
¿Cuál es el rol de las ITNF en el tratamiento de la HTA ya establecida?
- –
Y, específicamente, ¿cuáles son estas intervenciones?
Para responder estas preguntas se analizaron algunos artículos de la literatura, están en las referencias bibliográficas de libros de texto clásicos y en otras revisiones que se han publicado recientemente sobre la materia.
Dentro de las ITNF se tratará, con mayor extensión, la restricción del consumo de sodio dietario. Adicionalmente, se abordará el rol que tienen o pueden tener las dietas DASH (Dietary Approaches to Stop Hypertension) y mediterránea, el aporte dietario de ciertos iones, la optimización del peso corporal, el ejercicio físico, el tabaquismo, el alcohol y las bebidas que contienen cafeína.
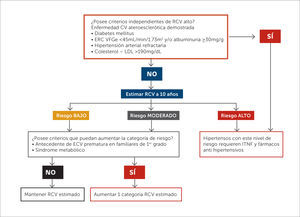
Si bien el punto de énfasis de este artículo está puesto en el valor terapéutico de la ITNF en quienes ya tienen un diagnóstico de HTA, ha de reconocerse que las ITNF poseen un papel relevante tanto para disminuir la probabilidad de llegar a desarrollar una HTA como en la reducción del riesgo cardiovascular global, que va incluso más allá de lo explicable sólo por el descenso de las cifras tensionales (3) (Figura 1).
Algoritmo para la estimación del riesgo cardiovascular global
Modificado de guía MINSAL “Enfoque de riesgo para la prevención de enfermedades cardiovasculares. Consenso 2014”.
RCV: Riesgo cardiovascular. ERC: Enfermedad renal crónica. VGGe: Velocidad de filtración glomerular estimada. ECV: Enfermedad cardiovascular. ITNF: Intervenciones terapéuticas no farmacológicas.
Desde una perspectiva histórica, uno de los primeros tratamientos relativamente efectivos para la HTA fue la denominada «dieta de arroz». Esta fue concebida y promovida por Walter Kempner -médico de origen judío-alemán-, quien poseía una sólida formación en metabolismo celular, pues había sido discípulo en Berlín del fisiólogo Otto Warburg, galardonado con el premio Nobel de Medicina en 1931. Sin embargo, Kempmer debió exiliarse en los Estados Unidos (Universidad de Duke, Durham, North Carolina) debido al hostigamiento del que fue víctima por parte del régimen nazi. Sus investigaciones en relación a la «dieta de arroz» las realizó durante la década de los años 40 del siglo pasado. La dieta se caracterizaba por un contenido de sodio extremadamente bajo: sólo 230mg/día (0.5g de sal/día). Se componía esencialmente de arroz blanco y frutas. Esto implica que su principal composición eran hidratos de carbono complejos, sólo un 5% de proteínas y un 3% de grasas. La dieta, aunque controvertida, alcanzó cierta fama en su época ya que logró estabilizar a algunos pacientes con HTA maligna, insuficiencia renal avanzada e insuficiencia cardíaca grave (4).
Sin embargo, una dieta tan estricta es extremadamente difícil de mantener en el mediano y largo plazo. El surgimiento de diuréticos efectivos la hizo, además, menos imprescindible para la supervivencia de los enfermos y, por último, existe evidencia de que una dieta tan escasa en sodio puede tener efectos adversos. Así, ingerir sólo 700mg de sodio al día (1.75g de sal/día) determina una elevación de los niveles plasmáticos de renina, aldosterona y triglicéridos (5,6).
Por lo anterior, lo recomendado para personas que tienen el diagnóstico de HTA, es una restricción moderada de la ingesta de sodio. Esto significa ingerir alrededor de 2.4g de sodio al día, lo que equivale a unos 6g de sal, aproximadamente (7).Alcanzar este objetivo y mantenerlo en el tiempo no debería ser tan difícil como podría parecer a primera vista, particularmente si se considera que la mayor parte del sodio que se ingiere en la dieta diariamente proviene de alimentos procesados industrialmente (8). Es decir, ningún alimento en su estado natural es rico en sodio. Se estima que aproximadamente el 75% del sodio ingerido proviene de alimentos procesados (8). De modo que bastaría con procurar evitar, la mayor parte del tiempo, los alimentos procesados y no adicionar innecesariamente sal a los alimentos una vez servidos para lograr una restricción moderada del consumo de sodio en la dieta.
Un estudio publicado el año pasado (9) ha generado algunas dudas adicionales, sugiriendo que la restricción de sodio dietario, incluso no estricta, podría producir efectos deletéreos. En este trabajo se analizó la excreción urinaria de sodio (como indicador de la ingesta de éste) en más de 130000 sujetos de todo el mundo. Se observó que una excreción urinaria de sodio baja (<3g/día, equivalente a <7g de sal) se asoció a una mayor mortalidad y a más eventos cardiovasculares, tanto en sujetos sin HTA como también en aquellos con esta condición clínica. Por otra parte, se apreció que individuos con una alta ingesta de sodio (>6g/día, equivalente a >15g de sal/día) presentaban más eventos cardiovasculares sólo si eran hipertensos; en aquellos sin hipertensión no se observaron eventos adversos durante el período de seguimiento que se prolongó durante más de 4 años. De notar, el aumento de la presión arterial en aquellos sujetos que presentaban un alto consumo de sal fue significativamente mayor en los hipertensos que en quienes no lo eran.
Los resultados de este estudio han generado controversia en la comunidad científica y como los mismos autores indican, sólo un estudio caso-control con asignación aleatoria de los pacientes podría zanjar la polémica. En el intertanto, sugerimos no efectuar restricciones de ingesta de sodio a menos de 3g/día en la población general. La restricción de sodio moderada sólo la recomendamos, en el momento actual, a pacientes que tienen el diagnóstico de HTA, particularmente si su dieta incluye una alta ingesta de sal.
Sensibilidad al sodioLa sensibilidad de la presión arterial al sodio, entre diferentes individuos, es diversa.
Desde un punto de vista fisiopatológico, exhiben una mayor sensibilidad al sodio aquellos sujetos que presentan niveles plasmáticos de renina bajos (10). Específicamente, la presión arterial muestra una mayor sensibilidad al sodio en personas de raza negra, en sujetos de edad avanzada (11) y en aquellos que han tenido un bajo peso al nacer (12) (Tabla 1).
La sensibilidad al sodio puede tener una base genética (13).
En la práctica, no se recomienda evaluar la sensibilidad al sodio de un paciente -que tiene el diagnóstico de hipertensión arterial-, antes de recomendar una restricción moderada de la ingesta de sodio. Si bien el descenso de la presión arterial será mayor en aquellos que son sensibles al sodio, quienes no lo son también pueden obtener cierto grado de beneficio; además, las pruebas para determinar la sensibilidad al sodio pueden no ser del todo reproducibles (14).
Restricción moderada del sodio y fármacos antihipertensivosUna dieta con una reducción moderada de su contenido en sodio es de valor en pacientes que están sometidos a tratamiento farmacológico. Se ha comprobado que todos los medicamentos utilizados en el tratamiento de la HTA ven su efectividad aumentada en el contexto de una dieta moderadamente hiposódica. Para ilustrar este punto, se estudiaron pacientes con daño renal que se encontraban en tratamiento con un inhibidor de la enzima convertidora de angiotensina (lisinopril 40mg/día). Se demostró que reducir la ingesta de sodio moderadamente, determinó una mayor reducción de la presión arterial y de la proteinuria que la adición de un bloqueador del receptor de la angiotensina II (valsartan hasta 320mg/día) (15).
Por otra parte, en pacientes hipertensos en tratamiento con diuréticos, una restricción moderada de la ingesta de sodio dietario disminuye la incidencia de hipokalemia inducida por estos medicamentos en comparación a pacientes en tratamiento con diuréticos pero que consumen una dieta rica en sodio. Esto ocurre porque en el túbulo distal existe una región que intercambia sodio por potasio (reabsorbe sodio y secreta al lumen tubular potasio). Cuando se está recibiendo un diurético, p. ej. una tiazida, en circunstancias de una dieta rica en sodio, el diurético inhibe la reabsorción de sodio. Esto determina que arribe una gran cantidad de sodio al nefrón distal que, en presencia de cierto grado de hipovolemia causada por el diurético, produce una activación del eje renina angiotensina aldosterona que hace que se reabsorba mucho sodio intercambiado por potasio que se secreta al lumen tubular; esto determinará hipokalemia. Este efecto se ve notablemente atenuado si el paciente ingiere una dieta con restricción moderada del sodio (16).
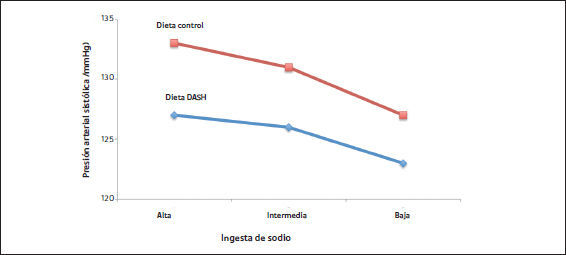
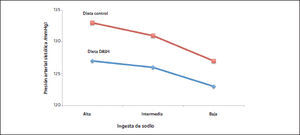
Una dieta que disminuye la presión arterialUn estudio clásico que demostró el beneficio potencial de las intervenciones terapéuticas no farmacológicas en HTA fue publicado por Sacks et al en 2001 (17). En este ensayo clínico los pacientes fueron asignados al azar a recibir una dieta norteamericana típica (grupo control) y la denominada dieta DASH (Dietary Approaches to Stop Hypertension). Además, los participantes del estudio fueron asignados, aleatoriamente, a recibir en la dieta que les correspondiera, tres niveles distintos de ingesta de sodio (alto, 3500mg de sodio/día que equivale a unos 9g de sal/día; intermedio, 2300mg de sodio/día que equivale a unos 6g de sal/día; y bajo, 1150mg de sodio/día que equivale a unos 3g de sal/día). Se observó una disminución significativa de la presión arterial sistólica con la dieta DASH versus la dieta control en cada nivel de ingesta de sal (Figura 2). Es decir, la dieta DASH determinó una disminución de la presión arterial con independencia de la ingesta de sodio. Sin embargo, si se ingería, además, menos sodio, la presión arterial descendía aún más. Así, si se compara la presión arterial sistólica promedio en el grupo con dieta control y alta ingesta de sodio con aquellos recibiendo la dieta DASH y baja ingesta de sodio, la presión arterial sistólica fue 8.9mmHg menor en los últimos (17) (Tabla 2).
Características de la composición alimentaria de la Dieta DASH (Dietary Approaches to Stop Hypertension)
| Frutas |
| 4 – 5 porciones/día (1 porción = 1 fruta mediana) |
| Verduras |
| 4 – 5 porciones/día (1 porción = 1 taza de lechuga) |
| Lácteos bajos en grasas |
| 2 – 3 porciones/día (1 porción = 1 taza de leche o de yogur) |
| Granos integrales |
| 6 – 8 porciones/día (1 porción = 1 rebanada de pan integral) |
| Carnes magras, aves y pescados |
| ≤2porciones/día (1 porción = 90 g) |
| Legumbres, nueces y semillas |
| 4 – 5 porciones/semana (1 porción = ½ taza) |
| Grasas y aceites vegetales |
| 2 – 3 porciones/día (1 porción = 1 cuchara de té) |
| Dulces y azúcar |
| ≤5/semana (1 porción = 1 cucharada de azúcar o mermelada) |
La dieta mediterránea, probablemente más cercana a la idiosincrasia alimentaria de quienes habitan América Latina, ha demostrado disminuir la incidencia de eventos cardiovasculares en un ensayo clínico con asignación aleatoria, que incorporó exclusivamente pacientes de alto riesgo cardiovascular en un contexto de prevención primaria. Si bien el estudio no fue diseñado para evaluar específicamente un efecto beneficioso sobre la presión arterial, sí plantea la posibilidad de que este tipo de dieta sea útil para este fin. Especialmente porque en el estudio se mostró una disminución notable en el número de ataques cerebro vasculares entre quienes fueron asignados a la dieta mediterránea versus los controles (18). Más estudios son necesarios a este respecto.
Suplementación de potasioUna dieta rica en potasio puede tener el efecto favorable de disminuir la presión arterial. Así, una dieta abundante en potasio puede reducir la presión arterial en 3.5/2.0mmHg en la población general. Es interesante que este efecto es aún más acentuado en hipertensos, con reducciones de la presión arterial del orden de 5.3/3.1mmHg (19).
Hay evidencias, además, de que un aumento del consumo de potasio dietario del orden de unos 1600mg/día adicionales se asocia a una significativa disminución en el riesgo de sufrir una ataque cerebro vascular (20% menos) (20).
A nivel poblacional lo recomendable sería disminuir el consumo de alimentos procesados industrialmente -los cuales son ricos en sodio y pobres en potasio-, y reemplazarlos por alimentos naturales, los cuales poseen una relación inversa de sodio/potasio, es decir, son abundantes en potasio y escasos en sodio (8). Las frutas y verduras son excelentes fuentes de potasio (21).
Los suplementos farmacológicos de potasio están indicados, principalmente, en la hipokalemia secundaria al uso de diuréticos. Su utilización en hipertensos que tienen un potasio plasmático normal no es recomendable por cuanto son caros y pueden ser, además, eventualmente causantes de hiperkalemia al interactuar con algunos de los fármacos que se utilizan frecuentemente en el tratamiento de la HTA (p. ej., inhibidores de la enzima de conversión de angiotensina II, β – bloqueadores o antagonistas del receptor de aldosterona).
Peso corporalEl sobrepeso y la obesidad -definidos como un índice de masa corporal igual o mayor a 25 y 30, respectivamente- son condiciones que favorecen la HTA. El aumento de la presión arterial se relaciona especialmente con el acúmulo de grasa visceral (abdominal), frecuentemente en el contexto del denominado síndrome metabólico (22,23) (ver Tabla 3). Factores humorales del tejido adiposo abdominal determinan la fosforilación de enzimas de la clase de las proteinkinasas las que interactúan con receptores de mineracolocorticoides, glucocorticoides y de angiotensina II promoviendo inflamación y fibrosis vascular. Esto explica, en parte, el mecanismo de la interacción entre el tejido adiposo, el sistema renina-angiotensina-aldosterona y las células musculares lisas de los vasos sanguíneos (24). De ahí la importancia de medir la circunferencia abdominal en los pacientes que están siendo evaluados para prevenir o tratar la HTA.
Características diagnósticas de Síndrome Metabólico
| Para el diagnóstico se requieren 3 o más de las siguientes características: |
| 1. Circunferencia abdominal ≥90 cm en varones o ≥80 cm en mujeres |
| 2. Triglicéridos ≥150 mg/dL |
| 3. Colesterol–HDL<40 mg/dL en varones o <50 mg/dL en mujeres |
| 4. Presión arterial ≥130/85 mm Hg |
| 5. Glicemia en ayunas ≥100 mg/dL (incluyendo diabetes) |
De acuerdo a la Encuesta Nacional de Salud 2010, la prevalencia de sobrepeso en la población chilena alcanza un 39% y la de obesidad un 25%. Las acciones terapéuticas deben implementarse tempranamente dado que el sobrepeso y la obesidad comienzan a observarse ya desde la infancia y adolescencia (25).
Ejercicio físicoEl ejercicio físico regular disminuye la probabilidad de hacerse hipertenso, incluso en personas con antecedentes familiares de HTA. Además, mejora el control de la presión arterial en aquellos que ya tienen HTA (26).
Por otra parte, el ejercicio físico regular contribuye a disminuir la mortalidad cardiovascular y la mortalidad por todas las causas, incluso cuando se efectúan sólo pequeñas cantidades de ejercicio (15 minutos al día) (27).
Las personas que han sido sedentarias durante años, que poseen factores de riesgo cardiovascular y que empiezan a hacer ejercicio físico intenso o extenuante en forma brusca, pueden presentar como complicación un síndrome coronario agudo. Por esto, se les debe recomendar que el inicio del ejercicio físico sea gradual. Se sugiere que algunas personas (p. ej., alguien que tiene síntomas cardiorrespiratorios) se sometan a una evaluación médica formal antes de involucrarse en un programa de ejercicio físico (28,29) (ver Tabla 4). Esta evaluación médica puede incluir la realización de una prueba de esfuerzo graduada u otro procedimiento diagnóstico complementario si el clínico lo considera apropiado. En algunos pacientes con enfermedad cardíaca ya establecida, los programas estructurados de rehabilitación cardíaca pueden ser de utilidad.
Necesidad de evaluación médica antes de iniciar un programa de ejercicio
| Ejercicio Moderado | Ejercicio Intenso | |
|---|---|---|
| Riesgo Bajo | ||
| Asintomático | NO | NO |
| <2 factores de riesgo | ||
| Riesgo Moderado | ||
| Asintomático | NO | SÍ |
| ≥2 factores de riesgo | ||
| Riesgo Alto | ||
| Sintomático, o | SÍ | SÍ |
| Enfermedad CV, pulmonar o renal | ||
Modificada de Sharman et al. (29).
* Ejercicio moderado: 3 – 5 METs; la intensidad causa un aumento significativo de la frecuencia cardíaca y respiratoria.
** Ejercicio intenso: ≥6 METs; la intensidad causa un aumento sustancial de la frecuencia cardíaca y respiratoria.
*** METs: equivalente metabólicos.
Algunos pacientes con HTA pueden exhibir mala tolerancia al ejercicio físico si su esquema de fármacos incluye un β–bloqueador, puesto que este puede interferir con el aumento de la frecuencia cardíaca y de gasto cardíaco inherentes a la actividad física. En estos casos puede intentarse prescribir otras clases de medicamentos que no posean este efecto hemodinámico (30) .
La recomendación actual es efectuar unos 30 minutos de ejercicio físico aeróbico de intensidad moderada la mayoría de los días de la semana, idealmente todos (15). Asimismo, ejercicios de resistencia (isométricos) dos o tres veces por semana han brindado efectos favorables (29). Cantidades menores de ejercicio físico también han mostrado beneficios. Por ejemplo, 30 minutos diarios de ejercicio físico aeróbico de baja intensidad sólo 3 veces por semana enlentece el deterioro cognitivo en personas de edad avanzada (31).
AlcoholEl consumo moderado de alcohol ha demostrado brindar cierta protección contra los infartos cardíacos (32) y los ataques cerebro vasculares (ACV). Sin embargo, es necesario precisar qué se entiende por un consumo moderado de alcohol y, asimismo, que las cantidades son diferentes de acuerdo al género de la persona en cuestión. Si se trata de una mujer, el consumo diario no debería exceder los 200mL de vino al día o unos 45mL de un licor destilado (p. ej., pisco o whisky). En el caso de los varones, las cantidades aceptables o protectoras contra eventos cardiovasculares pueden ser de hasta el doble de aquellas recomendadas para las personas de sexo femenino. Por otra parte, un consumo de alcohol mayor que el indicado eleva anormalmente la presión arterial y se asocia a un mayor riesgo cardiovascular (31).
Café y téNo hay evidencias de que un consumo moderado de estas infusiones tenga efectos adversos en personas que tienen HTA o en cuanto a prevenir la aparición de esta condición. Un gran estudio prospectivo que incluyó más de 400000 sujetos ha sugerido que el consumo de café podría disminuir la mortalidad por todas las causas y, además, específicamente la cardiovascular (34). Adicionalmente, un meta-análisis referente a estudios sobre el consumo de café no identificó evidencias de un mayor riesgo de desarrollar HTA ni de un efecto adverso en las cifras tensionales de aquellos individuos que ya tenían el diagnóstico de HTA (35). En cuanto a beber té, existe un pequeño ensayo clínico aleatorio que sugiere que un consumo de hasta tres tazas de té negro al día puede determinar una ligera disminución de la presión arterial (36).
TabaquismoEl efecto del tabaquismo sobre la presión arterial ha tenido resultados paradójicos y contradictorios en diversos estudios. Los fumadores, como grupo global, presentan una presión arterial más baja que quienes no fuman (37), probablemente porque los fumadores suelen tener un peso corporal menor que aquellos que no tienen este hábito. Además, la medición de la presión arterial habitualmente se realizar luego de que las personas pasan un tiempo sin fumar, principalmente porque los lugares donde se suele medir la presión arterial son centros de salud en los cuales no se permite fumar.
Sin embargo, la monitorización ambulatoria de la presión arterial (MAPA) ha permitido demostrar el efecto hipertensivo que posee el fumar, particularmente sobre la presión arterial sistólica diurna, lo que se correlaciona con una excreción aumentada de catecolaminas en la orina (38). Después de fumar un cigarrillo la presión arterial se eleva significativamente durante los siguientes 15 a 30 minutos. Esto se produce, al menos en parte, porque las sustancias contenidas en el humo del tabaco contribuyen a incrementar la rigidez arterial (39) y disminuir la función de la enzima óxido nítrico sintasa responsable de la síntesis del óxido nítrico, sustancia que posee reconocidos efectos vasodilatadores (40).
En Chile, el tabaquismo es el factor de riesgo número uno para sufrir un infarto agudo del miocardio (41). Es así como recomendar, enfáticamente, dejar de fumar tiene una importancia crucial.
Suplementación de CalcioNo se recomiendan los suplementos farmacológicos de calcio para la prevención ni para el tratamiento de la HTA. Esto se fundamenta en información proveniente de publicaciones que sugieren que tales suplementos pueden aumentar el riesgo de muerte de causa cardiovascular (42,43). Asimismo, la ingesta aumentada o exagerada de calcio se asoció a un mayor riesgo de ataque cerebro vascular en una cohorte de más de 30000 mujeres seguidas durante un período de tiempo de 10 años (44).
CONCLUSIONES- •
Las intervenciones terapéuticas no farmacológicas son útiles y forman parte integral del tratamiento de la HTA, incluso en los pacientes que se encuentran en tratamiento farmacológico.
- •
Se puede intentar un tratamiento no farmacológico inicial en aquellos pacientes con HTA leve y con un riesgo cardiovascular global que no es alto. Si la presión arterial no se normaliza al cabo de algunos meses, debería adicionarse medicamentos anti hipertensivos.
- •
Una restricción moderada de la ingesta de sodio y una dieta saludable (p. ej., DASH), asociada a un aporte de potasio adecuado ha mostrado beneficios en cuanto a las cifras de presión arterial.
- •
Lograr un peso corporal adecuado y efectuar ejercicio físico regular brinda beneficios respecto de la presión arterial.
- •
Finalmente, es fundamental no fumar. Asimismo, es esencial evitar beber alcohol en exceso.
El autor declara no tener conflictos de interés, en relación a este artículo.