En este artículo de revisión se analiza el estado actual del tratamiento anticoagulante oral prestando especial atención a sus indicaciones en cardiología, en particular en fibrilación auricular no valvular y valvular, y en las afecciones valvulares en las que está indicado. Se revisan las ventajas y desventajas de los anticoagulantes del tipo de los antagonistas de la vitamina K y de los anticoagulantes de introducción más reciente denominados anticoagulantes directos. En relación al tratamiento antitrombótico en fibrilación auricular se analizan las escalas de riesgo de tromboembolismo sistémico y cómo estimar el riesgo de sangrado para así seleccionar adecuadamente a los pacientes que deberían recibir tratamiento anticoagulante oral. Respecto de las afecciones valvulares del corazón, se revisa el tratamiento anticoagulante en relación a las indicaciones en las prótesis valvulares cardíacas, con los objetivos de International Normalized Ratio (INR) buscados en cada caso. Se destaca que los anticoagulantes directos están contraindicados como terapia antitrombótica, en el caso de las prótesis valvulares mecánicas como también en la estenosis mitral de etiología reumática de grado moderado o severo, estando indicados en estos casos los antagonistas de la vitamina K. Finalmente, se revisan algunos aspectos referentes al manejo perioperatorio de los anticoagulantes orales.
This review article analyzes the current status of oral anticoagulant treatment with particular attention to its indications in cardiology, especially non-valvular and valvular atrial fibrillation and cardiac valvular affections where it is indicated. The advantages and disadvantages of anticoagulants of the type vitamin K antagonists and of the more recently introduced anticoagulants called direct anticoagulants are reviewed. In relation to the antithrombotic treatment in atrial fibrillation the scales of risk of systemic thromboembolism are analyzed and how to estimate the risk of bleeding to properly select the patients who should receive oral anticoagulant treatment. In relation to valvular heart conditions, the anticoagulant treatment is reviewed in relation to the indications of this respect of heart valve prostheses, with the objectives of INR sought in each case and it is emphasized that direct anticoagulants are contraindicated as antithrombotic therapy in the mechanical valvular prostheses as well as in mitral stenosis of rheumatic etiology, with vitamin K antagonists being indicated in these cases. Finally, some aspects regarding the perioperative management of oral anticoagulants are reviewed.
En la actualidad, el uso de fármacos anticoagulantes orales constituye una herramienta esencial para la prevención primaria y secundaria de eventos tromboembólicos en diversas situaciones clínicas, entre las cuales destacan la fibrilación auricular, las afecciones valvulares del corazón y el tromboembolismo venoso (1-3).
Dentro de los fármacos disponibles para este efecto, los más utilizados son los antagonistas de la vitamina K (AVK). En Chile se dispone del acenocumarol y de la warfarina. La acción de estos medicamentos es monitorizada utilizando el tiempo de protrombina, a través de una fórmula de estandarización denominada International Normalized Ratio (INR) (3).
El tratamiento con AVK tiene varias limitaciones que lo hacen difícil de usar en la práctica clínica como son su respuesta variable, ventana terapéutica estrecha (p. ej., INR 2.5 ± 0.5), la necesidad de controlar sistemáticamente el grado de anticoagulación, un inicio y desaparición del efecto lento, el requerir frecuentes ajustes de la dosis, numerosas interacciones con medicamentos y alimentos, y algunos casos de resistencia a su acción (4). Sin embargo, también poseen algunas ventajas. Entre ellas puede mencionarse el que no son eliminados por vía renal, lo que permite su uso en pacientes con nefropatías avanzadas, un menor riesgo inmediato si el paciente omite una dosis, existe mucha experiencia en su utilización y un costo relativamente bajo (4).
Tener un INR sobre o bajo los niveles terapéuticos para la indicación específica, expone al paciente a un mayor riesgo de presentar complicaciones hemorrágicas o tromboembólicas, respectivamente. En la práctica clínica habitual, mantener un nivel de anticoagulación estable es difícil. En el mejor de los casos, en centros con programas de anticoagulación bien estructurados y rigurosos, se logra que los pacientes permanezcan con INR en el rango terapéutico durante el 70% del tiempo (5).
La duración de la terapia anticoagulante, el nivel de educación de los pacientes respecto de su enfermedad y tratamiento, además de la ingesta de vitamina K (contenida en los alimentos), también intervienen en la estabilidad del tratamiento. Por ello, se hace necesario mantener un seguimiento periódico y estricto de los pacientes en terapia (5).
La investigación para encontrar una alternativa a los AVK se ha concentrado en el desarrollo de un anticoagulante oral con amplio margen terapéutico y escasa variabilidad intra e interindividual que pueda administrarse con una dosis fija, sin necesidad de monitorizar sistemáticamente la coagulación y con pocas interacciones alimentarias y farmacológicas. En la actualidad existen tres inhibidores directos del factor X activado (rivaroxaban, apixaban y edoxaban) y un inhibidor directo de la trombina (dabigatran) con indicaciones aprobadas en profilaxis y tratamiento antitrombótico en varias situaciones clínicas. Esta clase de anticoagulantes ha sido denominada “nuevos anticoagulantes orales” o, con mayor propiedad, anticoagulantes directos (AD) (6).
Es muy importante estimular la adherencia de los pacientes, sobre todo mediante una educación individualizada a las necesidades de cada uno de ellos, ya que existen riesgos y precauciones comunes a todos los pacientes recibiendo tratamiento anticoagulante oral. Es crucial reforzar en el paciente la importancia de la adherencia y el correcto cumplimiento terapéutico. En este contexto, las unidades o clínicas especializadas de tratamiento anticoagulante pueden tener un papel decisivo en los procesos de inicio del tratamiento anticoagulante, de transición (p. ej., de AVK a AD o viceversa), educación y resolución de situaciones clínicas complejas (5).
En este artículo de revisión narrativa se tratarán los tópicos de anticoagulación oral en fibrilación auricular y en afecciones valvulares cardíacas.
FIBRILACIÓN AURICULAR (FA)La FA es, probablemente, la indicación médica más importante para prescribir tratamiento anticoagulante a un paciente determinado. Esto se debe a que esta arritmia -la más frecuente de las arritmias cardíacas tratadas en la práctica clínica y la más común por la cual los pacientes son hospitalizados- suele asociarse a un elevado riesgo de ataque cerebro vascular (ACV) y de muerte. Es así como la FA se asocia a un riesgo de ACV isquémico cinco veces mayor y de mortalidad por todas las causas del doble en comparación al ritmo sinusal (7). Por añadidura, la FA aqueja a 34 millones de personas a nivel mundial y los pronósticos indican que este número se doblará hacia el año 2050 debido al progresivo envejecimiento de la población (8). Si se compara los ACV isquémicos debidos a otras etiologías con aquellos causados por FA, se aprecia que estos últimos suelen ser más extensos y graves (9). Por lo anterior, causan en los pacientes afectados más secuelas invalidantes y mortalidad (10,11).
En pacientes con FA, el tratamiento anticoagulante con AVK (p. ej., warfarina o acenocumarol) logra disminuir el riesgo de ACV en un 64% y el de mortalidad por todas las causas en un 26% (12,13). Los anticoagulantes directos (AD), comparados con los cumarínicos, reducen el riesgo de ACV o de embolias sistémicas en un 19% adicional y el de mortalidad por todas las causas en un 10% adicional. Además, se asocian a menos hemorragias intracraneanas que los cumarínicos, por lo que su relación beneficio/riesgo es favorable (14).
Sin embargo, no todos los pacientes que presentan FA tienen el mismo riesgo de sufrir fenómenos de tromboembolismo sistémico, entre los que destaca el ACV. Para decidir qué pacientes se beneficiarán de una terapia anticoagulante, se han desarrollado varios esquemas de estratificación de riesgo. De estos, el recomendado actualmente es el CHA2DS2–VASc (por su sigla en inglés: Congestive Heart Failure, Hypertension, Age≥75 años, Diabetes Mellitus, Stroke, Vascular Disease, Age 65-74 años, Sex category). Esta escala de estratificación de riesgo asigna 2 puntos a la edad mayor o igual a 75 años y al antecedente de haber sufrido un ACV o crisis isquémica transitoria previamente. El resto de las variables recibe una ponderación de un punto (15) (Tabla 1). Se recomienda que en todo paciente con FA se efectúe una estimación del riesgo embólico utilizando esta escala, ya que permite identificar a los pacientes que verdaderamente poseen un riesgo muy bajo (CHA2DS2–VASc=0). Estos últimos no tienen indicación de recibir tratamiento anticoagulante ya que el riesgo de esta terapia (sangrado) supera los beneficios. Debe destacarse que tampoco requieren otro tipo de tratamiento antitrombótico como podría ser el ácido acetilsalicílico en dosis bajas. Hasta hace algunos años se consideraba que el sexo femenino constituía un factor de riesgo para tromboembolismo sistémico de igual ponderación que los otros factores incluidos en la escala de riesgo CHA2DS2–VASc. Sin embargo, estudios más recientes han demostrado que el sexo femenino no implica más riesgo, excepto en mujeres de 75 años o más. Esta consideración implica que mujeres de menos de 75 años de edad y sin otro factor de riesgo pueden homologarse a varones con una puntuación CHA2DS2–VASc de 0 y, en consecuencia, estas pacientes no tienen indicación de tratamiento anticoagulante. En síntesis, el tratamiento anticoagulante se recomienda categóricamente en pacientes varones con FA y un CHA2DS2–VASc igual o mayor a 2, y en mujeres con una puntuación de 3 o más. Por último, en pacientes con FA, debe darse una seria consideración a la utilización de tratamiento anticoagulante oral, en el caso de los varones con un CHA2DS2–VASc de 1, y en el de las mujeres, con una puntuación de 2 (16).
Factores de riesgo de la escala CHA2DS2-VASc y su ponderación
| Insuficiencia cardíaca: síntomas/signos o fracción de eyección ↓ | +1 |
| Hipertensión arterial | +1 |
| Edad ≥75 años | +1 |
| Diabetes mellitus | +1 |
| Previo ACV, crisis isquémica transitoria o tromboembolismo | +2 |
| Enfermedad vascular | +1 |
| Edad 65 – 74 años | +1 |
| Categoría de sexo (femenino) | +1 |
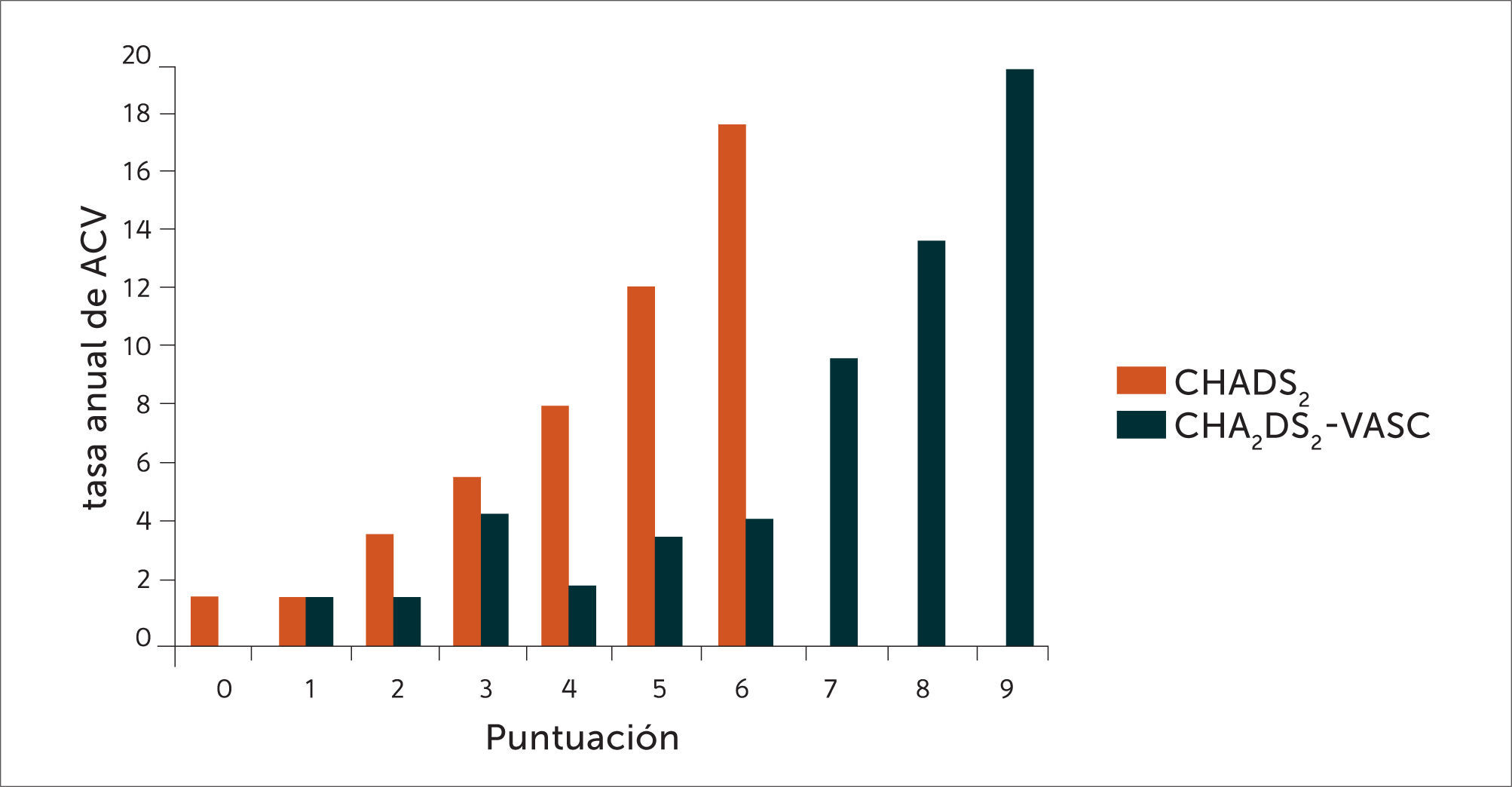
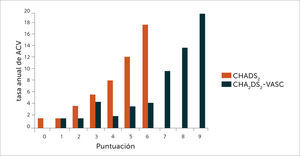
La figura 1 muestra cómo el número de puntos en la escala CHA2DS2–VASc es directamente proporcional al riesgo de sufrir un ACV. Se la compara con la escala CHADS2 (por sus sigla en inglés: Congestive Heart Failure, Hypertension, Age>75 años, Diabetes Mellitus, Stroke or TIA - transient ischemic attack) de estratificación de riesgo, más antigua (17) y que adolece del defecto de una menor capacidad de definir el riesgo a niveles de puntuación más bajos. Esto último es más relevante actualmente en que se dispone de los AD. Estos poseen menos riesgo de sangrado grave (menos hemorragia intracraneana) que los AVK lo que permite prescribir tratamiento anticoagulante a pacientes con un nivel de riesgo tromboembólico más bajo que en el pasado (Tabla 2).
Comparación de la tasa anual de ACV entre las escalas CHADS2 y CHA2DS2-VASc
Extraída de (21).
Es importante mencionar que el uso de ácido acetilsalicílico en FA disminuye el riesgo embólico sólo marginalmente, por lo que no se recomienda su uso en este contexto. En pacientes con FA en los que haya imposibilidad de usar anticoagulantes del tipo AVK, existe la alternativa de utilizar la combinación de ácido acetilsalicílico y clopidogrel. Esta asociación, si bien inferior a la terapia anticoagulante, es claramente superior a ácido acetilsalicílico solo y brinda un beneficio clínico neto en la prevención de embolias sistémicas versus sangrado, aunque la frecuencia de hemorragias graves o mayores fue importante (18). Un estudio posterior, en una población similar (es decir, en que el uso de AVK era considerado riesgoso o los pacientes no deseaban tomarlos), se comparó el inhibidor del factor Xa apixaban versus ácido acetilsalicílico. Se observó un claro beneficio de apixaban en la prevención de ACV y de tromboembolismo sistémico con un costo en hemorragias similar al de ácido acetilsalicílico(19).
El aumento del riesgo de sangrado -inherente al tratamiento anticoagulante- ha llevado a buscar objetivarlo en los pacientes con fibrilación auricular antes de decidir la indicación del tratamiento. Al igual que en la evaluación del riesgo tromboembólico en FA, existen escalas validadas para evaluar el riego hemorrágico. Entre estas, la con mejor valor predictivo es HAS–BLED (Tabla 3). Una puntuación igual o mayor a 3, indica un alto riesgo de hemorragias mayores. Se entiende por hemorragia mayor, un sangrado que posea una o más de las siguientes características (20):
- a)
Hemorragia intracraneana.
- b)
Una hemorragia que requiera hospitalización.
- c)
Un hemorragia que determine un caída de la hemoglobina mayor a 2g/dL.
- d)
Un hemorragia que requiera de transfusiones.
Escala HAS-BLED de predicción de riesgo de sangrado
| Letra | Característica Clínica | Puntos |
|---|---|---|
| H | HTA no controlada, PAS >160mmHg | 1 |
| A | Función renal o hepática anormal (1 punto c/u) | 1 o 2 |
| S | ACV (antecedente) | 1 |
| B | Hemorragia: previa o diátesis | 1 |
| L | INR lábiles (INR inestable/alto) | 1 |
| E | Edad avanzada (>65 años o fragilidad) | 1 |
| D | Medicamentos (p. ej., AAS) o abuso de alcohol (1 punto c/u) | 1 o 2 |
| Máxima puntuación posible | 9 |
HTA: hipertensión arterial. PAS: presión arterial sistólica. AAS: ácido acetilsalicílico
El uso juicioso de estas escalas de riesgo de tromboembolismo sistémico (particularmente de CHA2DS2–VASc) y de sangrado en pacientes con FA permiten individualizar la indicación de tratamiento anticoagulante. Es así como el riesgo anual aproximado de ACV en un paciente con un CHA2DS2–VASc de 2 puntos es de un 2% el cual, en general, justifica el uso de anticoagulación. Sin embargo, si el paciente tiene un HAS-BLED de 5 puntos, su riesgo anual de experimentar un sangrado mayor alcanza un 12% aproximadamente, haciendo reconsiderar seriamente la prescripción de anticoagulantes (21).
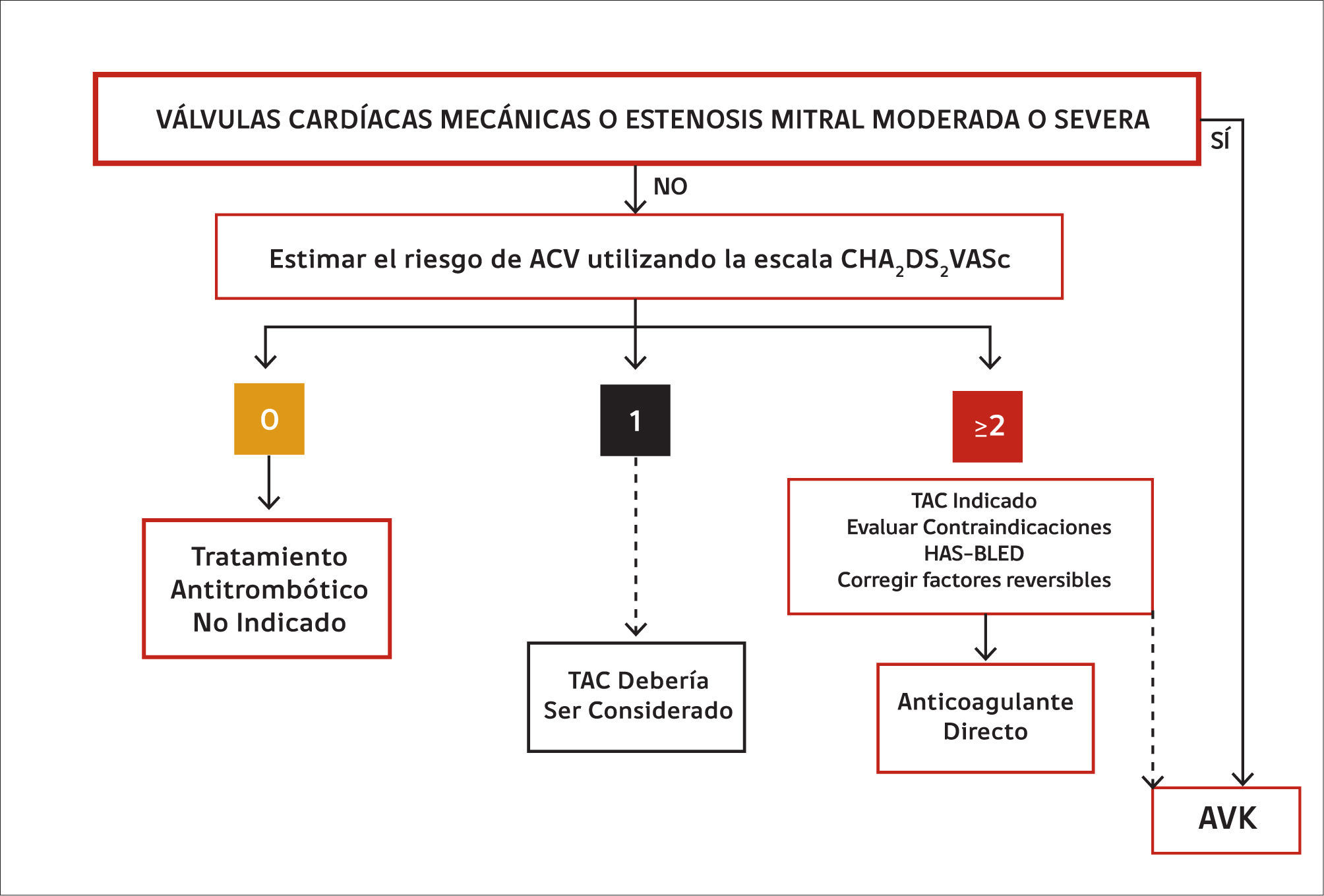
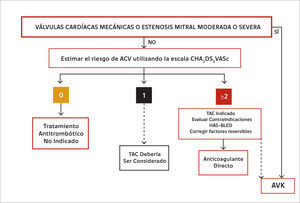
El uso de los anticoagulantes directos (AD) en FA está limitado a la denominada “fibrilación auricular no valvular”. Se entiende por FA valvular aquella que está asociada a la estenosis mitral -las inmensa mayoría de las veces de etiología reumática- moderada o severa y a válvulas cardíacas protésicas mecánicas (22). Por tanto, en el momento actual la FA asociada a una estenosis mitral moderada o severa y a válvulas cardíacas protésicas mecánicas ha de tratarse exclusivamente con AVK (16). La figura 2 proporciona una visión de conjunto respecto del tratamiento anticoagulante de la FA. Los pacientes portadores de válvulas cardíacas mecánicas sin FA deben ser tratados con AVK; un ensayo clínico que comparó dabigatran versus warfarina en esta población de pacientes debió detenerse prematuramente puesto que en el grupo dabigatran se observaron significativamente más eventos tromboembólicos y sangrados mayores que en el brazo asignado a warfarina (23).
Conducta de anticoagulación en diferentes situaciones clínicas
Las líneas contínuas denotan una indicación de mayor nivel de recomendación que las discontinuas. TAC: tratamiento anticoagulante. AVK: antagonista de la vitamina K. Modificada de (16).
Todos los pacientes con prótesis mecánicas cardíacas requieren tratamiento anticoagulante oral de por vida con AVK. Sin este tratamiento, el riesgo de complicaciones tromboembólicas es muy elevado como también lo es el riesgo de trombosis de la prótesis con la consecuente disfunción de ésta (24).
En pacientes portadores de una prótesis valvular mecánica de doble disco en la posición aórtica y sin otros factores de riesgo para tromboembolismo, el tratamiento antitrombótico recomendado consiste en un AVK (p. ej., warfarina o acenocumarol) con un INR objetivo de 2.5±0.5 (25). Sin embargo, si el paciente posee algún otro factor de riesgo tromboembólico (estos son: FA, embolias sistémicas previas, disfunción del ventrículo izquierdo, estado de hipercoagulabilidad o una prótesis mecánica de generación antigua tal como una prótesis de bola tipo Starr-Edwards) el INR objetivo es de 3.0±0.5 (25).
En los pacientes en que se ha implantado una prótesis mecánica en posición mitral, el INR objetivo indicado es de 3.0 ± 0.5 (25). Esto se fundamenta en que las prótesis implantadas en posición mitral presentan una mayor trombogenicidad que las ubicadas en la posición aórtica.
Las guías de práctica clínica norteamericanas sobre afecciones valvulares -elaboradas por el American College of Cardiology y American Heart Association- publicadas en 2014 como también su actualización publicada este año, recomiendan el uso de AVK asociado a ácido acetilsalicílico (75–100mg/día) en todos los pacientes portadores de prótesis mecánicas cardíacas, sin hacer distinciones (27,28). En cambio, las guías publicadas por la Sociedad Europea de Cardiología publicadas en 2017 recomiendan el uso exclusivo de AVK en los pacientes portadores de prótesis valvulares mecánicas, reservando la adición de ácido acetilsalicílico solo en aquellos casos en que se ha producido un evento embólico sistémico mientras el paciente se encuentra con un INR en rango terapéutico (29). En un esfuerzo por conciliar ambas posturas, nos parece apropiado utilizar solo AVK (sin ácido acetilsalicílico) en pacientes portadores de una prótesis mecánica en posición aórtica apuntando a un INR de 2.5±0.5 y aumentando el INR objetivo a 3.0±0.5 si el paciente presenta otros factores favorecedores de trombosis (Tabla 4), pero sin adicionar necesariamente ácido acetilsalicílico. En cambio, en aquellas prótesis mecánicas en posición mitral puede ser apropiado la utilización rutinaria de AVK más ácido acetilsalicílico rutinariamente a menos que existan contraindicaciones debidas a un riesgo de sangrado elevado.
Factores de riesgo adicionales de trombosis en pacientes con prótesis valvulares
| Prótesis mecánica en posición mitral |
| Prótesis mecánica en posición tricuspídea |
| Fibrilación auricular |
| Tromboembolismo previo |
| Condición de hipercoagulabilidad |
| Prótesis valvulares mecánicas de generación antigua |
| Disfunción sistólica severa del ventrículo izquierdo (fracción de eyección <30%) |
| Más de una prótesis valvular mecánica |
De acuerdo a la actualización de este año de las guías norteamericanas, la anticoagulación con un AVK es apropiada durante los primeros 3-6 meses que siguen al implante de una prótesis valvular biológica en la posición mitral teniendo un INR objetivo de 2.5. Esta misma conducta es sugerida, aunque con menos fuerza, cuando la prótesis es implantada en posición aórtica.
En pacientes con estenosis mitral cuya etiología es reumática, en la mayoría de los casos, el riesgo de tromboembolismo sistémico es particularmente alto. Cuando se hallan en ritmo sinusal el riesgo es mayor que en individuos controles, pero cuando coexiste la FA el riesgo es 7 veces mayor que cuando el paciente con estenosis mitral se encuentra en ritmo sinusal (30). Por lo tanto, en presencia de fibrilación auricular estos pacientes deben anticoagularse con AVK con un INR objetivo de 2.5±0.5. Es importante recordar una vez más, que los anticoagulantes directos no están aprobados para esta indicación.
Cuando el paciente con estenosis mitral se encuentra aún en ritmo sinusal, hay algunas circunstancias en que debe prescribirse anticoagulación oral (29). Las dos indicaciones más importantes son:
- 1.
Pacientes con antecedentes de haber sufrido una embolia sistémica previamente.
- 2.
Pacientes que tienen un trombo en la aurícula izquierda (detectado, en general, mediante ecocardiografía transesofágica).
La anticoagulación oral puede considerarse en estos pacientes cuando en un ecocardiograma transesofágico se detecta contraste espontáneo denso en el interior de la aurícula izquierda y cuando esta última se encuentra acentuadamente dilatada (diámetro mayor a 5.0cm o un volumen indexado por superficie corporal mayor a 60mL/m2 en ecocardiografía transtorácica) (29).
MANEJO PERIOPERATORIO DE PACIENTES CON TRATAMIENTO ANTICOAGULANTE CON AVKLos anticoagulantes no deben suspenderse para procedimientos con bajo riesgo de sangrado. En estos casos el riesgo de eventuales embolias sistémicas durante el período de suspensión del anticoagulante supera los riesgos de un eventual sangrado. Entre estos procedimientos quirúrgicos o invasivos que no requieren la suspensión de los AVK (o de los AD) se cuentan las extracciones dentarias, la cirugía de cataratas y de glaucoma y cirugías a nivel de la piel (16,27).
Ante cirugías o procedimientos invasivos cuyo riesgo de sangrado es mayor, es apropiado suspender transitoriamente el tratamiento anticoagulante con AVK. En muchos casos esto puede efectuarse sin la necesidad de realizar un puente con un anticoagulante parenteral de vida media corta en dosis terapéuticas (32) (p. ej., heparina no fraccionada endovenosa o heparina de bajo peso molecular por vía subcutánea) (16). Este es el caso de los pacientes con FA en tratamiento con warfarina. Un estudio publicado en 2015, enroló 1884 pacientes con FA en tratamiento anticoagulante con warfarina y que tenían programada una cirugía electiva que exigía la suspensión del tratamiento anticoagulante. Se asignó aleatoriamente a los pacientes a un brazo en que simplemente se suspendió la warfarina 5 días antes del procedimiento y a otro en que se utilizó heparina de bajo peso molecular en dosis terapéuticas. Hubo 0.4% de eventos de tromboembolismo sistémico en el grupo sin puente y 0.3% en el grupo en que se utilizó puente; la incidencia de sangrado mayor fue significativamente más elevada en el grupo en que se empleó puente de anticoagulación (33). Estos resultados sugieren que en el contexto de la FA puede realizarse la suspensión del tratamiento anticoagulante sin la necesidad de hacer un tratamiento de puente con heparina de bajo peso molecular en forma segura. En este estudio la warfarina se reinició dentro de las primeras 24 horas después de la cirugía, lo que indica que el tiempo de suspensión debe ser minimizado en lo posible.
Otro grupo de pacientes en que el AVK puede suspenderse, sin la utilización de un puente de anticoagulación con heparina, son los portadores de una prótesis valvular mecánica de doble disco en posición aórtica que no tengan otros factores de riesgo para trombosis (Tabla 4). El AVK es suspendido 3-4 días antes del procedimiento (hasta obtener un INR <1.5) y es reiniciado, típicamente, 12 o 24 horas después de la cirugía (28). El tiempo de suspensión requerido suele ser mayor para warfarina que para acenocumarol debido a la vida media más prolongada del primero (Tabla 5).
Existen, por el contrario, otras situaciones en las que sí se justifica utilizar una terapia anticoagulante de puente con heparina no fraccionada endovenosa o heparina de bajo peso molecular subcutánea, empleando dosis terapéuticas (28,29). Estas situaciones se limitan esencialmente a las prótesis valvulares mecánicas:
- •
Prótesis valvular mecánica en posición aórtica asociada a otros factores de riesgo de trombosis.
- •
Prótesis mecánica en posición mitral.
- •
Prótesis mecánica en posición tricuspídea.
La anticoagulación de puente se inicia cuando el INR es menor a 2.0 o 2.5 dependiendo del contexto clínico de riesgo trombótico (unas 36 a 48 horas antes de la cirugía o del procedimiento invasivo) y es detenida 6 horas antes (en el caso de la heparina no fraccionada) y 12 horas antes (en el caso de la heparina de bajo peso molecular) del procedimiento en cuestión (27).
Para pacientes con insuficiencia renal (velocidad de filtración glomerular <30ml/min), se sugiere una reducción de la dosis a la mitad de la que es usual.
ANTICOAGULANTES ORALES DIRECTOS (AD)Los anticoagulantes orales directos (AD) ejercen su efecto mediante el bloqueo directo de enzimas activas involucradas en la coagulación (trombina o factor Xa).
Todos los AD han mostrado poseer un riesgo menor de hemorragia intracraneana que los AVK en el contexto de la prevención de las complicaciones tromboembólicas de la FA (34).
En Chile se dispone de tres AD: dabigatran, rivaroxaban y apixaban.
DabigatranEl mecanismo de su efecto anticoagulante es el bloqueo directo de la trombina.
Está indicado como ya se ha mencionado, para el tratamiento preventivo de las complicaciones tromboembólicas de la FA, en especial el ACV. Sin embargo, también puede utilizarse para la prevención y tratamiento de la enfermedad venosa trombótica, incluyendo el tromboembolismo pulmonar.
El fármaco alcanza su efecto anticoagulante pleno con rapidez, 2-3 horas luego de su ingestión y su vida media es de 12-14 horas. Es eliminado, en un 80%, por vía renal; esto determina que no deba utilizarse en pacientes con una velocidad de filtración glomerular (VFG) menor a 30mL/min.
La dosis habitual para la prevención de ACV en pacientes con FA no valvular es de 150mg 2 veces/día. En pacientes de 80 años o más y en casos de VFG entre 30– 49mL/min se recomienda una dosis menor, 110mg 2 veces/día.
Para la prevención de trombosis venosa profunda después de cirugía ortopédica, la dosis recomendada es de 220mg/día (150mg/día si la VFG <50mL/min). El tratamiento para la trombosis venosa profunda aguda incluso cuando se asocia a tromboembolismo pulmonar es de 150mg 2 veces/día después de al menos 5 días de tratamiento inicial con heparina no fraccionada o de bajo peso molecular.
Dabigatran presenta escasas interacciones con otros fármacos. Las más relevantes ocurren con medicamentos que inhiben la glicoproteína P, tales como ketoconazol, itraconazol, rifampicina, carbamazepina, fenitoína y fenobarbital. Mientras el paciente esté recibiendo estos agentes el dabigatran está contraindicado. En el caso de pacientes en tratamiento con verapamilo, la dosis debe reducirse a 110mg 2 veces/día (34). Dabigatran posee escasos efectos adversos. Sin embargo, puede mencionarse que presenta un leve mayor riesgo de hemorragia digestiva que los AVK y que un 15% de los pacientes reporta dispepsia. Este último síntoma puede atenuarse ingiriendo el fármaco junto con las comidas o con abundante líquido.
En relación a qué hacer en pacientes que se encuentran en tratamiento con dabigatran y requerirán una cirugía o un procedimiento invasivo electivo, pueden ofrecerse las siguientes recomendaciones. Debe considerarse el riesgo de sangrado del procedimiento invasivo o cirugía, el riesgo tromboembólico del paciente y la función renal de este último. Ante una cirugía o procedimiento con alto riesgo de sangrado, dabigatran debe suspenderse 48–72 horas antes en sujetos con función renal normal o con una disminución leve de esta (VFG≥50 mL/min). Si existe disfunción renal moderada (VFG 30–49 mL/min) la suspensión debe efectuarse 72–96 horas antes. Frente a procedimientos con bajo riesgo de sangrado, dabigatran puede ser suspendido solo 24 horas antes, sin que sea necesario considerar la función del riñón (tablas 6 y 7) (35).
Suspensión de anticoagulante directo previo a procedimiento
| PACIENTE CON RIESGO BAJO DE SANGRADO |
| - Suspender AD 24 horas previo a procedimiento |
| - Reiniciar 6-8 horas después de hemostasia completa |
| PACIENTE CON RIESGO ALTO DE SANGRADO |
| - Suspender AD 48 - 96 horas previo al procedimiento |
| - Evaluar riesgo de sangrado frente a riesgo embólico para reiniciar |
AD: Anticoagulante directo
Suspensión de anticoagulante directo previo a procedimiento
| CIRUGÍAS O PROCEDIMIENTOS INVASIVOS CON RIESGO DE SANGRADO ALTO |
| Cirugía vascular |
| Cirugía general |
| Reemplazo bilateral de cadera o rodillas |
| Polipectomía |
| Esfinterotomía biliar |
| Resección transuretral de la próstata |
| Cirugía mayor cuya duración es >45 minutos |
| CIRUGÍAS O PROCEDIMIENTOS INVASIVOS CON RIESGO DE SANGRADO BAJO |
| Reparación de hernia abdominal |
| Histerectomía abdominal |
| Disección de adenopatías axilares |
| Broncoscopía sin o con biopsia |
| Cirugía de cataratas |
| Colecistectomía |
| Endoscopía digestiva sin o con biopsia |
| Implante de stent biliar o pancreático sin esfinterotomía |
| Hemorroidectomía |
| Extracciones dentarias |
El reinicio de la anticoagulación con dabigatran puede efectuarse una vez asegurada una hemostasia completa. Sin embargo, luego de un procedimiento quirúrgico con alto riesgo de sangrado se sugiere reiniciarlo 48 – 72 horas después. Tras un procedimiento con bajo riesgo de sangrado, dabigatran puede reiniciarse 24 horas después.
Un tratamiento anticoagulante de puente previo a la cirugía con heparina no fraccionada o de bajo peso molecular, solo se justifica en pacientes con un riesgo tromboembólico muy elevado y que requieren un período de suspensión de dabigatran más prolongado que el habitual debido a insuficiencia renal. Pacientes con un riesgo tromboembólico muy alto son aquellos que han tenido un ACV isquémico o crisis isquémica transitoria en los últimos 6 meses, que tienen un CHA2DS2-VASc ≥6, estenosis mitral asociada a FA, tromboembolismo venoso en los últimos 3 meses o trombofilia grave (35).
RivaroxabanEste fármaco ejerce su efecto anticoagulante a través de la inhibición directa del factor Xa.
Luego de ser ingerido, alcanza su concentración plasmática máxima dentro de 2–4 horas. Su vida media es de 5–9 horas.
Está indicado para prevenir el tromboembolismo sistémico en pacientes con FA no valvular, siendo la dosis habitual 20mg/día ingerido con alimentos para favorecer su biodisponibilidad. Si la VFG se halla entre 1–49mL/min, la dosis indicada es de 15mg/día, siempre con los alimentos. Si la VFG es menor a 15mL/min, el medicamento está contraindicado.
Rivaroxaban puede utilizarse como agente profiláctico de trombosis venosa profunda en relación a cirugía ortopédica o de otro tipo (dosis de 10mg/día por 12–35 días). Para el tratamiento de la trombosis venosa profunda establecida y tromboembolismo pulmonar, se utiliza una dosis de 15mg 2 veces/día por 21 días, continuándose con 20mg/día hasta completar al menos 3 meses. Dependiendo del caso, el tratamiento puede prolongarse 6 meses o mantenerse indefinidamente.
En algunos países, rivaroxaban ha sido aprobado como agente antitrombótico en prevención secundaria después de un síndrome coronario agudo, utilizándose en estos casos dosis muy bajas (2.5mg 2 veces/día).
El fármaco no puede utilizarse asociado a ketoconazol, itraconazol e inhibidores de la proteasa del virus de la inmunodeficiencia humana (34,35).
Frente a procedimientos quirúrgicos o invasivos con alto riesgo de sangrado (tabla 7), rivaroxaban debe ser suspendido 48 horas antes si la función renal es normal. Si el paciente presenta una insuficiencia renal moderada (VFG 30–59mL/min) el fármaco debe discontinuarse 72 horas antes y si existe una insuficiencia renal avanzada (VFG 15–29mL/min) debe detenerse su administración 96 horas antes.
Ante procedimientos con bajo riesgo de sangrado (tabla 7), basta con discontinuar el fármaco 24 horas antes.
El reinicio de rivaroxaban puede efectuarse una vez asegurada la hemostasia. Sin embargo, en pacientes y procedimientos con riesgo de sangrado alto, se sugiere reiniciar el medicamento 48–72 horas después de concluida la cirugía.
Las consideraciones respecto a efectuar un puente con heparina son similares a las ya expuestas en relación a dabigatran, reservándose en general para pacientes con un riesgo tromboembólico alto o muy alto.
ApixabanEjerce su efecto anticoagulante mediante la inhibición directa del factor Xa.
Su efecto anticoagulante pleno se observa 1–3 horas después de su ingestión y su vida media es de 8-15 horas.
Solo un 25% del medicamento es excretado por vía renal, siendo el menos dependiente de la función renal de los AD disponibles en nuestro medio.
Sus indicaciones son la prevención del tromboembolismo sistémico en FA no valvular y la prevención y tratamiento de la trombosis venosa profunda.
La dosis habitual en FA no valvular es 5mg 2 veces/día. La dosis ha de reducirse a la mitad -es decir, 2.5mg 2 veces/día- si concurren 2 o más de los siguientes factores: edad mayor a 80 años, creatinina sérica mayor a 1.5mg/dL o peso corporal menor a 60 kg (34).
Apixaban no debe utilizarse concomitantemente con ketoconazol, itraconazazol, inhibidores de la proteasa del virus de la inmunodeficiencia humana, rifampicina, fenitoína, carbamazepina y fenobarbital.
Ante un procedimiento quirúrgico o invasivo con alto riesgo de sangrado, se recomienda suspender el fármaco 24–48 horas antes si la función renal es normal. Si hay una insuficiencia renal moderada (VFG 30–59mL/min), el medicamento debe ser suspendido 72 horas antes. Si la disfunción renal es severa (VFG 15–29mL/min), se debe suspender el apixaban 96 horas antes (35).
En procedimientos que tienen un bajo riesgo de sangrado bastaría con suspender el fármaco solo 24 horas antes (35).
Es importante insistir en que ciertos procedimientos, con muy bajo riesgo de sangrado, pueden realizarse manteniendo la anticoagulación. Estos incluyen las extracciones dentarias (cuando no son múltiples), procedimientos cutáneos y la cirugía de cataratas.
CONCLUSIONES1. El tratamiento anticoagulante oral ha tenido un rol fundamental en cardiología, particularmente en la prevención del tromboembolismo sistémico en presencia de FA y en las afecciones valvulares del corazón, especialmente en presencia de estenosis mitral en válvula nativa y en prótesis valvulares mecánicas.
2. En FA el tratamiento anticoagulante tiene una gran relevancia dado el carácter devastador que frecuentemente adquiere el ACV embólico de este origen.
3. Los AVK -en uso durante más de 50 años-, han sido cruciales para el tratamiento exitoso de las condiciones reseñadas en el primer punto, sin embargo, su uso en la práctica clínica es difícil y engorroso dado su estrecho margen terapéutico.
4. Las anticoagulación en las prótesis valvulares cardíacas mecánicas es esencial. Solo los AVK resultan útiles para este efecto.
5. En las estrategias de terapia antitrombótica en prótesis valvulares mecánicas, se advierten discrepancias entre las guías norteamericanas y las europeas. Pensamos que cuando el riesgo trombótico sea elevado y en prótesis mecánicas en posición mitral puede ser razonable asociar al AVK ácido acetilsalicílico en dosis bajas.
6. El advenimiento de los AD ha sido un avance notable en el campo de la anticoagulación. Son fármacos de eficacia antitrombótica similar a los AVK con menos complicaciones hemorrágicas graves que estos (significativamente menos hemorragias intracraneanas).
7. Los AD están contraindicados en la FA valvular.
8. El manejo periperatorio de la anticoagulación oral requiere ponderar varios aspectos, tales como la farmacocinética del anticoagulante, el riesgo de sangrado de la cirugía propuesta, el riesgo tromboembólico del paciente y su función renal. El puente con un anticoagulante parenteral se ha hecho más infrecuente, pero aún puede tener un rol en pacientes cuyo riesgo tromboembólico es muy elevado.
Los autores declaran no tener conflictos de interés, en relación a este artículo.