El Registro de Cáncer Colorrectal Hereditario es uno de los registros más antiguos y más grandes de su tipo. Incluye a los pacientes con todos los síndromes hereditarios de cáncer colorrectal, utilizando los tres enfoques básicos, la atención al paciente, la educación y la investigación. Este artículo resume la estructura y función del registro, y da ejemplos de sus contribuciones al manejo de los pacientes afectados.
ACTIVIDADEn el año 2016 el registro atendió a más de 1000 familias con poliposis adenomatosa familiar, 224 familias con síndrome de Lynch, 61 con poliposis asociada a MYH y 146 con poliposis hamartomatosa. En el año 2016 hubo 1009 visitas de pacientes con 80 nuevos pacientes y 879 endoscopías. Se realizaron más de 60 cirugías.
RESUMENSe describe el enfoque de “Cleveland Clinic” para el cáncer colorrectal hereditario. Esto es multidisciplinario, involucrando varias especialidades y así como servicios de asesoramiento genético y de salud mental dentro del registro.
Los registros tienen un papel muy importante en el manejo de pacientes y familias con síndromes de cáncer colorrectal hereditario. Literalmente salvan vidas mediante una vigilancia eficaz y una atención clínica especializada 1,2. Los pacientes con estos síndromes merecen ser atendidos en un registro, o al menos por expertos con experiencia y conocimiento en el manejo de estos síndromes.
El Registro de Cáncer Colorrectal Hereditario en la “Cleveland Clinic” comenzó en 1979, cuando el Dr. David Jagelman estableció un registro para los pacientes y las familias con Poliposis Adenomatosa Familiar (PAF). En los 38 años subsiguientes el registro ha crecido para convertirse en el Registro de Cáncer Colorrectal Hereditario más grande en el mundo de una única institución. Utilizando el alto número de pacientes y familias, el registro de la clínica ha sido un líder en el desarrollo de guías de práctica clínica para el manejo de pacientes con síndromes de cáncer colorrectal hereditario. Durante su existencia, el Registro ha sufrido muchos cambios; en conocimiento, tecnología y personal.
En 1988, el Dr. Jagelman se mudó al nuevo hospital satélite de la “Cleveland Clinic” en Florida. El Dr. Church tomó la dirección del registro cuando llegó a la Clínica en 1989. En el año 2017 el liderazgo fue transferido a otro cirujano colorrectal, el Dr. Matthew Kalady. A lo largo de los años se han descubierto los genotipos de la mayoría de los principales síndromes de cáncer colorrectal hereditario. Si bien, algunos síndromes siguen siendo difíciles de identificar, ahora somos capaces de ofrecer estudios genéticos a familias con fenotipos sugerentes. La tecnología de secuenciación de ADN ha cambiado, lo que lleva a la introducción de la secuenciación masiva (NGS) 3. Esto permite estudiar utilizando paneles ampliados de varios genes que cubren todos los síndromes conocidos y algunos genes menos relacionados.
Los paneles multigénicos son más rápidos y más baratos que la antigua secuenciación de un único gen mediante la técnica de Sanger y pueden conducir a resultados sorprendentes. Esto ha aumentado la necesidad de asesoramiento genético y de una comprensión de la biología de la carcinogénesis colorrectal. Hay al menos 10 síndromes hereditarios conocidos de cáncer colorrectal, donde podemos ofrecer pruebas genéticas y un manejo clínico sólido. Debido a que estos síndromes son raros, multigeneracionales y familiares, y porque los pacientes afectados necesitan atención multidisciplinaria compleja de por vida, un repositorio central de información es esencial para que la atención pueda ser organizada. Este repositorio central de información es el registro.
DEFINICIÓNEn términos simples, un registro es una lista; en el mundo de la medicina esto es a menudo, una lista de pacientes. Un Registro de Cáncer Colorrectal Hereditario es una lista de nombres; nombres de pacientes con un síndrome de cáncer colorrectal hereditario y los nombres de sus familiares. Otros antecedentes sobre estos pacientes y familiares pueden almacenarse para facilitar la atención clínica, permitir la educación de las familias y permitir la investigación clínica. A medida que avanza la tecnología de la información, se han diseñado bases de datos para su uso en este ámbito. La “Cleveland Clinic” diseñó su propia base de datos, Cologene™, para su uso como una herramienta para almacenar genealogías familiares, así como información clínica, y para utilizar la información para citar a los pacientes y realizar investigación. La base de datos está en uso en varios centros de cáncer colorrectal hereditarios en todo el mundo.
ESTRUCTURALa mayoría de los registros de cáncer colorrectal hereditarios surgen a partir de una o dos personas claves, con especial interés y experiencia en el área. El Registro de Poliposis de St Marks, el registro original fundado en 1929, surgió en torno a las habilidades quirúrgicas de John Percy Lockhart- Mummery y la experiencia en patología de Cuthbert Dukes 4. El Registro Johns Hopkins fue fundado en 1973 por Victor McKusick, el “padre” de la genética médica americana y el registro de Creighton en Omaha, Nebraska por un oncólogo médico llamado Henry Lynch. Hay evidencia de las personas fundadoras en muchos registros y por lo general ellos han sido de las áreas de cirugía, genética médica o gastroenterología. En el año 2004 revisamos los 18 registros de cáncer colorrectal hereditario en los EE.UU., y se observó una amplia gama de definiciones y métodos. El hallazgo más sorprendente fue el pequeño número de registros disponibles para el número potencialmente grande de pacientes y familias afectados 5. Los efectos de esta falta de registros pueden verse en los desafortunados resultados de los tratamientos realizados por aquellos con poca experiencia. En Cleveland el registro se basó en el interés de David Jagelman, un cirujano colorrectal que se había entrenado en el Hospital St Marks y había notado allí los beneficios del registro. Por lo tanto, el registro de Cleveland se centró en la experiencia quirúrgica colorrectal, pero a lo largo de los años se han añadido servicios especializados de gastroenterología, patología, genética, cirugía general, endocrinología, urología, psicología y ginecología.
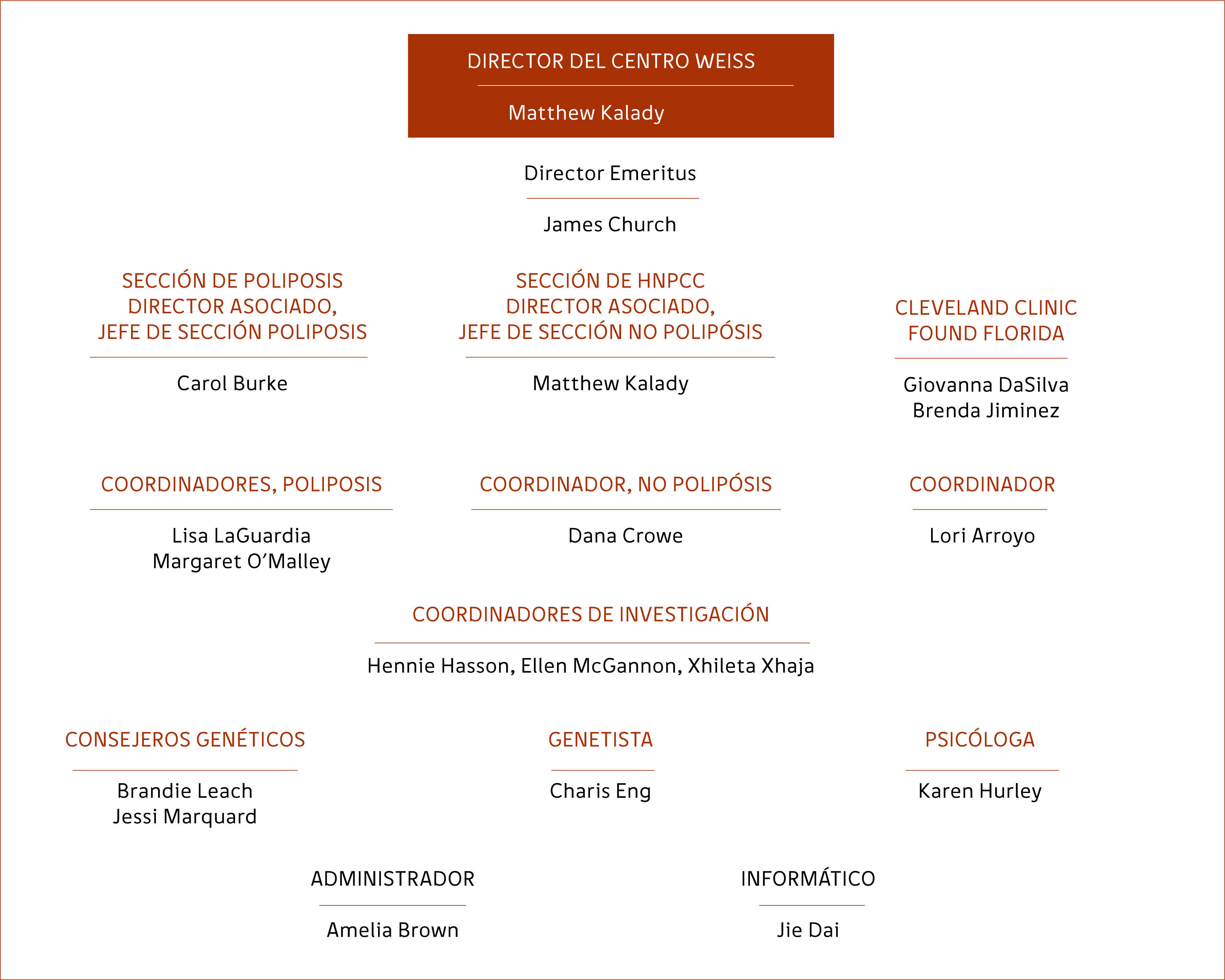
Por lo tanto, un registro comienza con un clínico interesado que se encarga de asignar a un coordinador de registro. El coordinador es el “intermediario” entre pacientes/familias y el personal del registro. Un coordinador recibe a los pacientes referidos, reúne antecedentes, agenda citas y es el contacto entre el registro y el paciente/familia. Los registros necesitan una base de datos, una oficina y algún apoyo organizacional. Sobre todo, necesitan financiamiento. Los registros pueden funcionar con un presupuesto ajustado, pero algunos apoyos deben venir de la institución anfitriona. Los registros generan ingresos atrayendo pacientes referidos, atendiendo a los pacientes y las familias de manera regular, y agendando citas para ellos con múltiples especialistas. En este sentido generan su propio financiamiento. La estructura actual del Registro de “Cleveland Clinic” se muestra en la figura 1. Debido al gran número de pacientes y familias, los síndromes se dividen en aquellos que implican poliposis y aquellos sin poliposis. La sede de “Florida” del Registro comparte la base de datos de Cologene, pero los pacientes son identificados de acuerdo con la Institución para que no se creen registros duplicados.
PROCESOLa misión del Registro de Cáncer Colorrectal Hereditario en la “Cleveland Clinic” es prevenir la muerte por cáncer relacionado con el síndrome, manteniendo la calidad de vida. La esencia del cumplimiento de esta misión es la excelencia en la atención al paciente. Esto implica un diagnóstico oportuno y preciso, una vigilancia eficaz y una endoscopía y cirugía apropiadas. Además de la atención al paciente, el cumplimiento de la misión implica la educación de los pacientes, las familias y los proveedores de atención médica, y el desempeño de la investigación relevante. Estos tres componentes del proceso de registro se detallan en la tabla 1.
Actividades del Centro Sanford R. Weiss MD para la Neoplasia Colorrectal Hereditaria
| ATENCIÓN AL PACIENTE | EDUCACIÓN | INVESTIGACIÓN |
|---|---|---|
| Clínica de Algo Riesgo Exámenes y consejería genética Clínica de pacientes ambulatorios Citas Médicas Compartidas Psicólogo Endoscopía y Cirugía Cologene Consultas a otras especialidades Grupo de apoyo | Folletos Asuntos familiares Sitio web Programas de educación pública Libro Día del Cáncer Colorrectal Hereditario Medios de comunicación social | Cologene Registros de Jagelman Presentaciones Manuscritos CGA/InSiGHT/IMRC Estudios de prevención de pólipos Estudios colaborativos: OCCPI CFR (Registro Colaborativo de Familias) |
CGA: “Collaborative Group of the Americas on Inherited Colorectal Cancer”. Grupo colaborativo de las Américas de cancer colorectal Hereditario.
InSiGHT: “International Society for Gastrointestinal Hereditary Tumours”. Sociedad Internacional para Tumores Gastrointestinales Hereditarios.
IMRC: “International Mismatch Repair Consortium”. Consorcio Internacional de Mala Reparación”
OCCPI: “Ohio Colorectal Cancer Prevention Initiative”. Iniciativa de Prevención del Cáncer Colorrectal de Ohio.
CFR: “Collaborative Familial Registry” Registro Colaborativo de Familias
Los pacientes referidos al registro generalmente son recibidos por un coordinador. Los antecedentes se solicitan, se reciben y se evalúan para determinar el síndrome probable que se padece el paciente, las pruebas médicas y genéticas que se han hecho, y el agendamiento probable que tendrá que ser establecido para el control médico. Los nuevos pacientes se reciben habitualmente en una clínica de “Alto Riesgo”, donde las consultas, las endoscopías y otros exámenes se programan el mismo día para facilitar la visita del paciente. Los pacientes a lo menos ven un cirujano colorrectal, un gastroenterólogo, o ambos, así como un consejero genético. Si el estudio genético es necesario y acordado, entonces se organiza la toma de este examen. Los pacientes reciben información sobre los síndromes que probablemente padezcan y después de que se obtiene la firma del consentimiento informado se enrrolan en el registro. Se dibuja un árbol genealógico completo y se ingresan los datos en el Cologene. Los familiares en riesgo deben ser contactados y se le pide al caso índice que lo haga, a menudo usando cartas que han sido proporcionadas por el registro. Se organizan y realizan cirugías o endoscopías.
Un desarrollo reciente en el registro es el inicio de citas médicas compartidas, donde grupos de pacientes con el mismo síndrome pueden recibir atención tanto individualizada como una sesión de información general sobre su síndrome. Es una manera eficiente de manejar a los pacientes referidos.
Durante el ingreso, los pacientes y las familias son evaluados para ver si necesitan ayuda social / financiera / psicológica. Hay recursos disponibles para ayudar con el financiamiento de los servicios necesarios que no tienen cobertura, con documentos relacionados con el trabajo (licencias médicas) y con apoyo psicológico.
Gran parte de la actividad del Registro es la vigilancia. Esto ocurre después de que los pacientes han tenido cirugías de reducción del riesgo o endoscopía. Se entregan recomendaciones para la vigilancia continua, los órganos y los intervalos dependen del genotipo y del fenotipo personal y familiar. Una vez que se establecen los programas de vigilancia, se ingresan en el Cologene, que envía cartas automáticas para recordar a los pacientes de una próxima cita.
EDUCACIÓNComo se muestra en la tabla 1, la educación a los pacientes, a las familias y a los proveedores de atención médica es un papel importante para el registro. Nuestra práctica es proporcionar la atención especializada necesaria y luego regresar al paciente y a la familia a sus médicos locales. Sin embargo, tanto la familia como los profesionales de la salud necesitan ser educados sobre el síndrome. Con este fin diseñamos folletos y un boletín informativo, y mantenemos un sitio web con enlaces a los recursos. Un Día del Cáncer Colorrectal Hereditario ofrece a los pacientes y a sus familias oportunidades de reunirse de manera menos formal con el personal del Registro e interactuar con ellos de manera más completa. Los medios sociales son cada vez más utilizados por los pacientes para comparar experiencias y establecer grupos de apoyo. La participación en esto es parte del proceso de registro.
INVESTIGACIÓNLa investigación es una respuesta al registro de la complejidad del cáncer colorrectal hereditario y la oportunidad que significa contar con un gran número de familias y pacientes afectados. Cologene es el centro de actividad de la investigación ya que el registro aborda las preguntas clínicas importantes para los pacientes y los profesionales de la salud. Debido a la rareza de los síndromes, la investigación colaborativa es a menudo necesaria. A veces esto se organiza a través de los grupos de colaboración que existen y de los cuales el registro de “Cleveland Clinic” es una parte integral. Existen el Grupo de Colaboración de las Américas para el cáncer colorrectal hereditario (CGA), y la Sociedad Internacional de Tumores Hereditarios Gastrointestinales (InSiGHT). El registro también participa en estudios prospectivos de quimioprevención y es un recurso para otras instituciones que pueden necesitar pacientes adicionales para agregar a sus estudios.
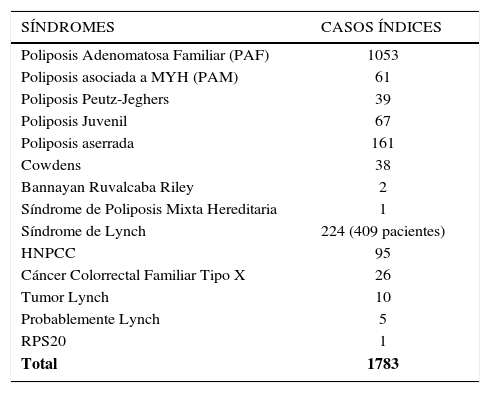
FLUJO DE PACIENTESEl número de casos índices con los diferentes síndromes a diciembre de 2016 se muestra en la tabla 2. La actividad ambulatoria para 2016 se muestra en la tabla 3. Estos números reflejan un aumento constante de pacientes nuevos y familias nuevas que son remitidos al Registro. Estas son a menudo presentaciones complejas ya que veces implican tratar de salvar situaciones desafortunadas que se han producido como resultado de la atención prestada en otros lugares. El registro de “Cleveland Clinic” tiene un interés especial en la enfermedad desmoide, y tiene un registro específico para estos pacientes. El registro de la “Cleveland Clinic” también cuenta con cirugía avanzada y técnicas de endoscopía, incluyendo cirugía mínimamente invasiva y robótica, duodenectomía con preservación del páncreas y resección endoscópica de la mucosa.
NÚMEROS DE CASOS ÍNDICES CON SÍNDROMES DE CÁNCER COLORRECTAL HEREDITARIOS A DICIEMBRE DE 2016
| SÍNDROMES | CASOS ÍNDICES |
|---|---|
| Poliposis Adenomatosa Familiar (PAF) | 1053 |
| Poliposis asociada a MYH (PAM) | 61 |
| Poliposis Peutz-Jeghers | 39 |
| Poliposis Juvenil | 67 |
| Poliposis aserrada | 161 |
| Cowdens | 38 |
| Bannayan Ruvalcaba Riley | 2 |
| Síndrome de Poliposis Mixta Hereditaria | 1 |
| Síndrome de Lynch | 224 (409 pacientes) |
| HNPCC | 95 |
| Cáncer Colorrectal Familiar Tipo X | 26 |
| Tumor Lynch | 10 |
| Probablemente Lynch | 5 |
| RPS20 | 1 |
| Total | 1783 |
HNPCC = cáncer colorrectal hereditario no polipósico (CCHNP) (definido como una familia que se ajusta a los criterios Ámsterdam I o II)
Tumor Lynch = tumor colorrectal con alta inestabilidad microsatelital o ausencia de una proteína de reparación por inmunohistoquímica, pero sin mutación en la línea germinal y sin historia familiar compatible con Ámsterdam
Probablemente Lynch = tumor colorrectal con alta inestabilidad microsatelital o ausencia de una proteína de reparación por inmunohistoquímica, pero sin mutación en la línea germinal, pero con una historia familiar compatible con Ámsterdam
RPS20: gen que codifica a un componente (S20) de la subunidad ribosomal pequeña.
No hay duda de que el Registro de Cáncer Colorrectal Hereditario en la “Cleveland Clinic” ha florecido desde su creación en 1979. Debido al apoyo institucional, la excelencia de los Coordinadores de Registro y el trabajo duro y la dedicación de los Médicos, la reputación del registro es insuperable. El número de casos índice habla por sí mismo. El registro ha producido más de 100 artículos en la literatura y al menos un libro sobre Genética Molecular del Cáncer Colorrectal 6. Cada uno de los médicos del Registro ha sido Presidente de la CGA, una organización que el Registro desempeñó un papel clave en la fundación. En el año 2003, el Registro organizó la reunión conjunta del “Leeds Castle Polyposis Group” y el “International Collaborative Group on HNPCC”, mientras que la CGA se reunió aquí en 1997 y 2008. La bibliografía del Registro muestra contribuciones clave en la enfermedad desmoide 7–18, pólipos gastrointestinales de la parte alta 19–23, cirugía colorrectal en PAF 24–39, cirugía profiláctica en síndrome de Lynch 40–42, enfermedad tiroidea en PAF y poliposis asociada a MYH (MAP) 43–45, telangiectasia hemorrágica hereditaria en poliposis juvenil (JPS) 46, cirugía en JPS y Síndrome Peutz-Jeghers 47–49, el fenotipo colorrectal de la enfermedad de Cowdens 50 y el síndrome raro de la poliposis mixta hereditaria 51. Los artículos de revisión han intentado mejorar la comprensión en la comunidad médica de nuevos síndromes y de los avances en tecnologías de los estudios genéticos 52–59 y el Registro ha sido representado en varios artículos de las guías clínicas 60–62. El registro ha servido de modelo para otras instituciones que desean iniciar su propio trabajo. Este es un papel importante para un registro establecido y que fomentamos.
EL FUTUROLos síndromes de cáncer colorrectal hereditarios están aquí para quedarse. Representan alrededor del 5% de todos los cánceres colorrectales y son importantes por la oportunidad que brindan para intervenir en familias de alto riesgo y salvar vidas. También son importantes para las lecciones que enseñan en la biología y el manejo del cáncer colorrectal esporádico. El campo se está volviendo cada vez más complejo, ya que el avance en la frontera del conocimiento descubre nuevas alteraciones moleculares que resultan en una predisposición hereditaria al cáncer colorrectal. Es necesario más esfuerzo clínico para diseñar tratamientos específicos de pacientes en lugar de tratamientos específicos para cada síndrome. La calidad de la vigilancia debe seguir mejorando y la importancia de la calidad de vida no puede ser subestimada. Las ramificaciones de salud mental de estos síndromes son poco conocidas y se necesita un gran esfuerzo para proporcionar la evaluación y el tratamiento que los pacientes merecen. Todo esto se llevará a cabo a través de registros, pero para que esto suceda, se necesitan médicos y consejeros nuevos y entusiastas para continuar el esfuerzo.
Los autores declaran no tener conflictos de interés en relación a este artículo.