El término cáncer de piel no melanoma (CPNM) comprende una gama de lesiones de la piel y abarca linfomas cutáneos, tumores de origen anexial, carcinomas de células de Merkel y una serie de otras neoplasias infrecuentes, pero se usa principalmente para definir carcinomas de células basales (CBC) y carcinomas de células escamosas (CEC), por su absoluta mayor frecuencia y relevancia. La agrupación de estos dos últimos, bajo un término general común plantea desafíos, porque existen diferencias claras en su etiopatogenia, curso clínico y estrategias de manejo preventivo y terapéutico. Los CPNM son los cánceres humanos más comunes y, a pesar de la creciente conciencia pública sobre los efectos causales y nocivos de múltiples factores, principalmente la exposición solar, la incidencia continúa en un aumento progresivo y muy preocupante a nivel mundial. Independientemente de esto, los registros y publicaciones de su incidencia son pocos y no reflejan la realidad del problema a nivel local, regional ni mundial. Las campañas de educación y métodos prevención han aumentado progresivamente por distintos medios de comunicación personalizada, audiovisuales y escritas, especialmente en relación y de acuerdo a los factores de riesgo regionales, ambientales, poblacionales, personales, étnicos, laborales. Sin embargo, claramente y acompañado de múltiples factores relacionados al desarrollo de la sociedad, entre otros el aumento de las expectativas de vida y a la evidente poca adherencia de la población a las recomendaciones, es un problema sanitario de crecimiento sostenido y exponencial.
The term non-melanoma skin cancer (NMSC) comprises a range of skin lesions and encompasses cutaneous lymphomas, tumors of adnexal origin, Merkel cell carcinomas and a number of other uncommon neoplasms, but is used primarily to define basal cells carcinomas (BCC) and squamous cell carcinomas (SCC), due to their absolute greater frequency and relevance. The grouping of these last two, under a common general term poses challenges, because there are clear differences in its etiopathogenesis, clinical course and preventive and therapeutic management strategies. NMSC are the most common human cancers and, despite the growing public awareness of the causal and harmful effects of multiple factors, mainly sun exposure, the incidence continues in a progressive and very worrying increase worldwide. Regardless of this, the records of its incidence are few and do not reflect the reality of the problem at local, regional or global level. The teaching campaigns and methods of prevention have progressively increased through different means of personalized communication, audiovisual and written, especially in relation and according to the regional, environmental, population, personal, ethnic, labor risk factors, etc., however, clearly and accompanied by multiple factors related to the development of society, among others the increase in life expectancy and the evident lack of adherence of the population to the recommendations, is a health problem of sustained and exponential growth.
La palabra epidemiología, traducida del griego, literalmente significa “el estudio de la población”. Bajo la definición de cáncer de piel no melanoma (CPNM), describimos todas las neoplasias malignas que no son derivadas de un tumor cutáneo de células pigmentadas que contienen melanina y epidemiológicamente el término CPNM, prácticamente se refiere a los carcinomas de queratinocitos, a saber, carcinomas de células basales (CBC) y de células escamosas (CEC), ya que estas representan el 99% de los tumores en este grupo1.
La incidencia de CPNM es 18-20 veces mayor que la del melanoma maligno (MM) sin embargo, en comparación con el MM, la epidemiología de CPNM es poco estudiada y deficiente en sus datos2. Existen limitaciones significativas atribuidas principalmente a su marcada variabilidad geográfica, así como al hecho de que los grandes registros de cáncer, por lo general, excluyen o son incompletos en relación al CPNM, siendo además los análisis secundarios de datos bastante limitados3.
Afortunadamente la mayoría de estos son de lenta progresión y baja tasa de mortalidad teniendo un mínimo potencial metastásico, pero, junto con las dificultades prácticas para determinar y registrar la gran cantidad de casos, no se conoce estrictamente la magnitud del problema. La incidencia de CBC y CEC metastásico varía entre 0.00281-0.05% y 0.5-1.6%, respectivamente, mientras que la tasa de mortalidad ajustada por edad se estima en 0.12 por 100000 para CBC y 0.3 por 100000 para CEC4,5.
Esta patología, pesar de su potencial maligno relativamente bajo, se asocia con una notable morbilidad y un costo económico considerable y progresivo6,7.
La falta de registros importantes nacionales y en general mundiales, restringe la capacidad para estimar y establecer tasas de incidencia definidas y comparables. La gran mayoría de los estudios de incidencia han sido enfocados en poblaciones de raza blanca en Europa, Estados Unidos y Australia; sin embargo, sólo hay datos limitados para otros tipos de poblaciones y en regiones como América, África y Asia8.
A nivel mundial, la incidencia de CPNM es variable con registros de tasas más altas en Australia >1000/100000 personas-año (CBC, 2448/100000 el 2011) y las más bajas en partes de África con <1/100000 personas-año para CBC, cifra baja pero posiblemente irreal por problema de registro. Las tasas de incidencia promedio en Inglaterra fueron 76.2/100000 y 22.6/100000 personas-año para CBC y CEC, respectivamente, con tasas más altas registradas en la región sudoeste de Inglaterra (CBC 121.29/100000 y CEC 33.02/100000) y tasas más bajas en Londres (CBC 0.24/100 000 y CEC14.98/100000). Las tasas de incidencia en el Reino Unido parecen estar aumentando a un ritmo mayor en comparación con el resto de Europa, donde el promedio estándar europeo registrado es 129.3/100000 en hombres y 90.8/100000 en mujeres. En el Reino Unido (2015) se registraron mas de 76000 casos nuevos CPNM, pero estimándose una incidencia real de al menos 100000 casos por año9.
En Gales, (1988-1998) la incidencia bruta de CPNM aumentó de 173.5 a 265.4 por 100000 habitantes. En Irlanda del Norte (1993-2003), la incidencia de melanoma y cáncer de piel no melanoma aumentó en un 62%. La incidencia creciente de CPNM se debe a la mayor conciencia de la enfermedad por parte de los pacientes y los médicos, además de una codificación mejorada que permite registro10. En Estados Unidos la tasa promedio registrada es 450/100000 (2010). La incidencia de CEC aumentó un 3-10% por año, en cambio, el CBC ha aumentado entre 20-80%. CBC es más común que CEC, con una proporción estandarizada de aproximadamente 4:1.211.
En la tabla n° 1 muestra las tendencias de estudios en varios países de la incidencia comparativa de CPNM1,10,12–16.
Ca. basocelular y espinocelular, incidencia comparativa en estudios de varios países
| Incidencia anual comparativa según país/latitud (×100.000hab.) H: hombre M: mujer | Ca. Basocelular | Ca. Espinocelular |
|---|---|---|
| - Escocia (2007) Latitud: N 56°0′0ref:15 | H: 60.6M: 47.4 | H: 24M: 9.4 |
| - Irlanda del N. (2007) Latitud: N 53°19′59ref: 12 | H: 94M: 72 | H: 46M: 23 |
| - Gales (2000) Latitud: N 52°30′0ref:10 | H: 12.,9M: 104.8 | H: 25.2M: 8.6 |
| - Alemania (2003) Latitud: N 51°0′0ref:1 | H: 53.6M: 44 | H: 11.2M: 5.3 |
| - Canadá (2007) Latitud: N 49°17′19ref:16 | H: 87M: 6.8 | H: 34M: 16 |
| - Holanda (2004) Latitud: N 27°44′59ref:13 | H: 93M: 82 | |
| - Australia (2008) Latitud: S 27°0′0ref:14 | H: 1041M: 1070 | H: 772M: 442 |
(ref.: 1,10,12,13,14,15 y 16)
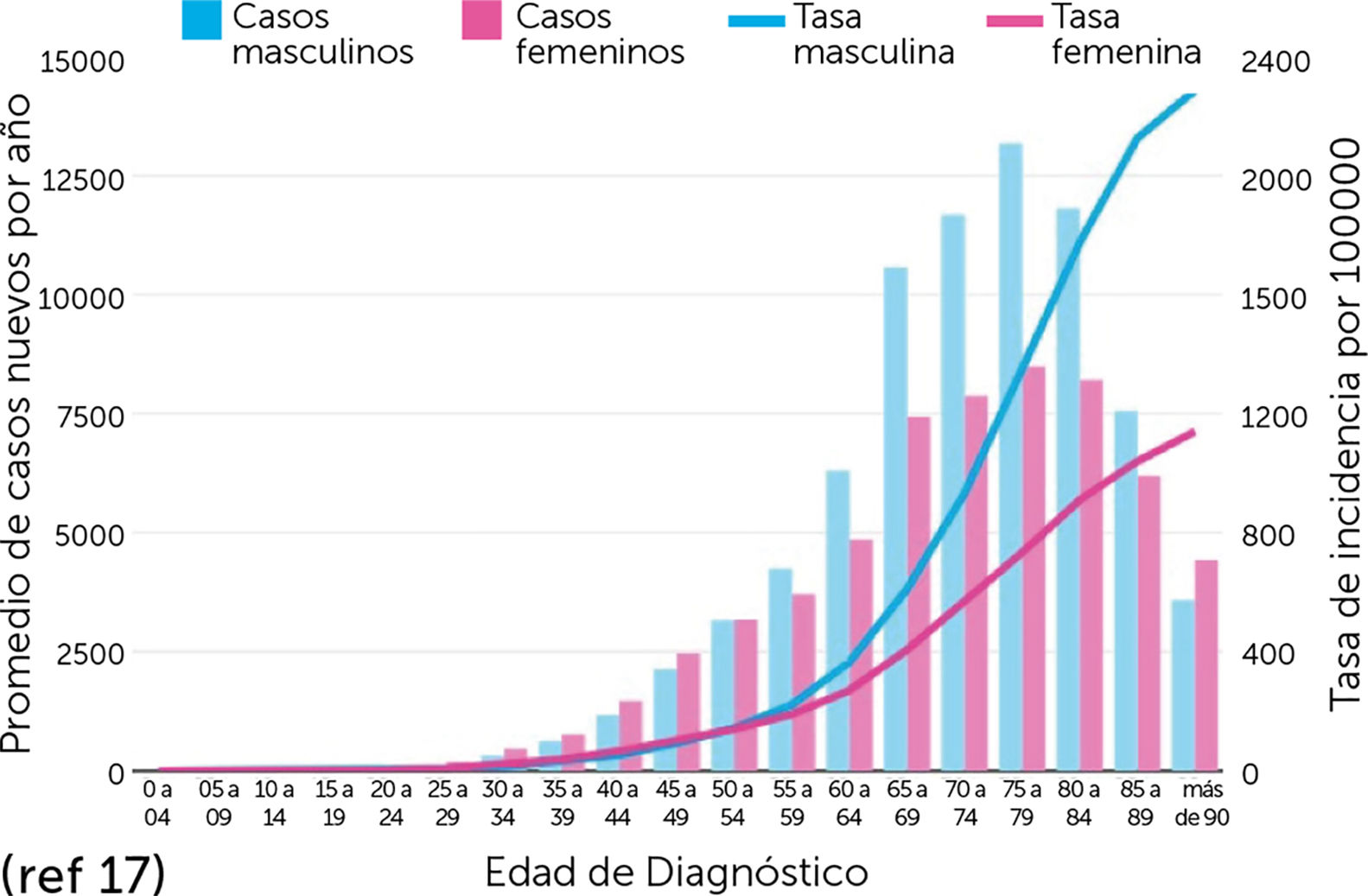
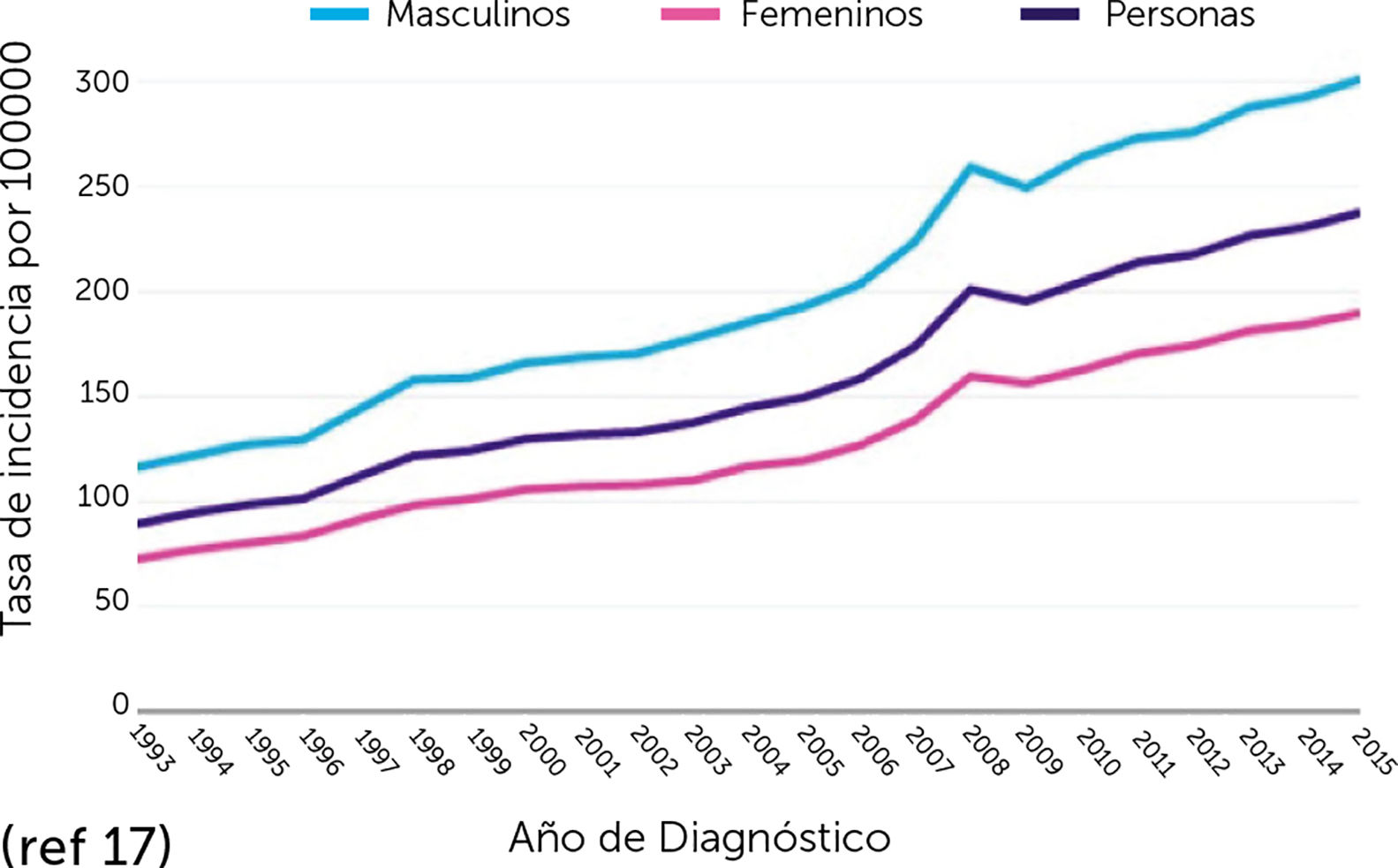
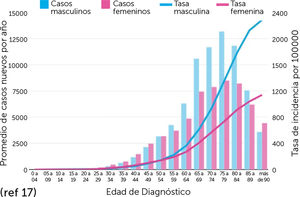
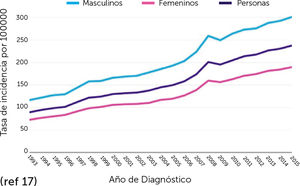
El envejecimiento progresivo de la población ha significado un aumento del número de casos ya que la incidencia del CPNM aumenta con la edad, puesto que el 80% de los casos ocurre en personas hombres de 60 años o más. Además, se prevé un aumento significativo de la incidencia en al menos un 50% para 2030 (Fig. 1 y 2)17.
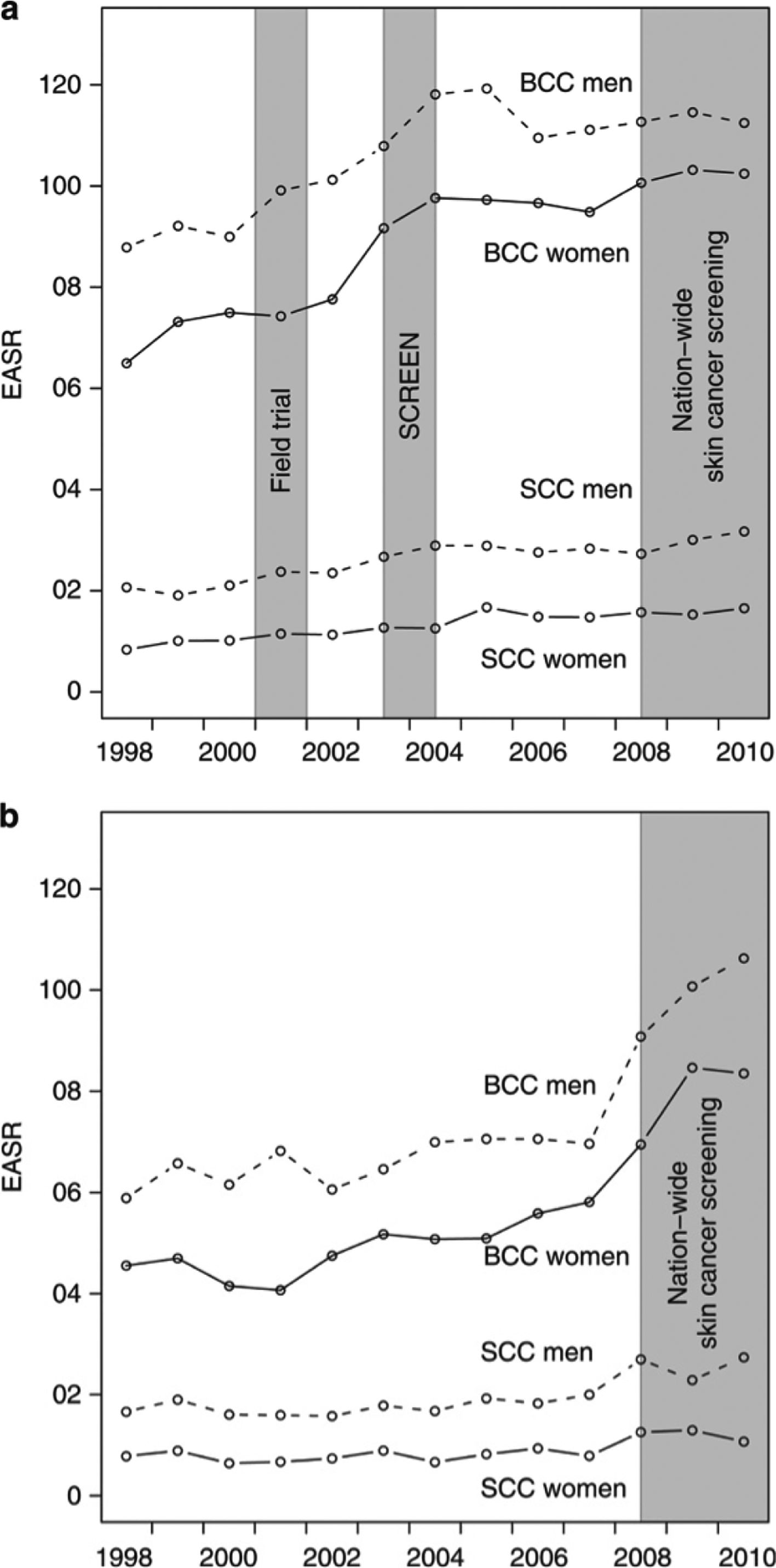
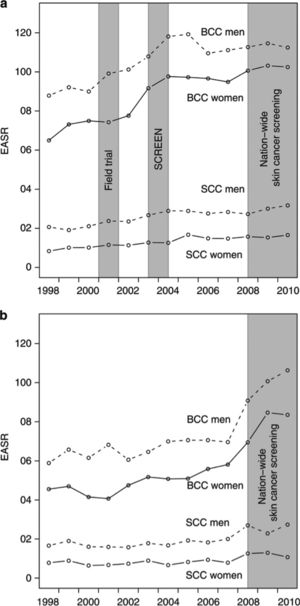
Siendo el CPNM la neoplasia maligna más común, cuya importancia para la salud pública a menudo no se reconoce, el impacto del screening en la incidencia es muy importante. Un estudio en Schleswig-Holstein, Alemania, analizó cuatro períodos: sin screening (1998-2000), proyecto piloto para probar eficacia (2003-2004), después de screening (2004-2008), y detección de cáncer de piel en todo el país (2008-2010) a una región de referencia (Sarre, Alemania). Durante la fase de implementación (2003-2004) la incidencia aumento de 81.5 a 1115/100.000, 47% las mujeres y 34% los hombres. Durante la detección más reciente, 2008-2010, la incidencia de CPNM estandarizada por edad llegó a 119/100000 para mujeres y 145/100000 para hombres. Todos los grupos de edad en las mujeres se vieron afectados por el aumento, pero los aumentos en los hombres se limitaron principalmente a los grupos de mayor edad18 (Fig. 3).
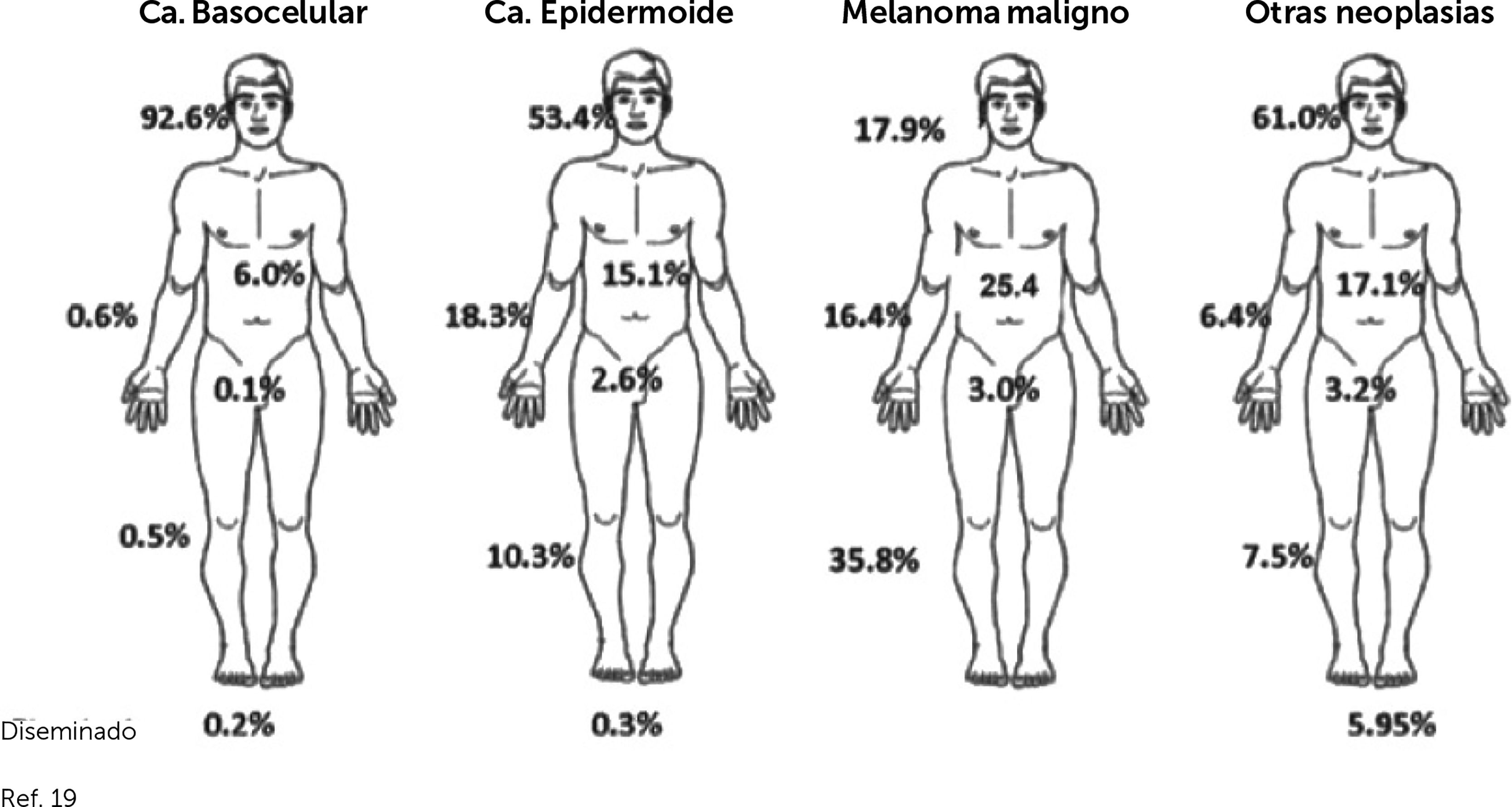
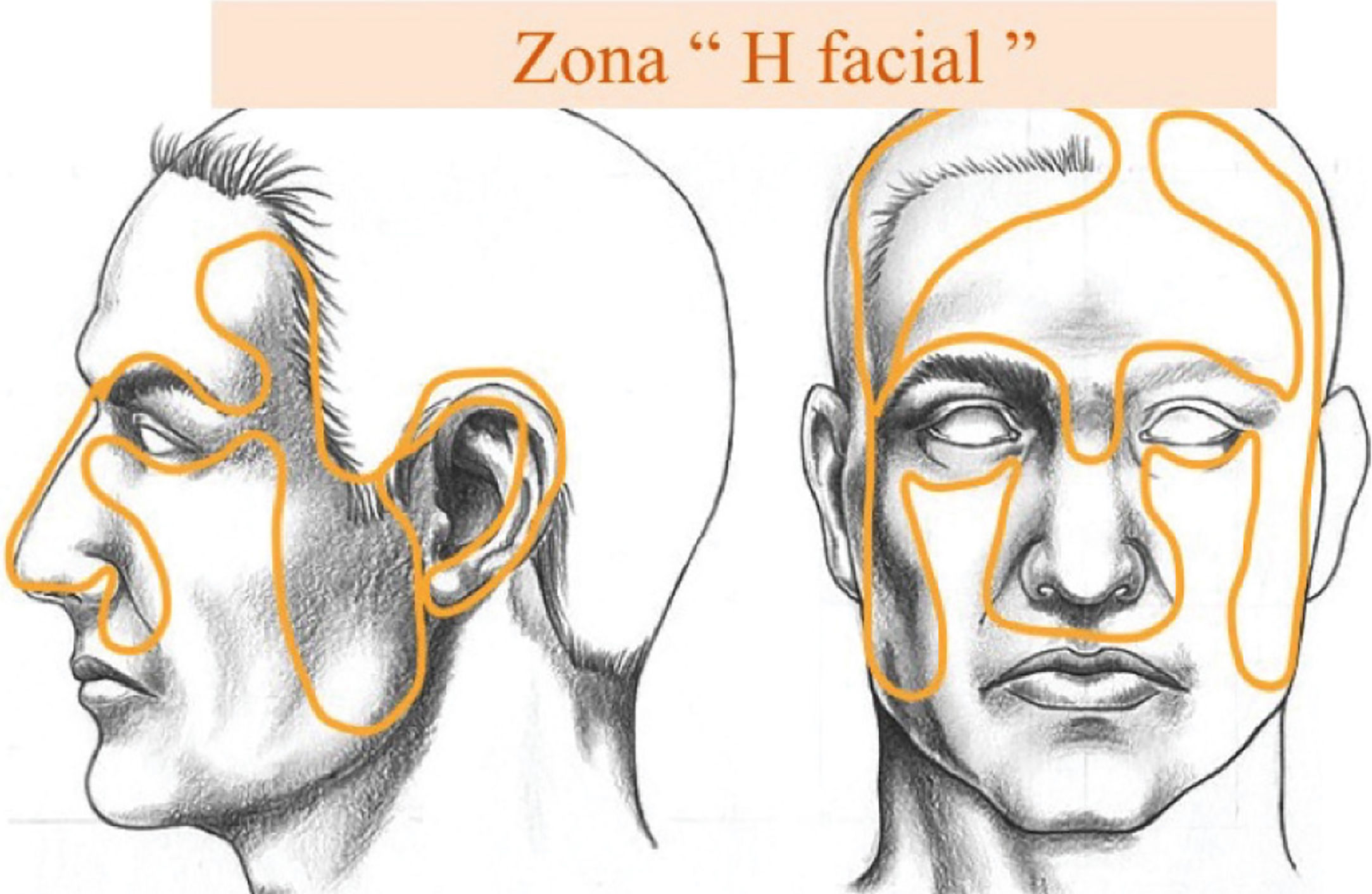
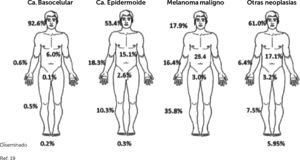
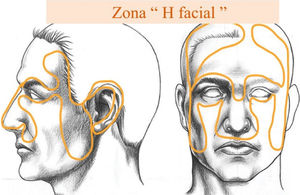
En cuanto a frecuencia según localización anatómica, específicamente en cabeza y cuello del CPNM hay pocos datos. La frecuencia de casos de ubicación en cabeza y cuello es de 92.6% de los CBC, 53.4% de los CEC, 61% en otros CPNM y en MM solo el 17.9% 19 (Fig. 4), relativamente similar al estudio de screening en Schleswig-Holstein, Alemania18. En cuanto a ubicación cutánea facial, la denominada zona “H” facial, es la de mayor frecuencia relativa (Fig. 5).
MÉTODOS DE PREVENCIÓN Y POBLACIONES DE ALTO RIESGO QUE REQUIEREN PROGRAMAS DE PREVENCIÓN Y DETECCIÓN PRECOZMétodos de PrevenciónLa prevención se debe subdividir en la PREVENCIÓN PRIMARIA, que significa evitar el desarrollo de la enfermedad, mediante campañas constantes de promoción y enseñanzas de la protección solar y exposición a radiación UV; la PREVENCIÓN SECUNDARIA, encargada de la detección y tratamiento oportuno, mediante campañas de screening (revisión y chequeo) y manejo y la PREVENCIÓN TERCIARIA o prevención de progresión o complicaciones (Tabla 2).
Métodos de Prevención CPNM
| TIPO DE PREVENCIÓN | ¿QUÉ DEBE ABARCAR? | ¿QUÉ DEBE INCLUIR? |
|---|---|---|
| Prevención Primaria | Conocer el riesgo y evitar el desarrollo de la enfermedad | Campañas de protección solar y según factores de riesgo |
| Prevención Secundaria | Detección y tratamiento precoz | Campañas de screening |
| Prevención Terciaria | Prevención de progresión y complicaciones | Seguimiento adecuado |
Una buena nemotecnia de Prevención Primaria, es la promoción del Decálogo para la prevención del cáncer de piel promocionado por la Sociedad Chilena de Dermatología (Tabla 3).
Decálogo para la prevención (Promoción Sociedad Chilena de Dermatología)
| DECÁLOGO PREVENCIÓN DEL CANCER DE PIEL |
|---|
| 1) Uso adecuado y frecuente de PROTECCIÓN SOLAR |
| 2) EVITAR exposición solar en horas de mayor intensidad |
| 3) No exponer al sol directo en MENORES DE 3 AÑOS |
| 4) Utilizar protección en ACTIVIDADES al AIRE LIBRE |
| 5) PROTECCIÓN ante menor sensación de calor (nubosidad, viento, altitud, superficies reflectantes como arena, nieve, aire) |
| 6) LENTES con filtro UVA/UVB, gorro y ropa seca (protección UV) |
| 7) SECARSE después de cada baño |
| 8) BEBER AGUA para mantener hidratación |
| 9) Evitar SESIONES BRONCEADORAS con rayos UVA |
| 10) REVISAR lunares y pecas y acudir a dermatólogo si cambian |
Los factores de riesgo más importantes para desarrollar un CPNM dependen de factores genotípicos, fenotípicos, personales y ambientales fundamentalmente la edad, género, tipo de piel y anexos, actividades laborales, hábitos personales y deportivos, etnia, lugar de residencia y patologías médicas, genéticas, relacionados a la exposición a la luz solar y su radiación ultravioleta (RUV).
La RUV se subdivide, en función de la longitud de onda, en UVA, UVB y UVC y desempeña un papel en el desarrollo de CPNM a través de varios mecanismos. La UVC es filtrada por la capa de ozono evitando que llegue a la superficie de la tierra, sin embargo la disminución sostenida de esta altera esa función. La UVB es responsable del mayor daño de la piel después de la exposición al sol y UVA, por su mayor longitud de onda, penetra más profundamente en la piel. La RUV actúa causando mutaciones en el ADN e inmunosupresión localizada, cuyo deterioro impide su detección temprana y eliminación efectiva permitiendo que la neoplasia se desarrolle.
La RUV es el factor exógeno más reconocido como implicado en la patogénesis del CPNM. En las sociedades occidentales, el comportamiento de búsqueda de bronceado, que incluye exposición directa al sol y broncearse bajo techo, actividades al aire libre sin protección solar adecuada, estilo de vestimenta y agotamiento de la capa de ozono se encuentran entre los parámetros que contribuyen a la mayor exposición a la RUV.
POBLACIONES DE ALTO RIESGO- 1)
Individuos portadores de lesiones precursoras
Tienen un mayor riesgo desarrollar un CEC, en que, por ejemplo, la enfermedad de Bowen se puede convertir en CEC en el 4-6% de los casos mientras que la progresión de queratosis actínica (QA) a CEC varía de 0.025% a 20%19,20.
- 2)
Portadores de CPNM previo
El riesgo no estaría bien definido, pero a mayor número, la incidencia sería mayor. El riesgo de desarrollar otro CPNM dentro de los 3 años siguientes es del 38% y con 3 a 9 CPNM previos, este riesgo aumenta al 93%21.
- 3)
Inmunodeficiencias
Personas trasplantadas tienen un riesgo tres o cuatro veces mayor en comparación con la población general, siendo aun muchísimo mayor y exponencial en el tiempo, en los trasplantados renales. El riesgo de desarrollar CPNM es dramáticamente más alto en personas con quimioterapia.
En las personas inmunocomprometidas, debido a trastornos congénitos, infecciones virales o SIDA, el CPNM es muy frecuente y su incidencia es más alta y a más temprana edad que en la población general, aunque no hay suficientes datos epidemiológicos para confirmarlo22.
- 4)
Xeroderma pigmentoso
Las personas con el raro trastorno genético hereditario (autosómico recesivo) de la piel, Xeroderma Pigmentoso (XP), tienen una anormalidad en la capacidad para reparar el daño del ADN inducido por la RUV.
- 5)
Albinismo
El albinismo describe a las personas que carecen de pigmento en la piel y, por lo tanto, a la capacidad de broncearse y es causado por un gran grupo de trastornos genéticos. Los albinos carecen de los efectos protectores de la melanina en la piel23.
- 6)
Traumas y quemaduras
El CEC es más frecuente en sitios de afecciones inflamatorias cutáneas crónicas y en secuelas por quemaduras o traumatismos.
- 7)
Síndrome de nevus de células basales
El síndrome de nevus de células basales o Síndrome de Gorlin, es una afección genética autosómica dominante caracterizada por una variedad de anomalías esqueléticas y cutáneas y una mayor incidencia de CBC antes de los 30 años.
- 8)
Exposición al arsénico
El arsénico es el vigésimo elemento más abundante y exhibe efectos agudos y crónicos en humanos. Es ubicuo en ciertos suelos y se encuentra en altas concentraciones en pozos de agua en Taiwán, Argentina, Suecia y otras regiones donde la minería y la fundición es prevalente. También está presente en algunas formas de medicina tradicional india y en bebidas alcohólicas producidas ilegalmente. Muchas ocupaciones involucran la exposición al arsénico, incluida la industria agrícola. Toma un promedio de 17.8 años desde la exposición inicial al arsénico hasta eldesarrollo de un CPNM24.
- 9)
Epidermólisis bulosa distrófica recesiva (EBDR)
Se cree que EBDR Hallopeau-Siemens (EBDRHS), el subtipo más generalizado de EBDR, es una de las enfermedades crónicas más devastadoras conocidas por los seres humanos. Se debe a un defecto hereditario en el gen de colágeno tipo VII, cuya función es formar fibrillas de anclaje, cruciales en integrar la epidermis de la dermis. Las complicaciones más graves son los CEC, que tienden a aparecer en lesiones cutáneas erosionadas crónicamente o hiperqueratósicas. Aproximadamente el 85% de todas las personas con EBDRHS habrán desarrollado un CEC a la edad de 45 años y el riesgo es aproximadamente 50 veces superior al normal.
- 10)
Personas tratadas con psoraleno (fotosensibilizante) y ultravioleta A (PUVA)
PUVA ha sido ampliamente utilizado como un tratamiento para la psoriasis y otras afecciones de la piel. La exposición a PUVA aumenta el riesgo de CEC. Es mutagénica y carcinogénica además de inmunosupresora en la piel.
Una combinación de prevención primaria, secundaria y terciaria es particularmente necesaria para las personas que están en alto riesgo de desarrollar CPNM.
DIAGNÓSTICO PRECOZ DE CÁNCER DE PIEL NO MELANOMA EN REGIÓN FACIALRol del pacienteEs ampliamente reconocido que el rol del paciente es fundamental en el diagnóstico precoz del cáncer de piel. Se ha reportado que el 57% de los melanomas son identificados por el paciente. En el caso del paciente que ya presentó un primer melanoma, se ha reportado que la educación en diagnóstico precoz y los controles regulares, disminuyen el grosor del segundo melanoma detectado25.
Si bien la mayoría de los reportes están focalizados en el melanoma maligno, esta situación también se observa en la práctica diaria de pacientes con cáncer de piel no-melanoma.
La utilidad del auto-examen regular de la piel como método para la detección precoz de cáncer de piel ha sido ampliamente demostrada. Incluso existe evidencia de que disminuiría la mortalidad asociada al cáncer de piel, específicamente de melanoma26. Una estrategia para optimizar su eficacia es mediante el uso de fotografías de referencia de toda la piel del paciente como ayuda para identificar lesiones nuevas o cambiantes27. En el caso de la región facial la utilidad del auto-examen apoyado por fotografías podría ser menor, ya que ésta es observada con una alta frecuencia por el paciente y las personas que lo rodean, facilitando la identificación de una lesión sospechosa.
Rol del examen dermatólogico completoEs fundamental el examen completo de la piel ya que con frecuencia el paciente presenta más de una lesión al momento del diagnóstico. En un estudio australiano se reportó que en 100 pacientes derivados por un cáncer de piel, en un 46% de ellos se pesquisó un segundo tumor maligno cutáneo al realizar un examen físico completo28. Otro estudio reportó que al realizar un examen cutáneo completo a 306 adultos mayores residentes de cuatros casa de reposo, se encontró que un 5.6% de ellos tenía un cáncer de piel no detectado previamente. Destaca en este trabajo que el 80% de estos tumores estaba ubicado en la región de la cabeza y cuello29.
Rol de la dermatoscopíaEn la actualidad un examen dermatológico completo debe ser realizado siempre mediante el uso de un dermatoscopio. Este instrumento consiste en una lupa capaz de aumentar la imagen de una lesión en 10-12x. Con el fin de eliminar el brillo de la superficie de la piel y lograr visualizar estructuras subyacentes, se utiliza en dos modos: luz no polarizada y luz polarizada. La luz no polarizada requiere del uso de un líquido (agua, alcohol, gel.) como interfase entre la piel y el lente. En el caso de la luz polarizada, el brillo se elimina mediante el efecto del polarizador cuya función es bloquear todos aquellos haces de luz que no se reflejan en un ángulo 90 grados respecto al plano horizontal. La ventaja de ambas modalidades es la posibilidad de observar estructuras subyacentes ubicadas en la epidermis y dermis.
Esta observación de atributos que no son visibles a ojo desnudo han validado ampliamente a la dermatoscopía como una herramienta para mejorar la asertividad en el diagnóstico del cáncer de piel, reportándose una sensibilidad del 98.6%30,31.
La dermatoscopía tiene un rol fundamental en el examen clínico de un paciente con foto daño, especialmente en la región facial. En las ultimas décadas se ha logrado caracterizar de forma muy especifica los hallazgos en la dermatoscopía del cáncer de piel no melanoma.
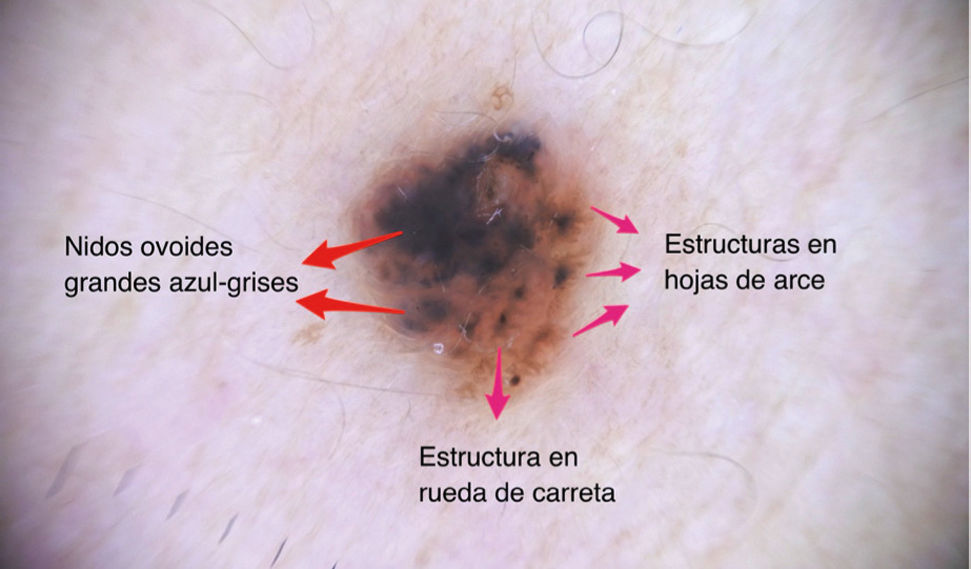
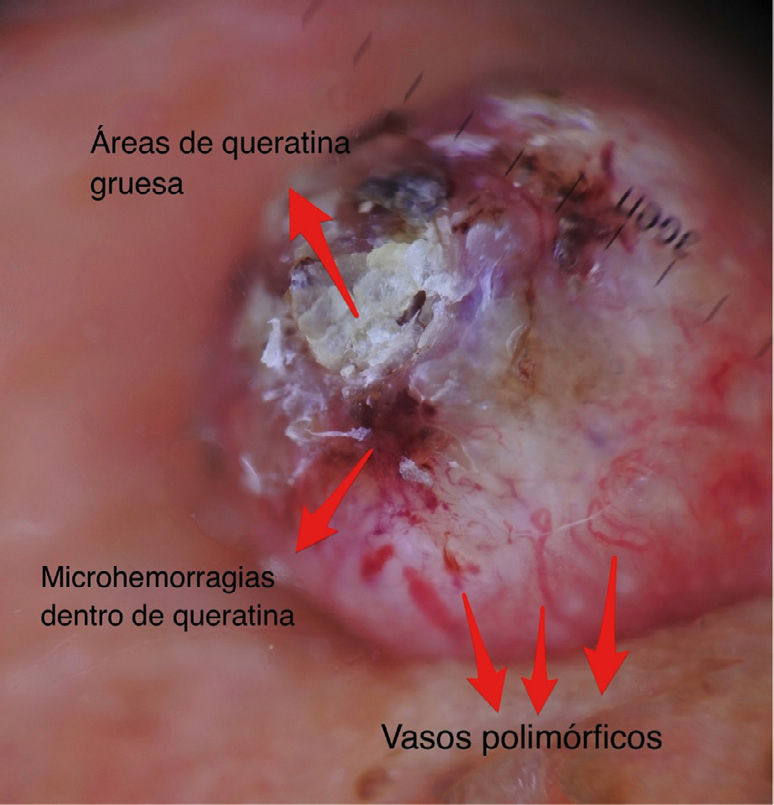
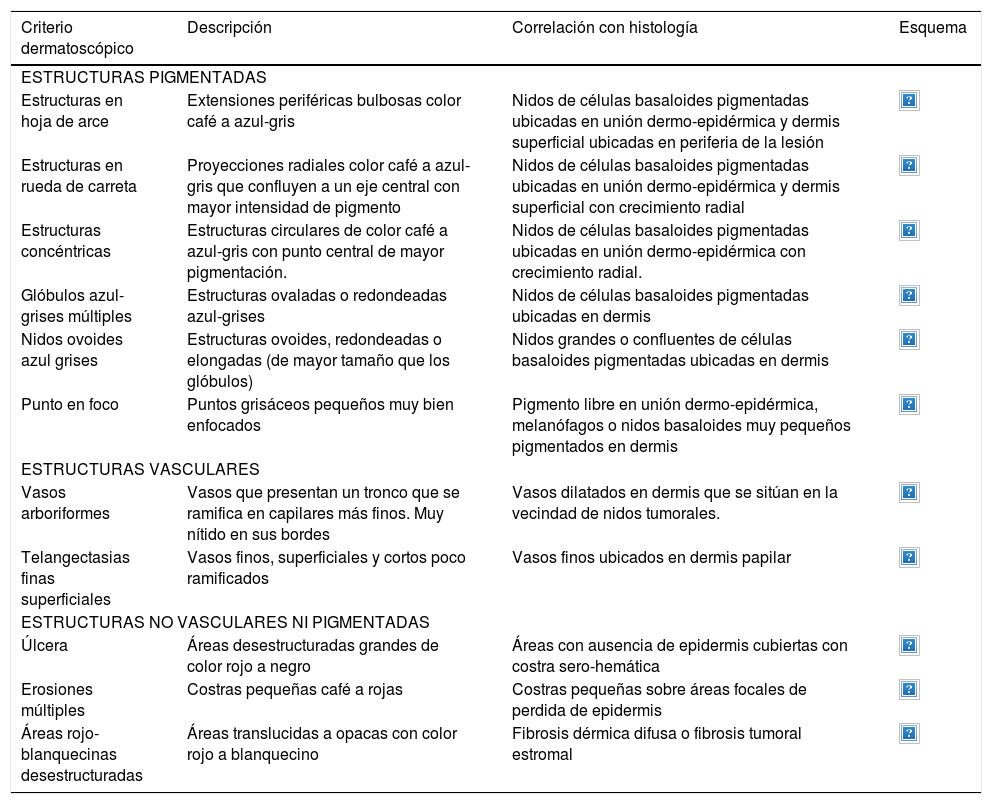
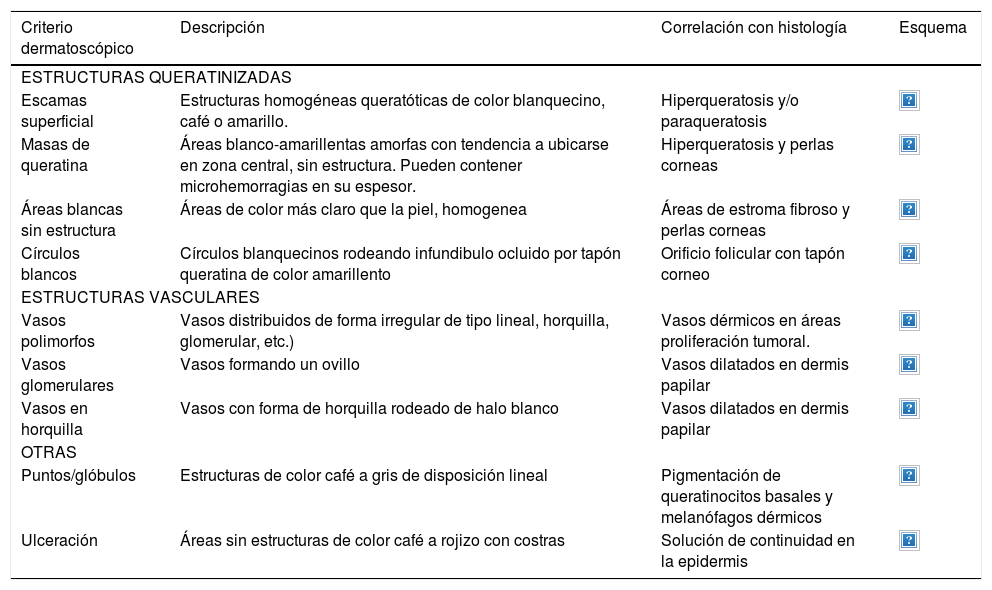
A continuación se describirán los hallazgos específicos en la dermatoscopía del CBC (Tabla 4 y Fig. 6A y 6B) y el CEC (Tabla 5 y Fig. 7A y 7B) así como su correlación con la histología32,33.
Dermatoscopía del carcinoma basocelular
| Criterio dermatoscópico | Descripción | Correlación con histología | Esquema |
|---|---|---|---|
| ESTRUCTURAS PIGMENTADAS | |||
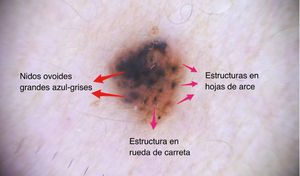
| Estructuras en hoja de arce | Extensiones periféricas bulbosas color café a azul-gris | Nidos de células basaloides pigmentadas ubicadas en unión dermo-epidérmica y dermis superficial ubicadas en periferia de la lesión | |
| Estructuras en rueda de carreta | Proyecciones radiales color café a azul-gris que confluyen a un eje central con mayor intensidad de pigmento | Nidos de células basaloides pigmentadas ubicadas en unión dermo-epidérmica y dermis superficial con crecimiento radial | |
| Estructuras concéntricas | Estructuras circulares de color café a azul-gris con punto central de mayor pigmentación. | Nidos de células basaloides pigmentadas ubicadas en unión dermo-epidérmica con crecimiento radial. | |
| Glóbulos azul-grises múltiples | Estructuras ovaladas o redondeadas azul-grises | Nidos de células basaloides pigmentadas ubicadas en dermis | |
| Nidos ovoides azul grises | Estructuras ovoides, redondeadas o elongadas (de mayor tamaño que los glóbulos) | Nidos grandes o confluentes de células basaloides pigmentadas ubicadas en dermis | |
| Punto en foco | Puntos grisáceos pequeños muy bien enfocados | Pigmento libre en unión dermo-epidérmica, melanófagos o nidos basaloides muy pequeños pigmentados en dermis | |
| ESTRUCTURAS VASCULARES | |||
| Vasos arboriformes | Vasos que presentan un tronco que se ramifica en capilares más finos. Muy nítido en sus bordes | Vasos dilatados en dermis que se sitúan en la vecindad de nidos tumorales. | |
| Telangectasias finas superficiales | Vasos finos, superficiales y cortos poco ramificados | Vasos finos ubicados en dermis papilar | |
| ESTRUCTURAS NO VASCULARES NI PIGMENTADAS | |||
| Úlcera | Áreas desestructuradas grandes de color rojo a negro | Áreas con ausencia de epidermis cubiertas con costra sero-hemática | |
| Erosiones múltiples | Costras pequeñas café a rojas | Costras pequeñas sobre áreas focales de perdida de epidermis | |
| Áreas rojo-blanquecinas desestructuradas | Áreas translucidas a opacas con color rojo a blanquecino | Fibrosis dérmica difusa o fibrosis tumoral estromal | |
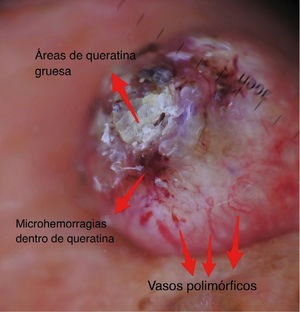
Dermatoscopía del carcinoma espinocelular
| Criterio dermatoscópico | Descripción | Correlación con histología | Esquema |
|---|---|---|---|
| ESTRUCTURAS QUERATINIZADAS | |||
| Escamas superficial | Estructuras homogéneas queratóticas de color blanquecino, café o amarillo. | Hiperqueratosis y/o paraqueratosis | |
| Masas de queratina | Áreas blanco-amarillentas amorfas con tendencia a ubicarse en zona central, sin estructura. Pueden contener microhemorragias en su espesor. | Hiperqueratosis y perlas corneas | |
| Áreas blancas sin estructura | Áreas de color más claro que la piel, homogenea | Áreas de estroma fibroso y perlas corneas | |
| Círculos blancos | Círculos blanquecinos rodeando infundibulo ocluido por tapón queratina de color amarillento | Orificio folicular con tapón corneo | |
| ESTRUCTURAS VASCULARES | |||
| Vasos polimorfos | Vasos distribuidos de forma irregular de tipo lineal, horquilla, glomerular, etc.) | Vasos dérmicos en áreas proliferación tumoral. | |
| Vasos glomerulares | Vasos formando un ovillo | Vasos dilatados en dermis papilar | |
| Vasos en horquilla | Vasos con forma de horquilla rodeado de halo blanco | Vasos dilatados en dermis papilar | |
| OTRAS | |||
| Puntos/glóbulos | Estructuras de color café a gris de disposición lineal | Pigmentación de queratinocitos basales y melanófagos dérmicos | |
| Ulceración | Áreas sin estructuras de color café a rojizo con costras | Solución de continuidad en la epidermis | |
Las estructuras dermatoscópicas permiten también identificar el subtipo histológico de CBC. Por ejemplo, si un CBC presenta una úlcera grande o vasos arboriformes o nidos ovoides azul-grises o glóbulos azul-grises, podemos predecir que éste NO es de tipo superficial34. La ventaja de esta discriminación es que nos permite seleccionar adecuadamente aquellos pacientes que podrían beneficiarse de tratamientos no quirúrgicos.
La dermatoscopía también permite el diagnóstico precoz de lesiones precursoras y etapas precoces del CEC. Están ampliamente reportadas la características dermatoscópicas de la queratosis actínica, enfermedad de Bowen y el queratoacantoma35.
Incluso se ha determinado un modelo de progresión dermatoscópica desde la lesión precursora (queratosis actínica) al CEC invasor36. Esto último constituye una herramienta muy valiosa en la práctica dado que permite un tratamiento oportuno y generalmente, no quirúrgico para aquellas lesiones en fases tempranas.
Se ha descrito la dermatoscopía de otros tipos menos frecuentes de CPNM, como el carcinoma de células de Merkel, el fibroxantoma atípico, histiocitoma de células malignas y dermatofibrosarcoma protuberans. Sin embargo, los atributos dermatoscópicos de éstos son menos específicos y consistentes37.
ROL DE LA MICROSCOPÍA CONFOCAL DE REFLECTANCIA (MCR)La MCR es una tecnología no-invasiva que permite obtener imágenes cuasi-histológicas de lesiones cutáneas. Mediante un láser diodo de baja potencia (830nm) se ilumina un punto focal en el tejido, para luego reflejarse en dirección contraria hacia un pequeño agujero y luego proyectado hacia un detector. El objetivo del agujero es filtrar todos los haces de luz que no corresponden al plano que está siendo observado, permitiendo a un software la generación de imágenes en 2D del tejido. De esta forma, se obtienen imágenes en tono de grises que corresponden a cortes en un plano horizontal del tejido en secciones ópticas de 3-5 micras. El nivel de amplificación permite visualizar estructuras un nivel celular y subcelular y con una profundidad máxima de 300 a 350 micras (dermis papilar)38,39.
En la última década se han publicado múltiples estudios respecto de la utilidad de la MCR para el diagnóstico de CPNM y melanoma40,41. Específicamente en CPNM, la MCR ha demostrado ser capaz de mejorar la asertividad diagnóstica para CBC y CEC.
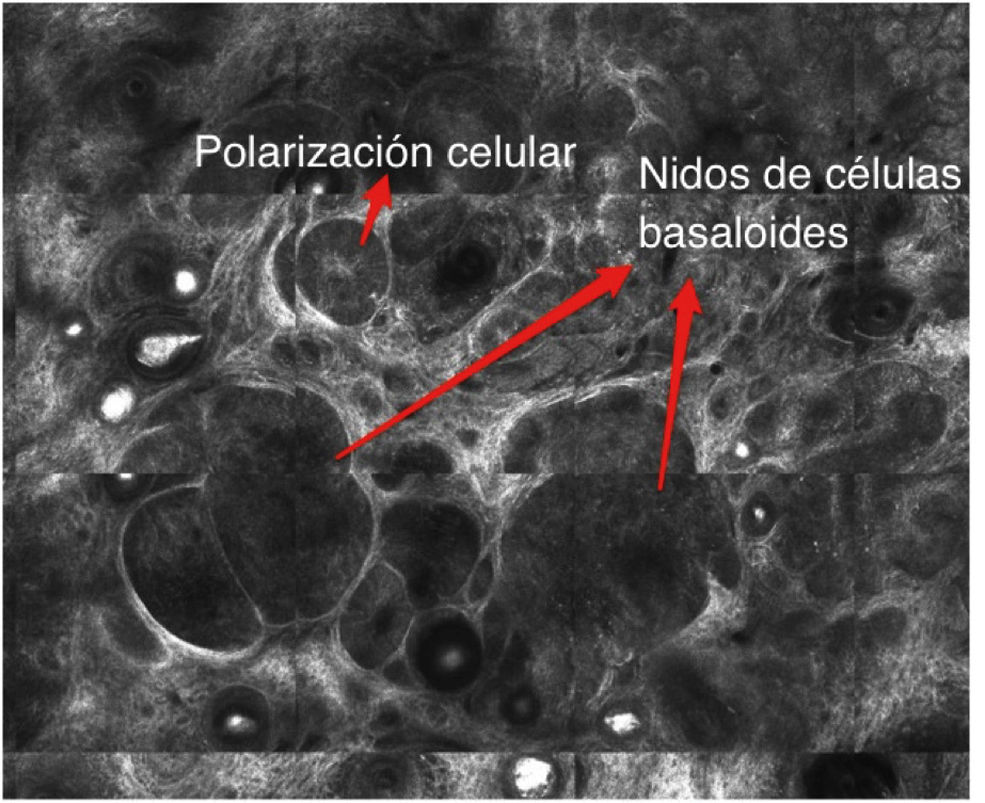
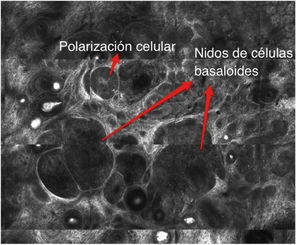
En el caso del CBC (Fig. 8A y 8B) un estudio de meta-análisis reciente reportó una sensibilidad del 91.7% y una especificidad del 91.3% para el diagnóstico mediante el uso del MCR42. Morfológicamente, se observan estructuras muy similares a las de la histopatología convencional, como nidos de células basaloides con polarización nuclear, hendidura peritumoral, vasos sanguíneos dilatados peritumorales e infiltrado inflamatorio40.
La MCR también permite la identificación del subtipo histológico predominante del CBC, lo que permitiría seleccionar mejor a aquellos pacientes tratables con métodos no quirúrgicos43.
Respecto a este último punto, se ha reportado la utilidad de la MCR en el monitoreo de la respuesta clínica al tratamiento de CBC con imiquimod44, terapia fotodinámica45 y crioterapia46.
La MCR también es de utilidad en el diagnóstico precoz de del CEC y la queratosis actínica. Respecto a ésta última, se ha reportado que la MCR logra una sensibilidad y especificidad del 80 y 98%, respectivamente47. Morfológicamente se observa hiperqueratosis, paraqueratosis, desorden arquitectural del estrato espinoso y alteración morfológica de los queratinocitos48. En el caso del CEC, se agregan a los hallazgos previamente mencionados, la observación de células nucleadas, redoneadas y/o dendríticas en dermis papilar49.
Si bien la MCR es una herramienta muy útil en el diagnóstico precoz del cáncer de piel, no está exenta de limitaciones. La principal restricción es que la profundidad máxima de observación alcanza los 300 micrones de profundidad. Otras limitaciones son la necesidad de un operador entrenado en la técnica de toma de imágenes, un observador entrenado en la interpretación de los hallazgos y su inaplicabilidad en algunas áreas del cuerpo como la zona acral o en zonas concávas (Ej. canto medial, interotejos, etc).
Otra tecnología que se ha ido desarrollando en los últimos años, corresponde a la Tomografia de Coherencia Óptica (TCO). La TCO es un examen no invasivo que utiliza ondas de luz del espectro infrarrojo para obtener imágenes de la sección transversal de la piel. Respecto a su utilidad en CPNM, se ha reportado una sensibilidad y espeficidad para CEC de 93.8% y 98.9%, respectivamente. En el caso del CBC se ha reportado una sensibilidad y especificidad de 86.4% y 90.5% respectivamente50.
En nuestro país está disponible la MCR para su aplicación clínica en sólo un centro asistencial privado. La TCO aún no se encuentra disponible en Chile para su uso en la práctica clínica.
CONCLUSIÓNTeniendo en cuenta las tendencias epidemiológicas mundiales del cáncer de piel, resulta obvio que existe una necesidad rigurosa de controlar el aumento de la incidencia y la carga socioeconómica posterior. Los esfuerzos para alcanzar este objetivo incluyen la optimización de los estándares de registro y el desarrollo de estrategias de prevención primaria, secundaria y terciaria eficientes y aplicables.
El diagnóstico precoz del cáncer de piel es el objetivo principal en el enfrentamiento de esta condición a nivel poblacional. En la actualidad se dispone de tecnologías de imagen ampliamente validadas para lograr este objetivo y se vislumbra un desarrollo creciente de nuevas tecnologías en el futuro cercano.
Declaración de interesesLos autores declaran no tener conflictos de interés con relación a este artículo.