Se analizan diferentes aspectos reproductivos en mujeres portadoras de mutaciones genéticas BRCA. Se revisa la evidencia científica del riesgo que agrega el uso de anticoncepción hormonal a mujeres con diferentes niveles de riesgo concluyendo que con las formulaciones recientes después del 2010 no hay aumento del riesgo de cáncer de mama. En portadoras de mutaciones BRCA, el uso prolongado antes de los 25 años se asocia a un leve mayor riesgo de diagnóstico temprano de cáncer de mama.
Se analiza el riesgo que agrega la terapia de reemplazo hormonal en la menopausia (TRH) a mujeres de alto riesgo de cáncer de mama concluyendo que en mujeres no mutadas no hay evidencia de mayor riesgo con el uso de TRH. En portadoras de mutaciones BRCA sometidas a salpingo ooforectomía de reducción de riesgo con sintomatología climatérica, es posible usar TRH por períodos limitados de tiempo previa adecuada consejería.
Se analiza la evidencia sobre cáncer de ovario y trompa de falopio en portadoras de mutaciones genéticas. 14% de los cánceres ováricos se asocian a mutaciones heredadas y habitualmente corresponden a adenocarcinomas serosos de alto grado, pobremente diferenciados y agresivos. La vigilancia y tamizaje para cáncer de ovario a portadoras de mutaciones BRCA mediante CA 125, ecografía transvaginal y examen clínico no ha demostrado que mejore la sobrevida. Por ello, la recomendación más adecuada es la salpingo oforectomía de reducción de riesgo a la edad de 35-40 años después de haber completado el deseo de tener hijos.
Se analizan las diferentes estrategias para preservación de la fertilidad en mujeres jóvenes portadoras de mutaciones BRCA, la reserva ovária, efecto de la quimioterapia sobre la reserva ovárica, criopreservación embrionaria y de oocitos, criopreservación de tejido ovárico, supresión ovárica y el estudio genético preimplantacional. Se concluye que las mujeres portadoras de mutaciones deben derivarse en forma oportuna a un equipo multidisciplinario de preservación de fertilidad para consejería reproductiva precoz por el alto riesgo de cáncer mamario sumado al uso de quimioterapia gonadotóxica. Las portadoras de mutaciones BRCA1 parecen tener menor reserva ovárica que las no portadoras. Los métodos de preservación de fertilidad más utilizados son la estimulación controlada de la ovulación y la criopreservación de embriones y oocitos.
Different reproductive aspects are analyzed in women with BRCA mutations. We review the scientific evidence of the risk that adds the use of hormonal contraception to women with different levels of risk concluding that with the recent formulations after 2010 there is no increased risk of breast cancer. In BRCA mutation carriers, prolonged use before 25 is associated with a slightly increased risk of early diagnosis of breast cancer.
The risk added by menopausal hormone replacement therapy (HRT) to women at high risk for breast cancer is analyzed, concluding that in non-mutated women there is no evidence of increased risk with the use of HRT. In carriers of BRCA mutations undergoing salpingo oophorectomy risk reduction with climacteric symptomatology, it is possible to use HRT for limited periods of time with counseling.
Ovarian and fallopian tube cancer evidence is analyzed in carriers of genetic mutations. 14% of ovarian cancers are associated with inherited mutations and usually correspond to high-grade, poorly differentiated and aggressive serious adenocarcinomas. Surveillance and screening for ovarian cancer to carriers of BRCA mutations by CA 125, transvaginal ultrasound and clinical examination have not been shown to improve survival. Therefore, the most appropriate recommendation is the salpingo oforectomy risk reduction at the age of 35-40 years after having completed the desire to have children.
The different strategies for preservation of fertility in young women with BRCA mutations, the ovary reserve, effect of chemotherapy on the ovarian reserve, embryo and oocyte cryopreservation, cryopreservation of ovarian tissue, ovarian suppression and the preimplantation genetic study are analyzed. It is concluded that women with mutations should be referred in a timely manner to a multidisciplinary team of fertility preservation for early reproductive counseling because of the high risk of breast cancer in addition to the use of gonadotoxic chemotherapy. BRCA1 mutation carriers appear to have less ovarian reserve than the non-carriers. The most widely used methods of preservation of fertility are controlled ovulation stimulation and cryopreservation of embryos and oocytes.
El cáncer de mama constituye la primera causa de muerte por cáncer en la mujer en Chile y representa, junto al cáncer de ovario, una importante causa de morbilidad. Se estima que se diagnostican alrededor de 4000 casos nuevos de cáncer de mama cada año 1, de ellos, 10% son de tipo hereditario lo que indica que probablemente existan alrededor de 400 nuevos casos de mujeres con diagnóstico de cáncer de mama portadoras de mutaciones genéticas que se caracterizan por el desarrollo de cáncer de mama y ovario a edades más tempranas 2. El avance del conocimiento ha permitido que cada vez nos enfrentemos en nuestro trabajo médico con mujeres de alto riesgo de desarrollar cáncer de mama/ovario y cada día necesitemos aconsejar profesionalmente a mujeres portadoras de mutaciones genéticas. En este capítulo analizaremos importantes aspectos reproductivos que es necesario manejar en mujeres jóvenes de alto riesgo principalmente en aquellas portadoras de mutaciones genéticas BRCA. Analizaremos el estado actual de la evidencia del riesgo de la anticoncepción hormonal en mujeres de alto riesgo. Analizaremos también el estado actual de la evidencia del riesgo de la terapia de reemplazo hormonal en la menopausia (TRH) en mujeres sin riesgo y con riesgo de cáncer mamario, la salpingo oforectomía de reducción de riesgo en mujeres portadoras de mutaciones genéticas y finalmente la preservación de la fertilidad, aspecto relevante que con frecuencia se omite.
ANTICONCEPCIÓN HORMONAL Y RIESGO DE CÁNCER DE MAMALa evidencia científica de la asociación de anticoncepción hormonal con el riesgo de cáncer de mama es variada y compleja. Los estudios publicados son mayoritariamente de casos y controles dependientes de los pacientes. Como son estudios heterogéneos, es difícil obtener resultados reales al usar meta-análisis. Las formulaciones de los anticonceptivos orales combinados (ACO) se han modificado con el transcurso de los años, cambiando sus componentes y disminuyendo la dosis de cada preparado lo que hace no comparables estudios antiguos con contemporáneos. Además, la alta frecuencia de uso de anticonceptivos hormonales dificulta disponer de grupos controles para realizar estudios prospectivos.
En 1996, se publica un importante meta-análisis en Oxford que relaciona el riesgo de cáncer de mama con el uso de anticonceptivos orales combinados (ACO) que analiza datos de 54 investigaciones realizados en 25 países 3. Se demuestra un leve y significativo aumento del riesgo de cáncer de mama asociado al uso de ACO. El aumento del riesgo (RR 1.24; 95% IC 1.15-1.33) es constante y mantenido e independiente del tiempo de uso de la píldora y del tipo de formulación anticonceptiva. Al suspender la píldora, el riesgo desciende paulatinamente y 10 años después de la discontinuación, el riesgo se hace igual al de las mujeres que nunca emplearon el método. Althuis compara el riesgo de cáncer de mama en usuarias de píldoras con diferentes dosis y potencia, reportando que aquellas mujeres que usan píldoras con dosis mayores de 35 microgramos de etinil estradiol tienen mayor riesgo que las mujeres que emplean preparados con dosis menores de 35 microgramos (RR 1.99, p<0.001). Esta asociación es más marcada en mujeres jóvenes menores de 35 años 4. Un segundo meta-análisis de 34 estudios reporta que mujeres que habían usado ACO antes del primer parto tuvieron un aumento del riesgo de cáncer de mama (RR 1.44; 95% IC 1.28-1.62), superior a aquellas que usaron ACO después del primer parto (RR1.15; 95% IC 1.06-1.26) 5. Aquellas mujeres que toman píldoras durante menos de 4 años antes del primer parto tuvieron un riesgo mayor (RR 1.52; 95% IC 1.26-1.82). Hunter publica un estudio de 116608 mujeres usuarias de ACO con seguimiento cada dos años. En 1246967 años mujer de seguimiento, se diagnostican 1344 casos de cáncer de mama infiltrante. Las usuarias de ACO presentaron aumento leve del riesgo de cáncer de mama (RR 1.33; 95% IC 1.03-1.73) 6.
Estudios contemporáneos con formulaciones anticonceptivas recientes que incluyen diferentes progestinas, ya no demuestran relación entre anticoncepción hormonal combinada y riesgo de cáncer de mama. Beaber el año 2014, publica un estudio de casos y controles con 1102 mujeres diagnosticadas de cáncer de mama entre los años 1990 y 2009 que usaron ACO entre los 20 y 49 años de edad versus 21952 controles. En usuarias de formulaciones con dosis menores de 50 microgramos de etinil estradiol, el OR fue 1.0 (95% IC 0.6-1.7) 7. Una revisión sistemática analiza 8 estudios de usuarias de ACO en mujeres de alto riesgo para cáncer de mama no logrando establecer mayor riesgo de cáncer, incluso en mujeres portadoras de mutaciones BRCA. Los Odds Ratio (95% IC) fueron 1.19 (0.91-1.54), 1.21 (0.93-1.58) y 1.36 (0.88-2.09) 8. Un meta–análisis de 23 estudios observacionales entre los años 2000 y 2012 tampoco reporta mayor riesgo de cáncer de mama en usuarias de ACO. El Odds Ratio fue 1.08 (95% IC 1.00-1.17) 9. Gierisch analiza 16 estudios de casos y controles además de 9 estudios de cohorte no demostrando mayor del riesgo de cáncer de mama con el uso de ACO. El Odds Ratio fue 1.08 (95% IC 1.00-1.16) 10. Charlton publica un estudio de cohorte prospectivo desde 1976 hasta 2012 (36 años de seguimiento) en que participan 121701 mujeres, 57951 usuarias de anticoncepción hormonal y 6626 no usuarias reuniendo 3600000 personas/año de seguimiento con 31286 muertes certificadas, no encontrando asociación entre uso de ACO y mortalidad por cáncer de mama. El Odds Ratio es 1.09 (95% IC 0.99-1.20). Sin embargo, informa en usuarias de ACO, mayor mortalidad por accidentes violentos y suicidios con Odds Ratio de 1.20; (95% IC 1.05-1.37) y 1.43 (95% IC 1.08-1.90) 11. La revisión de la evidencia publicada concluye que los anticonceptivos hormonales combinados de formulación actual no aumentan el riesgo de cáncer de mama, independiente de la edad y tiempo de uso del preparado.
Anticoncepción hormonal en mujeres sanas portadoras de mutaciones BRCAMilne, el año 2005 compara 1156 mujeres con cáncer de mama diagnosticado antes de los 40 años, en los que se incluyen 47 casos de portadoras de mutación BRCA1, 36 portadoras de BRCA2 y 815 casos controles. Los resultados indican aumento del riesgo de cáncer de mama asociado a las formulaciones de ACO usadas antes de 1976 (RR 1.52; 95% IC 1.22-1.91). Sin embargo, reportan disminución del riesgo en portadoras de BRCA1 que usaron ACO antes del diagnóstico de cáncer (RR 0.22; IC 95% 0.10-0.49) 12. Un estudio similar tampoco reporta asociación entre ACO y cáncer de mama en portadores de mutaciones BRCA e incluso recomienda su uso por la disminución del riesgo de cáncer de ovario en portadoras de mutaciones 13. Kotsopoulos el año 2014 publica un extenso estudio de casos y controles realizado en 72 centros de 13 países. Selecciona 2492 mujeres portadoras de mutaciones BRCA1 y compara la incidencia de cáncer de mama entre usuarias de ACO y no usuarias según edad del primer uso del anticonceptivo, edad al diagnóstico de cáncer y país de residencia. Las mujeres portadoras de mutaciones BRCA1 que usaron ACO antes de los 20 años de edad se asociaron a un aumento significativo del riesgo de cáncer de mama (OR 1.45; 95% IC 1.20-1.75; P=0.001). El uso de ACO entre los 20 y 25 años pudiera aumentar muy levemente el riesgo (OR 1.19; 95% IC 0.99-1.42; P=0.06). El efecto es limitado a cánceres de mama diagnosticados antes de los 40 años de edad (OR 1.40; 95% IC 1.14-1.70; P=0.001). El riesgo de diagnóstico temprano de cáncer de mama aumenta en 11% con cada año adicional de uso del ACO cuando se ha iniciado la píldora antes de los 20 años (OR 1.11; 95% IC 1.03-1.20; P=0.008). El uso de la píldora no aumenta el riesgo de cáncer de mama diagnosticado después de los 40 años (OR 0.97, 95% IC 0,79-1.20; P=0.81). No se incluye en el estudio mujeres con mutaciones BRCA2. Los autores concluyen que, en mujeres sanas portadoras de mutaciones BRCA1, el uso de anticonceptivos orales antes de los 25 años de edad aumenta el riesgo de diagnóstico temprano de cáncer de mama y que el riesgo en estas mujeres aumenta con la duración de uso. Por ello, a pesar del efecto protector para cáncer de ovario, recomiendan cautela para el uso de ACO antes de los 20–25 años 14.
Del análisis de la evidencia científica publicada se puede concluir lo siguiente: meta-análisis de estudios de casos y controles antes del año 2010 asocian el uso de ACO con leve mayor riesgo de cáncer de mama, pero meta-análisis y estudios de casos y controles posteriores con formulaciones recientes informan resultados que no lo asocian. La cohorte de mayor seguimiento (36 años), no asocia el uso de ACO con aumento de la mortalidad por cáncer de mama. En mujeres sanas portadoras de mutaciones genéticas BRCA1, el uso de anticoncepción hormonal oral combinada antes de los 25 años se asocia a un leve mayor riesgo de diagnóstico temprano de cáncer de mama.
MIRENA y riesgo de cáncer de mamaMirena es un dispositivo intrauterino que libera la progestina levonorgestrel. Consiste en un dispositivo plástico con forma de T en cuyo eje vertical se fija un cilindro que contiene 52 miligramos de levonorgestrel rodeado de una delgada membrana de silastic. Mirena libera diariamente alrededor de 20 microgramos de levonorgestrel alcanzando niveles plasmáticos de 150 a 200 picogramos a través de los años. Está diseñado para 5 años de excelente efecto anticonceptivo. Un estudio de cohorte retrospectivo realizado en Finlandia analiza 9956 mujeres postmenopáusicas con cáncer de mama entre los años 1995 a 2007 con el uso previo de terapia hormonal midiendo el Odds Ratio con análisis de regresión logística. Compara 329 usuarias de Mirena con 708 controles señalando un OR de 1.53 (95% IC 1.33-1.75) con p=0.0001. A mayor tiempo de uso de Mirena mayor es el riesgo de cáncer de mama; menos de 3 años OR= 1.65 (95% IC 1.32-2.07), tres a 5 años de uso OR=2.39 (95% IC 1.77-3.22) y más de 5 años OR= 2.78 (95% IC 2.11-3.67) 15. En Bélgica, otro estudio de cohorte señala que mujeres con cáncer de mama y usuarias de Mirena tienen mayor recurrencia de su cáncer mamario (OR= 3.39 (95% IC 1.01-11.35). Señala también que la mayoría de las recurrencias fueron sistémicas 16. Otro estudio de cohorte prospectivo realizado también de Finlandia, analiza mujeres de 30 a 39 años, usuarias de Mirena como tratamiento de menorragias durante los años 1994 a 2007 y estudia su relación con el desarrollo de cáncer. Se reclutan 93843 mujeres y se compara con la incidencia de cáncer en la población general. En usuarias de Mirena se observa menor incidencia de cáncer de endometrio, ovario, pulmón y páncreas. Sin embargo, se aprecia mayor incidencia de cáncer de mama que la esperada. En el grupo de Mirena se observaron 1542 casos de cáncer de mama en comparación con 1292 casos esperados. (OR= 1.19 (95% IC 1.13-1.25). A mayor edad de la mujer y a mayor tiempo de uso del dispositivo mayor es el riesgo de cáncer de mama 17. Existen también estudios que no asocian Mirena con riesgo de cáncer de mama. Dinger publica un estudio de casos y controles retrospectivo en que compara 5113 mujeres con cáncer de mama menores de 50 años usuarias de Mirena versus 20452 controles usuarias de dispositivos intrauterinos no hormonales (T cobre) no encontrando asociación entre Mirena y cáncer de mama 18. Por lo expuesto, existe controversia con relación a Mirena y riesgo de cáncer de mama. Mirena pareciera aumentar levemente el riesgo de cáncer de mama en especial en mujeres mayores de 40 años y con el uso prolongado mayor a 5 o 10 años. Parece recomendable retirar el dispositivo a mujeres diagnosticadas de cáncer de mama y usuarias de Mirena por el eventual mayor riesgo de recurrencias.
TERAPIA REEMPLAZO HORMONAL EN LA MENOPAUSIA Y RIESGO DE CANCER DE MAMASe denomina Terapia de Reemplazo Hormonal en la menopausia (TRH) al empleo de dosis reducidas de estrógenos y progestinas, en distintos esquemas y a través de distintas vías de administración, para controlar los síntomas propios del climaterio femenino y para prevenir o tratar enfermedades crónicas derivadas de la ausencia prolongada de la función ovárica 19. La asociación de TRH y riesgo de cáncer de mama ha constituido históricamente un tema de discusión científica respecto al manejo clínico de la menopausia y representa una importante causa de abandono de TRH o de temor para iniciar un tratamiento.
- 1.
TRH en mujeres con riesgo de cáncer de mama similar al de la población general.
Se ha calculado que el riesgo que tienen estas mujeres de desarrollar un cáncer de mama es menor de 0.5% a los 30 años de edad, 2% a los 50 años y 7% a los 70 años. Durante años, hasta el año 2007, a las usuarias de TRH se les atribuyó un leve mayor riesgo de cáncer de mama que dependía del tiempo de uso, del tipo de compuesto empleado, uso o no uso de progestinas e incluso según el tipo de progestina ocupada en la formulación, tema analizado con detalle en una publicación anterior de esta Revista 20–26. Sin embargo, estudios posteriores que reanalizan los datos de las principales publicaciones anteriores estiman que la metodología empleada y los resultados presentados no satisfacen los principios epidemiológicos de causalidad concluyendo que los resultados no establecen con certeza que la terapia de reemplazo hormonal en la menopausia aumente el riesgo de cáncer de mama en estas mujeres 27. Después del análisis de la evidencia científica, se puede concluir que la posible relación de TRH y riesgo de cáncer de mama en este grupo de mujeres es compleja. No se ha logrado demostrar en forma clara una relación directa entre uso de terapia hormonal combinada y mayor riesgo de cáncer de mama, las terapias con sólo estrógenos no aumentan el riesgo de cáncer mamario. Por lo tanto, la decisión del uso y tipo de tratamiento debe basarse en una información completa del tema tanto del médico que la indica como de la mujer que la recibe.
- 2.
TRH en mujeres de alto riesgo de cáncer de mama
A pesar de que ha existido preocupación por el empleo de TRH en este grupo de mujeres, es escasa la evidencia científica que relaciona TRH con aumento del riesgo en mujeres con alto riesgo de cáncer de mama sin mutaciones genéticas demostradas. Los antecedentes de cáncer de mama en familiares de primer o segundo grado no portadoras de mutaciones genéticas, no parece oponerse a la terapia de reemplazo hormonal si su empleo fuere necesario debido a deterioro de la calidad de vida 28. La mama radiológicamente densa (mama densa) se ha asociado a mayor riesgo de cáncer de mama y la terapia de reemplazo hormonal suele aumentar la densidad radiológica mamaria. Sin embargo, el aumento del riesgo de cáncer de mama en mamas densas parece ser independiente del empleo de TRH 29. Se requieren estudios prospectivos que relacionen el antecedente de mama densa, uso de TRH y riesgo de cáncer de mama. Con relación al antecedente personal de biopsias mamarias con presencia de hiperplasias atípicas o carcinoma lobulillar in situ (lesiones precursoras), no existen estudios que relacionen en forma directa el uso de TRH con cambios en el riesgo de cáncer de mama. Tampoco existe evidencia que evalúe el riesgo del empleo de TRH en mujeres de alto riesgo por el antecedente de radioterapia al tórax durante la adolescencia como tratamiento de tumores linfáticos. Por lo expuesto, la evidencia actual no contraindica el uso de TRH en mujeres de alto riesgo de cáncer de mama que lo necesiten, pero sugiere prudencia y seguimiento adecuado.
- 3.
TRH en mujeres sanas portadoras de mutaciones genéticas BRCA
El año 2005 se publica un estudio inicial que informa del uso de TRH en 462 mujeres mutadas sanas que fueron sometidas a salpingo-ooforectomia preventiva como estrategia para reducción del riesgo de cáncer de mama y ovario y sugiere que el uso de hormonoterapia por un tiempo limitado no aumenta el riesgo de cáncer de mama y que el empleo de TRH no anula el efecto protector de la ooforectomía 30.
El año 2008, otro estudio reporta que el uso de TRH en mujeres sanas portadoras de mutaciones BRCA se asocia a una modesta reducción del riesgo de cáncer de mama (OR=0.58; 95% IC 0.35-0.96; p= .03) 31.
La salpingo-ooforectomía ha sido recomendada a mujeres portadoras de mutaciones BRCA como opción para reducir el riesgo de cáncer de ovario como también para reducir la mortalidad por cáncer 32. La supresión ovárica brusca en mujeres premenopáusicas suele provocar sintomatología climatérica severa que disminuye la calidad de vida en forma importante lo que hace considerar la posibilidad de alguna terapia de alivio de las molestias. Por ello, para clarificar si el empleo de TRH en estas mujeres para mitigar los síntomas menopáusicos es un tratamiento seguro en mujeres portadoras de mutaciones, Kotsopoulos en Canadá realiza un estudio de casos y controles en que participaron 73 centros de 13 países. Selecciona 432 mujeres portadoras de mutaciones BRCA1 que reciben TRH y las compararon con 432 mujeres también portadoras de mutaciones BRCA1 que no reciben TRH. La duración promedio de la terapia hormonal fue 4.4 años en ambos grupos y no hubo diferencias en el riesgo de cáncer de mama (OR= 0.80; 95% IC 0.55-1.16; P= 0.24). Tampoco hay diferencias según edad de la menopausia, edad al diagnóstico de cáncer de mama, duración previa de uso de TRH. No hubo diferencias según tipo de formulación ya que no se observaron efectos adversos con estrógenos solos, progestinas solas o combinaciones de ambos 33.
El National Comprehensive Cancer Network (NCCN) versión 1,2017 señala que en mujeres sanas portadoras de mutaciones BRCA y sometidas a salpingo-ooforectomía podría indicarse terapia de reemplazo hormonal por un período corto previa consejería por profesionales competentes 34.
En conclusión, basado en la evidencia científica disponible, es posible utilizar terapia hormonal en mujeres portadoras de mutaciones BRCA que lo necesiten, pero por períodos limitados considerando que el riesgo de cáncer de mama de estas mujeres es alto.
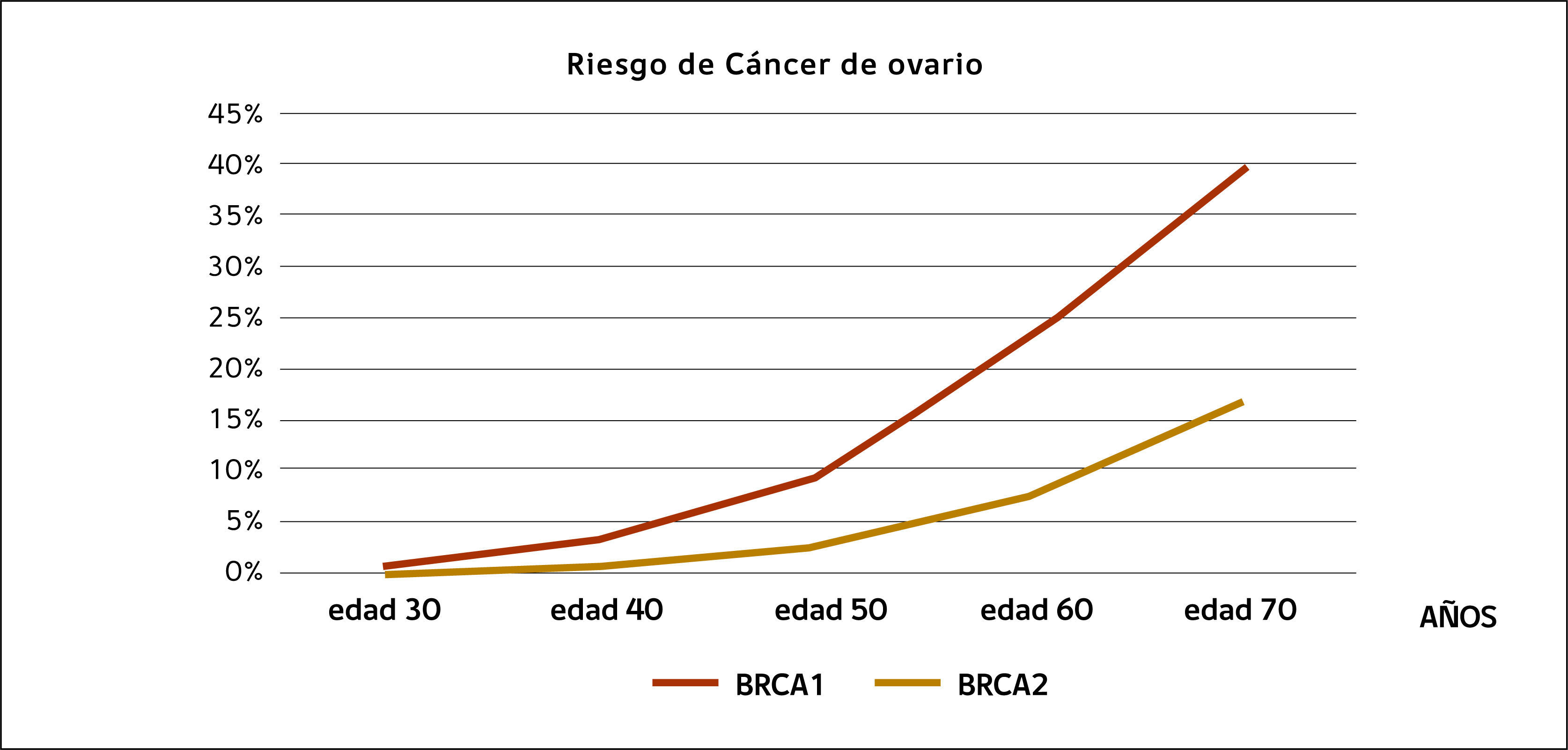
SALPINGO OFORECTOMÍA DE REDUCCIÓN DE RIESGO EN PACIENTES PORTADORAS DE MUTACIONES GENÉTICASEl síndrome de cáncer hereditario de mama y ovario fue identificado a principios de los 70 35. Posteriormente se efectuaron cirugías de reducción de riesgo, tanto mamarias como ováricas en mujeres de familias con sospecha de cáncer hereditario. Hubo, sin embargo, escepticismo en la comunidad médica respecto de la eficacia de estos procedimientos. A principios de los 90 se identifican los genes BRCA1 y BRCA2 y la posibilidad de hacer prueba genética clínica estuvo disponible en 1996. Basado en dos meta análisis, una mujer con mutación BRCA1 tiene un riesgo promedio de desarrollar cáncer de ovario de alrededor de 40% y una mujer con mutación BRCA2 tiene un riesgo de desarrollar un cáncer ovárico de 11-18% 36,37. El riesgo de cáncer ovárico para una portadora de mutación a los 40 años es menos de 3% pero sube a 10% a los 50 años (Figura 1)
Avances moleculares y anatomopatológicos han revelado que la mayoría de los adenocarcinomas serosos de alto grado, previamente atribuidos a origen ovárico, son probablemente implantes de un cáncer que se origina en la fimbria de las trompas de Falopio 38. Por otro lado, diversos estudios han mostrado que los cánceres ováricos en mujeres con mutaciones BRCA1 o BRCA2 son más frecuentemente adenocarcinomas serosos de alto grado en comparación con la proporción de cánceres de alto grado que presentan mujeres sin una mutación demostrada 39. Cabe enfatizar que el adenocarcinoma ovárico seroso de alto grado es el que más se presenta en estadios III, con carcinomatosis peritoneal al diagnóstico, y en consecuencia, la variedad más letal. Existe otra mutación genética, distinta de la de los genes BRCA1 y BRCA2. Esta constituye el síndrome de Lynch o cáncer colorrectal hereditario no poliposo. Esta mutación se estima que la portan 1 en 660 personas y corresponde al 1-3% de los cánceres de colón 40,41. Después del cáncer colorrectal, el cáncer de endometrio es el más común, ocurriendo en 15-30% de los portadores. El síndrome de Lynch se asocia a riesgo aumentado de cáncer ovárico, ocurriendo en 8-15% de mujeres mutadas con el gen MLH1 o MSH2. La edad promedio de diagnóstico de cáncer ovárico es 45 años. Las histologías son variadas y no concentran tumores serosos de alto grado como en la mutación BRCA1. La sobrevida global es mejor que en las mujeres mutadas BRCA1 – BRCA2.
Seguimiento de las pacientes que portan una mutaciónEl tamizaje para cáncer ovárico usando CA 125 seriado, ecografía transvaginal y/o examen clínico es controversial, no habiéndose demostrado que disminuya la mortalidad, y sí provoca numerosas cirugías para detectar un caso 42. El estudio aleatorizado PLCO Screening Trial no encuentra reducción en la mortalidad con CA 125 anual y ecografía transvaginal en mujeres post menopaúsicas con riesgo poblacional 43.
El estudio colaborativo del Reino Unido para tamizaje de cáncer ovárico aleatoriza 200000 mujeres post menopáusicas no seleccionadas, a CA 125 + ecografía transvaginal versus nada. Reporta que se hicieron 5 cirugías por cada caso de cáncer invasor. Desgraciadamente, menos de la mitad de los casos detectados por tamizaje fueron en etapas precoces (42%) y estos casos incluyeron tumores de bajo potencial maligno o limítrofes y los de bajo grado. No hubo reducción en la mortalidad. El estudio continúa en el Reino Unido 44.
A pesar de que no hay evidencia consistente del beneficio, algunas organizaciones en Estados Unidos de América recomiendan tamizaje cada 6 meses con CA 125 y ecografía transvaginal a mujeres con riesgo por herencia, que por razones de conservar el potencial reproductivo, postergan la cirugía de reducción de riesgo.
Cirugía de reducción de riesgoSiete estudios de eficacia y un meta análisis muestran una significativa disminución del riesgo relativo de cáncer ovárico, de aproximadamente 80% entre portadores de mutaciones BRCA1 y BRCA2. Los seguimientos son en promedio de 4 años 44–51. Se recomienda la salpingooforectomía de reducción de riesgo para portadoras de mutaciones BRCA1 y BRCA2 entre las edades de 35-40 años y que hayan completado el deseo de tener hijos 52,53. Sin embargo, como existen diferencias en el riesgo dependiendo si la mujer porta una mutación BRCA1 versus BRCA2 en relación a la edad de presentación del cáncer ovárico, algunos autores sugieren que la cirugía pueda ser postergada hasta los 45 años en mujeres con mutación BRCA2, dado que el riesgo de cáncer ovárico de éstas es de 1% solamente, en comparación con las portadoras BRCA1, cuyo riesgo a los 45 años es significativamente más alto (Figura 1). También, por la creciente evidencia de que los cánceres de alto grado tienen, en una proporción alta, su origen en la trompa de Falopio, se ha hecho la pregunta si sólo una salpingectomía preventiva pudiere ser profilaxis adecuada para aquellas mujeres que desean preservar función ovárica 54,55. Sin embargo, no hay data que compare salpingectomía con salpingooforectomía en relación a incidencia de cáncer.
Otro aspecto en el procedimiento de salpingooforectomía de reducción de riesgo es si realizar o no histerectomía. La histerectomía ha sido propuesta para prevenir el cáncer de trompa que se origina en la porción intramural de éstas, para prevenir cáncer de endometrio en el caso de uso de tamoxifeno para cáncer de mama y además para evitar hormonoterapia de reemplazo que contenga progestinas. Además, una histerectomía es preventiva de un adenocarcinoma de endometrio variedad serosa, similar a la diferenciación serosa del epitelio ovárico y tubario, los que si están en riesgo en pacientes mutadas BRCA 1-2. Los adenocarcinomas serosos de endometrio son habitualmente muy agresivos y debutan como carcinomatosis peritoneal. Finalmente, la decisión de agregar histerectomía al procedimiento debe individualizarse en el contexto de otros aspectos ginecológicos e inherentes a cada paciente.
PRESERVACIÓN DE LA FERTIliDAD EN MUJERES PORTADORAS DE MUTACIONES BRCALa disponibilidad de pruebas genéticas para detectar mutaciones ha determinado la identificación de mayor número de mujeres en edad reproductiva portadoras de esta condición. En ellas, una opción de vigilancia que se ofrece es la salpingooforectomía bilateral profiláctica entre los 35 y 40 años con la consecuente menopausia e infertilidad. Las portadoras de mutaciones BRCA1 parecen tener menor reserva ovárica al compararlas con portadoras de mutaciones BRCA2 o no portadoras, lo que es un factor negativo para lograr un embarazo: tienen niveles significativamente menores de hormona antimulleriana (AMH), el mejor marcador bioquímico de reserva ovárica 56, significativa mayor tasa de baja respuesta a estimulación ovárica (33.3 vs. 3.3%, P.014) 57 y también presentan la menopausia antes que los controles 58,59. Aunque faltan estudios, las portadoras de mutaciones BRCA1 podrían tener una vida reproductiva 2-4 años más corta que la población general, secundaria a esta menor reserva ovárica.
Numerosos estudios señalan que la paridad y el número de hijos son factores protectores de cáncer de mama en mujeres portadoras 60. Sin embargo, algunas no han logrado los hijos que desean antes de los 40 años, momento en que se plantea como opción realizar salpingooforectomía bilateral. Las mujeres sanas portadoras de mutaciones BRCA presentan mayor riesgo de cáncer en la etapa reproductiva de la vida que requerirá quimioterapia gonadotóxica. A ellas se les recomienda como opción salpingoooforectomía a los 35-40 años. Ahora, si se trata de mutaciones BRCA1 tendrían una probable menor reserva ovárica. Ello justifica la recomendación de completar sus familias a una edad más temprana de lo habitual 61. La Sociedad Americana de Medicina Reproductiva considera que ser portadora de una mutación BRCA es una condición médica en la que está indicado hacer intervenciones de preservación de la fertilidad 62 y se ha comprobado que ellas se benefician del consejo reproductivo adecuado 63. No hay estudios que demuestren impacto negativo del embarazo en sobrevivientes de cáncer de mama, especialmente en el riesgo de recurrencias y mortalidad 64. Los datos disponibles en la literatura apoyan como seguro y factible el embarazo y lactancia después de un cáncer de mama en mujeres con bajo riesgo de recurrencia 65. No hay información específica sobre embarazo después de cáncer de mama en mujeres con mutaciones BRCA.
Efecto de la quimioterapia sobre la reserva ováricaEn patología oncológica, los tratamientos con quimioterapia combinada pueden tener como secuela a largo plazo insuficiencia ovárica prematura. Hay drogas con alto riesgo de gonadotoxicidad, otras tienen riesgo intermedio y otras se asocian a un riesgo bajo o desconocido. Aquellas que tienen alto riesgo producen un daño citotóxico progresivo e irreversible en el ovario, donde el número de células germinales es limitado y fijo desde la vida fetal. Como consecuencia, con cada ciclo de quimioterapia citotóxica se produce una marcada pérdida de folículos primordiales, además la destrucción de un número significativo de folículos en crecimiento. Específicamente para el tratamiento de cáncer de mama, el uso combinado de ciclofosfamida y doxorubicina (AC), puede resultar en disminución significativa de la reserva ovárica que, basado en análisis histológicos, corresponde a la pérdida de al menos el equivalente a 10 años de reserva ovárica 66. Esto se confirma al comparar niveles de AMH antes y después de tratamiento con quimioterapia por cáncer de mama. Por último, las portadoras de mutaciones BRCA pueden ser más susceptibles a la pérdida ovocitaria inducida por quimioterapia debido a reparación deficiente del DNA, producto de la mutación 67.
La probabilidad de que una paciente experimente insuficiencia ovárica luego del tratamiento citotóxico también se asocia a la edad y reserva ovárica: a mayor edad y menor reserva ovárica la dosis de quimioterapia necesaria para producir daño gonadal irreversible es menor. Como las portadoras de mutaciones BRCA1 pueden tener menor reserva ovárica, es posible que en ellas el daño ovárico sea mayor. Si además requiere tratamiento con tamoxifeno, se verá obligada a retrasar el embarazo con la subsecuente mayor pérdida de reserva ovárica por la edad.
Preservación de la fertilidad en mujeres portadoras de mutaciones de los genes BRCA1/2Para decidir si una mujer con cáncer de mama es candidata a preservar su fertilidad, hay que tomar diversos puntos en cuenta: el impacto del tratamiento en la reserva ovárica, su edad, su reserva ovárica, la posibilidad de retrasar el inicio del tratamiento oncológico y el número de hijos que le gustaría tener. Como las variables son muchas no existe un abordaje estándar y hay que tomar decisiones caso a caso. Las portadoras presentan dos factores adicionales a considerar. El primero es que la probable menor reserva ovárica puede influir en que la respuesta a la hiperestimulación ovárica sea menor y la probabilidad de éxito de las intervenciones destinadas a preservar la fertilidad sea baja. El segundo se refiere a la posibilidad de que los ovocitos sean más sensibles a los agentes citotóxicos y la pérdida ovocitaria inducida por la quimioterapia sea mayor.
En portadoras, al igual que en mujeres jóvenes con cáncer de mama, el tratamiento oncológico condiciona inevitablemente una menor ventana reproductiva, pero en estos casos más corta dada la opción de realizar salpingooforectomía profiláctica a los 35-40 años, además de la aparente menor reserva ovárica de las portadoras de mutaciones BRCA1. Es fundamental que las portadoras de mutaciones con cáncer de mama, sean derivadas después del diagnóstico para ser evaluadas por un equipo experto en preservación de fertilidad que les debe dar la consejería adecuada y ofrecer estrategias para preservar la fertilidad. Así dispondrán de herramientas para decidir entre de las distintas opciones 68. Lamentablemente, la mayoría de las pacientes con cáncer de mama referidas para preservar fertilidad no saben si son portadoras de la mutación ya que las pruebas diagnósticas requieren semanas para ser confirmadas.
Criopreservación embrionaria y de ovocitosLa criopreservación embrionaria es el método con mejores resultados y se ofrece en primer lugar a mujeres con pareja que desean preservar la fertilidad. Cuando la mujer no tiene pareja se recomienda vitrificar ovocitos, método que en el año 2013 dejó de ser experimental. Publicaciones recientes estiman que los resultados de la vitrificación ovocitaria, en mujeres jóvenes, son similares a los de ciclos de Fertilización in Vitro (FIV) con ovocitos frescos. Además, los resultados perinatales son adecuados sin aumento de anormalidades cromosómicas en recién nacidos provenientes de ovocitos criopreservados, aunque los datos a largo plazo son limitados. Tanto la criopreservación embrionaria como la de ovocitos requieren estimulación ovárica desde el momento de la menstruación para lograr el desarrollo de varios folículos ováricos y así obtener múltiples ovocitos, lo que demora 2-6 semanas dependiendo del momento del ciclo menstrual en que se encuentre la paciente. Habitualmente en mujeres con cáncer de mama hay tiempo suficiente para la estimulación ya que después del diagnóstico inicial transcurren aproximadamente 2-4 semanas antes de la cirugía y la quimioterapia comienza alrededor de 3-5 semanas después de ésta. Es fundamental que la derivación sea lo más precoz posible (idealmente antes de la cirugía) para coordinar todos los tratamientos. En casos en que hay restricción de tiempo es posible comenzar la inducción de la ovulación en cualquier momento del ciclo menstrual, incluso después de la ovulación. Las drogas utilizadas para estimular la ovulación elevan significativamente los niveles de estrógeno lo que no es deseable en pacientes con cáncer de mama. Para disminuir la exposición a estas altas concentraciones se ha desarrollado un esquema que incluye letrozole, inhibidor de aromatasa que también estimula la ovulación en mujeres premenopáusicas, en conjunto con hormona folículo estimulante (FSH) y antagonistas de GnRH (hormona liberadora de gonadotrofinas). De esta forma se estimula eficientemente la ovulación con niveles de estrógeno cercanos a los de un ciclo natural, obteniéndose un número de ovocitos y embriones comparable con el que se logra en ciclos habituales de FIV 69. Resultados preliminares indican que las tasas de embarazo también son similares y, hasta el momento, no hay diferencias en tasas de sobrevida libre de enfermedad entre el grupo estimulado de esta forma versus el grupo no tratado 70.
Criopreservación de tejido ovárico y supresión ováricaLa criopreservación de tejido ovárico es una estrategia para preservar la fertilidad que se propone principalmente en niñas prepuberales (que no tienen otras opciones para preservar la fertilidad) o cuando no hay tiempo para vitrificar ovocitos o embriones. En el año 2014 había alrededor de 60 nacidos vivos reportados producto del trasplante de tejido ovárico. A pesar de esto, la criopreservación de tejido ovárico como estrategia para preservar la fertilidad aún es considerada experimental. Se puede realizar en mujeres con cáncer de mama no portadoras de mutaciones BRCA, que requieren preservación de fertilidad de urgencia. Existen dudas respecto a la reintroducción de células neoplásicas al trasplantar el tejido, ya que en algunas neoplasias hematológicas este riesgo es elevado y la criopreservación de tejido ovárico se contraindica. Sin embargo, no se han encontrado células malignas en el tejido ovárico de mujeres con cáncer de mama por lo que el riesgo de retransmisión se considera bajo. En mujeres portadoras de mutaciones BRCA aún no se han reportado casos de trasplante de tejido ovárico. En ellas, la recomendación es evitar la criopreservación de tejido ovárico ya que el trasplante podría resultar en el desarrollo posterior de un cáncer de ovario por su condición de base 71.
A pesar que estudios experimentales en animales demuestran un efecto protector del uso de análogos de GnRH, estudios realizados en humanos y publicados hasta ahora han sido inconsistentes y no apoyan su uso. La Sociedad Americana de Oncología Clínica concluye que no es una estrategia efectiva para la preservación de la fertilidad en la mujer.
Estudio genético preimplantacional (PGD) para pacientes portadoras de mutaciones BRCALas mutaciones BRCA pueden ser analizadas por este método de forma de transferir solo los embriones no portadores 72. Realizar este estudio produce controversias importantes porque, por un lado, las mutaciones no son letales y no garantizan el desarrollo de un cáncer y, por otro, el hecho de descartar embriones que por lo demás son normales puede no ser aceptable desde un punto de vista emocional, religioso y ético. Por esto, no hay consenso sobre si se debe realizar PGD en mujeres portadoras. Las que deciden hacerlo deben recibir la consejería psicosocial adecuada.
Los autores declaran no tener conflictos de interés en relación a este artículo.