La enfermedad de Perthes es una necrosis isquémica idiopática de la epífisis femoral proximal en niños. La prueba diagnóstica más utilizada es la radiografía simple, que además permite clasificar la enfermedad en función de su evolución y de su extensión. Aunque su historia natural, autolimitada en el tiempo, es generalmente benigna, existen una serie de factores asociados a un pronóstico menos favorable. Estos factores son la edad, la extensión de la enfermedad y determinados signos radiológicos, y definen a aquellos pacientes que más se van a beneficiar del tratamiento. La contención de la cabeza femoral en el acetábulo para permitir un óptimo remodelado de la misma es el objetivo del tratamiento que actualmente se basa en métodos quirúrgicos como las osteotomías femorales o acetabulares. Los métodos de contención ortopédicos como las ortesis de abducción no han demostrado obtener mejores resultados.
Perthes’ disease is an idiopathic avascular necrosis of the proximal femoral epiphysis in children. Plain radiograph is the main diagnosis tool and is also used to classify the phase and the extent of the disease. Although it is a self-limited condition and its natural history is often benign, there are several factors that can worsen prognosis. Those factors are age, extent of the disease and some radiological signs and are useful to identify patients who will benefit the most from treatment. Adequate containment of the femoral head within the acetabulum resulting in a more spherical and congruous joint is the main goal of treatment, which is based mainly on surgical techniques, such as femoral or acetabular osteotomies. It has been shown that orthopaedic containment methods, like abduction orthosis, have not achieved better results.
La enfermedad de Legg-Calvé-Perthes consiste en una necrosis isquémica de la epífisis femoral proximal en el esqueleto del niño de etiología desconocida. Fue descrita de forma simultánea e independiente por Legg, Calvé y Perthes en la primera década del siglo xx1. Se consideró durante algunos años un proceso infeccioso, pero fue finalmente Perthes quien describió las características histológicas de la enfermedad, pasándola a llamar «osteocondritis deformante juvenil»2. Se trata de un proceso autolimitado que se desarrolla a lo largo del tiempo en diferentes etapas. Todos los pacientes llegarán a la fase de curación mediante la reosificación y remodelación de la epífisis necrosada pero no todos van a conseguir formar una cadera esférica, cubierta y congruente. El papel del cirujano ortopédico consiste en saber reconocer aquellos casos con riesgo de presentar un pronóstico adverso y actuar para modificar la evolución de la enfermedad.
EpidemiologíaLa enfermedad de Perthes aparece generalmente en la primera década de la vida, aunque también se han descrito casos en la adolescencia3,4. Su incidencia anual varía según la región geográfica entre el 0,2 y el 29,4 por 100.000 habitantes entre 0 y 14 años de edad. Se ha observado una mayor incidencia en la raza caucásica siendo menos frecuente en asiáticos y excepcional en individuos de raza negra5,6. Es tres veces más frecuente en niños que en niñas y, aunque la mayoría de las veces se presenta de forma unilateral, puede afectar a ambas caderas hasta en el 14% de los casos3,7,8.
EtiologíaLa causa concreta de la enfermedad sigue siendo un misterio. Existen diversas teorías basadas en la asociación del trastorno con determinados factores. Algunos autores defienden un origen nutricional o ambiental ya que se ha observado una mayor incidencia de la enfermedad en áreas geográficas más pobres7,9. Además, existen diferencias antropométricas en los niños que padecen la enfermedad ya que suelen presentar un retraso en la edad esquelética con respecto a la cronológica. También se ha observado en estos niños una mayor incidencia de bajo peso al nacer y una talla al nacimiento significativamente más corta3,9–11.
El hecho de que el fenómeno fisiopatológico que se produce es una necrosis isquémica ha llevado a algunos investigadores a buscar una etiología vascular. Algunos han intentado encontrar una asociación con determinados estados de hipercoagulabilidad como la presencia del factor V de Leiden o el déficit de proteínas S y C, pero los resultados de los estudios son contradictorios12,13. Otros autores han observado una asociación con factores que disminuyen el aporte de oxígeno, como el consumo de tabaco materno durante el embarazo14. La sinovitis transitoria de cadera se ha considerado durante algunos años un posible factor causal debido al daño producido en los vasos epifisarios por el aumento de presión intraarticular. Sin embargo esta teoría no se ha confirmado y actualmente se considera que lo que sucede es una irritación sinovial secundaria a la necrosis de la epífisis15,16.
Por último, también se ha encontrado una relación con ciertos trastornos de la conducta como el trastorno por déficit de atención, así como con alteraciones urogenitales y retrasos en la osificación de elementos posteriores lumbosacros17–19.
ClínicaLa sintomatología es muy similar a la de la sinovitis transitoria de cadera. Suele aparecer de forma espontánea como dolor en cadera, muslo o rodilla frecuentemente acompañado de cojera y sin fiebre asociada. En la exploración física se puede encontrar una contractura de la musculatura adductora que se manifiesta como una limitación más o menos importante en la abducción de la cadera. Puede existir también una contractura en flexo y una limitación de la rotación interna. El dolor puede ceder puntualmente con la administración de antiinflamatorios no esteroideos pero vuelve a aparecer y persiste a lo largo de varias semanas o incluso meses antes de realizar el diagnóstico. Ante un niño diagnosticado de sinovitis transitoria de cadera que no remite al cabo de unos días hay que descartar la existencia de una enfermedad de Perthes incipiente3,15.
Pruebas de imagenDiagnósticoLa mayoría de los hallazgos descritos hasta ahora, tanto para establecer el diagnóstico, como para cuantificar el grado de afectación epifisaria se basan en la radiología simple. Para diagnosticar la enfermedad son necesarias y suficientes dos proyecciones, anteroposterior y axial de cadera, en las cuales se podrán observar diferentes signos radiológicos según el estadio de la enfermedad.
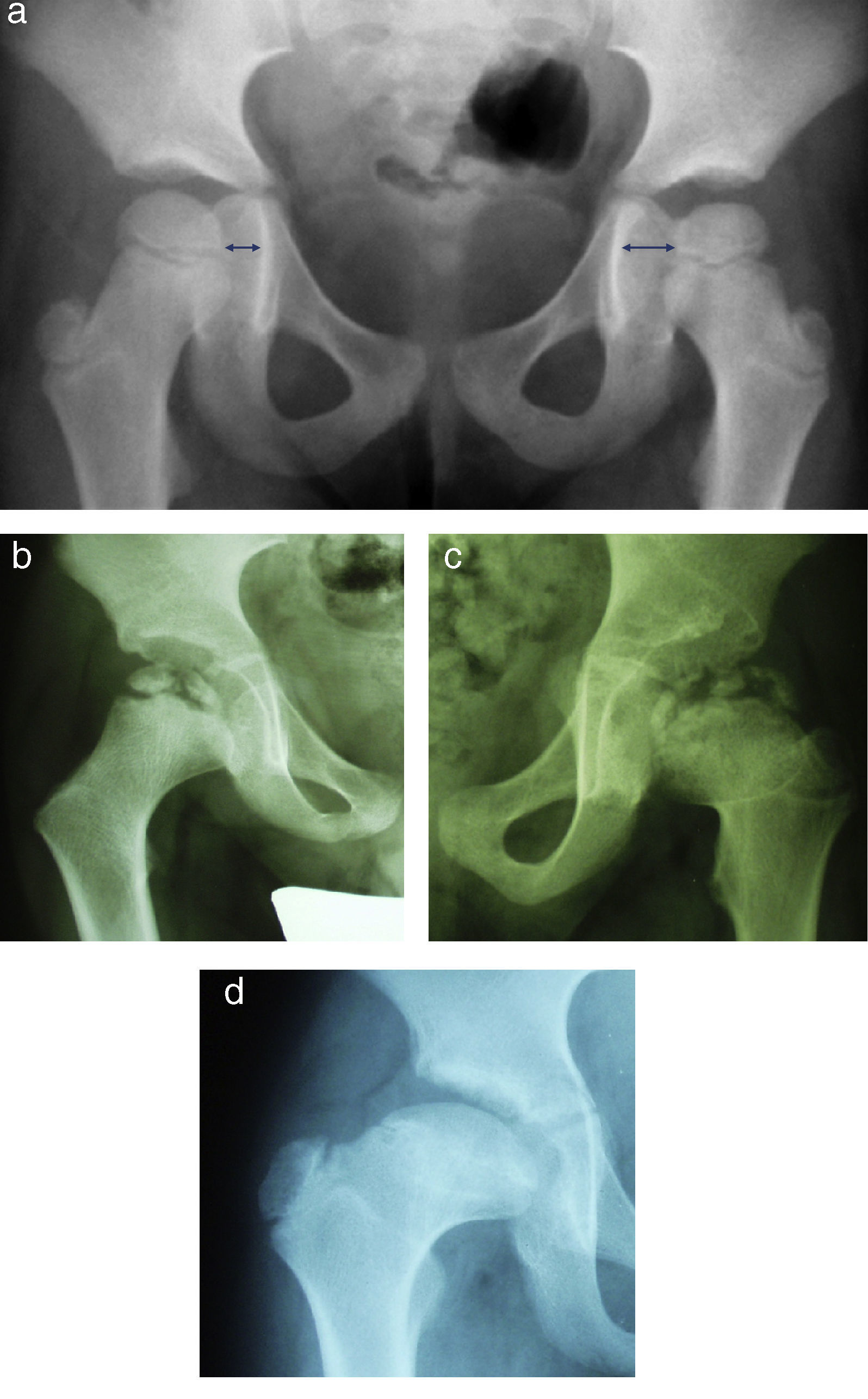
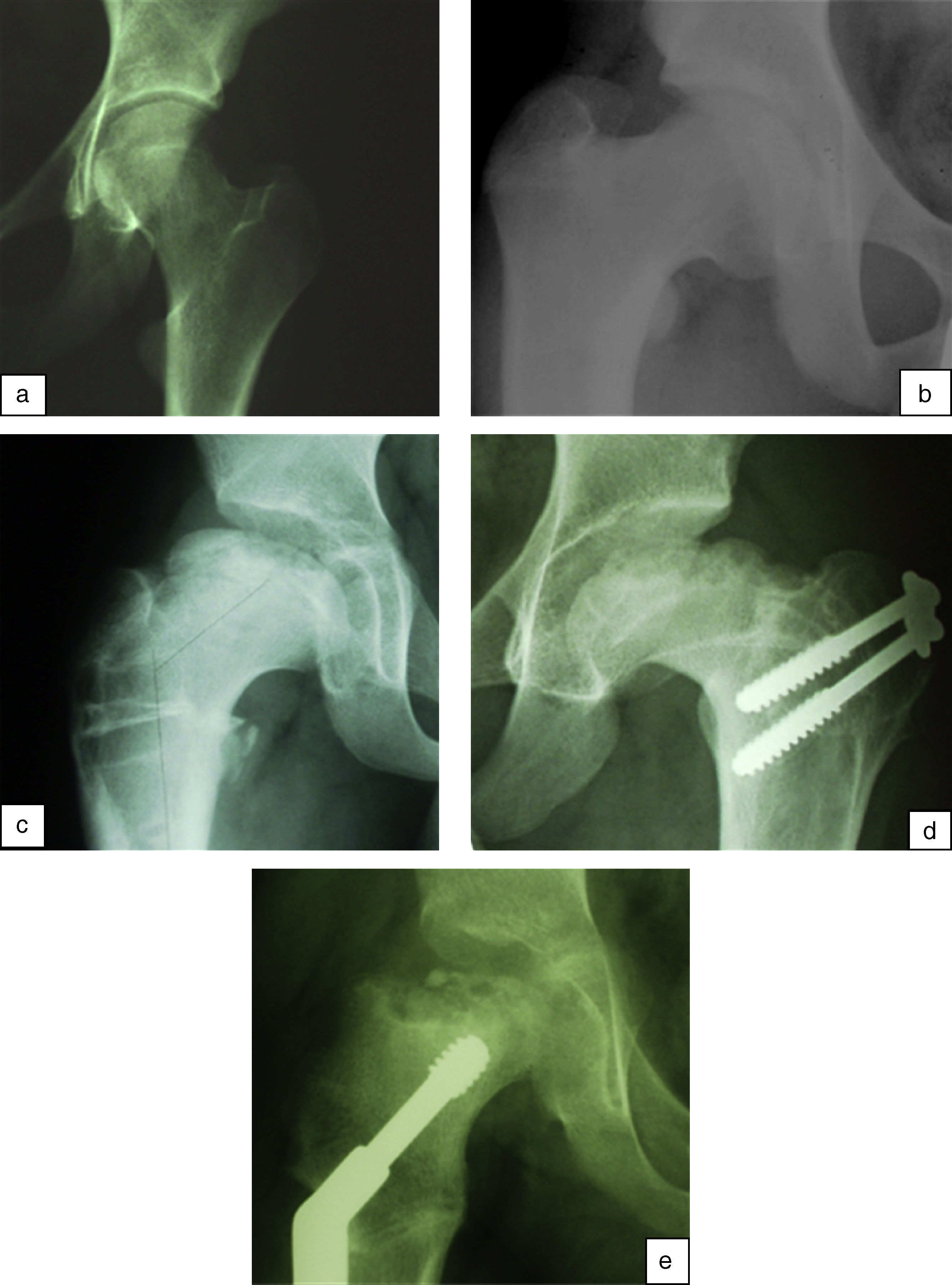
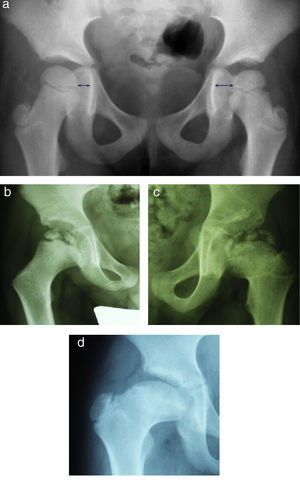
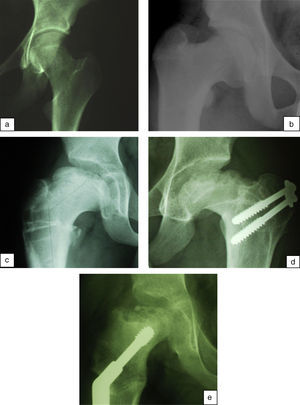
Waldenström definió cuatro estadios radiológicos evolutivos: inicial, fragmentación, reosificación y remodelación (fig. 1). El estadio «inicial» ocurre cuando comienza la necrosis. Se caracteriza por un aumento de la densidad epifisaria, una disminución del tamaño de la epífisis así como un aumento del espacio articular medial. Posteriormente, en la fase de «fragmentación», el hueso necrosado se empieza a reabsorber. Aparecen áreas escleróticas y áreas líticas en la zona afectada por la necrosis. Un hallazgo que se puede apreciar precozmente en este estadio y que marca el inicio del mismo es la presencia de una fractura subcondral. En la fase de «reosificación» comienza el proceso de curación. Las zonas de reabsorción son sustituidas poco a poco por hueso nuevo que tiene un aspecto algodonoso en las radiografías. Una vez que se ha completado la reosificación, la epífisis adquirirá su morfología definitiva mediante el crecimiento óseo a lo largo de la fase de «remodelación», que se prolonga hasta la madurez esquelética20,21.
La enfermedad de Perthes se suele diagnosticar en la fase inicial o en la de fragmentación aunque también existen casos que se detectan en la fase de remodelación. Es importante destacar que cualquier intervención por parte del cirujano ha de hacerse antes de que comience la fase de curación con el fin de poder modificar la evolución del proceso en los casos necesarios.
Cuando la enfermedad afecta a ambas caderas hay que realizar el diagnóstico diferencial con la displasia epifisaria de la epífisis femoral proximal (displasia de Meyer), las displasias epifisarias múltiples y las displasias espondiloepifisarias. La principal diferencia con todas ellas es que en la enfermedad de Perthes la afectación suele ser asimétrica, es decir que las caderas se encuentran en diferente estadio evolutivo. Además, el crecimiento de la pelvis y del acetábulo se altera en las displasias epifisarias múltiples y espondiloepifisarias mientras que en el Perthes es normal. Por otro lado, la enfermedad de Perthes se caracteriza por un empeoramiento inicial y una mejoría posterior mientras que las displasias epifisarias presentan una progresión lenta. No obstante, es conveniente realizar una serie ósea en casos bilaterales para descartar la existencia de alteraciones en otras epífisis del esqueleto22–24.
Otras pruebas de imagen como la ecografía o la resonancia magnética no tienen demasiado valor en el diagnóstico de la enfermedad de Perthes. El principal hallazgo ecográfico es un aumento del espacio articular que se suele deber a un engrosamiento de la sinovial más que a la presencia de derrame articular como ocurre en la sinovitis transitoria de cadera25. La resonancia magnética puede ser de utilidad en aquellos pacientes sintomáticos que presentan una radiografía normal. Se puede detectar una disminución de la perfusión de la epífisis femoral en las imágenes obtenidas tras la administración de contraste, por lo que resulta muy útil para el diagnóstico precoz26.
Aunque la gammagrafía ósea se ha utilizado en el diagnóstico de la enfermedad de Perthes, no ha demostrado ser superior a la resonancia magnética en el diagnóstico precoz. Por otro lado, las decisiones terapéuticas se basan en las clasificaciones descritas sobre las radiografías simples. Debido además a la radiación a la que se somete al niño para su realización, no la consideramos una prueba diagnóstica útil21,27.
ClasificaciónExisten dos tipos de clasificaciones radiológicas: las que definen el grado de afectación y las que establecen el resultado final, una vez alcanzada la madurez esquelética. Además, existe una serie de signos radiológicos que hay que conocer, ya que si están presentes indican un mayor riesgo de evolución adversa.
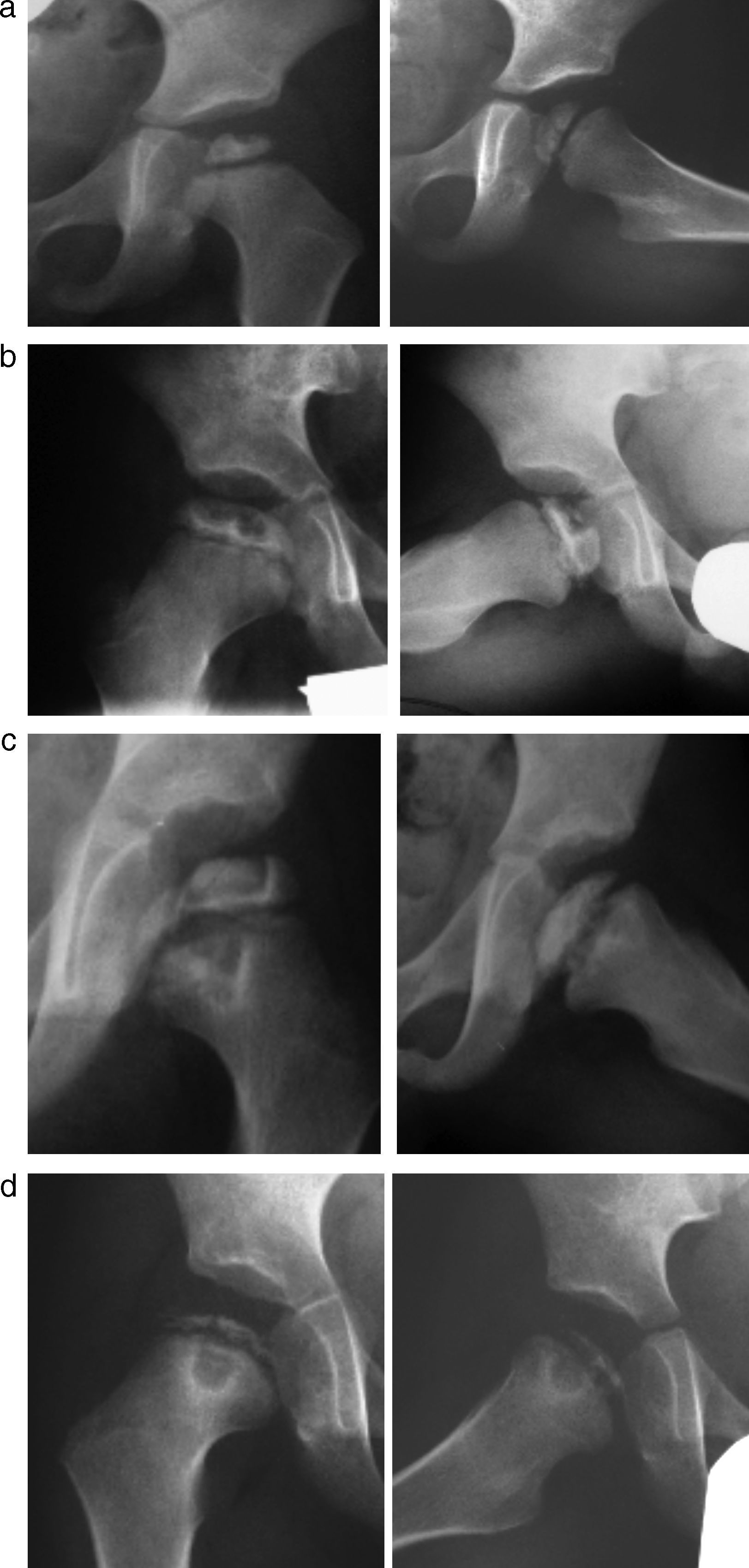
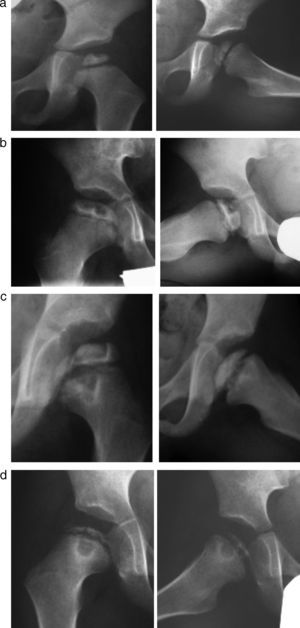
Grado de afectaciónClasificación de CatterallEn 1971 Catterall estudió el grado de afectación epifisaria como factor pronóstico y describió cuatro grupos en función de la extensión de la enfermedad en la proyección antroposterior y axial. El grupo I presenta una necrosis de la porción más anterior y central de la epífisis, sin colapso y sin secuestro. En el grupo II, el 50% de la porción anterior está afectada y existe un colapso central, manteniéndose la altura de las zonas medial y lateral. En el grupo III casi toda la epífisis se afecta salvo una pequeña porción medial y posterior. En el grupo IV la enfermedad se extiende por toda la epífisis y se produce un colapso total (fig. 2)21,28.
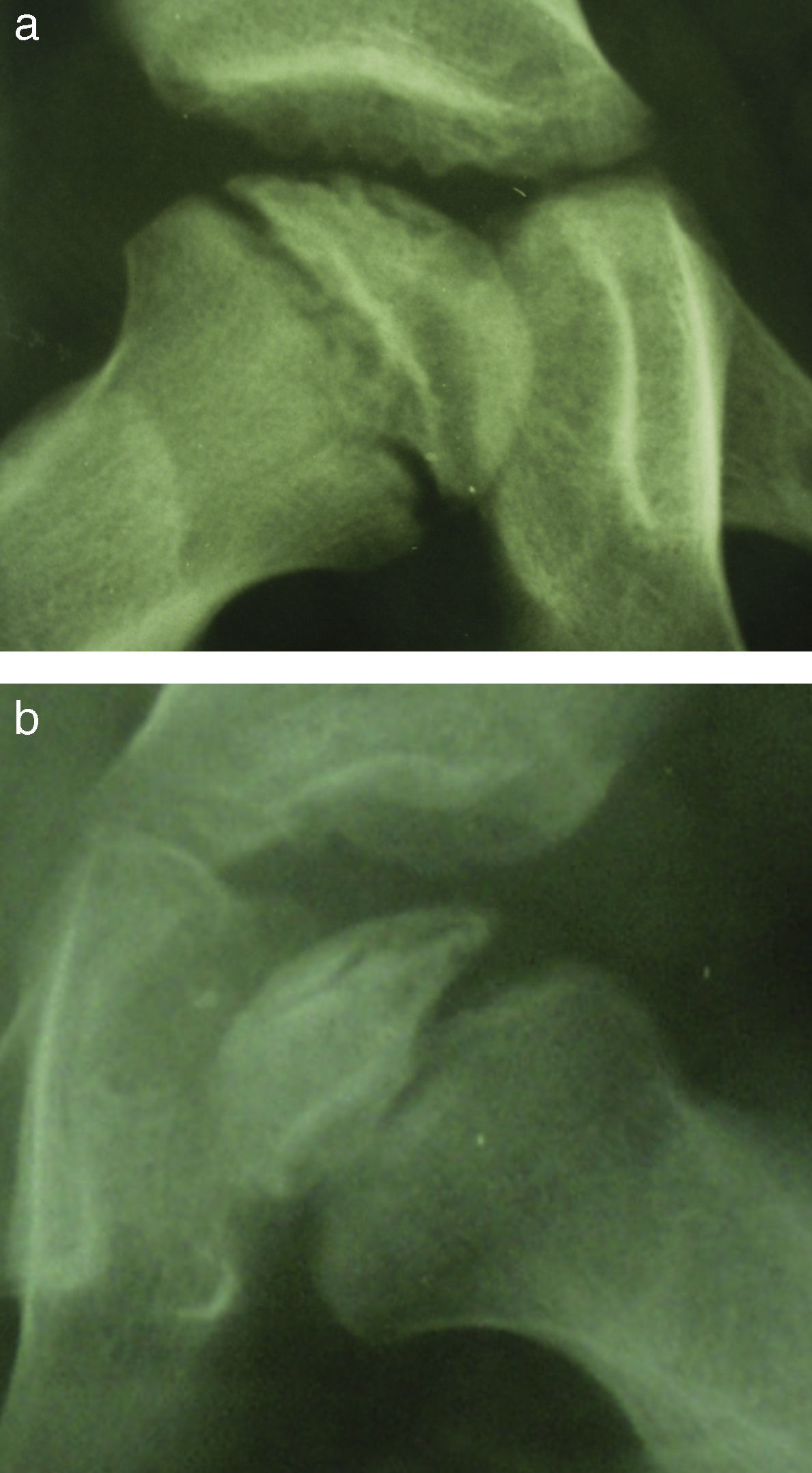
Clasificación de Salter y ThompsonDebido a que el sistema de Catterall se basa en el grado máximo de reabsorción radiológica y por tanto hay que esperar a que se complete la fase de fragmentación, Salter y Thompson describieron otra clasificación años más tarde para intentar establecer la extensión de la enfermedad de forma más precoz. Basándose en la presencia de la fractura subcondral al inicio de la fase de fragmentación, distinguieron dos grupos según la extensión de la misma en la radiografía axial. Así, en el grupo A la fractura abarca menos del 50% de la anchura de la epífisis y en el grupo B la fractura alcanza más de la mitad de la epífisis e indica una mayor extensión de la enfermedad (fig. 3). El inconveniente de este método es que no siempre se detecta la fractura en las radiografías ya que es un fenómeno muy precoz, y por tanto, no siempre se puede aplicar29,30.
Clasificación del pilar lateral de HerringAlgunos estudios han demostrado una baja reproducibilidad y fiabilidad de la clasificación de Catterall. Por ello, Herring describió en 1992 un sistema más sencillo para establecer el pronóstico según el grado de afectación epifisaria. Se basa en la división de la epífisis femoral, en la proyección anteroposterior, en tres sectores llamados pilares. El pilar lateral ocupa el 30% lateral de la epífisis y según el grado de colapso del mismo se distinguen 3 grupos. En el grupo A el pilar lateral se encuentra intacto, conservando su altura. En el grupo B se produce un colapso del pilar lateral de menos del 50% de su altura y en el grupo C el colapso supera el 50% de su altura (fig. 4)30,31. Debido a que casi todos los pacientes se encuentran en el grupo B y el C, posteriormente se distinguió un subtipo, el grupo B/C para describir de forma más precisa la transición entre un grupo y otro. El grupo B/C se caracteriza por presentar un pilar lateral muy estrecho (2-3mm) con una altura mayor del 50%, un pilar lateral con una escasa osificación pero una altura de al menos un 50% o un pilar lateral con una altura del 50% y sin colapso del pilar central32.
Clasificación de Sugimoto y AkazawaEsta clasificación trata de complementar el sistema del pilar lateral mediante la evaluación del pilar posterior siguiendo los mismos criterios. El pilar posterior se define como el 30% posterior de la epífisis femoral en la proyección axial. Estos autores observaron que la combinación de las dos clasificaciones (pilar lateral y pilar posterior) aumentaba el valor pronóstico ya que la gran mayoría de los casos pertenecen al grupo B de Herring33.
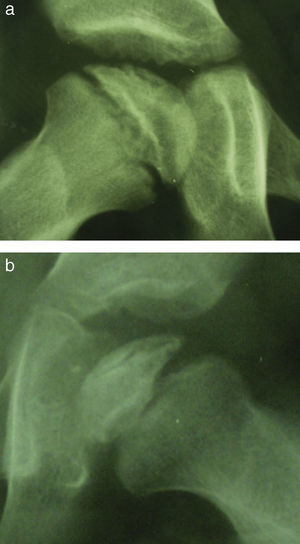
Resultado finalClasificación de StulbergDistingue 5 tipos de caderas. El tipo I es una cadera normal. En el tipo II la cabeza es esférica pero más grande de lo normal y el cuello es más corto. En el tipo III la cabeza deja de ser esférica y presenta una forma ovoidea. El acetábulo se ha adaptado a la forma de la cabeza resultando una cadera congruente. En el tipo IV la cabeza tiene una forma aplanada y sigue siendo congruente con el acetábulo. En el tipo V la cabeza es aplanada pero el acetábulo es normal por lo que la cadera no es congruente (fig. 5)34.
Sistema de MoseDetermina la esfericidad de la cabeza femoral aplicando unas plantillas transparentes de círculos concéntricos sobre las radiografías anteroposterior y axial. Se considera que una cabeza es esférica cuando su superficie se superpone al mismo círculo con una variación de dos milímetros como mucho en ambas radiografías35.
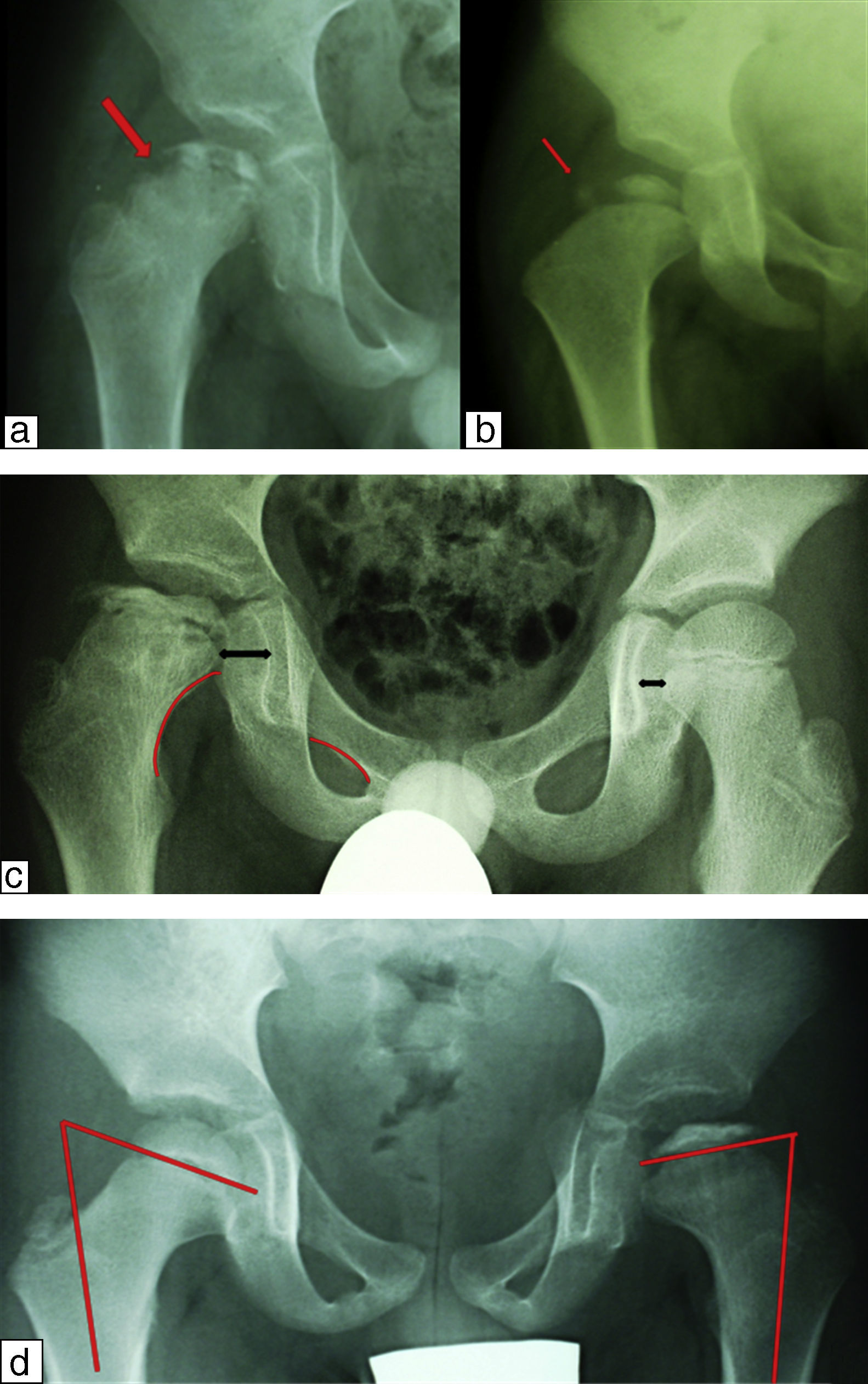
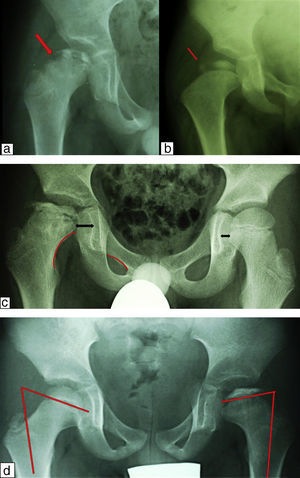
Signos radiológicos de riesgoCatterall describió, junto a su clasificación, una serie de signos radiológicos que cuando estaban presentes inidicaban un riesgo incrementado de pronóstico adverso. Estos signos son los siguientes y cuando los encontramos hablamos de «cabeza de riesgo» (fig. 6)28:
- •
Calcificación lateral de la epífisis.
- •
Horizontalización de la fisis.
- •
Zona osteolítica metafisaria o signo de Gage.
- •
Subluxación lateral.
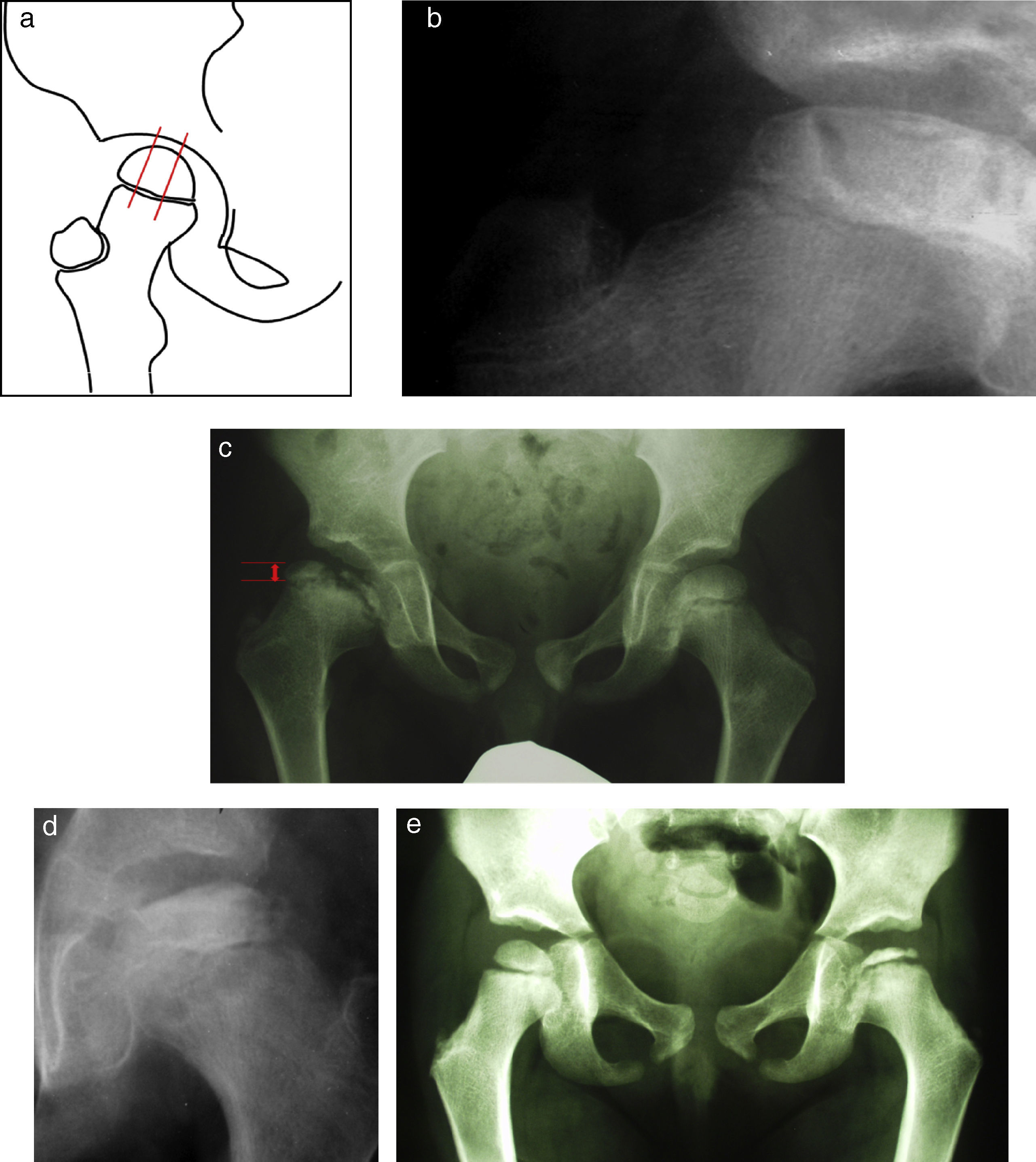
Signos radiológicos de riesgo. a) Signo de Gage. Se trata de una zona osteolítica en la región lateral de la metáfisis que conllevará un cierre precoz de la epífisis con hipercrecimiento relativo del trocánter y una discrepancia de longitud. b) La calcificación lateral de la epífisis indica que existe una zona de la epífisis que se está osificando por fuera del acetábulo con el consiguiente riesgo de desarrollar una futura coxa magna e incluso cadera en bisagra. c) Se aprecia un aumento del espacio articular medial que implica una subluxación lateral y una rotura de la línea de Shenton que implica una subluxación superior. d) Horizontalización de la fisis.
Cuando existe un colapso de toda la epífisis se puede producir además una subluxación proximal que se manifestará como una rotura de la línea de Shenton.
Historia natural y factores de riesgoLa enfermedad de Perthes sigue un curso autolimitado, y únicamente habrá que tratar a los pacientes que presenten un riesgo elevado de desarrollar una cadera incongruente. Se han descrito una serie de factores de riesgo que permiten identificar estos casos:
Edad: se ha visto que la edad de inicio se correlaciona con el resultado clínico y radiológico. Así, el debut por encima de los 6 años, y especialmente de los 8 años, empeora el pronóstico ya que a partir de esta edad la capacidad de remodelación es menor36,37.
Extensión de la enfermedad: el grado de afectación epifisaria también marca la evolución; los estadíos III y IV de Catterall, el grupo B de Salter y el grupo C de la clasificación de Herring, es decir, los grupos de mayor afectación, se asocian con un peor pronóstico28–30.
Signos radiológicos de riesgo: los descritos por Catterall.
Contracturas en adducción: si son mantenidas limitan el rango de movilidad y pueden condicionar una subluxación lateral de la epífisis38.
Las caderas esféricas y congruentes tendrán un futuro biomecánico normal. Sin embargo, los pacientes que al finalizar la fase de remodelación presenten caderas incongruentes tendrán un riesgo incrementado de desarrollar artrosis en la edad adulta temprana. Así, hasta los 30 años, todos los grupos de Stulberg conservarán una buena función articular, pero a partir de la cuarta década, serán sobre todo los pacientes del grupo V los que sufrirán un rápido deterioro34,36.
TratamientoLos objetivos del tratamiento de la enfermedad de Perthes son el alivio de los síntomas, la restauración de la movilidad articular en caso de estar afectada y el remodelado adecuado de la epífisis femoral, que se basa en el principio de contención. Según este principio, si se consigue asegurar una adecuada contención de la cabeza femoral dentro del acetábulo durante el proceso de reosificación se obtendrá una cabeza más esférica y más congruente gracias al remodelado recíproco que se produce entre la epífisis femoral y el acetábulo.
Alivio sintomáticoConsiste en el reposo funcional junto con la administración de antiinflamatorios no esteroideos en los períodos de más dolor. El reposo funcional se puede conseguir mediante el uso de muletas. Algunos autores hablan también de periodos cortos de tracción aunque está muy debatido su uso, especialmente en pacientes con gran afectación21.
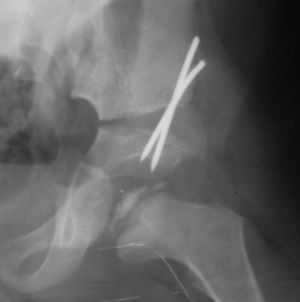
Restauración de la movilidadEs fundamental mantener una adecuada movilidad en aquellos pacientes que presenten una contractura de los adductores que pueda condicionar una subluxación lateral de la epífisis. Para ello se puede realizar fisioterapia y en casos severos o refractarios, con una abducción de 20° o menos, una tenotomía de adductores seguida de la aplicación de yesos de Petrie durante 4 semanas.
ContenciónPara intentar conseguir una buena contención se han descrito diferentes métodos. La contención no quirúrgica mediante el uso de ortesis de abducción y la contención quirúrgica mediante la realización de osteotomías a nivel femoral o a nivel pélvico.
Contención ortopédica: ortesis de abducciónEsta modalidad fue durante muchos años el tratamiento estándar. Se han utilizado muchos tipos de ortesis pero todas ellas aseguraban la contención mediante la abducción de la cadera: ortesis que limitaban la carga, ortesis que permitían la carga pero limitaban la movilidad y aparatos que permitían la carga así como cierto grado de movilidad manteniendo la abducción fija, como la ortesis Scottish Rite21. Sin embargo, en los últimos años se han publicado varios estudios que han puesto en duda su eficacia, y actualmente, cada vez son más los autores que desaconsejan su uso en la enfermedad de Perthes37,39–41.
Contención quirúrgicaLa contención quirúrgica se puede conseguir recolocando la cabeza del fémur en el acetábulo mediante una osteotomía varizante femoral o redireccionando el acetábulo mediante una osteotomía pélvica, o bien combinando ambas osteotomías. Las indicaciones clásicas, resumidas por Salter, son las siguientes: afectación de más de la mitad de la cabeza femoral (grupos III y IV de Catterall o grupo B de Salter), edad de inicio por encima de los seis años o subluxación de la cabeza femoral42.
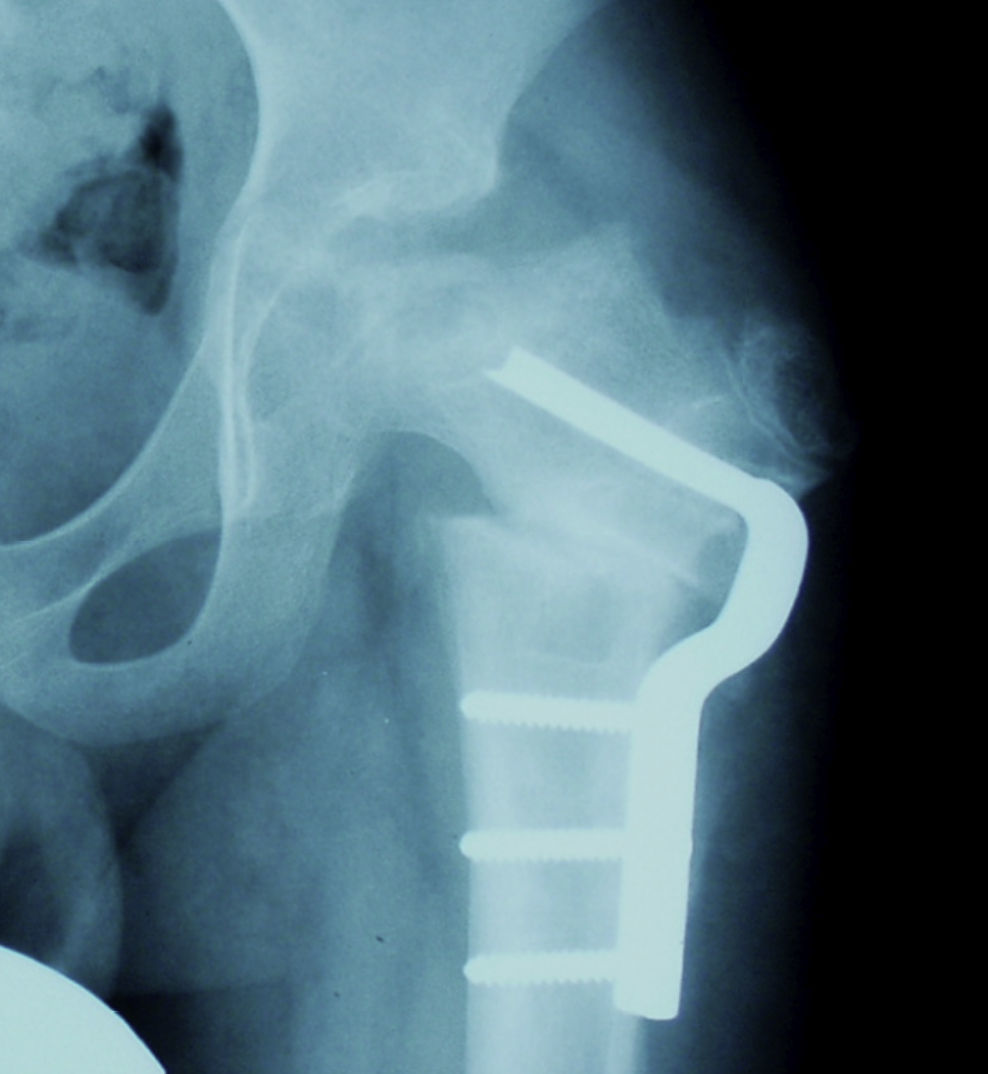
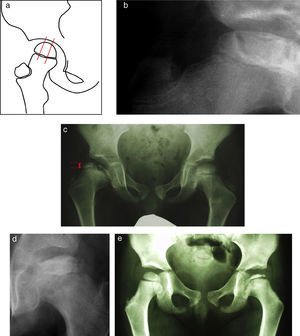
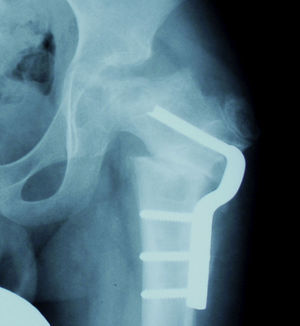
Osteotomía femoral varizanteEsta técnica permite actuar en el lado afecto de la articulación; debido además a su sencillez, resulta muy atractiva para muchos autores. La desventaja que presenta según algunos estudios es un riesgo incrementado de discrepancia de longitud así como de coxa vara con el consiguiente riesgo de desarrollar una debilidad de la musculatura abductora. Para prevenir estos fenómenos se recomienda evitar una varización excesiva. No existe un acuerdo en cuanto a la angulación exacta necesaria y aceptable pero se recomienda calcular la varización de manera que permita una cobertura completa de la cabeza por el acetábulo. Esto se puede valorar realizando una artrografía y observando el grado de abducción necesario para recolocar la cabeza dentro del acetábulo. Si el ángulo que se requiere se prevé excesivo, se debe optar por otra técnica (fig. 7)21,43.
Osteotomía pélvica de SalterTécnicamente es similar a la osteotomía utilizada en la displasia del desarrollo de la cadera. Las ventajas que ofrece frente a la osteotomía femoral son un riesgo menor de discrepancia de longitud de miembros inferiores y de coxa vara, una mayor distancia articulo-trocantérica, así como una mayor cobertura acetabular. Sin embargo, obliga a intervenir el lado sano de la articulación, es técnicamente más demandante y puede incrementar la presión intraarticular (fig. 8)42,44,45.
Ostetomía combinadaAlgunos autores han defendido el uso de las osteotomías pélvica y femoral combinadas cuando es necesaria una varización excesiva para lograr una buena contención de la cabeza en los casos con afectación severa y en niños mayores de 7 años. Sin embargo, otros autores no han demostrado una mejoría sustancial de los resultados con respecto a otras técnicas, por lo que no justifican su uso46,47.
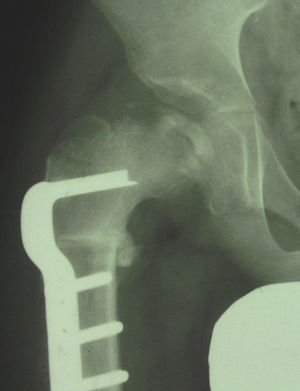
Osteotomía acetabular tipo ShelfLa osteotomía acetabular de cobertura tipo Shelf se ha empezado a utilizar en niños mayores, que tienen un potencial de remodelación menor, con subluxación de la cabeza femoral o en niños en los que se requiere una varización excesiva para conseguir una adecuada contención. Los mejores resultados parece que se obtienen entre los 9 y los 11 años. Según algunos autores, el principal inconveniente de esta técnica es el posible riesgo de producir un daño en la epífisis acetabular lateral y consecuentemente una inhibición del crecimiento acetabular. Sin embargo, este hecho no solo no se ha confirmado sino que algunos estudios recientes han detectado un estímulo del crecimiento acetabular tras realizar este tipo de osteotomía (fig. 9)48,49.
Osteotomía pélvica tripleFinalmente, en los últimos años se está realizando la osteotomía pélvica triple; la ventaja que parece ofrecer frente a las osteotomías clásicas es una mayor contención con un menor riesgo de acortamiento del miembro. El principal inconveniente es el riesgo de impingement si se produce una contención excesiva. Los resultados a corto plazo son alentadores, pero por el momento faltan estudios a largo plazo que consoliden estos resultados iniciales50,51.
Existen numerosas publicaciones sobre los resultados del tratamiento de la enfermedad de Perthes, pero en general son poco concluyentes debido a numerosos factores como son la ausencia de controles en los estudios, el escaso control de las variables conocidas o la utilización de métodos diferentes para evaluar los resultados52. Recientemente se ha publicado el primer estudio prospectivo, controlado y multicéntrico que compara los resultados de diferentes tratamientos37. Los autores observaron que el mayor beneficio del tratamiento quirúrgico, bien con osteotomía femoral o bien con osteotomía pélvica, lo obtuvieron los pacientes pertenecientes a los grupos B y B/C de Herring en los que la enfermedad debutó por encima de los 8 años. En los pacientes del grupo A de Herring y en los menores de 8 años el tratamiento quirúrgico no se asoció con una evolución mejor. De la misma manera, los pacientes del grupo C de Herring no presentaron un pronóstico más favorable tras el tratamiento quirúrgico. El factor pronóstico predictivo más importante fue la clasificación del pilar lateral de Herring seguido de la edad al diagnóstico.
Nuestra actitud terapéutica en los pacientes con enfermedad de Perthes es la siguiente. En niños menores de 7-8 años con afectación discreta (Herring A-B) adoptamos una actitud expectante, realizando revisiones clínico-radiológicas cada 4 meses; en caso de desarrollar una contractura en adducción optamos por un tratamiento rehabilitador si no es muy intensa o por una tenotomía de adductores cuando la cadera no se puede abducir más de 30° y no responde al tratamiento conservador. En niños mayores de 7-8 años con un estadio B de Herring o en niños con un estadio C, independientemente de su edad, realizamos generalmente una artrografía evaluando el grado de varización necesario para conseguir una buena contención. Si precisa abducción y rotación interna optamos por una osteotomía femoral varizante sobre todo en pacientes menores de 8 años, asociando generalmente una apofisiodesis del trocánter. Si precisa flexión, abducción y rotación interna optamos por una osteotomía pélvica tipo Shelf especialmente en pacientes mayores de 8 años. Si es necesaria una varización excesiva combinamos las dos osteotomías.
ComplicacionesLas principales complicaciones que pueden aparecer en la enfermedad de Perthes son la cadera en bisagra, el hipercrecimiento relativo del trocánter mayor y la osteocondritis disecante.
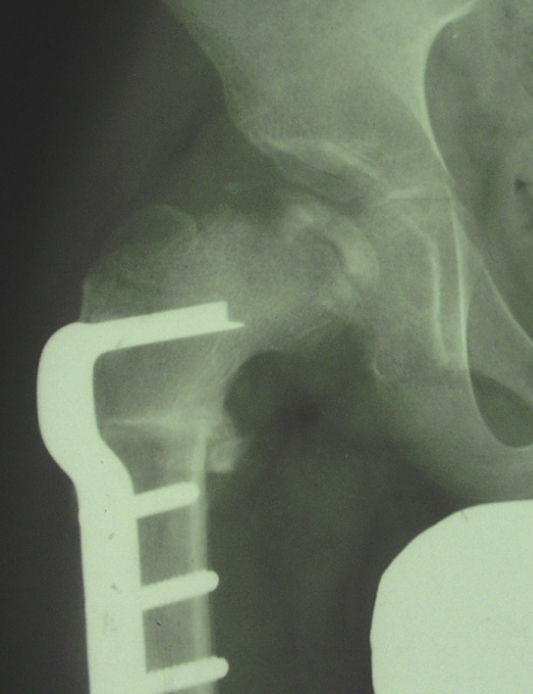
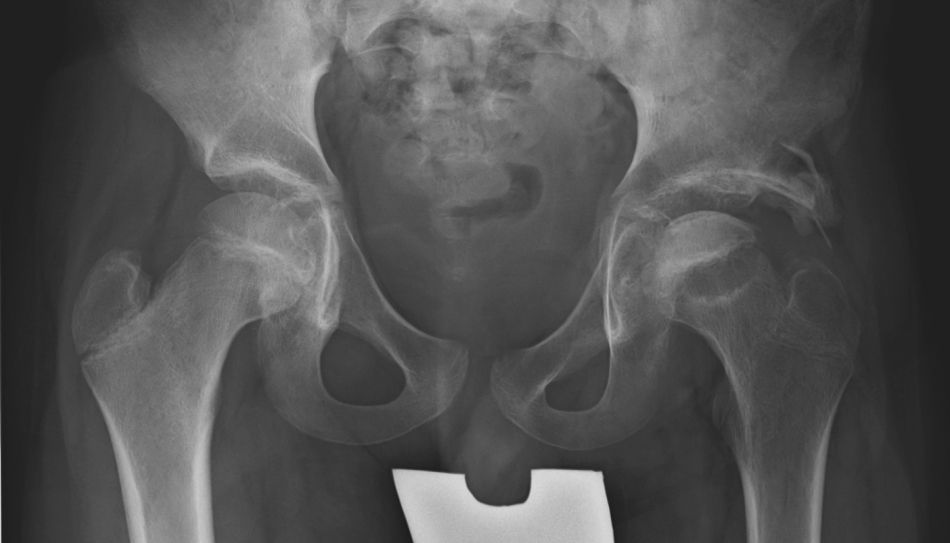
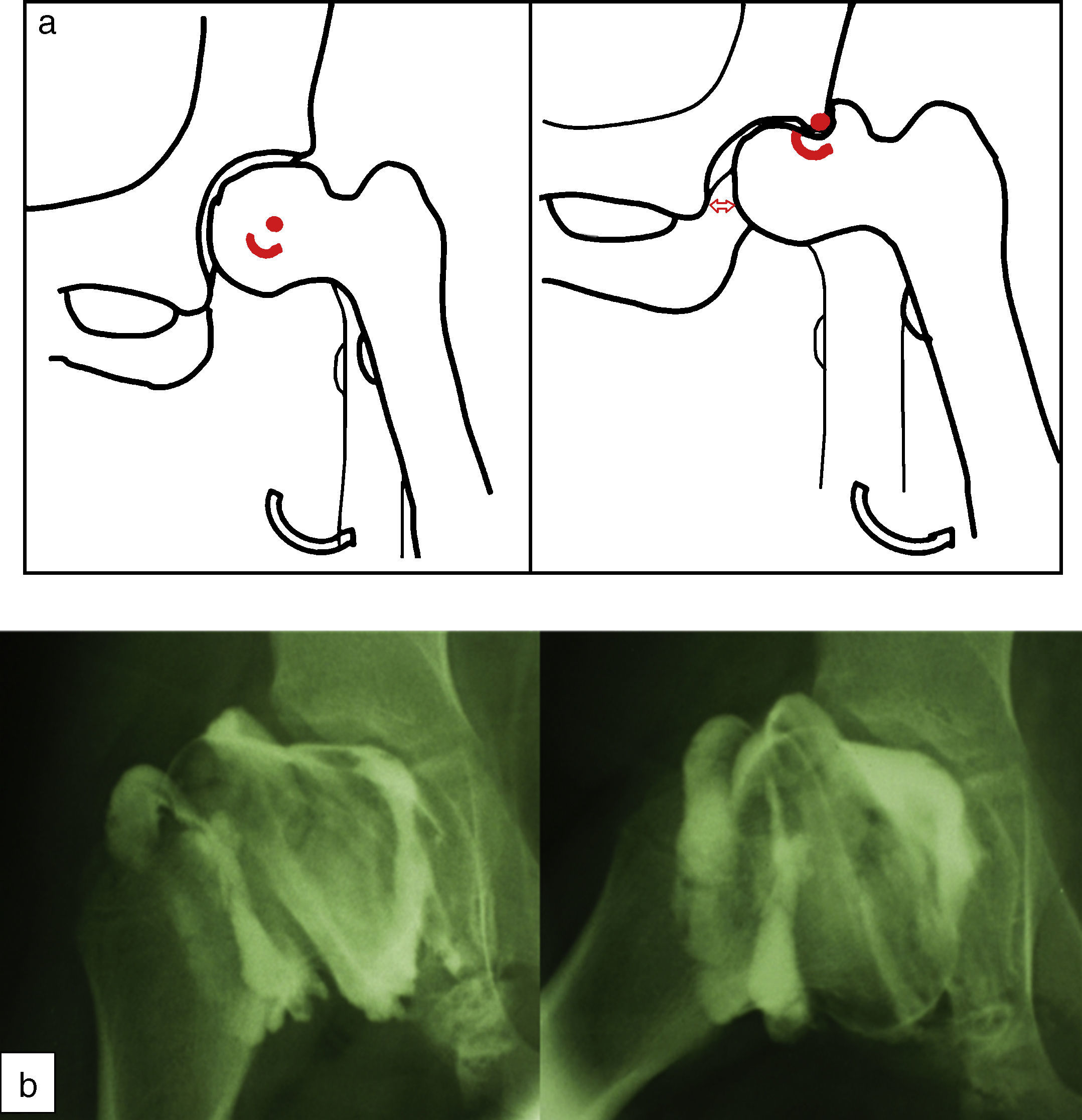
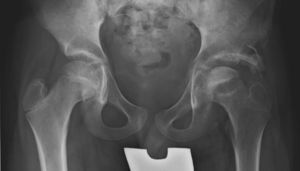
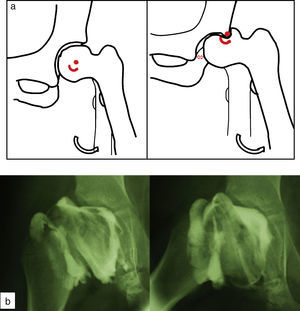
Cadera en bisagraLa cadera en bisagra es un término que se utiliza para describir el movimiento anómalo de la cadera que tiene lugar cuando la porción superolateral de la cabeza femoral deformada choca con el borde lateral del acetábulo, desplazando el centro de rotación de la cadera al realizar la abducción. Ésta se produce entonces por un «pivotaje» de la cabeza alrededor del borde lateral del acetábulo, aumentando el espacio articular medial (fig. 10a). El colapso del pilar central junto con una contractura mantenida de los adductores puede favorecer la subluxación lateral de la epífisis en la fase de fragmentación. En la fase de reosificación, la porción lateral de la epífisis con defecto de cobertura se reosificará por fuera del acetábulo, desarrollándose poco a poco la cadera en bisagra. Se ha asociado a una edad de presentación de la enfermedad más tardía y a una mayor afectación de la epífisis. El primer síntoma que aparece es una limitación de la movilidad de la cadera en un paciente que previamente había evolucionado bien. Los hallazgos radiográficos que demuestran un riesgo incrementado de desarrollarla son la subluxación lateral de la epífisis y la presencia de una calcificación lateral. Para confirmar el diagnóstico la prueba más fiable es la artrografía, que demostrará el efecto bisagra evidenciado por el acúmulo de contraste medial al realizar la abducción de la cadera (fig. 10b). El tratamiento más aceptado consiste en realizar una osteotomía valguizante de fémur, como técnica de rescate (fig. 11)53–55.
Hipercrecimento relativo del trocánter mayorEl crecimiento de la extremidad proximal del fémur se puede ver afectado como consecuencia de la enfermedad en algunos pacientes. El crecimiento en la fisis de la cabeza femoral se altera mientras que el del trocánter mayor se manteniene, pues su vascularización depende de vasos metafisarios que no se afectan por la isquemia; esto da lugar a un sobrecrecimiento relativo del mismo. La mayoría de estas alteraciones no se deben a barras fisarias sino más bien a un enlentecimiento del crecimiento. Se han asociado a un aumento de presión en el margen lateral de la epífisis que puede verse incrementado por una osteotomía varizante tardía, en una cabeza ya deformada, y no parecen tener relación con la aparición de quistes metafisarios o rarefacciones fisarias a lo largo de la enfermedad. El tratamiento consiste en detener el crecimiento del trocánter mayor en niños menores de 8 años mediante una apofisiodesis, mientras que en mayores de 8 años resulta más eficaz realizar un descenso del trocánter mayor.
En estos pacientes la longitud del miembro inferior también se afecta y en ocasiones, simultáneamente a un descenso del trocánter realizamos una epifisiodesis del fémur distal contralateral56–58.
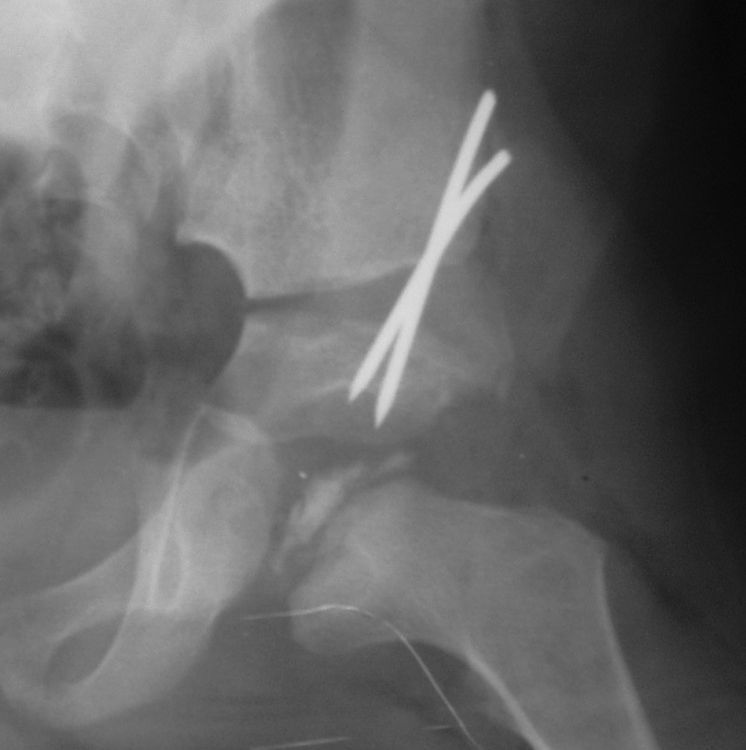
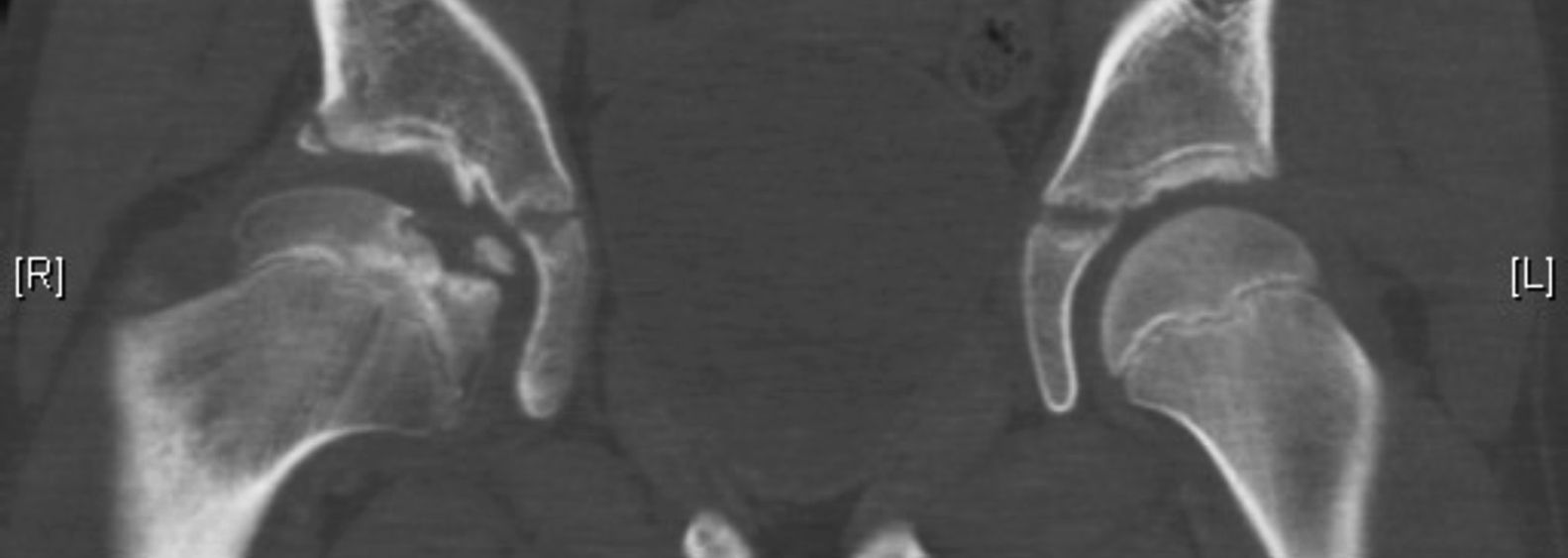
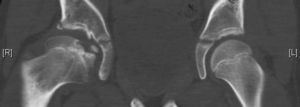
Osteocondritis disecanteLa osteocondritis disecante es una complicación rara que se da en un 3% de los casos. A diferencia de la osteocondritis disecante clásica, en la enfermedad de Perthes se debe a una alteración en el proceso de curación de manera que una porción de la epífisis no termina de reosificarse. Se puede manifestar en forma de dolor intermitente con episodios de bloqueo articular si el fragmento se desprende (fig. 12)59,60.
Otra complicación rara que se ha descrito y que también producirá dolor con chasquidos e incluso bloqueos es la lesión del labrum acetabular60.
ConclusionesLa enfermedad de Perthes es un fenómeno autolimitado en el tiempo pero con una evolución muy variable según los pacientes. El tratamiento deberá ir dirigido a aquellos pacientes con un peor pronóstico, es decir, aquellos con un mayor grado de afectación epifisaria o que presenten los signos radiológicos de riesgo descritos por Catterall, especialmente si son mayores de 8 años. Es importante dedicar un tiempo en la consulta a explicar a los padres el proceso, la evolución y el pronóstico para que entiendan la actitud «abstencionista» en los casos con historia natural benigna. La aplicación de ortesis de abducción como método de contención está abandonada por su escasa eficacia en favor del tratamiento quirúrgico mediante ostetomías femorales varizantes o acetabulares. Es importante realizar un seguimiento estrecho que permita sospechar el futuro desarrollo de una cadera en bisagra, o detectar alteraciones del crecimiento de la extremidad proximal del fémur.
Nivel de evidenciaNivel de evidencia V.
Proteccion de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.