Los anticuerpos monoclonales son una poderosa herramienta para el diagnóstico de laboratorio y un instrumento cada vez más utilizado en el tratamiento de diversas enfermedades.
DesarrolloEl descubrimiento y caracterización de los anticuerpos tiene una larga historia, que es la de la propia inmunología. En este artículo se hace una introducción histórica sobre la inmunidad humoral hasta el hallazgo de los anticuerpos monoclonales y se revisan conceptos relativos a la estructura y funciones de los anticuerpos, así como a la generación de diversidad, activación y maduración de los linfocitos B. Se mencionan las principales técnicas de producción de anticuerpos monoclonales y se enumeran algunas de sus aplicaciones en patología humana.
ConclusionesLos anticuerpos monoclonales han producido desde su descubrimiento una revolución de gran calado en el diagnóstico y el tratamiento de numerosas enfermedades. La utilización de anticuerpos monoclonales humanizados y humanos ha mejorado notablemente su tolerancia. La tecnología actual de fabricación de estos anticuerpos permite nuevos diseños que pueden ampliar sus posibles aplicaciones en medicina.
Monoclonal antibodies are a powerful tool in laboratory diagnosis and are increasingly used in the treatment of several diseases.
DevelopmentAntibody development and characterization has a long history and goes back to immunology itself. The present article provides a historical introduction to humoral immunity until the discovery of monoclonal antibodies and reviews concepts relating to the structure and function of antibodies, as well as to the generation of diversity, activation and maturation of B lymphocytes. The main techniques for producing monoclonal antibodies are outlined and some of their applications in human disease are described.
ConclusionsSince their discovery, monoclonal antibodies have revolutionized the diagnosis and treatment of numerous diseases. The use of human and humanized monoclonal antibodies has markedly improved their tolerability. Current technology for manufacturing these antibodies allows new designs that may broaden their possible applications in medicine.
El descubrimiento y caracterización de los anticuerpos tiene una larga historia, que es la de la propia inmunología, y se remonta a finales del siglo xix. En esa época, los microbiólogos estudiaban los mecanismos de defensa del organismo contra los agentes microbianos, en particular contra las toxinas bacterianas. Von Behring y Kitasato sentaron en los años noventa del siglo xix las bases de la inmunidad humoral al descubrir que el suero producía sustancias que antagonizaban toxinas como la diftérica o la tetánica. Ehrlich, a finales de siglo, consolidó la idea de que las toxinas generaban antitoxinas séricas que se comportaban según las leyes de la química; las células de la sangre eran capaces de producir unas cadenas laterales que reaccionaban frente a las toxinas de manera específica como una llave con su cerradura1. Por las distintas propiedades de reaccionar las antitoxinas se denominaban de varias maneras: aglutininas, opsoninas, etc.
En los años treinta del siglo xx Landsteiner, el descubridor del sistema ABO, identifica todas esas funciones y las centra en una sola molécula, los anticuerpos, y al tiempo va sustituyéndose el nombre de toxina por el de antígeno. Años más tarde, este mismo autor, junto con Pauling, desarrolla la teoría instruccionista de formación de los anticuerpos, según la cual los antígenos determinarían la conformación de los anticuerpos acomodándola a su estructura. A finales de los cuarenta se descubre el origen celular de los anticuerpos en las células B y plasmáticas. Años más tarde se describen las cadenas ligeras y se identifican las inmunoglobulinas A, D y E.
Frente a la teoría instruccionista, Jerne propuso en los años cincuenta que los anticuerpos preexistían en el organismo y que la función de los antígenos sería la selección de los más adecuados2. Poco después, Burnett y Talmage adelantan la teoría de la selección clonal3 que completa y expande las ideas de Jerne, y que presupone que cada célula B produce un solo tipo de anticuerpo con una especificidad concreta, el cual se genera por mutaciones somáticas al azar durante el proceso de maduración celular; más adelante, la exposición a los antígenos hace que esas células B proliferen.
En los años sesenta se describe el concepto de idiotipo y en los setenta se acuña la teoría de las redes de idiotipos/antiidiotipos, pero la revolución en el mundo de los anticuerpos ocurre en 1975 cuando Milstein y Köhler decubren en Cambridge los anticuerpos monoclonales. En 1976 Tonegawa describe la recombinación somática de los genes de inmunoglobulinas4. Desde entonces la investigación completa el conocimiento de la genética molecular de los anticuerpos y los mecanismos de generación de su diversidad.
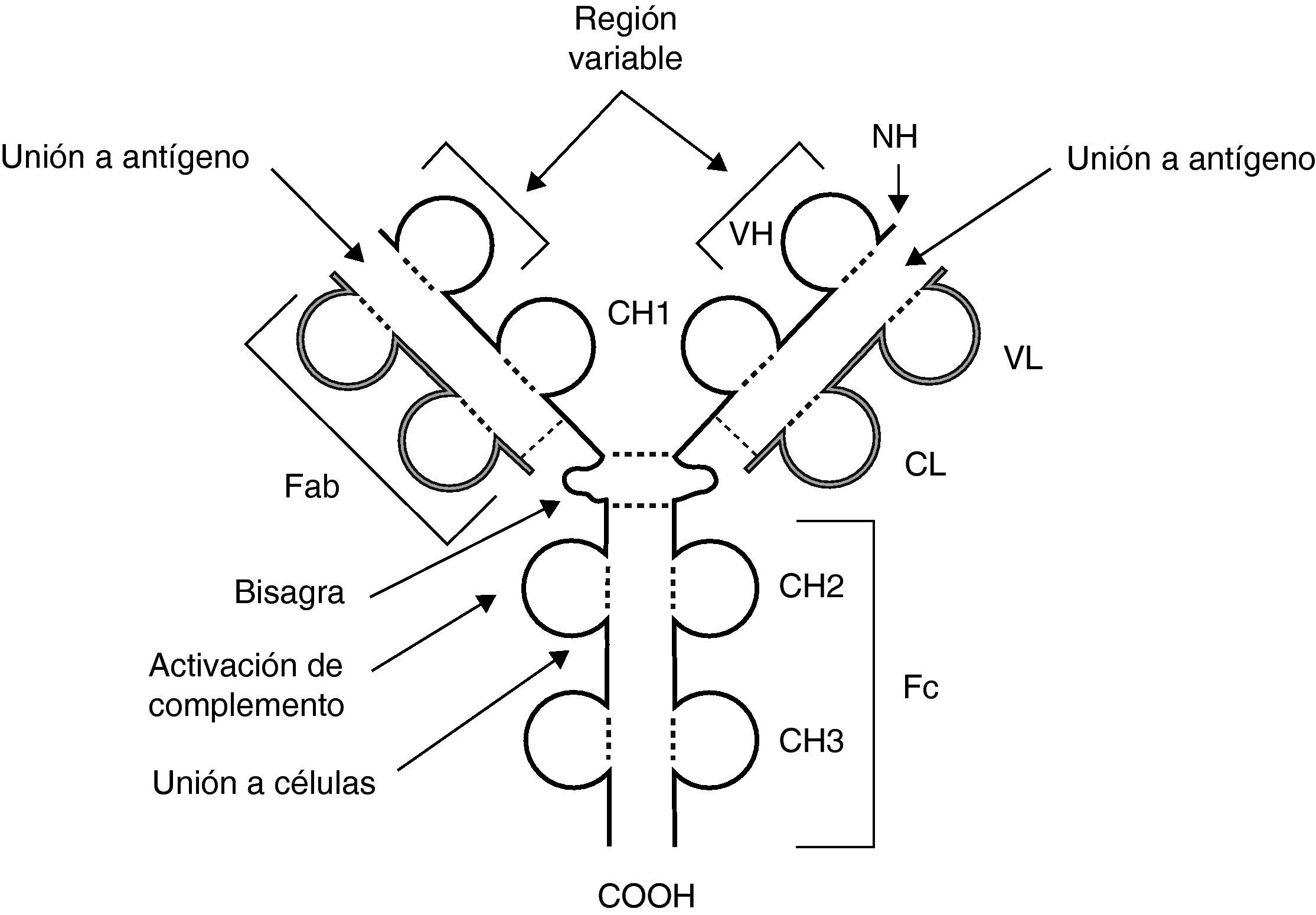
Estructura y características básicas de los anticuerposCada molécula de anticuerpo está formada por 4 cadenas, 2 ligeras y 2 pesadas, cada una de ellas idéntica, unidas por puentes disulfuro que forman una estructura espacial similar a una Y. Los anticuerpos tienen 2 funciones fundamentales, de reconocimiento y unión a antígenos, que llevan a cabo mediante los extremos aminoterminales de las cadenas, y una función efectora, realizada por el extremo carboxiterminal de las cadenas pesadas (fig. 1).
Esquema de la estructura de una molécula de inmunoglobulina. Las cadenas pesadas aparecen en negro y las ligeras en gris claro. CH: dominios de la región constante de la cadena pesada; CL: dominio constante de la cadena ligera; COOH: extremo carboxiterminal; Fab y Fc: fragmentos resultantes de proteólisis; NH: extremo aminoterminal; VH: dominio variable de la cadena pesada; VL: dominio variable de la cadena ligera; - - -: puentes disulfuro.
Las cadenas ligeras tienen una porción variable, de la que depende la especificidad, y una región constante que difiere según se trate de cadenas ligeras κ o λ.
Las cadenas pesadas poseen, asimismo, una región variable y una constante, la cual determinará las clases o isotipos principales de inmunoglobulina (Ig): γ, μ, α. δ y ¿, que formarán, respectivamente, la IgG, IgM, IgA, IgD e IgE. Además, la IgA tiene 2 subclases, IgA1 e IgA2, y la IgG se divide en 4 subclases: IgG1, IgG2, IgG3 e IgG4. Las propiedades de las Ig dependen de cada clase y subclase. Una vez secretadas, las Ig son monoméricas, con excepción de la IgA, que forma dímeros, y de la IgM, pentámeros.
Las regiones variables de las cadenas ligeras y pesadas están yuxtapuestas para formar el sitio de unión al antígeno; por consiguiente, en cada molécula de anticuerpo hay 2 sitios de unión antigénica.
Dentro de la estructura de las cadenas de las Ig se denominan dominios a estructuras repetidas de 110 aminoácidos (AA) con un pliegue beta. Las cadenas ligeras tienen 1 dominio en la región variable (VL) y 1 en la constante (CL). Las cadenas pesadas tienen, a su vez, 1 dominio en la región variable (VH) y 3 o 4 en la región constante (CH) según la clase de Ig. Entre los dominios CH1 y CH2 se encuentra un área denominada bisagra de la cadena constante que le da flexibilidad y permite un acoplamiento espacial adaptable.
En las regiones variables de las cadenas ligeras y pesadas hay 3 segmentos hipervariables de 10 AA yuxtapuestos que forman el sitio de unión al antígeno, que por ser complementarios a su secuencia se denominan CDR 1, 2 y 3, de los cuales el más variable es CDR3. Estas estructuras forman bucles en la superficie de los anticuerpos mediante los que interactúan con los antígenos. El resto del dominio variable se llama FR.
La proteólisis de las moléculas de Ig da lugar a distintos fragmentos según la sustancia empleada; el fragmento F(Ab’)2 se genera tras tratamiento con pepsina que corta la molécula a la altura de la bisagra dejando la parte superior de la Y con 2 fragmentos F(Ab) unidos entre sí. La papaína digiere la molécula más arriba y deja 3 fragmentos, 2 F(Ab) y un fragmento constante, Fc. Se habla de fragmento F(Ab’) cuando incluye la región de la bisagra de la cadena pesada.
Los anticuerpos son capaces de generar numerosas respuestas tras su unión a los antígenos. Esas respuestas efectoras dependen del extremo carboxiterminal de cada isotipo que determina el tipo de unión a determinados receptores de membrana de las células y la capacidad de fijar complemento.
Síntesis de inmunoglobulinas. Generación de diversidad. Activación y maduración de los linfocitos BLa producción de las Ig corre a cargo de las células B que en su etapa madura expresan en la membrana moléculas de IgM e IgD. Cuando se activan, comienza una producción de Ig de baja tasa, cambia el isotipo y comienza la maduración por afinidad. En la etapa de célula plasmática hay una alta secreción de Ig de alta afinidad con escasa presencia de Ig de membrana.
Los mecanismos que controlan la diversidad de los anticuerpos5 son altamente complejos y han ocupado la actividad de los investigadores durante décadas. Resumiendo mucho, podemos decir que existen 2 etapas básicas en este proceso: una recombinación somática, en la que se produce la combinación de distintos segmentos génicos presentes en las regiones variables de las cadenas ligeras y pesadas que terminan formando un gen funcional responsable de la secuencia de AA de la porción variable de la molécula de Ig, que da lugar a una muy elevada diversidad de moléculas en lo que se llama repertorio primario de anticuerpos, y una hipermutación somática durante la respuesta a antígenos, que corresponde a mutaciones puntuales de la secuencia variable una vez formada ésta y que terminan permitiendo una mayor afinidad de unión. Además, a medida que madura la respuesta inmune tiene lugar un cambio de isotipo mediante el cual el segmento variable reordenado puede combinarse con cualquiera de los segmentos constantes de las Ig y de ello dependerán las características efectoras finales de la molécula de Ig secretada.
Los genes de las cadenas ligeras se agrupan en 2 segmentos génicos de la región variable, V (variable) y J (unión) y un segmento constante (C) distinto según se trate de cadenas κ o λ. Las cadenas pesadas tienen 3 segmentos en las regiones variables: V, D (diversidad) y J, y un segmento C distinto según el isotipo de cada Ig.
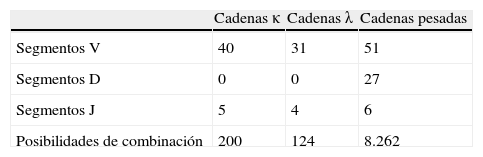
En los seres humanos la cadena ligera κ depende de una región en el cromosoma 2 que agrupa los segmentos V, J y C. Los mismos segmentos génicos responsables de la cadena λ están en el cromosoma 22. Los segmentos V, D, J y C de las cadenas pesadas se sitúan en un área del cromosoma 14. El número de segmentos V, D, J y C de las cadenas y la probabilidad de combinación se detallan en la tabla 1.
Combinaciones posibles en el repertorio primario de anticuerpos
| Cadenas κ | Cadenas λ | Cadenas pesadas | |
| Segmentos V | 40 | 31 | 51 |
| Segmentos D | 0 | 0 | 27 |
| Segmentos J | 5 | 4 | 6 |
| Posibilidades de combinación | 200 | 124 | 8.262 |
Posibilidades de combinación total: (200+124) x 8.262=2.676.888.
Tomado de Álvarez-Vallina et al, 2004.
Para que las células B se activen se necesita el contacto con los antígenos. Es importante resaltar que a diferencia de lo que ocurre con las células T, las células B reconocen una amplia variedad de antígenos proteicos y no proteicos. Las macromoléculas estimulan a los anticuerpos mediante determinantes antigénicos o epítopos que pueden ser lineales o conformacionales, esto es, yuxtapuestos en un pliegue de la proteína. Si la proteína se transforma puede originar nuevos determinantes antigénicos. La unión con el antígeno es reversible y la fuerza de su unión se llama afinidad. La fuerza global de unión al antígeno se conoce como avidez, que depende del número de puntos de unión disponibles. La especificidad es la capacidad de reconocer en un anticuerpo pequeñas diferencias antigénicas.
Las moléculas de IgM e IgD ancladas en la membrana de las células B actúan como receptores de antígeno. En el caso de los antígenos proteicos, se requiere la ayuda de las células T para activar a las B, lo cual implica el desencadenamiento de señales intracelulares con activación de factores de transcripción y expresión de genes, cambio de isotipo y diferenciación hacia célula productora de anticuerpos. En el caso de los antígenos no proteicos, no dependientes del timo, no se requiere la cooperación de las células T. La activación cesa a través de señales inhibitorias complejas cuando la cantidad de anticuerpo producida es suficiente.
Durante la activación y maduración las células B migran a los folículos de ganglios linfáticos y del bazo, donde maduran mediante hipermutación somática con aumento creciente de afinidad por el antígeno. Al final sobreviven solamente las más afines al antígeno presentado por células dendríticas y, finalmente, migran hacia órganos linfáticos secundarios, aunque una pequeña parte permanece como células B de memoria que recirculan entre ganglios linfáticos y del bazo. Cada clon de células plasmáticas produce un solo tipo de anticuerpo.
Producción de anticuerpos monoclonalesLos anticuerpos monoclonales se descubrieron en la primera mitad de los años setenta por Milstein y Köhler en el laboratorio de biología molecular de Cambridge (Reino Unido). Estos autores investigaban los mecanismos moleculares de la generación de diversidad de los anticuerpos y necesitaban producir una célula B inmortal con especificidad conocida, para así poder analizar en detalle las mutaciones de los genes de las Ig. Para ello fusionaron una línea de células de mieloma murino, sensible a ciertos fármacos, con células de bazo de un animal inmunizado. Mediante este procedimiento consiguieron seleccionar solamente las células híbridas y los clones con especificidad conocida. Su trabajo fue publicado en Nature en 19756 y 9 años más tarde recibieron el premio Nobel por este descubrimiento. Su trascendencia fue enorme, ya que por primera vez era posible disponer de cantidades ilimitadas de anticuerpos con especificidades precisas.
Las células tumorales de mieloma de ratón procedían todas ellas de una línea creada por Michael Potter en los años sesenta denominada MOPC21, deficitarias en enzimas clave para la síntesis de oligonucleótidos por la vía de rescate. El agente fusionante inicial era el virus Sendai, pero pronto se sustituyó por polietilenglicol. Las células B provenían de ganglios linfáticos o del bazo de ratones inmunizados repetida y eficazmente con el antígeno deseado. Estas células se cultivaban con las de mieloma y el agente fusionante en un medio de cultivo de composición especial (HAT) que no permite la supervivencia de las de mieloma no hibridadas; los linfocitos B no fusionados morían también y quedaban las células fusionadas. La especificidad se analizaba en los sobrenadantes de los pocillos de las placas de cultivo, seleccionando sólo los deseados y al final se llevaba a cabo la clonación por dilución límite u otros medios7,8.
Los hibridomas creados pueden conservarse indefinidamente en dimetil sulfóxido y los anticuerpos monoclonales se purifican a partir de los sobrenadantes. El rendimiento en cultivo no es muy alto y por ello se ha desarrollado la técnica de producción de ascitis en ratones mediante la inyección intraperitoneal de los hibridomas, método no aceptado en todos los países, o procedimientos in vitro mediante la fermentación de cultivos de células de mamífero utilizando biorreactores y sistemas de cultivo de perfusión continua.
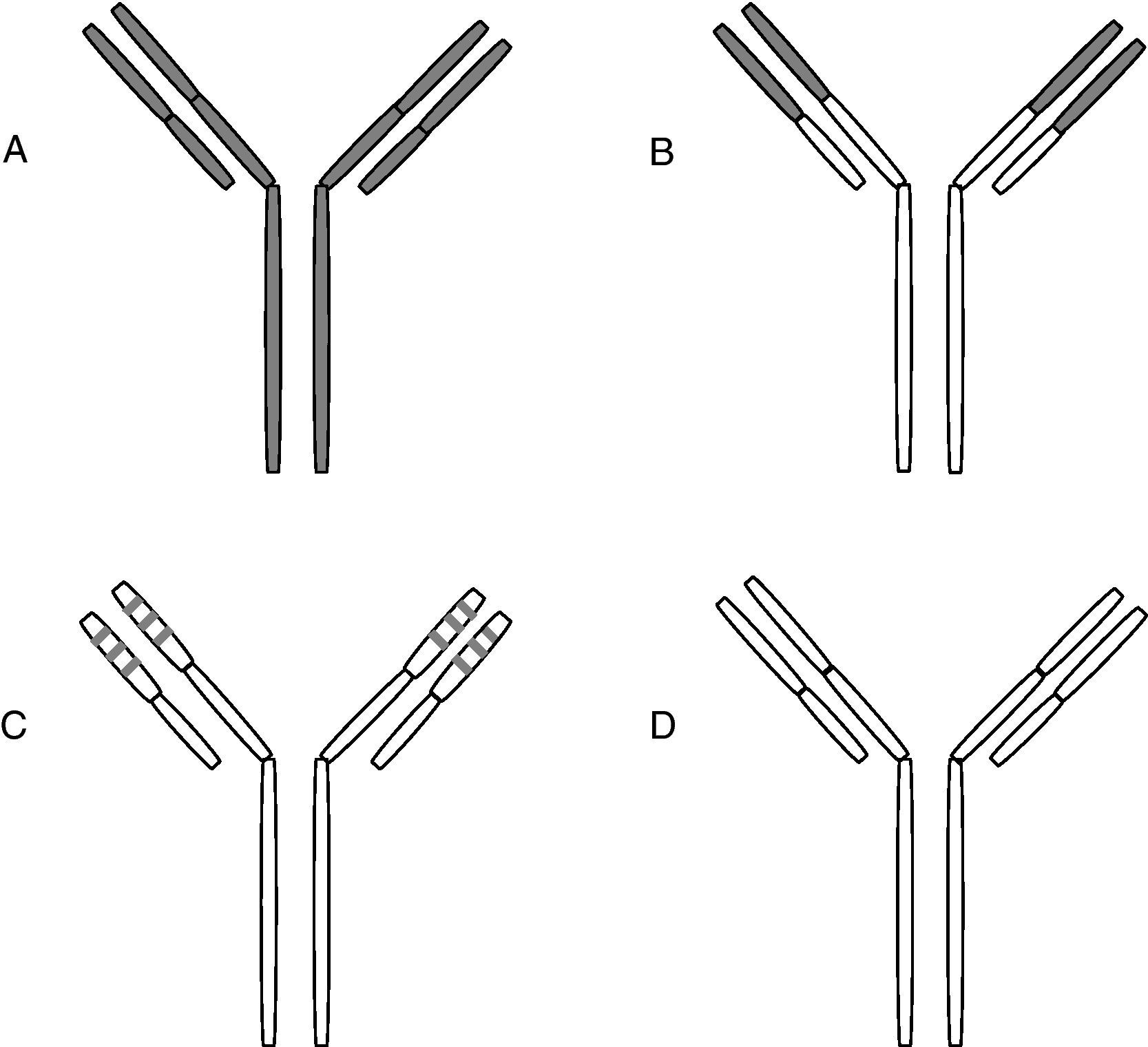
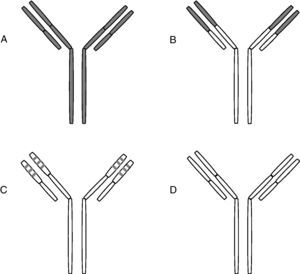
El primer uso en terapia humana fue en 1982 para el tratamiento de un linfoma9. Pronto se vio que el uso de monoclonales murinos arrastraba el problema de la tolerancia con producción de anticuerpos humanos antimurinos que disminuían su eficacia. Para solventar estas dificultades se exploraron diversas alternativas, de las que las más importantes son la quimerización y la humanización. La quimerización se desarrolló en 198410. Por quimerización se entiende la producción de anticuerpos monoclonales en los que solamente la región variable es de origen murino, y el resto de las cadenas pesadas y ligeras es de origen humano. En los anticuerpos humanizados sólo son murinas las regiones hipervariables de las cadenas ligeras y pesadas11,12. La mitad de los monoclonales utilizados en terapia humana son quiméricos o humanizados (fig. 2).
Quimerización y humanización de anticuerpos monoclonales
A) Monoclonal murino. B) Monoclonal quimérico, en el que las regiones variables son de origen murino siendo humano el resto de las cadenas.
C) Monoclonal humanizado: sólo incluye los segmentos hipervariables de origen murino. D) Monoclonal humano.
Otra alternativa son los monoclonales humanos que se producen en animales transgénicos portadores de genes de Ig humanas; los transgenes incluyen fragmentos de las regiones variables en línea germinal, lo que les facilita la capacidad recombinatoria de los anticuerpos humanos. Las vías de introducción de esos segmentos son los miniloci, los cromosomas artificiales de levadura o humanos, y los vectores P1. Los animales pueden tener inactivados los genes de sus Ig endógenas13,14. Los monoclonales humanos son más ventajosos por su menor antigenicidad y mejor tolerancia, y por su mayor tiempo en circulación en relación con los quiméricos.
La tecnología de fragmentos de bibliotecas de anticuerpo desplegados en proteínas de la superficie de fagos filamentosos, introducida en la última década del pasado siglo, es otra posibilidad de producir grandes repertorios de genes de las regiones variables de las Ig humanas15.
Es importante señalar que la tecnología recombinante disponible permite además la fabricación de varios tipos de fragmentos derivados de anticuerpos, entre ellos los F(ab’)2 sin región Fc, los fragmentos Fab, los bivalentes o diabodies, o incluso trímeros o tetrámeros llamados triabodies y tetrabodies. Estos fragmentos permiten solventar algunos de los problemas relacionados con la molécula completa del anticuerpo, mejorar la avidez y facilitar la unión a determinadas dianas.
Utilidad y aplicación en patología humana de los anticuerpos monoclonalesIndependientemente de su uso en técnicas de diagnóstico, que han supuesto una revolución en el campo de la histopatología o permitido el desarrollo de técnicas de laboratorio como la citometría de flujo, las posibilidades de aplicación para tratar enfermedades humanas son amplísimas16. Dependiendo de la región Fc, la unión del anticuerpo monoclonal al antígeno contra el que está diseñado puede facilitar la producción de citotoxicidad celular dependiente de anticuerpos (ADCC) o citotoxicidad por la activación del sistema de complemento. La propia unión al antígeno puede bloquear receptores de la membrana celular, unirse a factores presentes en el suero y evitar su unión a receptores, o inducir señales intracelulares. Las consecuencias finales de estas interacciones son numerosas y han encontrado aplicación en áreas muy diversas.
Una manera de modificar la capacidad efectora de los anticuerpos monoclonales es la conjugación con moléculas citotóxicas con toxinas, con radiofármacos o con citocinas; esta última ha sido una estrategia utilizada en oncología mediante la creación de proteínas de fusión que incorporaban genes de IL-2, IL-12 o GM-CSF, entre otras. La conjugación de enzimas capaces de convertir un profármaco en fármaco con anticuerpos monoclonales dirigidos a células tumorales ha permitido una acción muy selectiva en el tejido tumoral del fármaco en cuestión.
La oncología es, sin duda, el área de aplicación terapéutica más importante. Son de amplia utilización los anticuerpos dirigidos contra HER2 en cáncer de mama, o contra el factor de crecimiento epidérmico (EGF) o el factor de crecimiento del endotelio vascular (VEGF) en varios tipos de tumores, o los anti CD20 o anti CD52 para linfomas/leucemias.
Las enfermedades autoinmunes son el grupo siguiente de patología humana en el que más se han empleado estos productos y, fundamentalmente, en artritis reumatoide, enfermedad inflamatoria intestinal, esclerosis múltiple, lupus eritematoso, así como en el rechazo de trasplantes y enfermedad de injerto contra el huésped. Los más utilizados han sido anticuerpos contra citocinas, sobre todo TNF-α y anti VLA4, pero también anti CD20 y anti CD25, entre otros.
Los anticuerpos monoclonales se han empleado también con otras finalidades, como el tratamiento de la septicemia, la prevención de complicaciones de enfermedades virales o el tratamiento de intoxicaciones por fármacos. No es el propósito de este artículo una revisión detallada de las aplicaciones actuales de los anticuerpos monoclonales actualmente aprobados y de muchos más en distintas etapas de desarrollo terapéutico. Sin ninguna duda, la disponibilidad de estos anticuerpos y de la tecnología para su refinamiento constituye ahora y más aún en el futuro una parte fundamental de nuestra terapéutica.
ConclusionesMás allá del impacto en el diagnóstico de laboratorio, los anticuerpos monoclonales son una herramienta terapéutica poderosísima. Su alta especificidad permite el abordaje de dianas muy precisas que pueden determinar cambios celulares muy variados; además, dependiendo de la región Fc pueden diseñarse para facilitar distintos tipos de respuestas efectoras. El empleo de anticuerpos humanizados y humanos ha mejorado notablemente su tolerancia clínica. La manipulación de los anticuerpos mediante la unión a otras moléculas o el diseño de nuevas fragmentos de anticuerpos abren un gran abanico de posibles aplicaciones en medicina.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.