Journal Information
Vol. 122. Issue 6.
Pages 231-236 (February 2004)
Vol. 122. Issue 6.
Pages 231-236 (February 2004)
Alternativas farmacológicas a la transfusión sanguínea. ¿Qué hay de nuevo?
Pharmacological alternatives to blood transfusion: what is new about?
Visits
7353
This item has received
Article information
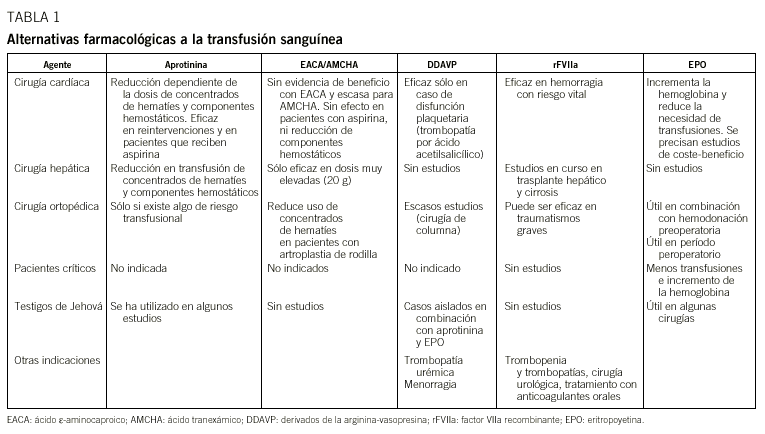
Las principales alternativas farmacológicas a la transfusión sanguínea son los inhibidores de las serinproteasas (aprotinina), los antifibrinolíticos (ácido *-aminocaproico y ácido tranexámico), los derivados sintéticos de la arginina-vasopresina, como el DDAVP, y el factor VIIa recombinante (rFVIIa). Dichos agentes pueden reducir la necesidad de transfusión de hemoderivados tras cirugía mayor (cardíaca, hepática y ortopédica). Entre los agentes no hemostáticos, la eritropoyetina se ha mostrado eficaz para reducir las necesidades transfusionales en pacientes médicos y quirúrgicos. La aprotinina es efectiva en la reducción de transfusiones en cirugía cardíaca y hepática, pero no existen datos para su empleo habitual en cirugía ortopédica. Los resultados con antifibrinolíticos no muestran evidencia de efecto beneficioso para los ácidos *-aminocaproico y tramexánico en cirugía cardíaca y no deben ser empleados de forma habitual en cirugía ortopédica. Un número limitado de publicaciones apunta a que DDAVP puede reducir las necesidades transfusionales, pero sólo en casos en que se constata un defecto de la función plaquetaria. El rFVIIa emerge como el fármaco más prometedor, no sólo en pacientes hemofílicos con inhibidor, sino también en la prevención de hemorragias postoperatorias y en pacientes con trombocitopenia y trombocitopatías. Estudios en curso permitirán definir si el rFVIIa puede catalogarse como «agente hemostático universal». Finalmente, las citocinas hemopoyéticas, como la eritropoyetina, pueden ser de gran utilidad para evitar la necesidad de transfusiones en diversas situaciones clínicas, en pacientes con cáncer y en pacientes críticos.
Palabras clave:
Transfusión sanguínea
Antifibrinolíticos
Vasopresina
Factor Vlla
Eritropoyetina
Pharmacological approaches to reduce blood transfusion include the protease inhibitor aprotinin, lysine-analogue antifibrinolytics synthetic arginine-vasopressin derivatives (DDAVP) and recombinant factor VII (rfVIIa). These agents are known to prevent the need for blood after major surgery (cardiac, hepatic, and orthopaedic). Among the nonhemostatic agents erythropoietin (EPO) may be effective to reduce blood requirements in medical and surgical patients. Aprotinin is consistently effective in reducing blood transfusion in cardiac and hepatic surgical procedures, but there is little data to support its use in elective orthopaedic surgery. Antifibrinolytics show no evidence of efficacy in cardiac and hepatic surgery and its use is not warranted in orthopaedic surgery. Limited data suggest that DDAVP may be effective when a deffect in platelet function is demonstrated. rFVIIa emerges as a promising haemostatic agent with proven benefit to reduce bleeding in haemophiliacs with inhibitors but might also be effective in patients with thrombocytopenia and thrombopathy, as well as in life-threatening hemorrhage in postsurgical patients. Ongoing studies will established its role a posible «universal haemostatic agent». Hematopoietic cytokines, such as EPO, may have a place to avoid blood transfusion in a variety of clinical conditions, including cancer and critically ill patients.
Keywords:
Bood transfusion
Antifibrinolytics
Vasopressin
Factor Vlla
Erythropoietin
These are the options to access the full texts of the publication Medicina Clínica
Subscriber
Subscribe
Purchase
Contact
Phone for subscriptions and reporting of errors
From Monday to Friday from 9 a.m. to 6 p.m. (GMT + 1) except for the months of July and August which will be from 9 a.m. to 3 p.m.
Calls from Spain
932 415 960
Calls from outside Spain
+34 932 415 960
E-mail