Journal Information
Vol. 133. Issue 20.
Pages 798-801 (November 2009)
Vol. 133. Issue 20.
Pages 798-801 (November 2009)
Diagnóstico y tratamiento
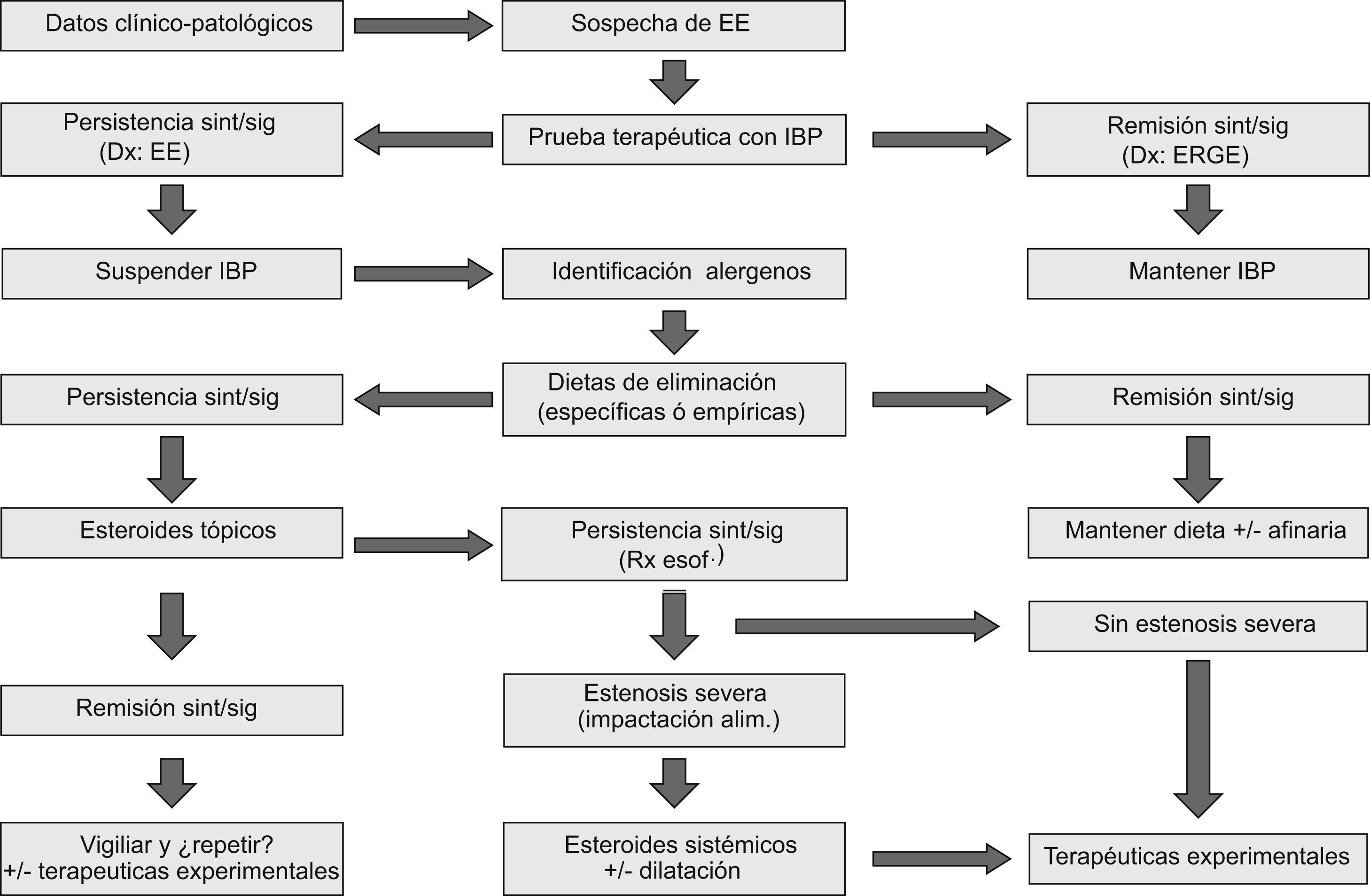
Esofagitis eosinofílica: algoritmo secuencial de opciones terapéuticas
Eosinophilic esophagitis: sequential algorithm of therapeutic possibilities
Visits
3814
P.. Paloma Sánchez-Fayos Calabuig
, M.J.. María Jesús Martín Relloso, Juan Carlos Porres Cubero
Corresponding author
Servicio de Aparato Digestivo, Fundación Jiménez Díaz, Facultad de Medicina, Universidad Autónoma de Madrid, Madrid, España
This item has received
Article information
These are the options to access the full texts of the publication Medicina Clínica
Subscriber
Subscribe
Purchase
Contact
Phone for subscriptions and reporting of errors
From Monday to Friday from 9 a.m. to 6 p.m. (GMT + 1) except for the months of July and August which will be from 9 a.m. to 3 p.m.
Calls from Spain
932 415 960
Calls from outside Spain
+34 932 415 960
E-mail