Estudiar el manejo multidisciplinar de los pacientes con enfermedad de Crohn (EC) y enfermedad perianal (EPA) asociada y analizar la posible relación entre la recidiva de la sintomatología perianal, el tipo de fístula y los tratamientos empleados.
Pacientes y métodosEstudio retrospectivo descriptivo en pacientes con EPA asociada a la EC seguidos en la Unidad de Enfermedad Inflamatoria Intestinal. Se recogieron variables epidemiológicas, clínicas, diagnósticas y terapéuticas, la evolución clínica y respuesta a los tratamientos administrados.
ResultadosSe incluyeron 65 pacientes con EC y EPA de los 300 pacientes controlados en consulta externa de un hospital universitario. Se diagnosticaron 16 fístulas simples (24,6%) y 49 fístulas complejas (75,4%). La técnica diagnóstica más empleada fue la ecografía endoanal (45%). Se utilizaron antibióticos en el 77,4% de los pacientes y el 70% precisaron utilización de un fármaco anti-TNF para el control de la EPA. Se realizó cirugía en el 75,4% del conjunto de la muestra. La EPA recidivó en el 41,5% precisando cambio de fármaco biológico y/o cirugía. Las fístulas complejas necesitaron con más frecuencia tratamiento quirúrgico (p=0,012) y la recidiva de la EPA fue más frecuente en las fístulas complejas (p=0,036).
ConclusiónLa mayor parte de los pacientes con EC y EPA compleja necesita tratamiento con fármacos biológicos. El manejo de la EPA deber ser multidisciplinar y combinado. Sin embargo, hay un porcentaje de casos en los que no se consigue la remisión de la clínica perianal lo que justifica el desarrollo de nuevas terapias para los casos refractarios.
To study the multidisciplinary management of patients with Crohn's disease (CD) and perianal disease (perianal Crohn's disease, PCD), as well as to analyse a possible relationship between the recurrence of perianal symptoms, the type of fistula and the treatment used.
Patients and methodsDescriptive, retrospective study of patients with PCD who were treated in the Inflammatory Bowel Disease Unit. Epidemiological, clinical, diagnostic and therapeutic variables were collected, as well as clinical outcome and response to treatment.
ResultsOf the 300 patients who attended the outpatient clinic at a university hospital, 65 had PCD. Sixteen simple fistulas (24.6%) and 49 complex fistulas (75.4%) were diagnosed. The most commonly used diagnostic technique was the endoanal ultrasound (45%). Antibiotics were used in 77.4% of patients, and 70% needed anti-TNF therapy to manage the PCD. Surgery was performed on 75.4% of the patients overall. PCD recurred in 41.5% of cases, requiring a change of the biological drugs administered and/or surgery. Complex fistulas were more likely to require surgery (P=.012) and recurrence of PCD was also more common with complex fistulas (P=.036).
ConclusionManagement of PCD must be multidisciplinary and combined. Most patients with complex PCD require treatment based on biological drugs. Despite therapy, remission of perianal symptoms is not achieved in a percentage of patients, supporting the need to develop new therapies for refractory cases.
La enfermedad inflamatoria intestinal (EII) es un trastorno sistémico crónico que afecta al tubo digestivo en el que pueden aparecer complicaciones en la zona perianal, hecho que se observa en aproximadamente un tercio de los pacientes con enfermedad de Crohn (EC). Las lesiones perianales pueden constituir una complicación en su evolución o incluso aparecer antes del diagnóstico de la propia EII, generando importante morbilidad en estos pacientes. La enfermedad perianal (EPA) se manifiesta en forma de fisuras, fístulas, abscesos, colgajos cutáneos y úlceras1. Las fístulas pueden clasificarse en simples o complejas, siguiendo la clasificación propuesta por Sandborn en 20032 por la que una fístula puede ser compleja bien por el origen del trayecto fistuloso (interesfinteriana alta, transesfinteriana alta, extraesfinteriana o supraesfinteriana), o bien por presentar múltiples orificios externos, dolor, fluctuación o por la presencia de estenosis anal. También se incluyen aquí las fístulas rectovaginales y aquellas fístulas con actividad inflamatoria en la rectoscopia. Los métodos diagnósticos incluyen la ecografía endoanal, la resonancia magnética pélvica (RMp) y la exploración perianal bajo anestesia, considerada esta como la herramienta diagnóstica patrón oro en la valoración de la EPA1. Durante los últimos años se han ido desarrollando nuevos medios terapéuticos para el manejo de la EPA, que debe ser individualizado, combinado y en el que se debe evitar maniobras quirúrgicas de agresividad desmedida.
El objetivo de este estudio fue analizar las características de la EPA en los pacientes de nuestro centro, los tratamientos empleados y la respuesta a los mismos. También se analizó el manejo de la recidiva y su posible relación con las características basales de los pacientes y con los tratamientos utilizados.
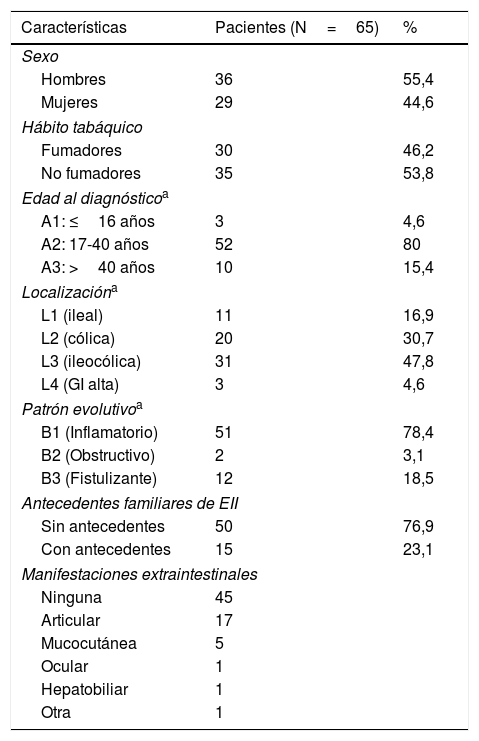
MétodosSe revisaron de forma retrospectiva todos los casos de pacientes con EPA asociada a la EC desde 2004 hasta junio de 2016 seguidos en un hospital universitario de segundo nivel de Madrid que atiende a una población de unos 225.000 habitantes, siendo un porcentaje importante de ellos pacientes menores de 40 años (tabla 1). Las decisiones terapéuticas se tomaron de forma consensuada en las reuniones periódicas del comité médico-quirúrgico de EII con presencia de gastroenterólogos, cirujanos colorrectales y radiólogos con especial dedicación al campo de la EII.
Características demográficas de los pacientes del estudio
| Características | Pacientes (N=65) | % |
|---|---|---|
| Sexo | ||
| Hombres | 36 | 55,4 |
| Mujeres | 29 | 44,6 |
| Hábito tabáquico | ||
| Fumadores | 30 | 46,2 |
| No fumadores | 35 | 53,8 |
| Edad al diagnósticoa | ||
| A1: ≤16 años | 3 | 4,6 |
| A2: 17-40 años | 52 | 80 |
| A3: >40 años | 10 | 15,4 |
| Localizacióna | ||
| L1 (ileal) | 11 | 16,9 |
| L2 (cólica) | 20 | 30,7 |
| L3 (ileocólica) | 31 | 47,8 |
| L4 (GI alta) | 3 | 4,6 |
| Patrón evolutivoa | ||
| B1 (Inflamatorio) | 51 | 78,4 |
| B2 (Obstructivo) | 2 | 3,1 |
| B3 (Fistulizante) | 12 | 18,5 |
| Antecedentes familiares de EII | ||
| Sin antecedentes | 50 | 76,9 |
| Con antecedentes | 15 | 23,1 |
| Manifestaciones extraintestinales | ||
| Ninguna | 45 | |
| Articular | 17 | |
| Mucocutánea | 5 | |
| Ocular | 1 | |
| Hepatobiliar | 1 | |
| Otra | 1 | |
EII: enfermedad inflamatoria intestinal; GI: gastrointestinal
Las fístulas se clasificaron en fístulas simples y en fístulas complejas, siguiendo la clasificación de Sandborn2. En aquellos casos en los que un paciente tuviera una fístula simple y una fístula compleja de forma concomitante, se le clasificó como fístula compleja.
Se recogieron las siguientes variables a través de la revisión de la historia clínica informatizada:
Variables cualitativasEpidemiológicas: sexo, hábito tabáquico, antecedentes familiares de EII.
Clínicas: tipo de EII, localización y patrón evolutivo de la enfermedad intestinal según la clasificación de Montreal3, presencia de otras manifestaciones extraintestinales, fecha de diagnóstico de la EII y de la EPA, tipo de fístula y la presencia de absceso perianal asociado.
Método diagnóstico inicialTerapéuticas: antibioterapia (metronidazol, ciprofloxacino, levofloxacino), inmunomoduladores (azatioprina o mercaptopurina), fármacos biológicos (infliximab, adalimumab, certolizumab pegol).
Evolución clínica y respuesta a los tratamientos administrados: Se consideró respuesta completa al cierre del orificio fistuloso y cese del drenaje en todas las fístulas y respuesta parcial a la disminución en al menos el 50% de las fístulas. Para la evaluación de la respuesta se siguieron indicadores clínicos y en algunos casos RMp o ecografía endoanal.
Variables cuantitativasEdad, tiempo de evolución desde el diagnóstico de la enfermedad luminal, número de fístulas, posología del tratamiento médico y número de cirugías.
Se analizó la evolución de la EPA en pacientes que iniciaron tratamiento con inmunomoduladores después del diagnóstico de la EPA y en pacientes que ya estaban recibiendo tratamiento inmunomodulador antes de desarrollar un evento perianal. También se analizó la respuesta tras la administración de los fármacos biológicos anti-TNF. En aquellos pacientes que tuvieron recidiva de la EPA se revisaron los tratamientos que se les había administrado y sus características clínicas basales.
El análisis de los datos obtenidos se realizó con el programa estadístico SPSS. Las variables cualitativas se expresaron mediante frecuencias e intervalos de confianza del 95% (IC 95%). Las variables cuantitativas quedaron representadas como la media±desviación estándar si la variable seguía una distribución normal o mediante la mediana y el rango intercuartílico cuando no lo hacía. Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de las variables continuas. La comparación entre variables categóricas se realizó mediante la prueba de Chi-cuadrado. La comparación entre variables cuantitativas y cualitativas de 2 categorías se realizó mediante la prueba t de Student (si la distribución era normal) o la prueba de U-Mann-Whitney (cuando la variable no se ajustaba a una distribución normal). Las comparaciones entre variables cuantitativas y cualitativas con 3 o más categorías se hicieron a través del análisis de la prueba de varianza (ANOVA) o por el test no paramétrico de Kruskal-Wallis. Se llevó a cabo un análisis multivariante mediante regresión logística para identificar los posibles factores de riesgo relacionados con una recidiva de la EPA. Se consideró como estadísticamente significativo un valor de p<0,05.
ResultadosSe incluyeron 65 pacientes con EC y EPA de un total de 300 pacientes con EC controlados en la Unidad de EII de nuestro centro. La prevalencia de EPA en nuestros pacientes con EC fue del 22% (IC 95%: 17,1-26,8). Las características demográficas y clínicas basales de los pacientes incluidos en el estudio quedan recogidas en la tabla 1.
El tiempo medio del diagnóstico de la EPA fue de 43±63 meses tras el diagnóstico de la EC y en 8 pacientes (12,1%) el diagnóstico de la fístula fue previo al diagnóstico de la enfermedad luminal. Se diagnosticaron 16 fístulas simples (24,6%) y 49 fístulas complejas (75,4%) (tabla 2).
Clasificación de las fístulas perianales
| Tipo de fístula | Subtipo |
|---|---|
| Fístula simple (N=16) | Superficial: 9 (57%) |
| Interesfinteriana baja: 4 (24%) | |
| Transesfinteriana baja: 3 (19%) | |
| Fístula compleja (N=49) | Interesfinteriana alta: 7 (14%) |
| Transesfinteriana alta: 13 (27%) | |
| Supraesfinteriana: 10 (21%) | |
| Extraesfinteriana: 6 (12%) | |
| Rectovaginal: 3 (6%) | |
| Simples con proctitis: 1 (2%) | |
| Con actividad endoscópica: 9 (18%) |
En nuestro centro la técnica inicial realizada con mayor frecuencia fue la ecografía endoanal (45% de los casos) llevada a cabo por cirujanos coloproctólogos, seguida de la RMp con un 36,7% y de la exploración bajo anestesia con un 18,3%. En el caso de las fístulas complejas (49 pacientes) se realizó una segunda técnica en 37 pacientes (para colocar sedal, o RMp para completar estudio).
El 79% de los casos presentó además un absceso perianal asociado al diagnóstico, que precisó drenaje.
Con relación al tratamiento médico empleado, globalmente en el 77,4% (IC 95%: 65,9-87,9) de los pacientes se utilizaron los antibióticos, metronidazol, ciprofloxacino y/o levofloxacino como tratamiento complementario, observándose mejoría de los síntomas perianales en un 97,5; 89,5% y 87,5%, respectivamente.
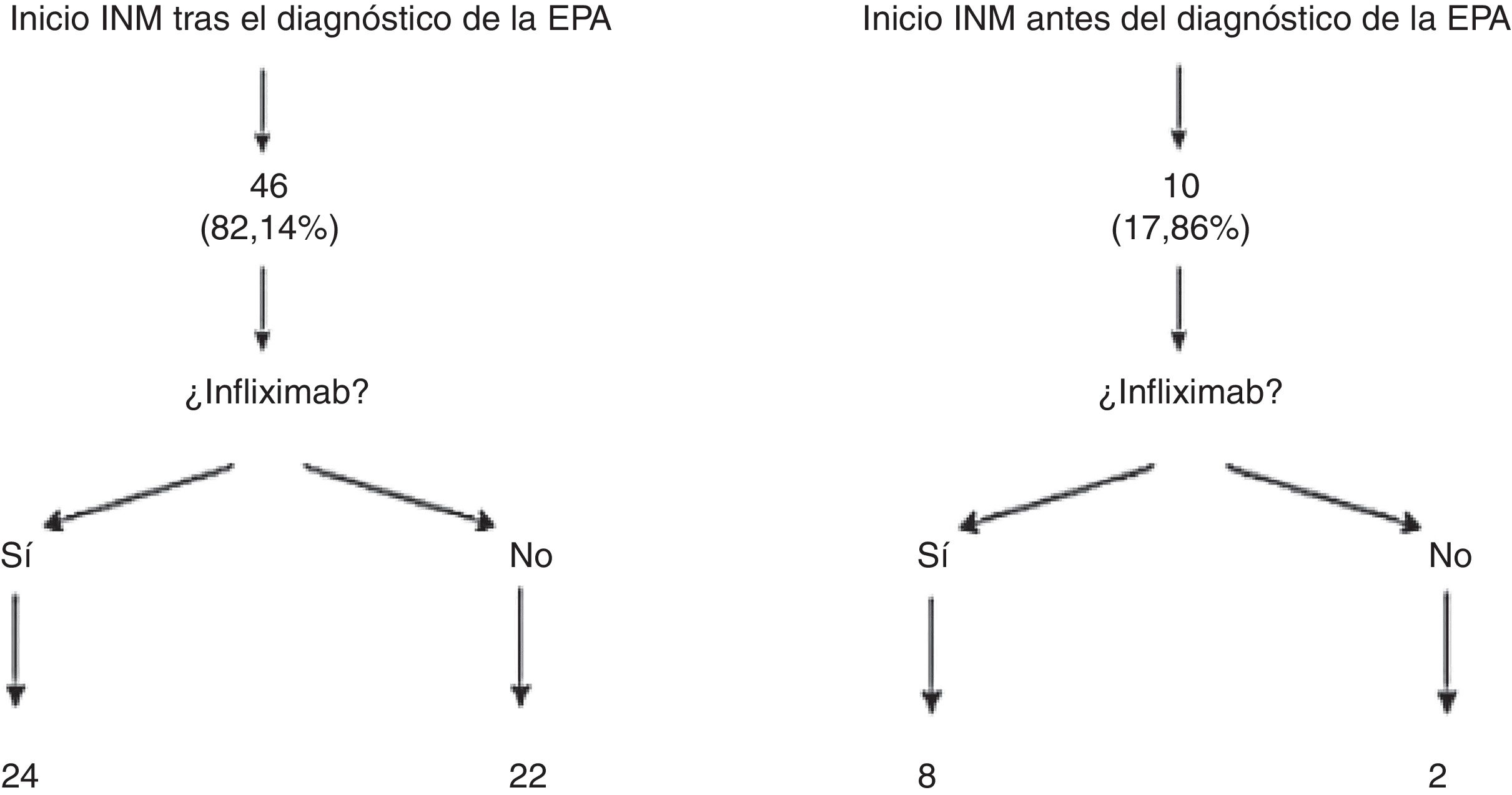
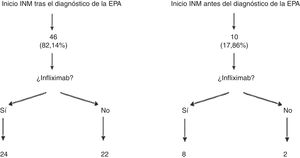
Los pacientes que presentaron recidivas frecuentes o precoces (a pesar de mejoría con antibióticos), o que tenían fístulas complejas fueron subsidiarios de tratamiento quirúrgico, inmunosupresor con tiopurinas (azatioprina o mercaptopurina) y/o anti-TNF. En nuestra muestra, 56 pacientes (84,8%; IC 95%: 76,9-95,3) precisaron inmunomoduladores, de ellos, 46 pacientes lo hicieron tras el diagnóstico de la EPA, mientras que los 10 casos restantes habían iniciado azatioprina o mercaptopurina antes de desarrollar el evento perianal. Es importante destacar que de los 56 pacientes tratados con inmunomoduladores, 24 de ellos no requirieron inicio de tratamiento con un fármaco biológico. Entre esos 24 casos se encontraban 16 fístulas complejas (32,6%) (fig. 1).
Se utilizaron fármacos biológicos anti-TNF como tratamiento de la EPA en las fístulas que no respondieron a otros tratamientos, en los que estos produjeron toxicidad o intolerancia o en fístulas complejas con alto riesgo de destrucción de esfínteres e incontinencia secundaria. En nuestro centro se utilizaron fármacos biológicos para el tratamiento de la EPA en 34 de las 49 fístulas complejas: 69,4%; IC 95%: 55,5-83,3.
El fármaco biológico de primera línea fue el infliximab, utilizado en 32 de los 34 pacientes. Catorce pacientes (43,7%) obtuvieron respuesta completa; 6 pacientes (18,7%) obtuvieron respuesta parcial; 12 pacientes (37,5%) no obtuvieron respuesta. En 9 de los casos que no obtuvieron respuesta a infliximab se decidió cambiar a otro fármaco anti-TNF, adalimumab, obteniendo respuesta completa en 4 de esos 9 pacientes. En cuanto al manejo de los 5 casos restantes, en 2 pacientes se inició tratamiento con vedolizumab (uno de ellos no respondió por lo que se realizó ileostomía terminal); en un caso adalimumab se tuvo que suspender tras el diagnóstico de un cáncer de mama y la paciente precisó resección intestinal (y colostomía); en otro paciente se inició tratamiento con metotrexato por aparición de manifestaciones extraintestinales de predominio articular manteniendo sedal y leve supuración; y el último de los casos falleció tras complicación posterior a cirugía por fístulas intestinales en el contexto de una sepsis abdominal grave tras pérdida de seguimiento durante varios años.
En cuanto al tratamiento quirúrgico, se realizó cirugía en 49 de los 65 pacientes con fístulas perianales: el 75,4% de los casos, IC 95%: 64,1-86,7. La técnica quirúrgica más frecuente fue la limpieza del trayecto y la colocación de sedal (77,5%). En la mayoría de ellos (73,7%) se mantuvo el sedal durante más de 12 meses (en el 21% menos de 3 meses y en el 5,3% entre 3 y 6 meses). Tras los procedimientos quirúrgicos realizados, se obtuvo respuesta completa en el 93,7% de las fístulas simples. El 65,3% de las fístulas complejas intervenidas tuvieron respuesta completa (a destacar que aproximadamente 3 de cada 4 pacientes que respondieron al tratamiento quirúrgico estaban bajo tratamiento con un fármaco anti-TNF).
En cuanto a la respuesta radiológica tras el tratamiento, en 13 pacientes se evaluó la respuesta con RMp y en 23 pacientes con ecografía endoanal.
Del conjunto de nuestra muestra, 27 pacientes (41,5%; IC 95%: 28,8-54,3) tuvieron recidiva de su EPA. El manejo terapéutico de la recidiva fue en un 59,2% la colocación de un sedal, en un 25,9% la combinación de sedal e intensificación de fármaco biológico y en un 14,8% solo intensificación del fármaco anti-TNF. Finalmente, tras el tratamiento individualizado médico-quirúrgico, se analizó la respuesta clínica global de los pacientes sobre su EPA. Un 78,7% refirieron respuesta clínica completa, un 14,8% parcial y un 6,6% sin respuesta. Se realizó un análisis bivariante en el que se comparó la probabilidad de requerir cirugía en función del tipo de fístula, que mostró que los pacientes con fístulas complejas necesitaron con más frecuencia tratamiento quirúrgico (p=0,012). El tratamiento quirúrgico realizado de forma global con más frecuencia fue la limpieza del trayecto fistuloso y colocación de sedal. Por otra parte se realizó un análisis multivariante por regresión logística para ver factores de riesgo asociados con el desarrollo de recidiva en el que se puso de manifiesto que la recidiva de la EPA fue más frecuente en las fístulas complejas (p=0,036). El sexo, el tabaco, la edad al diagnóstico, la localización de la enfermedad luminal o el comportamiento de la misma no demostraron influencia en este modelo. Tampoco hubo diferencias entre fumadores y no fumadores.
DiscusiónEn la actualidad, debido a la complejidad y heterogeneidad de los pacientes con EC y EPA, el diagnóstico y tratamiento de la misma deben ser multidisciplinares, involucrando a gastroenterólogos y a cirujanos colorrectales con especial dedicación al manejo de pacientes con EC. En nuestra experiencia, disponer de un comité con reuniones periódicas en las que se evalúan estos pacientes según la evidencia científica más actualizada resulta de gran ayuda para el manejo consensuado de los mismos.
La RMp es un excelente método, aunque si no hay estenosis rectal la ecografía endoanal es una buena alternativa en manos expertas por su accesibilidad4. Un reciente metaanálisis describe una sensibilidad del 87% para la ecografía endoanal y para la RMp, diferenciándose en la especificidad (43% para la ecografía endoanal, 59% para la RMp). La RMp, además de ser una prueba con menor dependencia del operador, puede identificar abscesos o inflamación clínicamente silentes5. La tomografía axial computarizada y la fistulografía han sido relevadas por las anteriores técnicas debido a su menor sensibilidad diagnóstica. La exploración bajo anestesia es el patrón oro para el diagnóstico de las fístulas perianales. Además de tener una elevada especificidad (cercana al 90%) permite realizar terapéutica en la zona afectada. Su combinación con la ecografía endoanal consigue una especificidad cercana al 100%6. En nuestra serie casi la mitad de los pacientes se realizaron el estudio inicial mediante ecografía endoanal ya que se trata de un método más accesible, coste-eficaz y que se puede realizar en un periodo corto de tiempo tras su indicación. Por otra parte, se debe tener en cuenta que en los casos en los que una fístula simple tenga actividad en la rectoscopia debe ser considerada y tratada como fístula compleja. Por ello, se trata de una prueba que es obligada en todos los pacientes. En nuestra muestra, debido al número limitado de casos, únicamente contamos con un caso de fístula simple con proctitis que requirió tratamiento con anti-TNF.
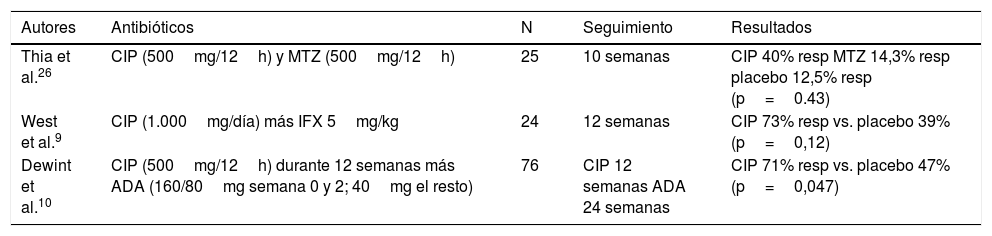
Más de 3 cuartas partes de nuestros pacientes recibieron antibióticos en el manejo inicial de su EPA. El uso de antibióticos sin otro tratamiento adyuvante no está indicado en la actualidad5 y, aunque la efectividad de los antibióticos en la EPA no ha sido evaluada en estudios con alto nivel de evidencia, existen series que muestran su beneficio en el tratamiento de la misma, como se muestra en la tabla 3. Ciprofloxacino y metronidazol forman parte del tratamiento de primera línea y mejoran la sintomatología perianal disminuyendo la supuración de las fístulas y el dolor (RR=0,8; IC 95%: 0,66-0,98)7. La dosis estándar de ciprofloxacino es de 500mg/12h. En cuanto al metronidazol se suelen utilizar dosis de hasta 1.000mg/día. La mayoría de los efectos adversos relacionados con el tratamiento antibiótico son leves y relacionados con intolerancia gastrointestinal que por lo general no requieren suspensión del tratamiento. La duración del tratamiento con antibióticos es un aspecto controvertido, algunos estudios sugieren que debe ser entre 8 y 12 semanas8. En nuestro centro la mayoría de los pacientes había recibido inicialmente tratamiento con ciprofloxacino, metronidazol y/o levofloxacino a las dosis habituales, consiguiendo mejoría clínica con disminución o cese, al menos temporal, del drenaje de las fístulas. Esto es coherente con los escasos estudios hasta ahora publicados. El levofloxacino podría tener un papel en el control de los síntomas –en dosis única frente a las 2 dosis del ciprofloxacino–, tal y como describimos en nuestra experiencia, por lo que creemos que en futuras investigaciones podría incluirse levofloxacino como objetivo de estudio. Por el momento existe escasa evidencia que establezca las diferencias entre los antibióticos que se administran en la EPA o la combinación de antibióticos, inmunomoduladores y fármacos biológicos óptima para obtener el control de la clínica perianal. La evaluación con prueba de imagen como la RMp podría ayudar a seleccionar aquellos casos que precisen escalar tratamiento. La combinación de los antibióticos con fármacos anti-TNF (ciprofloxacino con infliximab9 y ciprofloxacino con adalimumab10) obtiene respuestas hasta del 70-73% de los casos, superiores a las que se consiguen con la administración de anti-TNF en monoterapia. Los antibióticos se utilizan con frecuencia en pacientes con EPA en los que se realiza la colocación de sedal5.
Estudios publicados sobre antibioterapia en la enfermedad de Crohn fistulizante
| Autores | Antibióticos | N | Seguimiento | Resultados |
|---|---|---|---|---|
| Thia et al.26 | CIP (500mg/12h) y MTZ (500mg/12h) | 25 | 10 semanas | CIP 40% resp MTZ 14,3% resp placebo 12,5% resp (p=0.43) |
| West et al.9 | CIP (1.000mg/día) más IFX 5mg/kg | 24 | 12 semanas | CIP 73% resp vs. placebo 39% (p=0,12) |
| Dewint et al.10 | CIP (500mg/12h) durante 12 semanas más ADA (160/80mg semana 0 y 2; 40mg el resto) | 76 | CIP 12 semanas ADA 24 semanas | CIP 71% resp vs. placebo 47% (p=0,047) |
ADA: adalimumab; CIP: ciprofloxacino; IFX: infliximab; MTZ: metronidazol; resp: respuesta.
Las tiopurinas (azatioprina y mercaptopurina) son los fármacos inmunosupresores que se han utilizado con más frecuencia en nuestros pacientes con EPA. Sus efectos secundarios más frecuentes son las molestias gastrointestinales. También pueden provocar toxicidad medular, infecciones o pancreatitis que en algunos casos suponen la retirada del fármaco, y requieren seguimiento clínico-analítico. No disponemos de estudios cuyo objetivo primario sea la efectividad de estos inmunomoduladores en la EPA. Algunos estudios, incluido el metaanálisis de Pearson et al.11 han concluido que las tiopurinas eran un tratamiento eficaz en la inducción de la remisión y en el mantenimiento. Cuando se realizó la recogida de datos para este estudio, el último consenso ECCO publicado era el del año 201012 y estaba basado en las conclusiones de esos estudios.
Así, se recomendaba el uso en primera línea de azatioprina o mercaptopurina en los pacientes con fístulas complejas, dejando los fármacos anti-TNF en segunda línea. Por ello muchos de nuestros pacientes iniciaron tratamiento con azatioprina antes que con un fármaco biológico según la evidencia de ese momento.
En el análisis estadístico que hemos realizado en nuestros pacientes hemos querido diferenciar a aquellos que ya estaban recibiendo inmunomoduladores antes del evento perianal de los que lo iniciaron tras el diagnóstico de la EPA (fig. 1). Este análisis por subgrupos se realizó en el estudio ACCENT I13 ya que en la práctica clínica diaria no es infrecuente que un paciente con inmunomoduladores por su enfermedad luminal comience tiempo después a desarrollar eventos perianales. En nuestra opinión esto puede ser un sesgo significativo a la hora de analizar y extrapolar los datos.
La mayor parte de nuestros pacientes con EC y EPA compleja precisaron tratamiento con fármacos biológicos para el control de la enfermedad. Los fármacos anti-TNF con los que se tiene amplia experiencia son infliximab y adalimumab. No se ha estudiado el papel de estos fármacos en fístulas simples (tabla 4). Ante la falta o pérdida de respuesta a los anti-TNF, se puede intensificar el tratamiento o cambiar a otro fármaco biológico. En la práctica clínica diaria se deberá descartar la presencia de actividad luminal, la formación de anticuerpos anti-TNF y evaluar los niveles valle de infliximab en sangre. Especial interés tiene esta última medida ya que se está investigando en la actualidad su utilidad para decidir modificaciones del tratamiento. Estudios recientes indican que niveles elevados de infliximab (>9-10mcg/mL) se relacionan con un mejor control de la EPA. En el caso de que el paciente tenga bajos niveles se recomienda intensificar la dosis del anti-TNF utilizado.
Estudios publicados sobre la eficacia de los fármacos biológicos en fístulas complejas
| Autores | Biológico | N | Seguimiento | Resultados |
|---|---|---|---|---|
| Present et al.27 | IFX 5mg/kg en semana 0, 2 y 6 | 94 | 6 semanas | 55% resp (13% placebo) (p<0,05) |
| Sands et al.28 | IFX 5mg/kg cada 8 semanas | 195 | 54 semanas | 36% resp (19% placebo) (p<0,05) |
| Colombel et al. (CHARM)29 | ADA 40mg semanal | 117 | 56 semanas | 33% resp (13% placebo) (p<0,05) |
| Schreiber et al. (PRECISE II)18 | CTZ pegol 400mg mes | 58 | 24 semanas | 36% resp (17% placebo) (p<0,05) |
| Sandborn et al. (GEMINI 2)30 | VDZ 300 mg cada 8 semanas | 57 | 52 semanas | 41,2% resp (11% placebo) (p<0,05) |
| Sands et al.31 | USTK | 238a | 8 semanas | 24,7% resp (14,1% placebo) (p=0,073) |
| 26b | 44 semanas | 80% resp (45.5% placebo) (p=0,.64) |
ADA: adalimumab; CTZ: certolizumab; IFX: infliximab; resp: respuesta (desaparición del drenaje de la fístula o cierre de la misma); USTK: ustekinumab; VDZ: vedolizumab.
Si el paciente por el contrario tuviera niveles bajos del fármaco pero con anticuerpos frente el fármaco, puede recomendarse cambiar de fármaco anti-TNF14. Nuestros resultados son semejantes a los descritos en el estudio ACCENT II15, que fue diseñado específicamente para evaluar los resultados de infliximab en la EPA compleja, observando que en la semana 52 el cierre fistuloso ocurría en el 36% de los pacientes tratados con infliximab en comparación con el 19% del grupo en el que se administró placebo. Además la terapia de mantenimiento con infliximab reducía las hospitalizaciones y la necesidad de cirugía. La efectividad de adalimumab se ha revisado en el estudio de Colombel et al. (CHARM)16. Lichtiger et al. diseñaron un estudio en pacientes con EPA no respondedores a infliximab y concluyeron que adalimumab podría ser una opción en estos pacientes (respuesta en el 39% de los casos)17.
En el estudio PRECISE II se evaluó la eficacia de certolizumab pegol en los pacientes con enfermedad fistulizante y se concluyó que este fármaco biológico podría ser una opción terapéutica en pacientes con enfermedad fistulizante en comparación con placebo18. No hay estudios por el momento que prioricen la elección de un anti-TNF sobre otro. En el metaanálisis realizado por de Groof et al.19, de 1.449 pacientes tratados con anti-TNF no hubo diferencias en cuanto al cierre del orificio fistuloso. Sin embargo, se trata de un metaanálisis heterogéneo con estudios con diferentes niveles de evidencia y con distintos tiempos de seguimiento. Concluyen además que el tratamiento combinado (anti-TNF con o sin inmunomodulador) y cirugía muestra mejores resultados que cada uno de ellos por separado.
Tres cuartas partes de nuestros pacientes precisaron algún tipo de técnica quirúrgica para el control de su EPA. En un porcentaje importante de los pacientes con EC aparecen abscesos perianales durante la evolución que deben ser drenados. Además, la presencia de proctitis contraindica temporalmente la realización de una fistulectomía, no solo por las complicaciones infecciosas sino también porque se ha observado que aumenta el riesgo de incontinencia fecal4. Se ha descrito que el drenaje quirúrgico disminuye el riesgo de complicaciones infecciosas en comparación con el drenaje espontáneo20. Las técnicas quirúrgicas en la EPA asociada a la EC persiguen respetar la funcionalidad de la zona perianal con abordajes mínimamente invasivos. El tratamiento fundamental de las fístulas simples es la cirugía mediante la colocación de sedal y en casos seleccionados la fistulotomía.
En las fístulas complejas el tratamiento médico combinado con la colocación de sedales suele ser la opción más adecuada19. El momento de retirada del sedal es un tema muy discutido y suele ser una decisión que se toma de manera individualizada durante el seguimiento evolutivo en las consultas de cirugía15. En la mayoría de nuestros pacientes el sedal ha permanecido durante más de un año, permitiendo un control adecuado de la EPA. En los pacientes refractarios a las anteriores medidas en algunas ocasiones se realizan ileostomías o colostomías derivativas, como sucedió en algunos de nuestros pacientes, aunque es una medida que se trata de evitar y se utiliza como último recurso.
La aparición de nuevos fármacos biológicos con diferente diana terapéutica, y que ya se están empleando en pacientes con EII, supone una posible opción de tratamiento en los casos refractarios.
Vedolizumab es un anticuerpo monoclonal que se une a la integrina α4β7 intestinal inhibiendo la adhesión y la migración de los leucocitos a ese nivel. Los estudios sobre este nuevo fármaco biológico tenían como objetivo primario evaluar la repuesta a nivel luminal. Sin embargo muchos de los pacientes incluidos tenían fenotipo fistulizante por lo que de forma preliminar se ha visto una respuesta positiva de este fármaco para la EPA21. En nuestra muestra 2 pacientes iniciaron tratamiento con vedolizumab por EPA refractaria a los fármacos biológicos aprobados hasta el momento. Uno de ellos tuvo respuesta clínica y en el otro paciente se terminó por realizar colostomía de descarga por mala evolución. Ustekinumab es un anticuerpo monoclonal de muy reciente aprobación para EC, que inhibe la actividad de las citocinas humanas IL-12 e IL-23 al impedir la unión de estas citocinas a su proteína receptora IL-12Rß1, expresada en la superficie de las células inmunitarias. En los estudios UNITI 1, UNITI 2, CERTIFI e IM-UNITI22 (diseñados también para evaluar la efectividad de la enfermedad luminal) se han observado resultados preliminares que señalan que ustekinumab podría ser una alternativa terapéutica en la EPA. En una serie española23 el 61% de los pacientes que recibieron ustekinumab tuvieron mejoría clínica. Nuevos estudios cuyo objetivo primario sea la evaluación de la EPA podrán dar respuesta a la utilidad de estos nuevos tratamientos en pacientes con EC y EPA compleja.
A pesar de todos los nuevos fármacos que se han ido desarrollando en los últimos años, hay un porcentaje importante de pacientes (cercano al 50%) en los que no se consigue el cierre completo de la fístula. En algunos casos se acaban realizando cirugías con resecciones intestinales que generan una significativa morbilidad en los pacientes. Recientemente se están realizando estudios con inyección local de células madre mesenquimales en el trayecto de la fístula. Estas son células multipotentes no hematopoyéticas que tienen la capacidad de diferenciarse en diferentes tipos celulares y poseen propiedades antiinflamatorias e inmunomoduladores, por lo que parece que podrían tener un papel en la EPA24.
La recidiva de la EPA se produce en un porcentaje importante de los pacientes con la reaparición del dolor y del drenaje a través del orificio fistuloso. En los últimos años se está apostando por realizar una prueba de imagen confirmatoria (preferiblemente una RMp por su especificidad) que ayude a decidir sobre la continuidad de terapias clínicamente eficaces como los anti-TNF.
En aquellos casos en los que se confirme por la clínica la recidiva (o de forma ideal mediante pruebas de imagen) se debe analizar los tratamientos actuales y previos bajo los que ha estado el paciente. Las opciones más aceptadas por el momento son es el cambio (switch) de biológico o bien cirugía4. En la recidiva de la EPA intervienen factores como el tipo de fístula (fístulas complejas recidivan más y por tanto requieren optimización del tratamiento, bien sea cambiando de fármaco biológico, bien necesitando cirugía25). Esto ha ocurrido también en la serie de pacientes de nuestro centro: de forma significativa, entre aquellos con fístulas complejas se produjeron más recidivas y hubo una necesidad mayor de intervenciones quirúrgicas.
Nuestro estudio tiene limitaciones inherentes a la naturaleza del mismo. Es un estudio retrospectivo, con un número limitado de casos. Además, los resultados se midieron como respuesta clínica, según los hallazgos de la exploración física de los trayectos y solo en un porcentaje de casos se confirmaron con una prueba de imagen. En nuestro centro disponemos de la determinación de niveles valle de anti-TNF y anticuerpos anti-TNF desde fechas recientes y por ello no tenemos datos al respecto en este estudio, que recoge pacientes tratados en fechas en las que no disponíamos de esta técnica. No obstante, creemos que aporta información sobre la práctica clínica en el complejo escenario de la EPA asociada a la EC.
ConclusionesEl manejo de la EPA debe realizase desde un enfoque multidisciplinar (que incluye gastroenterólogos, cirujanos coloproctólogos y radiólogos) y con tratamiento médico combinado (antibioterapia, inmunomoduladores y fármacos biológicos junto a técnicas quirúrgicas). El uso de antibióticos mejora la sintomatología perianal aunque no consiguen el cierre fistuloso. En nuestra experiencia, buena parte de los pacientes con EPA compleja requieren fármacos biológicos para su control. Estos pacientes presentan una EPA que recidiva con mayor frecuencia y que requiere mayor número de cirugías. A pesar de las recidivas, la efectividad de los fármacos biológicos es buena en este tipo de pacientes y constituyen el tratamiento de primera línea en la EPA compleja. Existe un porcentaje de pacientes con EPA refractaria a los tratamientos actuales.
Se necesitan nuevos estudios que ayuden a conocer la eficacia y el posicionamiento de nuevos fármacos biológicos y de tratamientos como la terapia local con células madre en la EPA asociada la EC y que podrían ser útiles en la mejora de la calidad de vida de estos pacientes.
Conflicto de interesesAlicia Algaba ha recibido financiación para investigación de MSD. Fernando Bermejo ha desempeñado papel como orador y consultor para MSD, Abbvie, Pfizer, Takeda y Janssen. Cristina Rubín de Célix, Iván Guerra, Ángel Serrano, Estíbaliz Pérez-Viejo y Carolina Aulló no declararon ningún conflicto de intereses.