Evaluar la efectividad y toxicidad del erlotinib en pacientes con cáncer de pulmón no microcítico.
MétodosLos pacientes se han seleccionado de una base de datos de dispensación a pacientes ambulatorios. El periodo de tiempo seleccionado fue de enero 2008 a enero 2010 y para la recolección de datos se empleó la historia clínica del paciente en formato electrónico y en papel. Como medida de respuesta hemos usado los criterios RECIST (Response Evaluation Criteria in Solid Tumors), también hemos medido el tiempo hasta la progresión y la supervivencia global. La toxicidad se evaluó según la Common Terminology Criteria for Adverse Events (CTCAE).
ResultadosSe encontraron respuestas parciales en 5/46 pacientes y criterios de enfermedad estable en 14/46 pacientes. El tiempo hasta progresión de la enfermedad fue 4,01 meses (mediana 2,33 meses) y la supervivencia global 5,63 meses (mediana 4,67). Las toxicidades más frecuentes fueron exantema, anorexia, astenia, infecciones y efectos adversos gastrointestinales. Los pacientes que desarrollaron toxicidad cutánea tuvieron un tiempo hasta la progresión y una supervivencia global mayor (estadísticamente significativo) que el grupo que no la desarrolló (media de tiempo hasta la progresión: 7,87 meses versus 2,76; media supervivencia global: 10,74 meses versus 3,98).
ConclusionesLos hallazgos del análisis de supervivencia indican una efectividad menor en nuestra población de pacientes en relación con otras publicaciones y las reacciones adversas describen el patrón esperado. A pesar de tener en cuenta nuestra principal limitación, el tamaño de la muestra, podría tratarse de una alternativa para los pacientes con cáncer de pulmón no microcítico.
To evaluate the efficacy and toxicity of erlotinib in patients with non-small cell lung cancer.
MethodPatients were selected from an outpatients’ dispensing database. The time period selected was from January 2008 to January 2010. Data was collected from patient's medical history – electronic and paper based. We used Response Evaluation Criteria in Solid Tumours (RECIST) to measure response and measured time to progression and overall survival. Toxicity was evaluated according to the Common Terminology Criteria for Adverse Events (CTCAE).
ResultsWe found partial response in 5/46 patients and stable disease in 14/46 patients. Time to disease progression was 4.01 months (median 2.33 months) and overall survival was 5.63 months (median 4.67). The most common toxicities were rash, anorexia, asthenia, infection and gastrointestinal side effects. Patients who developed skin toxicity had a (statistically significant) greater time to progression and overall survival rate than the group that did not develop this toxicity (mean time to progression: 2.76 vs. 7.87 months; mean overall survival: 10.74 months vs. 3.98).
ConclusionsSurvival analysis findings suggest lower efficacy in our patient population in comparison with data seen in other publications, and adverse events followed the expected pattern. Although our greatest limitation was sample size, which must be kept in mind, this therapy could be an alternative for patients with non-small cell lung cancer.
El cáncer de pulmón en Europa es la primera causa de muerte por cáncer en hombres y la tercera en mujeres. Nadie niega que el consumo de tabaco está fuertemente ligado al desarrollo de cáncer de pulmón, pero también existen otros factores de riesgo1. Solo un pequeño porcentaje de los pacientes son diagnosticados de forma casual2 y la determinación del estadio tiene mucho valor desde el punto de vista terapéutico y con vistas al pronóstico.
En el tratamiento del cáncer de pulmón no microcítico (CPNM), que es el que nos atañe, existen varias opciones: cirugía, quimioterapia, radioterapia y las nuevas terapias. La selección de unas u otras va a depender del estadio de la enfermedad, del estado general del paciente, de su edad, etc. Dentro del tratamiento del CPNM hay que nombrar a los inhibidores de las señales de transducción (gefitinib y erlotinib, entre ellos).
En septiembre de 2005, el erlotinib fue aprobado por la EMEA por el procedimiento europeo centralizado. Su eficacia y seguridad fueron analizadas en 3 ensayos clínicos (uno principal y dos secundarios en fase II). El principal ensayo fue el BR.213. Sus indicaciones terapéuticas aprobadas hasta ahora4 se han extendido durante la realización de este estudio: «en monoterapia para el tratamiento de mantenimiento en pacientes con CPNM localmente avanzado o metastásico con enfermedad estable tras 4 ciclos de quimioterapia con el tratamiento estándar de platino de primera línea»5.
En los ensayos iniciales de fase I de erlotinib se evalúan diferentes dosis y diferentes regímenes hasta encontrar la dosis máxima tolerada (150mg)6. En los resultados del estudio BR.213, las tasas de respuesta fueron superiores en los siguientes grupos de pacientes: mujeres, no fumadores, etnia asiática y aquellos con histología de adenocarcinoma. Diarrea y exantema fueron las reacciones adversas más frecuentes en este estudio. En contraposición con este estudio anterior, en un estudio europeo (TRUST, fase IV)7 se observa un beneficio de menor calibre en los pacientes que supuestamente iban a tener un peor pronóstico. Las toxicidades más frecuentes sí coinciden con las del estudio BR.21 (diarrea y exantema). Emery et al.8 llevaron a cabo un estudio retrospectivo con 160 pacientes con CPNM. Recibieron gefinitib 115 pacientes y 45 erlotinib, siendo este último ligeramente superior en todas las medidas de respuesta, aunque no fue estadísticamente significativo. Los efectos adversos más comunes fueron, en ambos grupos: exantema, diarrea, náuseas, vómitos y fatiga. En la guía del National Institute for Health and Clinical Excellence (NICE) para el tratamiento con erlotinib del cáncer de pulmón no microcítico9 se recogen los siguientes efectos secundarios: diarrea, erupción, anorexia, hemorragia gastrointestinal, alteraciones de la función hepática y queratitis.
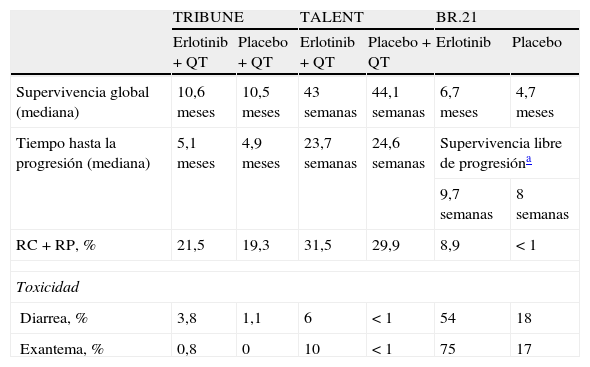
En cuanto a la asociación de inhibidores de la tirosincinasa con otros tratamientos quimioterápicos existen varios estudios en los que datos preclínicos indican un efecto antitumoral sinérgico10,11. El estudio INTACT12, de asociación de gefitinib con quimioterapia, no demostró ninguna mejoría en la supervivencia. Erlotinib ha sido evaluado en primera línea en 2 ensayos fase III aleatorizados y controlados, el TRIBUNE13 y el TALENT14. En estos estudios existen 2 brazos donde se compara erlotinib más quimioterapia frente a quimioterapia más placebo. Ninguno de los estudios demostró beneficios en la supervivencia con la adición de erlotinib a la quimioterapia. Diarrea y exantema fueron los efectos adversos más frecuentes observados en ambos ensayos, y fueron mayores en la rama de los pacientes a los que se les había asociado erlotinib. En la tabla 1 recogemos los resultados de algunos de estos estudios. Se ha comparado también erlotinib en primera línea frente a quimioterapia. El estudio de Lilenbaum et al.15 es un estudio fase II multicéntrico y aleatorizado donde se concluye que la quimioterapia (paclitaxel y carboplatino) es superior a erlotinib en primera línea de tratamiento en pacientes con CPNM no seleccionados.
Índices de respuesta, análisis de supervivencia y toxicidades de ensayos implicados con el erlotinib
| TRIBUNE | TALENT | BR.21 | ||||
| Erlotinib + QT | Placebo + QT | Erlotinib + QT | Placebo + QT | Erlotinib | Placebo | |
| Supervivencia global (mediana) | 10,6 meses | 10,5 meses | 43 semanas | 44,1 semanas | 6,7 meses | 4,7 meses |
| Tiempo hasta la progresión (mediana) | 5,1 meses | 4,9 meses | 23,7 semanas | 24,6 semanas | Supervivencia libre de progresióna | |
| 9,7 semanas | 8 semanas | |||||
| RC + RP, % | 21,5 | 19,3 | 31,5 | 29,9 | 8,9 | < 1 |
| Toxicidad | ||||||
| Diarrea, % | 3,8 | 1,1 | 6 | < 1 | 54 | 18 |
| Exantema, % | 0,8 | 0 | 10 | < 1 | 75 | 17 |
QT: quimioterapia; RC: respuesta completa; RP: respuesta parcial.
En la ficha técnica del erlotinib4 se recoge expresamente la siguiente leyenda: «No se ha demostrado beneficio en la supervivencia u otros efectos clínicamente relevantes del tratamiento en pacientes con tumores que no expresen el receptor del factor de crecimiento epidérmico (EGFR)». Tsao et al.16 realizaron un ensayo en el que se comparaba erlotinib frente a placebo en CPNM en el cual encontraron que la presencia de la mutación EGFR puede aumentar la capacidad de respuesta a erlotinib, pero sin ser indicativo de beneficio en la supervivencia. En el estudio BR.213 se encontró una asociación entre la expresión de EGFR y una mayor supervivencia global. De igual forma, en el estudio fase III IRESSA17, los pacientes con tumores EGFR positivos que recibieron gefitinib tuvieron una mayor supervivencia que los pacientes EGFR negativos. En la revisión llevada a cabo en el año 2008 por Eberhard et al.18, se nos presenta un nuevo horizonte hacia la identificación de predictores clínicos de respuesta para pacientes tratados con inhibidores de la tirosincinasa y el estudio de Rossel et al.19 aún va más allá. Se trata de un estudio abierto y no aleatorizado donde se dejan a un lado los factores clínicos y demográficos usados hasta el momento para predecir la respuesta, para dar paso a un posible uso de las mutaciones EGFR, que pueden desempeñar una función muy importante en las decisiones terapéuticas.
Ante todos estos datos, nuestro objetivo en este trabajo es determinar la efectividad y toxicidad del erlotinib en el tratamiento del CPNM en pacientes de la práctica clínica asistencial.
MétodosEstudio de observación retrospectivo que incluye a los pacientes tratados con erlotinib en el periodo de enero de 2008 a enero de 2010 en un hospital general.
Los criterios de inclusión fueron: pacientes diagnosticados de CPNM que hubieran recibido tratamiento con erlotinib dentro del periodo de estudio.
Las fuentes consultadas para su realización fueron: programa informático que recoge las diferentes dispensaciones realizadas a los pacientes (sección de dispensación a pacientes ambulantes) e historia clínica electrónica y en formato papel.
Las variables recogidas fueron: datos del paciente (número historia clínica, nombre, edad al diagnóstico, sexo, fecha de nacimiento y estado general. El estado general se recogió según indica el Eastern Cooperative Oncology Group performance status (ECOG PS). También se recogieron los datos socioculturales (consumo de alcohol y tabaco), datos del tratamiento (dosis pautada, fecha inicio, requirió disminución de dosis, reacciones adversas observadas) y datos de la enfermedad (tipo histológico).
En la valoración de la eficacia se usaron como medida de respuesta las siguientes variables: tasa de respuesta objetiva (respuesta completa, parcial o progresión). Se utilizaron los criterios Response Evaluation Criteria in Solid Tumors (RECIST). Cuando no se cumplen criterios de respuesta completa, parcial o progresión de la enfermedad, se recogió como enfermedad estable. En lo que respecta al análisis de supervivencia se midió el tiempo hasta la progresión y supervivencia global. El tiempo hasta la progresión se midió como el tiempo transcurrido desde el inicio del tratamiento hasta la progresión de la enfermedad o muerte, cualquiera que ocurra primero. De igual forma, la supervivencia global se calculó como el tiempo transcurrido desde el inicio del tratamiento hasta el fallecimiento del paciente, independientemente de su causa. Como medida de seguridad, la toxicidad se evaluó siguiendo la conocida Common Terminology Criteria for Adverse Events (CTCAE) v3.0 2006 del National Cancer Institute. El tratamiento estadístico de los datos se ha realizado con el programa SPSS versión 15 (Statistical Package for the Social Sciences) para Windows.
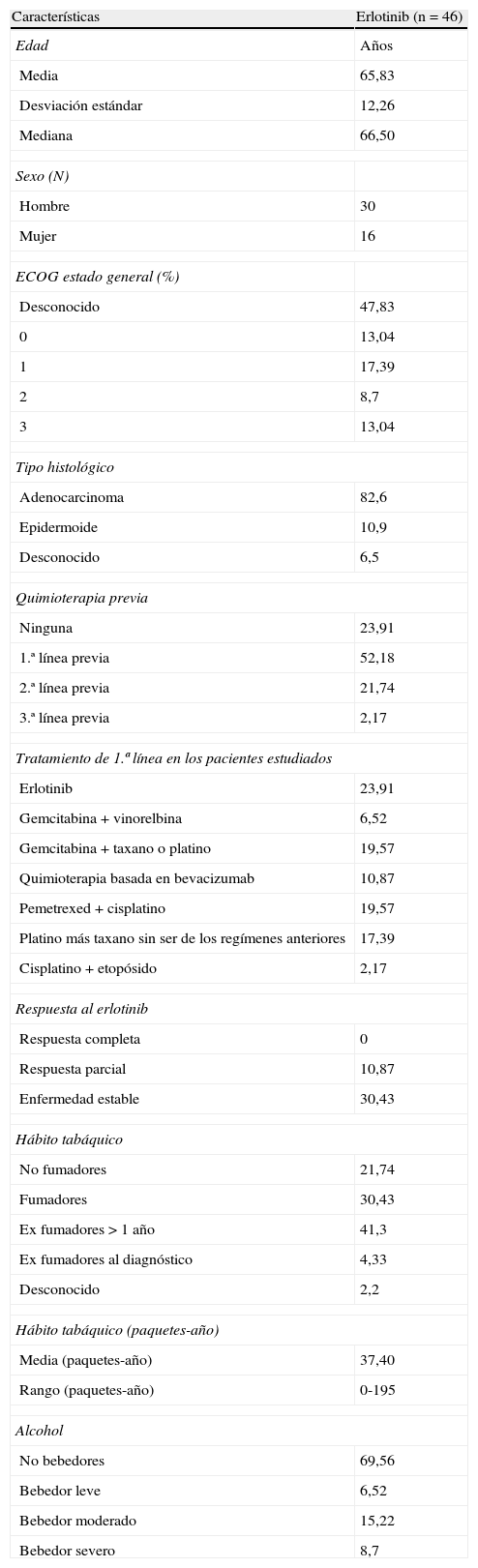
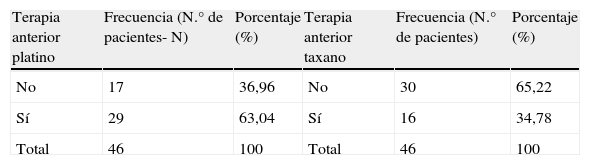
ResultadosHemos evaluado un total de 46 pacientes. En la tabla 2 se muestran las características basales de estos pacientes. Muchos de los pacientes recibieron terapias con diferentes agentes citostáticos anteriores a la terapia con erlotinib. De forma global, 35 pacientes (76,09%) recibieron otro tipo de quimioterapia previa al tratamiento con erlotinib. De los 35 pacientes con tratamientos previos, 32 pacientes (91,4%) recibieron tratamientos basados en platinos o en taxanos y los otros 3 pacientes (8,6%) recibieron gemcitabina combinada con vinorelbina. En la tabla 3 se muestran los pacientes que han recibido tratamiento con algún tipo de taxano o platino, ya sea en primera o en segunda línea.
Características basales de los pacientes incluidos en el estudio
| Características | Erlotinib (n = 46) |
| Edad | Años |
| Media | 65,83 |
| Desviación estándar | 12,26 |
| Mediana | 66,50 |
| Sexo (N) | |
| Hombre | 30 |
| Mujer | 16 |
| ECOG estado general (%) | |
| Desconocido | 47,83 |
| 0 | 13,04 |
| 1 | 17,39 |
| 2 | 8,7 |
| 3 | 13,04 |
| Tipo histológico | |
| Adenocarcinoma | 82,6 |
| Epidermoide | 10,9 |
| Desconocido | 6,5 |
| Quimioterapia previa | |
| Ninguna | 23,91 |
| 1.ª línea previa | 52,18 |
| 2.ª línea previa | 21,74 |
| 3.ª línea previa | 2,17 |
| Tratamiento de 1.ª línea en los pacientes estudiados | |
| Erlotinib | 23,91 |
| Gemcitabina + vinorelbina | 6,52 |
| Gemcitabina + taxano o platino | 19,57 |
| Quimioterapia basada en bevacizumab | 10,87 |
| Pemetrexed + cisplatino | 19,57 |
| Platino más taxano sin ser de los regímenes anteriores | 17,39 |
| Cisplatino + etopósido | 2,17 |
| Respuesta al erlotinib | |
| Respuesta completa | 0 |
| Respuesta parcial | 10,87 |
| Enfermedad estable | 30,43 |
| Hábito tabáquico | |
| No fumadores | 21,74 |
| Fumadores | 30,43 |
| Ex fumadores > 1 año | 41,3 |
| Ex fumadores al diagnóstico | 4,33 |
| Desconocido | 2,2 |
| Hábito tabáquico (paquetes-año) | |
| Media (paquetes-año) | 37,40 |
| Rango (paquetes-año) | 0-195 |
| Alcohol | |
| No bebedores | 69,56 |
| Bebedor leve | 6,52 |
| Bebedor moderado | 15,22 |
| Bebedor severo | 8,7 |
Pacientes que han recibido tratamiento previo con un platino o con un taxano
| Terapia anterior platino | Frecuencia (N.° de pacientes- N) | Porcentaje (%) | Terapia anterior taxano | Frecuencia (N.° de pacientes) | Porcentaje (%) |
| No | 17 | 36,96 | No | 30 | 65,22 |
| Sí | 29 | 63,04 | Sí | 16 | 34,78 |
| Total | 46 | 100 | Total | 46 | 100 |
Si excluimos un dato en el que la duración media desde el diagnóstico hasta el inicio del tratamiento con erlotinib fue de 145 meses, la media es de 13,84±16,37 meses, con un mínimo que va desde 0 (fue el primer tratamiento una vez diagnosticada la enfermedad) hasta 71,27 meses. La dosis inicial en 45/46 (97,8%) pacientes fue de 150mg de erlotinib, solo un paciente con CPNM inició con una dosis de 100. Esto fue motivado por la edad del paciente (83 años) y una vez confirmado que toleraba bien el tratamiento, esta dosis fue aumentada hasta la dosis habitual en pacientes con CPNM. De forma inversa, 4/46 fueron los pacientes que comenzaron con la dosis de erlotinib habitual (150mg/24 h) y tuvieron que disminuir dicha dosis por intolerancia. En uno de ellos el motivo de disminución de dosis fue un exantema cutáneo de grado 3 y diarrea de grado 2. En el segundo también hubo exantema de grado 3 asociado además a diversas molestias gastrointestinales (sin especificar el grado). En los otros 2 pacientes se trató de astenia en diversos grados: 1 y 2. En uno de estos casos se encontró una progresión al tratamiento pero no se logró averiguar por qué se vuelve a introducir el mismo tratamiento al cabo de varios meses.
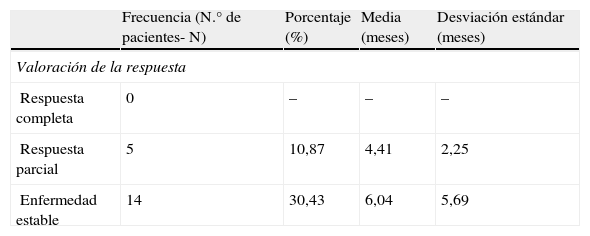
La valoración de la respuesta se expone en la tabla 4. Solo añadir que un 60% (3 pacientes) de los pacientes que presentaron respuestas parciales eran no fumadores. El 20% (un paciente) era fumador y el otro 20% restante desconocido. Así mismo, de 10 pacientes no fumadores, 3 desarrollaron respuestas parciales (30%); frente a 35 pacientes fumadores, de los cuales, solo uno desarrolló respuesta parcial (4%).
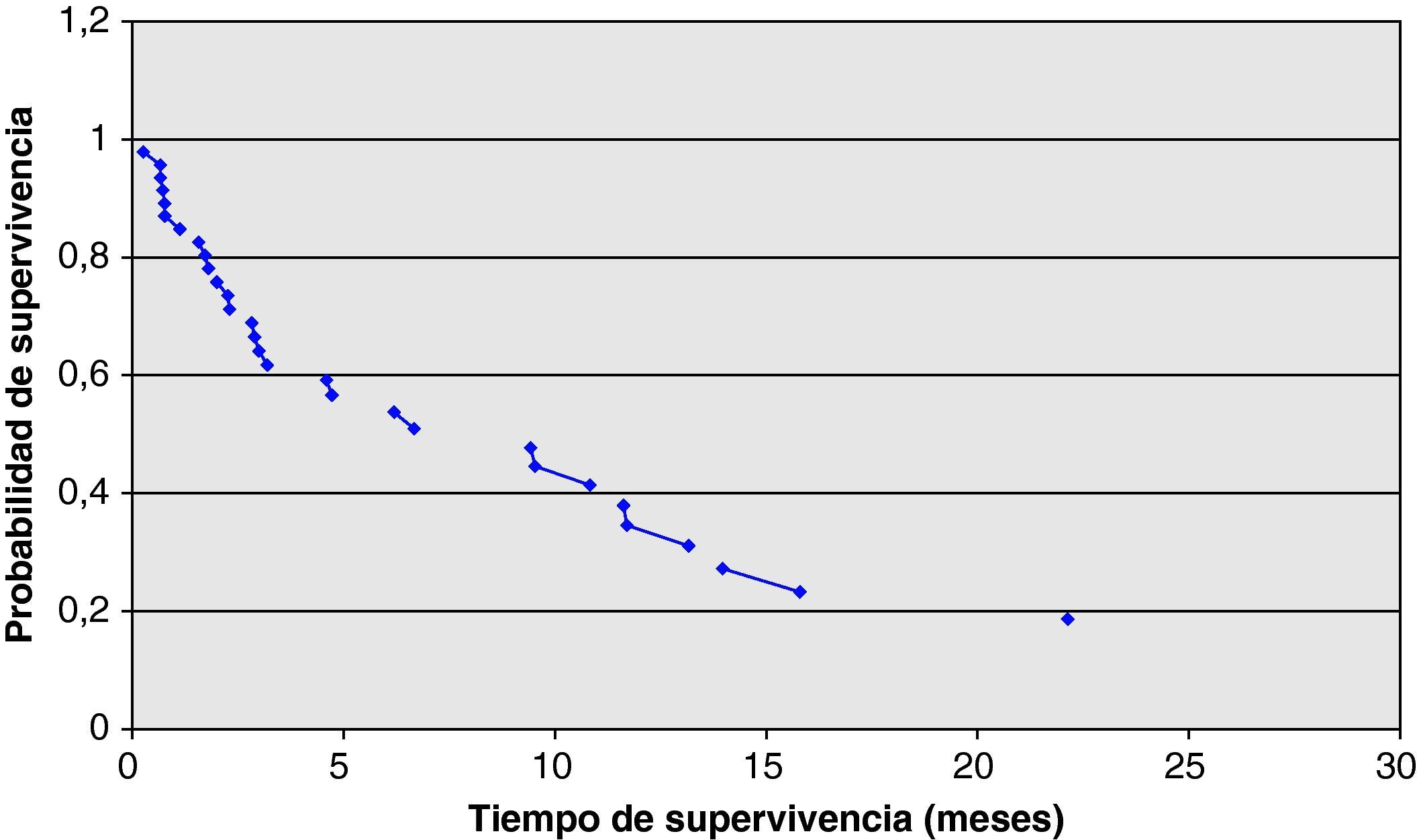
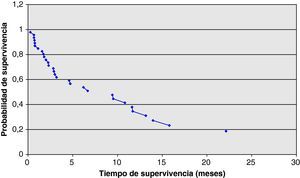
En lo que respecta al análisis de supervivencia, el tiempo hasta progresión de la enfermedad fue de media: 4,01 meses. La supervivencia global (SG) se calculó en 30/46 pacientes, ya que esos 16 pacientes excluidos continúan vivos a fecha de hoy y por tanto no se incluyeron en este análisis. La media de SG fue de 5,63 meses, con un rango que va de 0,3 hasta 21,8 meses. Si censuramos aquellos pacientes que continúan vivos obtenemos una mediana de SG de 4,67 meses. De la misma forma, la mediana del tiempo hasta progresión es de 2,33 meses (media 4,01±4,62 meses). Si reagrupamos a los pacientes en 2 grupos, los que recibieron erlotinib en primera línea y los que lo recibieron en segunda línea o sucesivas, obtenemos los siguientes resultados: mediana SG en 1.a línea; 4,6 versus 4,73 en 2.a o sucesivas y mediana de tiempo hasta progresión 2,47 versus 2,33 meses. Hemos utilizado el método Kaplan-Meier para representar gráficamente la probabilidad de supervivencia y se puede consultar en la figura 1.
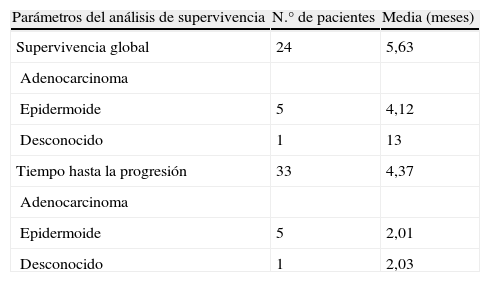
Para analizar la relación entre las medias de la supervivencia global, el tiempo de enfermedad estable y el tiempo hasta progresión con el tipo histológico se usó el análisis ANOVA para variables cuantitativas. En cuanto a los datos que se incluyeron en la valoración de la respuesta, no se aplicó este análisis a los pacientes con respuesta parcial por tratarse de un grupo muy reducido. Se desglosó el tiempo de enfermedad estable en los 14 pacientes en los que se desarrolló: 13 pacientes con adenocarcinoma tuvieron un tiempo de enfermedad estable de 5,78 meses frente a un individuo con tipo histológico desconocido en el que este tiempo fue de 9,47 meses. En lo que respecta al análisis de supervivencia según el tipo histológico, los resultados se recogieron en la tabla 5. La mayor diferencia entre estos valores la encontramos en el tiempo hasta progresión, pero según el resultado del análisis estadístico no es significativo.
Media de los parámetros de análisis de supervivencia según el tipo histológico
| Parámetros del análisis de supervivencia | N.° de pacientes | Media (meses) |
| Supervivencia global | 24 | 5,63 |
| Adenocarcinoma | ||
| Epidermoide | 5 | 4,12 |
| Desconocido | 1 | 13 |
| Tiempo hasta la progresión | 33 | 4,37 |
| Adenocarcinoma | ||
| Epidermoide | 5 | 2,01 |
| Desconocido | 1 | 2,03 |
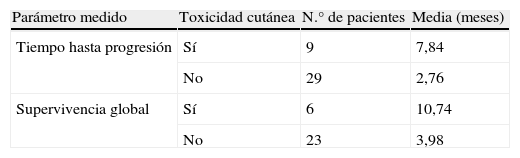
Para asociar la presencia de toxicidad cutánea (cualquier grado) con la supervivencia global o con el tiempo libre de progresión hemos visto la normalidad por Kolmogorov-Smirnov y Shapiro.
- –
Tiempo de progresión versus toxicidad cutánea: como el tiempo hasta progresión tiene una distribución normal, hemos usado la t de Student para valorar la asociación. El resultado es significativo, hay una diferencia significativa de mayor tiempo hasta progresión entre los pacientes que tienen toxicidad cutánea frente a los que no la presentan (p=0,003).
- –
Supervivencia global versus toxicidad cutánea: como la supervivencia global no presenta una distribución normal, hemos aplicado una prueba no paramétrica (Mann-Whitney) para la obtención de las medias. El resultado es significativo, existen diferencias estadísticamente significativas en la supervivencia global entre ambos grupos de pacientes (p=0,010).
En la tabla 6 se encuentran los resultados de supervivencia global y de tiempo hasta la progresión según la ausencia o presencia de toxicidad cutánea.
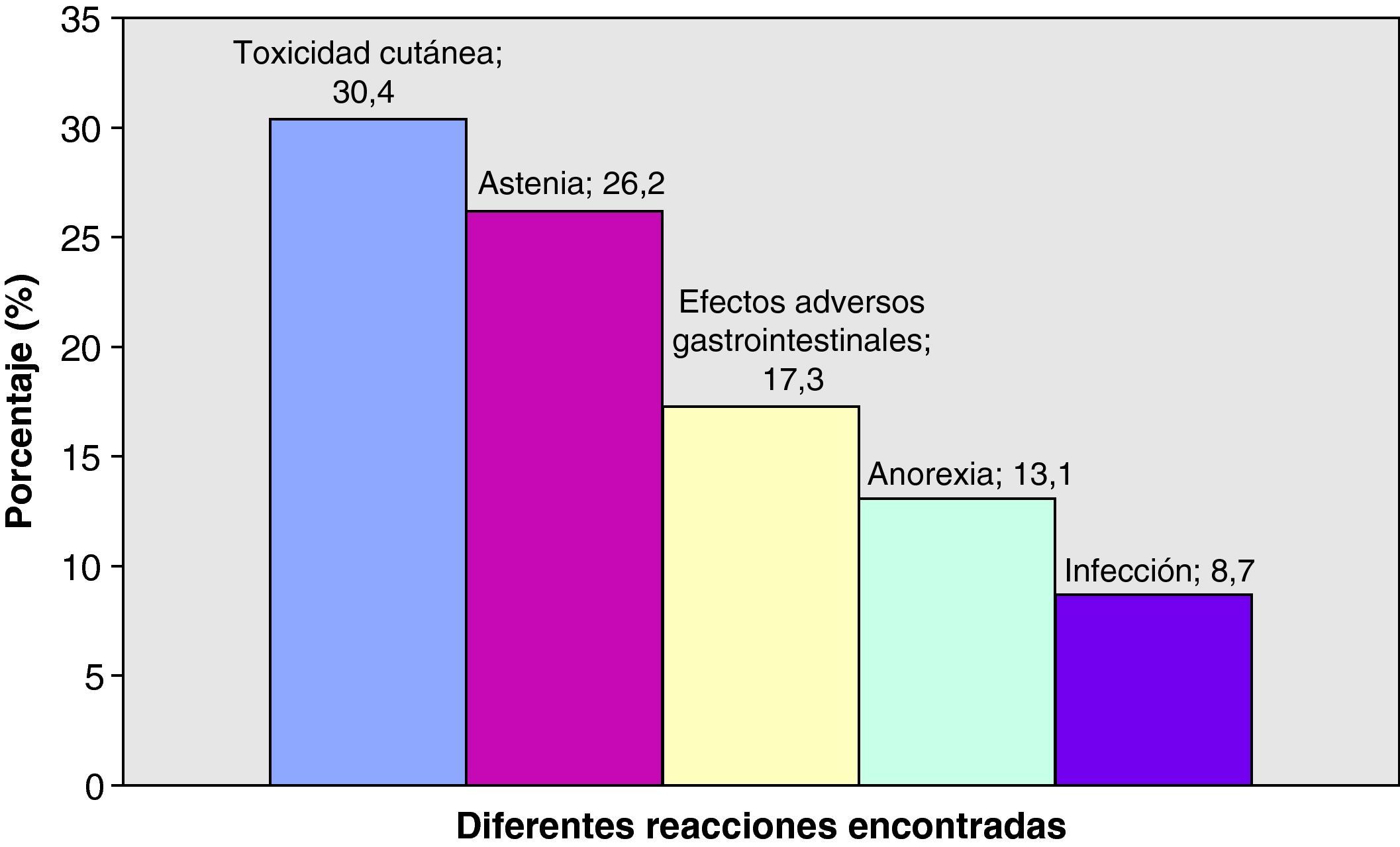
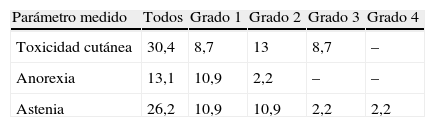
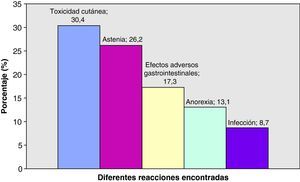
De forma global, el tratamiento con erlotinib fue bien tolerado por la gran mayoría de nuestros pacientes. En 40/46 pacientes (87%) el tratamiento fue bien tolerado, en 5/46 pacientes (10,9%) fue necesaria bien la interrupción temporal del tratamiento, bien la disminución de la dosis, y en un único paciente (2,2%) se suspendió este tratamiento como consecuencia de sus reacciones adversas. En este último caso, la suspensión fue motivada por un conjunto de reacciones adversas entre las que se encontraban: astenia, anorexia intensa y molestias gastrointestinales calificadas como intolerancia digestiva. En la figura 2 se recogen las diversas reacciones adversas provocadas por el tratamiento con erlotinib. Toxicidad cutánea, anorexia y astenia acontecieron en diferentes grados recogidos en la tabla 7. No presentaron infección 42 frente a 4 pacientes que sí la presentaron (91,3 versus 8,7%). Entre los efectos adversos gastrointestinales encontramos: diarrea grado 2 (n=3, 6,5%), vómitos, náuseas y disfagia (n=2, 4,3%), molestias gastrointestinales (n=3, 6,5%).
No recibieron ningún tratamiento posterior a erlotinib 25 pacientes (54,35%) y 15 pacientes (32,61%) sí fueron subsidiarios de tratamientos posteriores. Seis pacientes (13%) continúan a fecha de cierre de nuestro estudio en tratamiento con el fármaco. Las causas de suspensión del tratamiento fueron: muerte (34,8%), progresión (47,8%), intolerancia (2,2%) y otras (2,2%).
DiscusiónLa incidencia por edad de cáncer de pulmón no microcítico se sitúa entre los 50 y los 75 años, con una media de edad en el momento del diagnóstico de 72 años20, datos que se aproximan a nuestra media. También hemos obtenido un porcentaje mayor de hombres que de mujeres entre nuestros diagnosticados. La mayoría de nuestros pacientes son o han sido fumadores, pero también nos hemos encontrado con pacientes no fumadores que han desarrollado un cáncer de pulmón. Este dato puede resultar algo elevado pero puede ser debido a que con el tratamiento con erlotinib se ha visto que los no fumadores tienen una mayor oportunidad y quizás por ello se seleccionen más pacientes no fumadores que fumadores para recibir este tratamiento. Habría que hacer un apunte en este apartado al estudio BR.213, donde encuentran tasas de respuesta mayores en no fumadores (24,7%). En nuestro estudio también hemos encontrado más respuestas parciales en el grupo de no fumadores. Estos resultados concuerdan con lo descrito en la bibliografía y nos recuerdan las recomendaciones de la ficha técnica en cuanto a la abstención tabáquica. En el ensayo de fase III BR.213 solo incluyen pacientes con un PS menor o igual a 3. En nuestro hospital recibieron tratamiento pacientes con diferentes estados generales, sin destacar especialmente ninguno en particular. Es habitual en la práctica clínica el uso del erlotinib en función de la edad del paciente y de su estado general, ya que en situaciones de diagnóstico de enfermedad metastásica con edad avanzada y un PS elevado no se opta por la quimioterapia y en ocasiones se ha administrado este fármaco en primera línea. Esto no está recogido en la ficha técnica ni tampoco en las nuevas guías de la American Society of Clinical Oncology (ASCO) del cáncer de pulmón no microcítico estadio IV publicadas en 200921. En ellas encontramos las siguientes recomendaciones: el erlotinib es aceptable en segunda línea en pacientes con CPNM avanzado con un adecuado estado general cuando la enfermedad ha progresado a una primera línea basada en platino (grado de recomendación B). En pacientes no seleccionados, erlotinib no debe ser usado en combinación con quimioterápicos en primera línea. Como grado de recomendación A recogen: la evidencia es insuficiente para recomendarlo en monoterapia en primera línea. Si existe mutación de EGFR, la primera línea con gefitinib estaría indicada; si la mutación es negativa o se desconoce es preferible la quimioterapia citotóxica.
Los pacientes tenían en su mayoría un adenocarcinoma, que además presentaron una supervivencia global y un tiempo libre hasta la progresión menor. Ello concuerda con los resultados de varios estudios donde sugieren la importancia de varios factores en la predicción del beneficio terapéutico (histología de adenocarcinoma).
La media de SG tiene un rango muy amplio. El hecho que explica este rango es que muchos pacientes ni siquiera llegaron a estar a tratamiento con erlotinib un mes, y otros llegaron a estar más de 7 meses. En el ensayo BR.213, la mediana de supervivencia global en el grupo del erlotinib es de 6,67 versus 4,7 meses en el grupo placebo. La mediana de nuestro estudio coincide con la del grupo placebo.
En cuanto a las limitaciones de nuestro estudio hay que señalar que se trata de un estudio retrospectivo con datos obtenidos de la historia clínica de los pacientes. Esto nos lleva a platearnos que algunas variables pueden no haber sido contempladas, como por ejemplo estudios de mutación del gen EGFR. Existe una revisión realizada por Neal et al.22 donde se analizan los estudios en los que se apoya el uso de inhibidores de la tirosincinasa en primera línea en pacientes con mutaciones de EGFR (recalcando en concreto los resultados del ensayo Iressa). Entre nuestros pacientes, solo 11 fueron tratados con erlotinib en primera línea, todos ellos tenían una media de 78,9 años (mediana 80) y en ninguno existía estudios de mutación del gen EGFR. Es más, entre los pacientes que entraron en este estudio, en ninguno se había solicitado estudio de mutaciones EGFR, a excepción de 2 pacientes. En nuestro centro, el Servicio de Anatomía Patológica no realiza esta determinación, pero en los casos en los que se realiza, se envían a otros hospitales. Durante nuestro periodo de estudio no ha habido muchas determinaciones, pero a partir de finales del año 2009 se ha comenzado a solicitar este estudio de mutaciones, lo que supone un gran avance. La mayoría de los pacientes recibieron erlotinib en segunda línea. Basado en este aspecto encontramos un estudio de Melosky et al.23, donde afirman que los pacientes con CPNM que progresan a quimioterapia basada en platino se benefician de un tratamiento de segunda línea con erlotinib. La segunda línea con erlotinib obtuvo el mayor valor de tiempo hasta progresión (mediana: 9,2 meses), mayor que en la primera línea y mayor que en la tercera. En nuestro estudio no existen diferencias entre su uso en primera línea o sucesivas.
Otra de las limitaciones encontradas es el corte temporal. Es decir, no sabemos si van a aparecer o no más reacciones adversas a lo largo del tiempo, aunque estos enfermos tienen una expectativa de vida corta y eso sugiere que es difícil que no se recoja. En último lugar, nombrar el pequeño tamaño muestral y la mezcla de distintas líneas de tratamiento en nuestros pacientes.
En cuanto a la toxicidad, erlotinib es un tratamiento por lo general muy bien tolerado. Las reacciones adversas más frecuentes son: toxicidad cutánea, anorexia, astenia y efectos adversos gastrointestinales. Las fuentes consultadas evidencian que las reacciones adversas más frecuentes son toxicidad cutánea (exantema) y diarrea. Nosotros las hemos observado en nuestros pacientes, pero quizás hemos obtenidos un porcentaje muy alto de anorexia y astenia, lo que puede estar influido por el propio curso de la enfermedad cuando se encuentra en una fase avanzada o terminal. La aparición de exantema se asoció de forma significativa con una mayor supervivencia global y un mayor tiempo hasta la progresión. Si nos remontamos al estudio llevado a cabo por Pérez-Solar et al.24, podemos ver cómo este tipo de toxicidad es tan importante. Se trata de un ensayo fase II en donde solo fueron incluidos pacientes con EGFR positivo previamente tratados con quimioterapia basada en platino. La tasa de respuesta global fue de un 12,3% y todos los pacientes que respondieron desarrollaron exantema, siendo por tanto un predictor de supervivencia. La relación entre exantema y eficacia también ha sido descrita en el estudio de Wacker et al.25. Se trata de 2 ensayos fase III, el BR.21 (erlotinib en monoterapia en CPNM) y el PA.3 (erlotinib más gemcitabina en cáncer de páncreas), donde se determina la SG, el tiempo libre de progresión y la respuesta en función del desarrollo o no de exantema. En ambos estudios la presencia de exantema se correlaciona con una mayor SG. En el BR.21 las correlaciones aumentaron con la severidad del exantema y en el PA.3 se asoció a un grado ≥ 2 versus no exantema. Resultados similares se obtuvieron con los demás parámetros. Nuestros datos de porcentaje de pacientes que desarrollan toxicidad cutánea con erlotinib en monoterapia son bajos respecto a la bibliografía (Ensayo BR.213, 75%, Uhm et al.26, 78%, y TRUST7, 70%). Esto se puede volver a asociar al poco tiempo durante el cual estuvieron recibiendo tratamiento algunos de nuestros pacientes, pero no obstante no es un dato despreciable. En cuanto a la diarrea, también obtenemos un porcentaje menor que en cualquier dato de la bibliografía. Aun incluyendo todos los datos recogidos como efectos adversos gastrointestinales de forma global, seguimos obteniendo un porcentaje menor al documentado. Según la ficha técnica del medicamento se ha observado diarrea en aproximadamente el 50% de los pacientes que reciben erlotinib y para ser aún más selectivos, en el estudio BR.213 esta proporción asciende al 54%. Se tuvo que disminuir la dosis en un 10,87% de los pacientes, porcentaje similar al del estudio BR.213 (12% por exantema y 5% por diarrea) y al del estudio TRUST7 (14%). En los estudios en los que se combina erlotinib y quimioterapia en primera línea de tratamiento10,11 encontramos unos porcentajes de exantema y diarrea menores a los descritos con dicho tratamiento en monoterapia y quizás más semejantes a los nuestros, siendo en nuestro caso un tratamiento de monoterapia.
Las causas de suspensión del tratamiento se pueden resumir en 2: muerte o progresión. Solo se reportó un caso de suspensión por intolerancia. El erlotinib suele ser una de las últimas líneas usadas en el tratamiento del CPNM, ya que de los 46 pacientes 6 continúan en tratamiento y en 25 pacientes este fue el último tratamiento. Las reacciones adversas más frecuentes que se han desarrollado en nuestro trabajo coinciden con las descritas previamente, aunque no debemos olvidar las advertencias y precauciones de la FDA acerca del tratamiento con erlotinib:
En septiembre de 2008 la FDA notificó a los profesionales de la salud que se habían reportado casos de síndrome hepatorrenal e insuficiencia hepática (incluyendo fatalidades) en pacientes tratados con erlotinib, especialmente en pacientes con insuficiencia hepática de base27. A raíz de ello, los pacientes con insuficiencia hepática deberán ser estrechamente monitorizados durante el tratamiento, debiéndose utilizar con mucha precaución en pacientes con un nivel de bilirrubina total tres veces superior al normal. La administración debe ser interrumpida o suspendida en el caso de cambios severos de la función hepática. En mayo de 2009, como consecuencia de las actividades de farmacovigilancia, la FDA vuelve a notificar acerca del tratamiento con erlotinib28. En esta ocasión se trata de casos de perforación gastrointestinal (incluyendo muertes), formación de ampollas y lesiones cutáneas exfoliativas (incluyendo casos de síndrome de Stevens-Johnson y necrólisis epidérmica tóxica, en algunos casos mortales) y afectación ocular (incluyendo perforación corneal o ulceraciones).
Las diferencias en el análisis de supervivencia (SG y tiempo hasta progresión) entre los pacientes que recibieron erlotinib en primera línea o en sucesivas no son significativas. Existen diferencias significativas en estos parámetros entre los pacientes que desarrollan toxicidad cutánea y los que no la desarrollan (a favor del grupo que la desarrolla). Los datos de efectividad encontrados son menores que los descritos en los ensayos clínicos, teniendo en cuenta que la muestra es pequeña en comparación con otros estudios. Sin embargo, la toxicidad observada refleja lo esperado aun tratándose de una pequeña muestra de pacientes, como ya hemos apuntado. Con todo ello, podría ser una alternativa para los pacientes con CPNM debido a la facilidad de administración.
En la actualidad, no existe ninguna característica clínica que obligue a considerar a un paciente como no candidato a erlotinib tras el fracaso de una o varias líneas de quimioterapia. La hipótesis de trabajo futura radica en las mutaciones positivas de EGFR, que si bien no han sido objeto de este trabajo, abren la puerta al uso lógico de los inhibidores de la tirosincinasa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se ha presentado una comunicación de este trabajo al 55 Congreso Nacional de Farmacia Hospitalaria. Dicha comunicación fue aceptada y se puede encontrar en: Romero Ventosa EY, Mucientes Molina A, Pedrido Reino E, Lago Rivero N, Constenla Caramés L, Arias Santos I. Comunicaciones. 55 Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria. 1.a edición. Madrid: Editorial Vision Libros; 2010. P. 166-167.