Desde 1986 se han realizado cinco estudios de prevalencia de Staphylococcus spp. en España. En este trabajo se presentan los datos de 2006 correspondientes al sexto estudio.
MétodosParticiparon 145 hospitales de todas las areas geográficas y se estudiaron 866 cepas de estafilococos (463 S. aureus). Se determinó la sensibilidad a 16 antimicrobianos mediante un sistema automatizado de microdilución en caldo. La sensibilidad a tigeciclina se determinó mediante el método de E-test.
ResultadosLa resistencia de S. aureus a oxacilina se ha estabilizado (el 31,2% en 2002 frente al 29,2% en 2006), así como la resistencia a eritromicina, clindamicina y ciprofloxacino. En 2006 los aislados fueron más sensibles a gentamicina (el 16,9% en 2002 frente al 8,6% en 2006; p < 0,001), ninguno presentó sensibilidad disminuida a vancomicina y la resistencia a cotrimoxazol (0,9%) y a rifampicina (0,6%) fue anecdótica. Un aislado fue resistente a linezolid. La resistencia de los estafilococos coagulasa negativos a oxacilina (el 61,3% en 2002 frente al 66,7% en 2006) y a eritromicina (el 63,0% en 2002 frente al 66,5% en 2006) se ha mantenido relativamente estable, aunque ha aumentado la resistencia a gentamicina (el 27,8% en 2002 frente al 44,2% en 2006; p < 0,001), ciprofloxacino (el 44,9% en 2002 frente al 54,3% en 2006; p = 0,010) y clindamicina (el 33,8% en 2002 frente al 46,2% en 2006; p = 0,001). Dos aislados presentaron sensibilidad disminuida a teicoplanina y uno fue resistente a linezolid. Todos los Staphylococcus spp. fueron uniformemente sensibles a quinupristina-dalfopristina y a tigeciclina.
ConclusionesEn España la resistencia de Staphylococcus spp. a oxacilina sigue siendo elevada, aunque parece haberse estabilizado. Asimismo, comienzan a aparecer aislados resistentes a linezolid.
Since 1986 we have carried out five nationwide point-prevalence studies in Spain analyzing Staphylococcus spp. The 2006 data, corresponding to the sixth study, are presented herein.
MethodsA total of 145 hospitals from all geographic areas of the country participated in the study. We investigated 866 staphylococcal isolates (463 S. aureus). Antimicrobial susceptibility testing was performed against 16 antimicrobials by an automated microdilution method. Susceptibility to tigecycline was determined by the E-test method.
ResultsResistance of S. aureus to oxacillin seemed to have stabilized (31.2% in 2002 vs. 29.2% in 2006), and the same was true for resistance to erythromycin, clindamycin and ciprofloxacin. In 2006, isolates were more susceptible to gentamicin (16.9% resistance in 2002 vs. 8.6% in 2006, P < 0.001). None of the isolates presented decreased susceptibility to vancomycin, and the resistance to cotrimoxazole (0.9%) and rifampin (0.6%) was minimal. One isolate showed linezolid resistance. Resistance of coagulase negative staphylococci to oxacillin (61.3% in 2002 vs. 66.7% in 2006) and erythromycin (63.0% in 2002 vs. 66.5% in 2006) remained stable, although resistance to gentamicin (27.8% in 2002 vs. 44.2% in 2006, P < 0.001), ciprofloxacin (44.9% in 2002 vs. 54.3% in 2006, P = 0.010) and clindamycin (33.8% in 2002 vs. 46.2% in 2006, P 0.001) has increased. Two isolates presented decreased susceptibility to teicoplanin and one was linezolid-resistant. All Staphylococcus spp. were uniformly susceptible to quinupristin-dalfopristin and tigecycline.
ConclusionsResistance of Staphylococcus spp. to oxacillin remains high in Spain, but seems to have stabilized in the last years. Linezolid resistance is emerging.
Los estafilococos son una de las principales causas de infecciones en humanos, tanto en el medio hospitalario como en la comunidad. Estos microorganismos son responsables principalmente de infecciones de piel y partes blandas, bacteriemia, endocarditis y neumonía, pero además producen un creciente número de infecciones relacionadas con la utilización de diferentes tipos de catéteres, prótesis articulares y vasculares y otros dispositivos médicos. Asimismo, los estafilococos poseen una extraordinaria capacidad para desarrollar resistencia a antimicrobianos1-3.
En los últimos años han surgido nuevas circunstancias que hacen aconsejable llevar a cabo estudios de vigilancia de la situación actual de la resistencia a antimicrobianos de estos patógenos. El incremento y la diseminación de cepas de Staphylococcus aureus resistentes a meticilina (SARM) no sólo en el medio hospitalario, sino también en otros centros de atención y cuidados sanitarios2, la reciente emergencia de SARM comunitario3, la comunicación de infecciones causadas por cepas de S. aureus y estafilococos coagulasa negativos (ECN) con sensibilidad disminuida o con resistencia a glucopéptidos4-8 y la variación en los patrones de resistencia a otros antibióticos9 son algunos de los factores preocupantes en cuanto al control y tratamiento de la infección por S. aureus. En el caso de los ECN, si bien se dispone de una información más limitada, las tasas de resistencia a meticilina y a otros antimicrobianos son elevadas, principalmente en aislados de origen nosocomial2. Además, los ECN pueden constituir un reservorio de genes para el futuro desarrollo de resistencia en S. aureus10.
En este contexto, la mayoría de los estudios que evalúan la evolución de la resistencia de los estafilococos a los antimicrobianos aportan datos limitados a determinados tipos de hospitales11,12 o servicios hospitalarios (como las unidades de cuidados intensivos [UCI]13), a determinados tipos de pacientes o síndromes clínicos14, o bien estudian solamente algunos antibióticos15. Para determinar la realidad global de la infección estafilocócica en España en todas las áreas geográficas, sin restricciones por tipo de hospital o servicio, tipo de paciente, origen de la muestra, o adquisición de la infección, desde el año 1986 hemos llevado a cabo cinco estudios multicéntricos de prevalencia encaminados a conocer la resistencia de Staphylococcus spp. en España16-20. El objetivo del presente trabajo es presentar los datos del sexto estudio (2006), evaluar la situación actual y comparar estos resultados con los obtenidos en estudios previos.
Material y métodosHospitales participantesDesde 1986 hemos realizado cinco estudios de prevalencia (1986, 1991, 1994, 1996 y 2002) analizando todos los estafilococos identificados en un único día en cada hospital participante sin duplicar cepas del mismo paciente y muestra. En este trabajo se presentan los datos de 2006 correspondientes al sexto estudio. La metodología empleada en los seis estudios ha sido la misma16-20. En el sexto estudio participaron un total de 145 hospitales de toda la geografía nacional dividida en nueve áreas: área 1 (Galicia, Asturias y Cantabria), área 2 (País Vasco, La Rioja y Navarra), área 3 (Cataluña), área 4 (Valencia, Murcia e Islas Baleares), área 5 (Madrid), área 6 (Aragón y Castilla-La Mancha), área 7 (Castilla y León, y Extremadura), área 8 (Andalucía, Ceuta y Melilla) y área 9 (Islas Canarias). Los hospitales participantes en todos los estudios son fundamentalmente los mismos, sobre todo aquéllos de más de 1.000 camas, a los que se han ido añadiendo otros de menor tamaño (hospitales comarcales) en los últimos estudios. Se solicitó el envío de todos los aislados de Staphylococcus identificados en un único día predefinido al Servicio de Microbiología del Hospital General Universitario Gregorio Marañón junto con un protocolo que incluía la identificación del microorganismo, las características del hospital de origen, número de camas, servicio de procedencia del paciente, tipo de muestra clínica y adquisición de la infección (considerada comunitaria cuando el paciente no estaba ingresado, no presentaba ninguna relación previa con el hospital o con un centro de cuidados sanitarios –hospital de día, centros de diálisis, residencias de ancianos, etc.– al menos en el último mes previo a la toma de la muestra o cuando el cultivo resultó positivo en las primeras 48 h del ingreso, y nosocomial cuando el cultivo fue positivo después de 48 h del ingreso). No obstante, esta definición no es muy estricta y es posible que algunos aislados relacionados con la asistencia sanitaria hayan sido clasificados como comunitarios (especialmente en los primeros estudios).
Identificación de los aislados y pruebas de sensibilidad a antibióticosTodos los aislados se reidentificaron tras su recepción y se determinó la sensibilidad a antimicrobianos por el método de microdilución en caldo utilizando un sistema automatizado (MicroScan, Dade Behring, Sacramento, California, EE.UU.) y los paneles Pos Combo 23S. Adicionalmente, en algunos aislados se realizaron procedimientos estándar de identificación21. La determinación de la sensibilidad a tigeciclina se realizó mediante el método de E-test en agar Mueller-Hinton (Becton Dickinson, Cocksville, Maryland, EE.UU.). La detección del fenotipo M en los aislados resistentes a eritromicina y sensibles a clindamicina se realizó mediante la prueba de aproximación de discos (D-test) en agar Mueller Hinton siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI)22. Para la determinación de los puntos de corte se siguieron las indicaciones del CLSI22, excepto en el caso de mupirocina y de tigeciclina que se siguieron las recomendaciones de MENSURA23 (Mesa Española de Normalización de la Sensibilidad y Resistencia a los Antimicrobianos) y del European Committee on Antimicrobial Susceptibility Testing (Eucast)24, respectivamente. La detección de la presencia de betalactamasa se realizó mediante la prueba de nitrocefin (Cefinase, Becton Dickinson, Sparks, Maryland, EE.UU.). Los antibióticos evaluados fueron: penicilina, oxacilina, eritromicina, clindamicina, gentamicina, tobramicina, rifampicina, cotrimoxazol, cloranfenicol, ciprofloxacino, vancomicina, teicoplanina, linezolid, quinupristina-dalfopristina, mupirocina y tigeciclina. Como cepas control se utilizaron S. aureus ATCC 29213 y Enterococcus faecalis ATCC 29212. En los artículos previamente publicados de los anteriores estudios se puede encontrar de forma más detallada la metodología empleada16-20.
Análisis estadísticoEl análisis estadístico de los datos se realizó con el programa informático SPSS 11.5 (SPSS, Chicago, Illinois, EE.UU.). La significación estadística se determinó mediante la prueba de chi al cuadrado (variables categóricas). En todos los casos se consideraron estadísticamente significativos los valores de p ≤ 0,05.
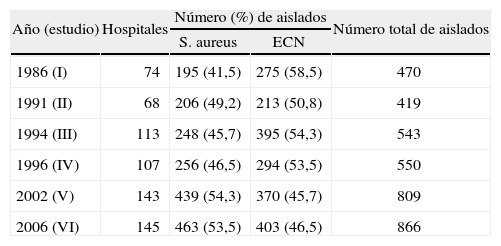
ResultadosDatos demográficos e identificaciónEn el sexto estudio (2006) se recogieron, en un único día, un total de 866 cepas de estafilococos (todas ellas aptas para el estudio) procedentes de 145 hospitales españoles pertenecientes a todas las áreas geográficas. Esta cifra supone un mayor número de cepas que en todos los estudios anteriores, tanto de S. aureus como de ECN (tabla 1), si bien el número de hospitales participantes también fue mayor que en los estudios previos (74 hospitales en 1986, 68 en 1991, 113 en 1994, 107 en 1996 y 143 en 2002). Un total de 15 hospitales notificaron que no habían aislado ningún estafilococo en el día fijado.
Aislados de Staphylococcus spp. estudiados
| Año (estudio) | Hospitales | Número (%) de aislados | Número total de aislados | |
| S. aureus | ECN | |||
| 1986 (I) | 74 | 195 (41,5) | 275 (58,5) | 470 |
| 1991 (II) | 68 | 206 (49,2) | 213 (50,8) | 419 |
| 1994 (III) | 113 | 248 (45,7) | 395 (54,3) | 543 |
| 1996 (IV) | 107 | 256 (46,5) | 294 (53,5) | 550 |
| 2002 (V) | 143 | 439 (54,3) | 370 (45,7) | 809 |
| 2006 (VI) | 145 | 463 (53,5) | 403 (46,5) | 866 |
ECN: estafilococos coagulasa negativos; S. aureus: Staphylococcus aureus.
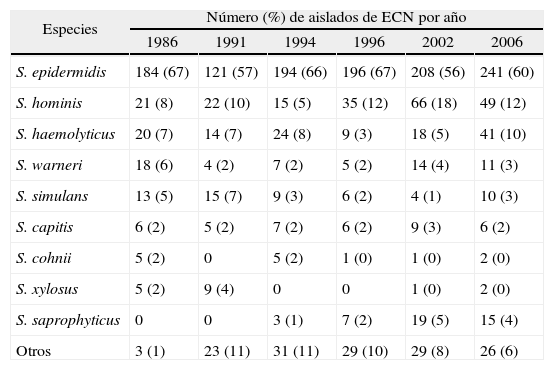
La especie de ECN más frecuente fue Staphylococcus epidermidis, que constituyó más de la mitad de los aislados de ECN, situación similar a la encontrada en todos los estudios anteriores (tabla 2).
Distribución de especies de estafilococos coagulasa negativos
| Especies | Número (%) de aislados de ECN por año | |||||
| 1986 | 1991 | 1994 | 1996 | 2002 | 2006 | |
| S. epidermidis | 184 (67) | 121 (57) | 194 (66) | 196 (67) | 208 (56) | 241 (60) |
| S. hominis | 21 (8) | 22 (10) | 15 (5) | 35 (12) | 66 (18) | 49 (12) |
| S. haemolyticus | 20 (7) | 14 (7) | 24 (8) | 9 (3) | 18 (5) | 41 (10) |
| S. warneri | 18 (6) | 4 (2) | 7 (2) | 5 (2) | 14 (4) | 11 (3) |
| S. simulans | 13 (5) | 15 (7) | 9 (3) | 6 (2) | 4 (1) | 10 (3) |
| S. capitis | 6 (2) | 5 (2) | 7 (2) | 6 (2) | 9 (3) | 6 (2) |
| S. cohnii | 5 (2) | 0 | 5 (2) | 1 (0) | 1 (0) | 2 (0) |
| S. xylosus | 5 (2) | 9 (4) | 0 | 0 | 1 (0) | 2 (0) |
| S. saprophyticus | 0 | 0 | 3 (1) | 7 (2) | 19 (5) | 15 (4) |
| Otros | 3 (1) | 23 (11) | 31 (11) | 29 (10) | 29 (8) | 26 (6) |
ECN: estafilococos coagulasa negativos; S.: Staphylococcus.
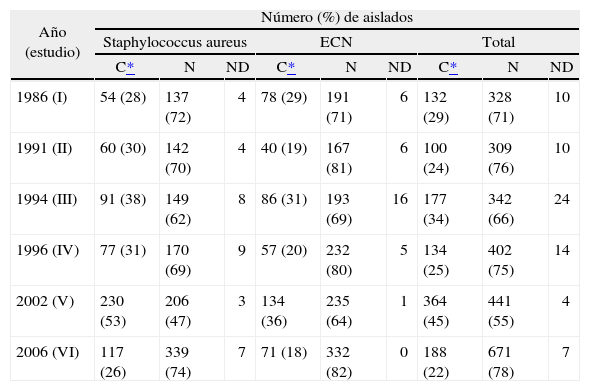
La distribución de cepas atendiendo al lugar de adquisición (comunitario o nosocomial) se muestra en la tabla 3. Se observó una disminución casi a la mitad en el número de aislados considerados como de origen comunitario respecto al quinto estudio. De un modo general, el porcentaje de aislados comunitarios fue del 22% (el 26% para S. aureus y el 18% para ECN). La proporción de cepas comunitarias frente a nosocomiales fue aproximadamente de 1:4.
Distribución de aislados por lugar de adquisición
| Año (estudio) | Número (%) de aislados | ||||||||
| Staphylococcus aureus | ECN | Total | |||||||
| C* | N | ND | C* | N | ND | C* | N | ND | |
| 1986 (I) | 54 (28) | 137 (72) | 4 | 78 (29) | 191 (71) | 6 | 132 (29) | 328 (71) | 10 |
| 1991 (II) | 60 (30) | 142 (70) | 4 | 40 (19) | 167 (81) | 6 | 100 (24) | 309 (76) | 10 |
| 1994 (III) | 91 (38) | 149 (62) | 8 | 86 (31) | 193 (69) | 16 | 177 (34) | 342 (66) | 24 |
| 1996 (IV) | 77 (31) | 170 (69) | 9 | 57 (20) | 232 (80) | 5 | 134 (25) | 402 (75) | 14 |
| 2002 (V) | 230 (53) | 206 (47) | 3 | 134 (36) | 235 (64) | 1 | 364 (45) | 441 (55) | 4 |
| 2006 (VI) | 117 (26) | 339 (74) | 7 | 71 (18) | 332 (82) | 0 | 188 (22) | 671 (78) | 7 |
C: comunitario; ECN: estafilococos coagulasa negativos; N: nosocomial; ND: no disponible.
En el sexto estudio, atendiendo al tamaño de hospital, la distribución del total de aislados de S. aureus fue del 42% para hospitales con menos de 500 camas, el 36% en hospitales de entre 500 y 1.000 camas y el 22% en hospitales de más de 1.000 camas. Los porcentajes equivalentes para ECN fueron del 37, el 45 y el 18%, respectivamente. Solamente se observó un aumento estadísticamente significativo en el número de aislados de S. aureus procedentes de hospitales con menos de 500 camas respecto al quinto estudio (el 32% en 2002 frente al 42% en 2006; p = 0,002).
Atendiendo al servicio de procedencia del paciente se observó que los clasificados como médicos o quirúrgicos aportaron un mayor número de aislados de estafilococos (el 31 y el 28%, respectivamente), si bien el número de camas hospitalarias en servicios de alto riesgo fue sensiblemente menor que en otros servicios. No se observaron cambios significativos en la evolución al comparar este estudio con los anteriores.
Los orígenes de la muestra clínica más frecuentes para S. aureus fueron las heridas (52,4%), seguido de las mucosas (13,8%), tracto respiratorio inferior (13,2%) y hemocultivos (8,3%). Solamente se detectó un incremento estadísticamente significativo para los aislados procedentes de heridas (el 45% en 2002 frente al 52% en 2006; p = 0,023). Haciendo el mismo análisis para ECN se observó un predominio de los aislados de sangre (37,0%), heridas (20,3%) y catéter (17,6%), aunque no se encontraron variaciones significativas respecto al quinto estudio de 2002.
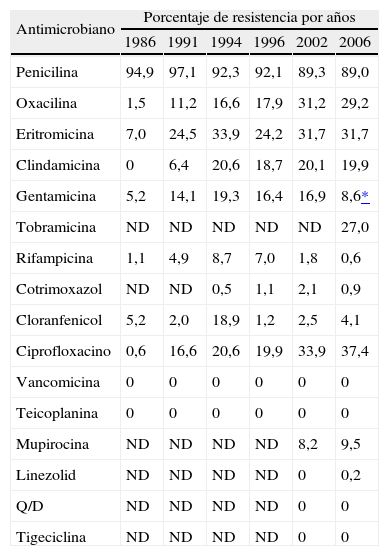
Evolución de la resistencia de Staphylococcus aureus a antimicrobianosLa resistencia de S. aureus a los diferentes antimicrobianos se muestra en la tabla 4. En este sexto estudio se ha observado una gran estabilidad respecto al estudio de 2002 en la resistencia a penicilina, oxacilina (el 29,2% en 2006, frente al 31,2% en 2002), eritromicina, clindamicina y ciprofloxacino. Sin embargo, ha disminuido significativamente la resistencia a gentamicina (el 16,9% en 2002 frente al 8,6% en 2006; p < 0,001). En el sexto estudio se observó la presencia de fenotipo M (resistencia a eritromicina y sensibilidad a clindamicina) en el 11,8% de las cepas de S. aureus. La resistencia a clindamicina en 2006 fue del 19,9% y se distribuyó de la siguiente forma: el 10,4% constitutiva y el 9,5% inducible. No se observó en ninguna cepa de S. aureus el patrón de resistencia a clindamicina y sensiblidad a eritromicina. La resistencia a tobramicina íue del 27,0% y la resistencia a mupirocina se mantuvo en cifras inferiores al 10%, similares a las obtenidas en el quinto estudio; así, todas las cepas con resistencia a mupirocina (41/44) mostraron resistencia de alto nivel a este antimicrobiano (> 128 mg/l). Rifampicina (el 0,6% de aislados resistentes) y cotrimoxazol (0,9%) siguen siendo antimicrobianos muy activos frente a S. aureus en nuestro medio, al igual que cloranfenicol (el 4,1% de aislados resistentes). Todos los aislados de S. aureus fueron uniformemente sensibles a glucopéptidos, a quinupristina/dalfopristina y a tigeciclina. Los valores (en mg/l) de concentración inhibitoria mínima para el 90% (CMI90) para vancomicina, teicoplanina, quinupristina/dalfopristina y tigeciclina fueron ≤ 1, ≤ 4, ≤ 1 y 0,19, respectivamente. Se encontró una cepa de S. aureus resistente a linezolid que se confirmó mediante E-test (CMI > 32 mg/l) y mediante amplificación por reacción en cadena de la polimerasa (PCR) del dominio V del 23S rRNA y posterior secuenciación, detectándose la presencia de la mutación G2576T previamente descrita25.
Evolución de la resistencia de Staphylococcus aureus a antimicrobianos (1986-2006)
| Antimicrobiano | Porcentaje de resistencia por años | |||||
| 1986 | 1991 | 1994 | 1996 | 2002 | 2006 | |
| Penicilina | 94,9 | 97,1 | 92,3 | 92,1 | 89,3 | 89,0 |
| Oxacilina | 1,5 | 11,2 | 16,6 | 17,9 | 31,2 | 29,2 |
| Eritromicina | 7,0 | 24,5 | 33,9 | 24,2 | 31,7 | 31,7 |
| Clindamicina | 0 | 6,4 | 20,6 | 18,7 | 20,1 | 19,9 |
| Gentamicina | 5,2 | 14,1 | 19,3 | 16,4 | 16,9 | 8,6* |
| Tobramicina | ND | ND | ND | ND | ND | 27,0 |
| Rifampicina | 1,1 | 4,9 | 8,7 | 7,0 | 1,8 | 0,6 |
| Cotrimoxazol | ND | ND | 0,5 | 1,1 | 2,1 | 0,9 |
| Cloranfenicol | 5,2 | 2,0 | 18,9 | 1,2 | 2,5 | 4,1 |
| Ciprofloxacino | 0,6 | 16,6 | 20,6 | 19,9 | 33,9 | 37,4 |
| Vancomicina | 0 | 0 | 0 | 0 | 0 | 0 |
| Teicoplanina | 0 | 0 | 0 | 0 | 0 | 0 |
| Mupirocina | ND | ND | ND | ND | 8,2 | 9,5 |
| Linezolid | ND | ND | ND | ND | 0 | 0,2 |
| Q/D | ND | ND | ND | ND | 0 | 0 |
| Tigeciclina | ND | ND | ND | ND | 0 | 0 |
ND: no determinado; Q/D: quinupristina/dalfopristina.
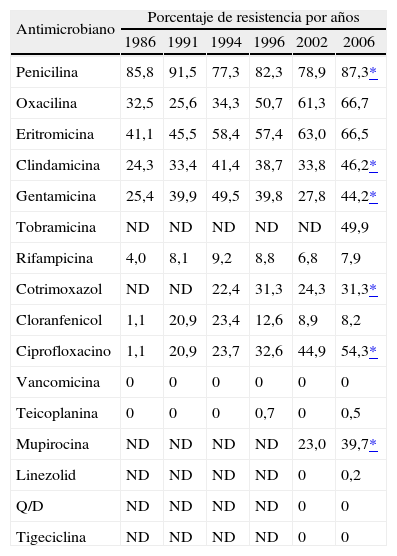
En el estudio de 2006 se ha producido un aumento significativo en la resistencia a penicilina respecto al estudio anterior (el 78,9 en 2002 frente al 87,3 en 2006; p = 0,002) (tabla 5). La resistencia a oxacilina se ha situado en el 66,7%, lo que constituye un aumento respecto al estudio anterior, aunque no significativo. La resistencia a eritromicina ha aumentado ligeramente (el 63,0% en 2002 frente al 66,5% en 2006), y se ha producido un aumento significativo en la resistencia de los ECN a clindamicina (el 33,8% en 2002 frente al 46,2% en 2006; p < 0,001), que fue constitutiva en el 31% e inducible en el 13,4%. Se detectó el fenotipo M en el 22,1% de las cepas de ECN, y el 1,8% presentaron el patrón de resistencia a clindamicina y sensibilidad a eritromicina. La resistencia de ECN a gentamicina aumentó significativamente desde el último estudio (el 27,8% en 2002 frente al 44,2% en 2006; p < 0,001) y prácticamente la mitad de las cepas mostraron resistencia a tobramicina. También se observó un aumento significativo en la resistencia de los ECN a ciprofloxacino, del 44,9% en 2002 al 54,3% en 2006 (p = 0,010), a cotrimoxazol (el 24,3% en 2002 frente al 31,3% en 2006; p = 0,037) y a mupirocina desde el 23,0% en 2002 hasta el 39,7% en 2006 (p < 0,001). Entre los aislados resistentes a mupirocina, el 94% presentó alto nivel de resistencia (CMI > 128 mg/l). La resistencia a rifampicina y a cloranfenicol fueron estables respecto al estudio anterior y muy poco frecuentes (el 7,9 y el 8,2%, respectivamente).
Evolución de la resistencia de estafilococos coagulasa negativos a antimicrobianos (1986-2006)
| Antimicrobiano | Porcentaje de resistencia por años | |||||
| 1986 | 1991 | 1994 | 1996 | 2002 | 2006 | |
| Penicilina | 85,8 | 91,5 | 77,3 | 82,3 | 78,9 | 87,3* |
| Oxacilina | 32,5 | 25,6 | 34,3 | 50,7 | 61,3 | 66,7 |
| Eritromicina | 41,1 | 45,5 | 58,4 | 57,4 | 63,0 | 66,5 |
| Clindamicina | 24,3 | 33,4 | 41,4 | 38,7 | 33,8 | 46,2* |
| Gentamicina | 25,4 | 39,9 | 49,5 | 39,8 | 27,8 | 44,2* |
| Tobramicina | ND | ND | ND | ND | ND | 49,9 |
| Rifampicina | 4,0 | 8,1 | 9,2 | 8,8 | 6,8 | 7,9 |
| Cotrimoxazol | ND | ND | 22,4 | 31,3 | 24,3 | 31,3* |
| Cloranfenicol | 1,1 | 20,9 | 23,4 | 12,6 | 8,9 | 8,2 |
| Ciprofloxacino | 1,1 | 20,9 | 23,7 | 32,6 | 44,9 | 54,3* |
| Vancomicina | 0 | 0 | 0 | 0 | 0 | 0 |
| Teicoplanina | 0 | 0 | 0 | 0,7 | 0 | 0,5 |
| Mupirocina | ND | ND | ND | ND | 23,0 | 39,7* |
| Linezolid | ND | ND | ND | ND | 0 | 0,2 |
| Q/D | ND | ND | ND | ND | 0 | 0 |
| Tigeciclina | ND | ND | ND | ND | 0 | 0 |
ND: no determinado; Q/D: quinupristina/dalíopristina.
Ningún aislado fue resistente a quinupristina/dalfopristina (CMI90 ≤ 1 mg/l) ni a tigeciclina (CMI90 = 0,25 mg/l). Se detectó una cepa de S. epidermidis con resistencia a linezolid (CMI > 32 mg/l) que se confirmó del mismo modo que la cepa resistente de S. aureus. Todos los ECN fueron uniformemente sensibles a vancomicina (CMI90 ≤ 1 mg/l), pero se encontraron dos cepas con sensibilidad disminuida a teicoplanina con valores de CMI = 16 mg/l (S. epidermidis y S. haemolyticus).
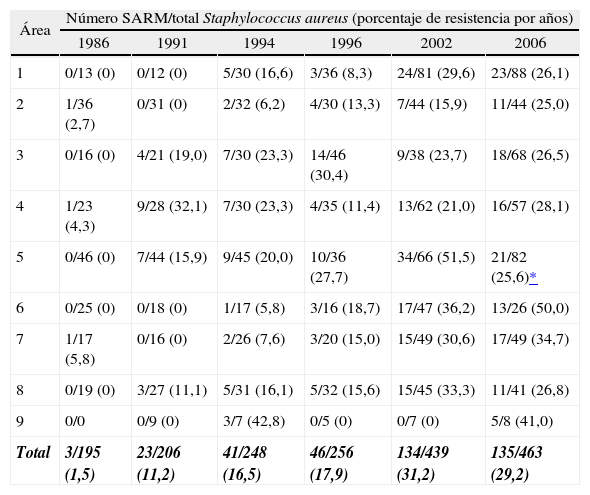
Staphylococcus aureus resistente a meticilina (SARM)Como ya se ha indicado anteriormente, la resistencia de S. aureus a oxacilina se ha mantenido prácticamente estable desde el año 2002 (31,2%) y en 2006 se ha situado en el 29,2% (tabla 4). En todas las áreas geográficas se detectó la presencia de SARM (tabla 6). Asimismo, se observó un aumento de la resistencia a oxacilina en 2006 respecto al estudio de 2002 en todas las áreas excepto en el área 1 (Galicia, Asturias, Cantabria), el área 5 (Madrid) y el área 8 (Andalucía, Ceuta y Melilla). En Madrid se ha producido una disminución estadísticamente significativa de la presencia de SARM (el 51,5% en 2002 frente al 25,6% en 2006; p = 0,002). En cuanto a la presencia de aislados de SARM en el medio extrahospitalario, las cifras encontradas en este sexto estudio demuestran estabilidad respecto al quinto (el 17,8% en 2002 frente al 17,9% en 2006). En cuanto a los porcentajes de SARM atendiendo al tamaño de hospital se observó que para hospitales de me nos de 500 camas la tasa de SARM fue 28,6% (el 28,8% en 2002), para hospitales de 500-1.000 camas fue el 29,8% (el 29,8% en 2002) y para hospitales de más de 1.000 camas fue el 29,1% (el 36,6% en 2002). Ninguna de estas variaciones fue estadísticamente significativa. El análisis por servicios hospitalarios demostró una disminución no significativa en el porcentaje de SARM para servicios médicos (el 35,4% en 2002 frente al 29,6% en 2006) de forma paralela a un aumento, tampoco significativo, en servicios de bajo riesgo (dermatología, oftalmología, obstetricia) (el 11,1% en 2002 frente al 17,3% en 2006). El porcentaje de cepas de SARM en servicios de alto riesgo (UCI) y quirúrgicos no experimentó variaciones significativas entre 2002 y 2006 (el 34,1% en 2002 frente al 36,1% en 2006 y el 34,6% en 2002 frente al 33,6% en 2006, respectivamente). No se observan variaciones significativas de la prevalencia de SARM en función de la muestra clínica en el estudio del año 2006 respecto al estudio del año 2002. La distribución en los dos últimos estudios es prácticamente idéntica, con una amplia mayoría de muestras de SARM procedentes de exudados de herida (el 42,6% en 2002 frente al 45,2% en 2006), seguida de muestras del tracto respiratorio (el 15,7% en 2002 frente al 17,8% en 2006). Los porcentajes de SARM en muestras de sangre y catéter son inferiores al 10% en ambos estudios (el 9,7% en 2002 frente al 7,4% en 2006 y el 6,7% en 2002 frente al 2,2% en 2006, respectivamente).
Distribución de Staphylococcus aureus resistente a meticilina por áreas geográficas (1986-2006)
| Área | Número SARM/total Staphylococcus aureus (porcentaje de resistencia por años) | |||||
| 1986 | 1991 | 1994 | 1996 | 2002 | 2006 | |
| 1 | 0/13 (0) | 0/12 (0) | 5/30 (16,6) | 3/36 (8,3) | 24/81 (29,6) | 23/88 (26,1) |
| 2 | 1/36 (2,7) | 0/31 (0) | 2/32 (6,2) | 4/30 (13,3) | 7/44 (15,9) | 11/44 (25,0) |
| 3 | 0/16 (0) | 4/21 (19,0) | 7/30 (23,3) | 14/46 (30,4) | 9/38 (23,7) | 18/68 (26,5) |
| 4 | 1/23 (4,3) | 9/28 (32,1) | 7/30 (23,3) | 4/35 (11,4) | 13/62 (21,0) | 16/57 (28,1) |
| 5 | 0/46 (0) | 7/44 (15,9) | 9/45 (20,0) | 10/36 (27,7) | 34/66 (51,5) | 21/82 (25,6)* |
| 6 | 0/25 (0) | 0/18 (0) | 1/17 (5,8) | 3/16 (18,7) | 17/47 (36,2) | 13/26 (50,0) |
| 7 | 1/17 (5,8) | 0/16 (0) | 2/26 (7,6) | 3/20 (15,0) | 15/49 (30,6) | 17/49 (34,7) |
| 8 | 0/19 (0) | 3/27 (11,1) | 5/31 (16,1) | 5/32 (15,6) | 15/45 (33,3) | 11/41 (26,8) |
| 9 | 0/0 | 0/9 (0) | 3/7 (42,8) | 0/5 (0) | 0/7 (0) | 5/8 (41,0) |
| Total | 3/195 (1,5) | 23/206 (11,2) | 41/248 (16,5) | 46/256 (17,9) | 134/439 (31,2) | 135/463 (29,2) |
Área 1: Galicia, Asturias, Cantabria; área 2: País Vasco, La Rioja, Navarra; área 3: Cataluña; área 4: Valencia, Murcia, Islas Baleares; área 5: Madrid; área 6: Aragón, Castilla-La Mancha; área 7; Castilla y León, Extremadura; área 8: Andalucía, Ceuta, Melilla; área 9: Islas Canarias. SARM: Staphylococcus aureus resistente a meticilina.
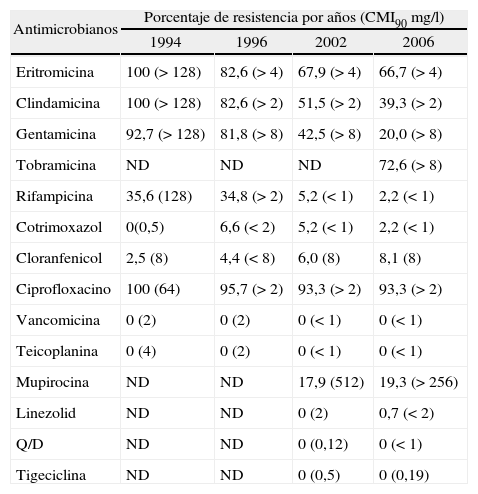
En cuanto a las cifras de resistencia de aislados de SARM a otros antimicrobianos se observó una disminución significativa en la resistencia a clindamicina (el 51,5% en 2002 frente al 39,3% en 2006; p = 0,050) (tabla 7). La resistencia a clindamicina en las cepas de SARM se distribuyó de la siguiente manera (2002 frente al 2006): constitutiva el 44,0 frente al 29,6% (p = 0,016); inducible el 7,5 frente al 9,7% y fenotipo M 16,4 frente al 27,4% (p = 0,039). También se observó una disminución significativa en la resistencia a gentamicina (el 42,5% en 2002 frente al 20,0% en 2006; p < 0,001). La resistencia a tobramicina en 2006 fue elevada (72,6%), aunque no se dispone de las cifras de anteriores estudios para comparar. La resistencia al resto de los antimicrobianos evaluados se mantuvo estable sin cambios significativos.
Evolución de la resistencia de Staphylococcus aureus resistente a meticilina a antimicrobianos (1994-2006)
| Antimicrobianos | Porcentaje de resistencia por años (CMI90 mg/l) | |||
| 1994 | 1996 | 2002 | 2006 | |
| Eritromicina | 100 (> 128) | 82,6 (> 4) | 67,9 (> 4) | 66,7 (> 4) |
| Clindamicina | 100 (> 128) | 82,6 (> 2) | 51,5 (> 2) | 39,3 (> 2) |
| Gentamicina | 92,7 (> 128) | 81,8 (> 8) | 42,5 (> 8) | 20,0 (> 8) |
| Tobramicina | ND | ND | ND | 72,6 (> 8) |
| Rifampicina | 35,6 (128) | 34,8 (> 2) | 5,2 (< 1) | 2,2 (< 1) |
| Cotrimoxazol | 0(0,5) | 6,6 (< 2) | 5,2 (< 1) | 2,2 (< 1) |
| Cloranfenicol | 2,5 (8) | 4,4 (< 8) | 6,0 (8) | 8,1 (8) |
| Ciprofloxacino | 100 (64) | 95,7 (> 2) | 93,3 (> 2) | 93,3 (> 2) |
| Vancomicina | 0 (2) | 0 (2) | 0 (< 1) | 0 (< 1) |
| Teicoplanina | 0 (4) | 0 (2) | 0 (< 1) | 0 (< 1) |
| Mupirocina | ND | ND | 17,9 (512) | 19,3 (> 256) |
| Linezolid | ND | ND | 0 (2) | 0,7 (< 2) |
| Q/D | ND | ND | 0 (0,12) | 0 (< 1) |
| Tigeciclina | ND | ND | 0 (0,5) | 0 (0,19) |
CMI90: concentración mínima inhibitoria frente al 90% de las cepas;
ND: no determinado; Q/D: quinupristina/dalfopristina;
SARM: Staphylococcus aureus resistente a meticilina.
Todos los aislados de SARM fueron uniformemente sensibles a vancomicina con CMI < 4 mg/l y sólo seis cepas (4,4%) presentaron CMI de 2 mg/l (dos de ellas fueron aislados de hemocultivos). También fueron sensibles a teicoplanina, quinupristina/dalfopristina y tigeciclina y se detectó una cepa resistente a linezolid que supuso el 0,7%. Asimismo, los aislados de SARM presentaron unas cifras de resistencia a mupirocina superiores a las del estudio anterior aunque no alcanzaron significación estadística (el 17,9% en 2002 frente al 19,3% en 2006; p = 0,876).
DiscusiónLos estudios de prevalencia tienen limitaciones en cuanto al análisis de la evolución o de la tendencia a largo plazo de las variables en estudio. Sin embargo, presentan las ventajas añadidas de la facilidad en su diseño, rapidez en la ejecución y menor coste económico que los estudios longitudinales. El inconveniente queda minimizado cuando se realizan varios estudios concretos a lo largo del tiempo que permiten obtener una idea general de la tendencia de la resistencia en un intervalo de tiempo amplio y para un número elevado de hospitales16-20.
En los seis estudios realizados por este grupo de trabajo a lo largo de las dos últimas décadas se ha observado que la proporción de cepas de S. aureus y ECN obtenidas se ha mantenido cercana a 1:1. En estos estudios se ha observado que la mayor parte de los ECN de origen intrahospitalario proceden de muestras de sangre, catéteres intravenosos y heridas, hecho que demuestra que estos microorganismos tienen un papel importante en la etiología de las infecciones nosocomiales, como se ha demostrado en otros estudios2,26. Como cabría esperar, la especie S. epidermidis es la más frecuentemente aislada, seguida de Staphylococcus hominis, ya que se trata de las dos especies más frecuentes en la microbiota de la piel humana2,27. En el caso de S. aureus, se ha producido un aumento significativo en el número de aislados procedentes de heridas y mucosas, que al igual que en otros estudios, indica que las infecciones de piel y partes blandas son las más frecuentemente producidas por esta especie28. Resulta llamativa la disminución a la mitad en el número de aislados considerados como comunitarios tanto de S. aureus como de ECN respecto al estudio anterior (tabla 3), circunstancia que puede ser debida a la aplicación en este sexto estudio de criterios más estrictos a la hora de considerar los aislados verdaderos comunitarios y probablemente a la inclusión entre los aislados nosocomiales de aquéllos no estrictamente hospitalarios pero sí relacionados con la atención sanitaria.
En cuanto a la resistencia a antimicrobianos de S. aureus es de destacar una gran estabilidad en los últimos 4 años. Un aspecto importante es la estabilización del porcentaje de resistencia de S. aureus a oxacilina, y se ha observado incluso un ligero descenso en 2006 respecto a 2002. Mientras que en los cinco estudios previos (1986-2002) la resistencia a oxacilina aumentó desde el 1,5 hasta el 31,2%, en el estudio de 2006 el valor se situó en el 29,2%, marcando así un punto de inflexión y rompiendo la tendencia creciente observada desde 1986. En algunos países europeos esta resistencia es más elevada que en España (en torno al 40% en Bélgica, Grecia, Irlanda y Reino Unido). Sin embargo, en otros (Dinamarca, Finlandia), la resistencia es inferior, presentando incluso tasas del 0,6% en Suecia29. Datos similares ha mostrado el European Antimicrobial Resistance Surveillance System (EARSS) en su último informe general30, que aunque únicamente analiza aislados procedentes de bacteriemia, los datos son extrapolables a los de nuestro estudio. En algunos países, como Francia y Eslovenia, también se ha detectado una tendencia decreciente de cepas de SARM en los últimos 5 años30.
Otros datos importantes destacables son el mantenimiento de la actividad casi universal de rifampicina y cotrimoxazol, el descenso significativo de la resistencia de S. aureus a gentamicina (8,6%), cifra similar a la obtenida en el primer estudio de 1986, y el aumento paulatino de la resistencia a ciprofloxacino, superando actualmente el 37%. A pesar de la creciente descripción de casos de aislados de S. aureus con sensibilidad disminuida a glucopéptidos en diversos lugares del mundo6,7,31-33, en este estudio no se ha detectado ningún aislado con estas características. Del mismo modo, la actividad de quinupristina/dalfopristina ha sido uniforme frente a todos los aislados estudiados así como la de tigeciclina, que presentó una gran actividad (CMI90 = 0,19 mg/l). Sin embargo, se detectó una cepa resistente a linezolid, lo que puede indicar la creciente utilización de este antimicrobiano en nuestros hospitales.
Uno de los aspectos más preocupantes de la infección estafilocócica es la diseminación de cepas de SARM en el medio extrahospitalario. En el quinto estudio la presencia de cepas de SARM en este medio alcanzó el 17,8%20,34. En 2006 continúa la misma problemática, si bien el porcentaje se ha mantenido prácticamente en el mismo valor (17,9%). No obstante, sólo cuatro cepas fueron resistentes a oxacilina (y antibióticos betalactámicos) y sensibles al resto de antimicrobianos (dos procedentes de exudados de herida, una de hemocultivo y otra de orina) y en todas ellas la determinación de toxina de Panton-Valentine resultó ser negativa. Todos estos datos obligan a pensar que la estimación indirecta en función de estas características no es suficiente y se requiere información epidemiológica adicional para la correcta clasificación como cepas comunitarias o nosocomiales. Aunque en los últimos años SARM ha surgido como un importante patógeno comunitario en muchos países3, en nuestro estudio no podemos considerar el mencionado 17,9% de los casos como verdaderamente comunitarios, ya que se trata de cepas multirresistentes que corresponden a pacientes no hospitalizados pero relacionados con la atención sanitaria. Además, teniendo en cuenta que solamente se disponía de la información epidemiológica del microbiólogo de cada centro, es posible que se hayan clasificado erróneamente como comunitarios algunos aislados relacionados con la asistencia sanitaria (especialmente en los primeros estudios). En cualquier caso, se debe realizar una vigilancia activa en el medio extrahospitalario, ya que la presencia de aislados de SARM verdaderamente comunitarios ya ha sido comunicada en España en diversos estudios35-38. A pesar de la elevada tasa de SARM en el medio extrahospitalario, este microorganismo sigue siendo principalmente nosocomial, como demuestran los datos de este estudio, aunque en los últimos años su presencia en los hospitales se ha estabilizado e incluso ha disminuido significativamente como en el área de Madrid. En cuanto a la sensibilidad de los aislados de SARM a otros antimicrobianos es de destacar que en el momento actual los SARM en nuestro medio son más sensibles que en anteriores estudios, principalmente a clindamicina y a gentamicina. Sin embargo, presentan unas tasas elevadas de resistencia a tobramicina. La resistencia a tobramicina y sensibilidad a gentamicina es probablemente debida a la diseminación actual del gen ant4' como ocurre en otros países39. En este sexto estudio todos los aislados de SARM fueron sensibles a vancomicina, y este antimicrobiano sigue constituyendo uno de los tratamientos de elección en las infecciones producidas por este microorganismo. No obstante, la existencia en nuestro país de aislados de SARM frente a los cuales la CMI de vancomicina es de 2 mg/l puede comprometer su utilidad en el tratamiento de infecciones graves. Del mismo modo, en los últimos años se han desarrollado nuevos agentes antimicrobianos como quinupristina-dalfopristina, linezolid y tigeciclina que constituyen nuevas alternativas terapéuticas40,41. En este estudio estos antimicrobianos presentaron una excelente actividad frente a SARM, aunque un aislado fue resistente a linezolid.
En el caso de los ECN, a diferencia de lo que ha sucedido con S. aureus, es de destacar el aumento progresivo de la resistencia a penicilina y a oxacilina (66,7%), junto con la resistencia a eritromicina, clindamicina, gentamicina, ciprofloxacino, cotrimoxazol y mupirocina. Estos datos son similares a los obtenidos en otros estudios multicéntricos realizados en España, como es el caso de estudio VIRA 2006, en el que se detectó una tasa de resistencia a oxacilina del 70,6% en cepas de ECN42 y el estudio EARSS43 en el que la tasa de resistencia de S. aureus a oxacilina en el período 2000-2002 en aislados de bacteriemia fue del 24,5%. Paralelamente al aumento de cepas multirresistentes se ha observado un aumento de los aislados de origen nosocomial que explicaría en parte este hecho, ya que la utilización de antimicrobianos de amplio espectro en los hospitales puede seleccionar cepas multirresistentes en la microbiota de la piel que posteriormente serían las causantes de las infecciones44. De todos modos, disponemos de alternativas terapéuticas, ya que todos los aislados fueron sensibles a vancomicina, quinupristina-dalfopristina y tigeciclina. Al igual que en el caso de S. aureus, también se detectó un aislado de S. epidermidis resistente a linezolid, resistencia que podría estar asociada a la utilización cada vez mayor de este antimicrobiano, como se ha demostrado en algunos estudios45. Dos cepas presentaron sensibilidad disminuida a teicoplanina, hecho que también se detectó en 1996 en el cuarto estudio19 y cuya frecuencia ha llegado a ser elevada en algunos hospitales españoles8.
Los resultados obtenidos en este estudio y en los cinco anteriores demuestran que los estudios de prevalencia constituyen un excelente método para determinar la situación de la resistencia en el ámbito nacional, con una metodología sencilla y económicamente asequible. Por ello, sería deseable realizar este tipo de estudios de forma continuada a intervalos regulares de tiempo, a fin de conocer los patrones de resistencia más habituales que permitan instaurar tratamientos empíricos adecuados y poder tomar medidas epidemiológicas eficaces para controlar la diseminación de cepas multirresistentes.
AgradecimientosEl coste del transporte de cepas y del material de laboratorio necesario para su estudio ha sido financiado por Wyeth-Farma.
Miembros del Grupo Español para el Estudio de Estafilococos y coautores de este estudioAndalucía: Adolfo Sicilia, Armando Reyes (Hospital de Torrecárdenas, Almería); Juan García Herruzo, Pilar Marín (Hospital Universitario Puerta del Mar, Cádiz); Inés Ruiz (Hospital Punta de Europa, Algeciras); Luis Calbo, José Luis de Francisco Ramírez (Hospital de Jerez de La Frontera, Cádiz); Eustaquio Arrimadas, Antonio Sánchez Porto (Hospital de La Línea de La Concepción, Cádiz); Manuel Casal, Manuel Causse del Río (Hospital Universitario Reina Sofía, Córdoba); Carlos Plata, Rocío Tejero (Hospital Infanta Margarita, Cabra, Córdoba); Manuel de la Rosa, M.a Fe Bautista (Hospital Universitario Virgen de las Nieves, Granada); Carmen Maroto, Trinidad Escobar (Hospital Universitario San Cecilio, Granada); Lucía Pascual, José Saavedra (Hospital Juan Ramón Jiménez, Huelva); Inocente Cuesta, Inmaculada Carazo (Hospital Universitario de Jaén); Juan Hernández Molina (Hospital Regional Carlos Haya, Málaga); Alfonso Pinedo, Ma Victoria García, Mar Gallardo (Hospital Virgen de la Victoria, Málaga); Alvaro Pascual, Marina de Cueto, Evelio Perea (Hospital Virgen Macarena, Sevilla); Javier Aznar, María de Toro Crespo (Hospital Universitario Virgen del Rocío, Sevilla); Estrella Martín Mazuelos, José Luis García López (Hospital Nuestra Señora de Valme, Dos Hermanas, Sevilla). Aragón: Miguel Ferrero (Hospital General San Jorge, Huesca); Pilar Chocarro (Hospital Obispo Polanco, Teruel); Carmen Navarro, Luis Torres (Hospital de Alcañiz, Teruel); Cristina Miñana (Hospital Nuestra Señora de Gracia, Zaragoza); Ma José Revillo, Antonio Rezusta (Hospital Miguel Servet, Zaragoza); Carmen Rubio, Estrella Durán (Hospital Clínico Universitario Lozano Blesa, Zaragoza). Asturias: Fernando Vázquez, Carlos Aranaz (Hospital Monte Naranco, Oviedo); Ma Jesús Santos, Ana Fleites, Marta Lantero (Hospital Central de Asturias, Oviedo); Isabel Sánchez Folgueras (Instituto Nacional de Silicosis, Oviedo); Elisa Hidalgo (Fundación Hospital de Jove, Gijón); Luis Otero, Ma Dolores Miguel (Hospital de Cabueñes, Gijón); Pilar Prendes, Ma Carmen Galarraga, Gema Sierra (Hospital San Agustín, Avilés); Pedro de la Iglesia (Hospital Comarcal de Jarrio); José Francisco Ordás, Lucía Barreiro (Hospital Carmen y Severo Ochoa, Cangas de Narcea). Baleares: José Luis Pérez, Nuria Borrell, Antonio Oliver (Hospital Son Dureta, Palma de Mallorca); Javier Sánchez Gómez, Adoración Hurtado (Hospital Can Misses, Ibiza). Canarias: Nínive Batista, Isabel Gutiérrez González (Hospital Nuestra Señora de La Candelaria, Santa Cruz de Tenerife); Antonio Sierra, Ma Antonia Miguel Gómez (Hospital Universitario de Canarias, La Laguna);Antonio Manuel Martín, Araceli Hernández (Hospital Universitario Insular de Gran Canaria, Las Palmas de Gran Canaria). Cantabria: Luis Martínez Martínez, Ana Belén Campo, Celia García de la Fuente (Hospital Marqués de Valdecilla, Santander); Purificación Mellado (Hospital Comarcal de Laredo). Castilla-La Mancha: Ma Dolores Crespo, Elena Escribano, Juan José Palomar (Complejo Hospitalario Universitario de Albacete); Ma Dolores Romero, Sonia Solís (Hospital General de Ciudad Real); Rafael Carranza (Hospital General La Mancha-Centro, Alcázar de San Juan, Ciudad Real); Carmen Martínez Medina, Germán Seseña (Hospital Virgen de la Luz, Cuenca); Julia Bisquert, Daniel Tena (Hospital Universitario de Guadalajara); Luis Díaz Pierna, Ma Victoria Martino Castañar (Hospital Virgen de la Salud, Toledo); Ana Ma Leturia (Hospital Nacional de Parapléjicos, Toledo). Castilla y León: Rosario Ibáñez, Rafael Sánchez Arroyo (Hospital Nuestra Señora de Sonsoles, Avila); Isidro Pozas, Eva Ojeda, Gregoria Mejías (Hospital General Yagüe, Burgos); Carmen Lizondo, Ma Dolores Badía (Hospital Provincial Divino Vallés, Burgos); Carmen Gimeno (Hospital Comarcal Santiago Apóstol, Miranda de Ebro, Burgos); Sonia Junquera (Hospital Santos Reyes, Aranda de Duero, Burgos); Felipe Cachón, M.a Isabel Fernández Natal (Hospital de León); Carlos Fuster (Hospital del Bierzo, Ponferrada, León); Elena Álvarez Alonso, Ma Antonia García Castro (Complejo Hospitalario Río Carrión, Palencia); José Elías García Sánchez, José Angel García Rodríguez, Marta Fernández Vázquez (Hospital Clínico de Salamanca); Santiago García Carbajosa, Pablo Carrero, Susana Hernando Real (Hospital General de Segovia); Angel Campos, Ana Betrán, Carmen Aldea (Complejo Hospitalario de Soria); Pilar Pérez Pascual, Armando Alberte (Hospital Universitario Río Hortera, Valladolid); Antonio Rodríguez Torres, Miguel Ángel Bratos (Hospital Universitario de Valladolid); Belén Lorenzo (Hospital de Medina del Campo, Valladolid); M.a Fe Brezmes, Luis López Urrutia (Hospital Virgen de la Concha, Zamora). Cataluña: Guillem Prats (Hospital Vall d'Hebron, Barcelona); Ma Teresa Jiménez de Anta, Francesc Marco (Hospital Clínic i Provincial de Barcelona); Pere Coll, Beatriz Mirelis (Hospital de la Santa Creu i Sant Pau, Barcelona); Anna Vilamala, Carmina San José (Hospital Comarcal Alt Penedes, Barcelona); Rogelio Martín, Fe Tubau (Hospital Universitario de Bellvitge, Hospitalet de Llobregatm Barcelona); Margarita Salvadó, Araceli González (Laboratorio de Referencia de Cataluña-Hospital del Mar, Hospitalet Llobregat, Barcelona); Dolores Dionisia Fontanals (Corporación Sanitaria del Parc Taulí, Sabadell, Barcelona); Josep Lite (Hospital Mutua de Terrassa, Barcelona); Francisca Corcoy, Roser Angrill (Residencia Sant Camil, Sant Pere de Ribes, Barcelona); Monserrat Morta, Dolors Estivill (Hospital San Joan de Deu, Manresa, Barcelona); Ma Luisa Urcuola (Hospital Provincial de Santa Caterina, Gerona); Jordi de Batlle Surroca, Montserrat Motje (Hospital Universitario Doctor Josep Trueta, Gerona); Antoni Nogues, Mercé García (Hospital Universitari Arnau de Vilanova, Lérida); Josep Ma Santamaría, Frederic Gómez, J. Tapiol (Hospital Universitario Joan XXIII, Tarragona). Ceuta: José López Barba (Hospital Cruz Roja de Ceuta). Extremadura: Javier Blanco (Hospital Universitario Infanta Cristina, Badajoz); Pilar Teno, Jesús Viñuelas (Hospital San Pedro de Alcántara, Cáceres). Galicia: Rosa Villanueva, Ana Fernández González (Complejo Hospitalario Universitario Juan Canalejo, La Coruña); Manuel Rodríguez Jove (Hospital General Juan Cardona, El Ferrol, La Coruña); Andrés Agulla, María Rodríguez Mayo (Complejo Hospitalario Arquitecto Marcide-Novoa Santos, El Ferrol, La Coruña); Prof. Benito Regueiro, Fernanda Pardo (Hospital Clínico Universitario de Santiago de Compostela, La Coruña); Pilar Alonso, Amparo Coira (Complejo Hospitalario Xeral-Calde, Lugo); Gloria Esteban, Begoña Fernández Pérez (Complejo Hospitalario de Ourense); Patrícia Álvarez García (Complejo Hospitalario de Ponteve Marta García Campello); Teresa González del Blanco, Isabel Otero (Complejo Hospitalario Xeral-Cies, Vigo, Pontevedra); Julio Torres, Francisco José Vasallo (Hospital do Meixoeiro, Vigo, Pontevedra); Ponteve Joaquina Sevillano, Irene Rodríguez Conde (Policlínico de Vigo-POVISA). La Rioja: Luis Borque, Inés Olarte, Estibaliz Ugalde (Hospital San Millán, Logroño). Madrid: Emilio Bouza, Emilia Cercenado, Oscar Cuevas (Hospital General Universitario Gregorio Marañón); Avelino Gutiérrez, Adela García Perea (Hospital La Paz); Joaquín Rodríguez Otero, Fernando Chaves (Hospital Universitario 12 de Octubre); Ignacio Gadea, Ricardo Fernández Roblas (Fundación Jiménez Díaz); Francisco Hervás, Ma Victoria Buezas, Paloma Sánchez Santana (Hospital Central de la Defensa); Juan José Picazo, Paloma Merino (Hospital Clínico San Carlos, Madrid); Fernando Baquero, Ma Isabel Morosini (Hospital Ramón y Cajal); Carmen Pazos (Hospital Santa Cristina); Margarita Baquero, Ana Ma Enríquez (Hospital Carlos III); Diego Dámaso, Isabel Sánchez Romero (Hospital Puerta de Hierro); Manuel López Brea, Teresa Alarcón (Hospital Universitario de la Princesa);
Rosario Cortés, Ma Victoria Portús (Hospital de la Cruz Roja); Amalia de Urmeneta (Hospital de Cantoblanco); María Beltrán, Rosa González (Hospital Príncipe de Asturias, Alcalá de Henares); José Luis Gómez Garcés, Liliana Vargas (Hospital General de Móstoles); Almudena Burillo, Esteban Aznar (Hospital de Madrid); Almudena Burillo, Aida Sánchez (Hospital de Madrid, Montepríncipe); Almudena Burillo, Alicia Rico (Hospital de Madrid, Torrelodones); Isabel Wilhelmi, Concepción Gómez Criado (Hospital Severo Ochoa, Leganés); Alberto Delgado, José Valverde (Fundación Hospital de Alcorcón); Juan Ignacio Alós, Margarita Sánchez Concheiro (Hospital Universitario de Getafe). Melilla: Ma Isabel Galán (Hospital Comarcal de Melilla); Juan Antonio Tur Sánchez (Hospital Militar Pages). Murcia: Cristobal Ramírez, Carmen Guerrero (Hospital Morales Meseguer, Murcia); Manuel Segovia, Genoveva Yagüe, Ana Menasalvas (Hospital Universitario Virgen de la Arrixaca, El Palmar). Navarra: Víctor Martínez de Artola, Xavier Beristain (Hospital Virgen del Camino, Pamplona); Coro Pina, Ana Fontaneda (Hospital San Juan de Dios, Pamplona); Inés Dorronsoro, José Javier García Irure (Hospital de Navarra, Pamplona); José Leiva, Silvia Hernáez (Clínica Universitaria de Navarra, Pamplona). País Vasco: Emilio Pérez Trallero, José M.a García Arenzana (Hospital Donostia, San Sebastián, Guipúzcoa); José Antonio Jiménez Alfaro, Borja Redondo (Policlínica Gipuzkoa, San Sebastián, Guipúzcoa); Lourdes Arteche, Ana Iturzaeta, Aitziber Aguinaga (Hospital de Zumárraga, Guizpúzcoa); Ramón Cisterna, Karmele Ibarra (Hospital de Basurto, Bilbao, Vizcaya); Felicitas Calvo (Hospital de Santa Marina, Bilbao, Vizcaya); Ignacio Corral, Luis Elorduy, Inés Martínez Rienda (Hospital San Eloy, Baracaldo, Vizcaya); Ma José López de Goikoetxea (Hospital de Galdakao, Vizcaya); Lourdes Michaus, A. Perales (Hospital Txagorritxu, Vitoria); Alicia Labora, Andrés Canut (Hospital Santiago Apóstol, Vitoria). Valencia: Joaquín Plazas, Mariano Andreu López (Hospital General Universitario de Alicante); Victoria Ortiz de la Tabla, Alfredo Zorraquino (Hospital de San Juan, Alicante); Nieves Gonzalo (Hospital de la Vega Baja, Orihuela, Alicante); Victoria Sánchez, Encarna Fuentes (Hospital de Elda, Alicante); Gloria Royo, Pilar López (Hospital General Universitario de Elche, Alicante); Rosario Moreno, Alfonso García del Busto (Hospital General de Castellón); Alberto Yagüe (Hospital La Plana, Villareal, Castellón); Manuel Gobernado, José Luis López Hontangas (Hospital Universitario La Fe, Valencia); Juan García de Lomas, Nuria Tormo, Tomás García Lozano (Hospital Clínico Universitario de Valencia); Joaquín Maiquez (Instituto Valenciano de Oncología, Valencia); José Miguel Nogueira, Manuel Canós (Hospital Peset, Valencia); Ma Rosario Llucián (Consorcio Hospitalario General Universitario de Valencia); Ana Ma Lloret, Montserrat Bosque (Hospital Arnau de Vilanova, Valencia); Antonio Guerrero, Javier Colomina (Hospital de la Ribera, Alzira, Valencia); José Ma García Aguayo (Hospital de Requena, Valencia); Luis Andreu Miguel, Ma Carmen Alonso Jiménez (Hospital Francisco de Borja, Gandía, Valencia); Rosa Ma Ferreruela (Hospital Lluís Alcanyís, Xativa, Valencia); José Luis Hernández Tintorer, Ignacio Vírseda (Hospital General Básico de la Defensa, Quart Poblet, Valencia); Josep Prat Fornells, Rosa Escoms (Hospital de Sagunto, Valencia); Salvador Giner (Hospital Moliner, Serra, Valencia).