Es frecuente que la suspensión de aporte de tiroxina como preparación para un rastreo-ablación se prolongue durante 4 semanas, en las que es habitual la aparición de clínica de hipotiroidismo. Una alternativa útil en algunos casos es utilizar TSHhr, pero sus problemas de disponibilidad durante el año 2012 limitarán su uso.
Pacientes y métodosSe realizó un análisis de la concentración de TSH y T4 libre en los días 7, 14, 21 y 28 desde el momento de la realización de una tiroidectomía total (12 pacientes) o desde la suspensión del tratamiento con tiroxina (20 pacientes). Se usó el test de Mann Wittney para analizar las comparaciones de variables cuantitativas y el Chi-cuadrado para las nominales.
ResultadosEn el día 14, la concentración plasmática de TSH fue igual o superior a 30μUI/mL en el 71% de los pacientes (66% de los del grupo de tiroidectomía y en el 75% de los del grupo de suspensión de tratamiento). En el día 21 esta condición la cumplía la práctica totalidad de los pacientes (el 91% en el grupo de tiroidectomía y el 100% en el grupo de suspensión de tratamiento). En el día 14, la mayoría de los pacientes de ambos grupos tenían un hipotiroidismo franco, con una concentración de T4L inferior a lo normal.
ConclusionesNo es necesario prolongar el tiempo sin aporte de tiroxina durante 4 semanas. Catorce días es suficiente en la mayoría de los pacientes, y 21 días lo es en prácticamente todos.
It is a usual practice to discontinue thyroxine treatment for four weeks before 131I ablation. Symptoms of hypothyroidism usually occur during this time. Use of rhTSH is a helpful alternative in some cases, but problems of availability of this agent during 2012 will limit its use.
Patients and methodsPlasma TSH and FT4 levels were measured on days 7, 14, 21, and 28 after total thyroidectomy (12 patients) or discontinuation of thyroxine treatment (20 patients). A Mann-Whitney U test was used to compare quantitative variables, and a Chi-square test was used for nominal variables.
ResultsOn day 14, TSH levels were 30μIU/mL of higher in 71% of patients (66% in the thyroidectomy group and 75% in the group discontinued thyroxine treatment). On day 21, almost all patients from both groups (91% in the thyroidectomy group and 100% in the group discontinued thyroxine treatment) had TSH levels of 30μIU/mL or higher. On day 14, most patients in both groups had FT4 levels below the normal range.
ConclusionsDiscontinuation of thyroxine treatment for four weeks is not required. Fourteen days is an adequate time in most patients, and 21 days are sufficient in virtually all patients.
El radioyodo (I131) es el principal complemento de la cirugía en el tratamiento del cáncer diferenciado de tiroides. Se utiliza con dos objetivos: la localización gammagráfica de tejido capaz de captar el isótopo, y su ablación tanto si ese tejido es un resto de tiroides sano como si es tumoral1.
La gammagrafía se realiza 48-72 horas después de administrar entre 2 y 5 mCi de I131. Y la ablación utilizando entre 30 y 150 mCi del isótopo si el remanente es tiroides sano2,3, y entre 150 y 200 mCi si es tejido tumoral residual o metastásico4. La dosis ablativa de I131 permite realizar una gammagrafía de cuerpo entero entre 2 y 8 días después, e identifica focos de captación no visibles con dosis menores en hasta un 20% de los casos5,6. Esta secuencia descrita de gammagrafía-ablación-gammagrafía (llamada genéricamente rastreo-ablación) puede repetirse cada 6-12 meses si se demuestra la persistencia de tejido captante a pesar de ablaciones previas, y recomendaciones recientes sugieren que la primera de las gammagrafías se haga solamente en los casos en los que no se conozca la extensión real de la tiroidectomía, bien por el informe quirúrgico o por el de la ecografía7
La eficacia del I131 como trazador y como ablativo depende de 4 factores: la histología del tumor, la localización del tejido, la dosis de I131 administrada y la preparación del paciente:
Histología del tumor: el I131 es útil solamente en los tumores tiroideos de origen folicular bien diferenciados (lo que excluye su uso en carcinomas medulares, anaplásicos y linfomas tiroideos). La capacidad captante de carcinomas papilares y foliculares es similar8, aunque ciertos subtipos como el carcinoma folicular oxifílico (comunmente llamado de células de Hürtle), el carcinoma papilar de células altas y los carcinomas poco diferenciados lo captan con menos avidez.
Localización del tejido: el tejido tiroideo sano remanente tras una tiroidectomía tiene mayor capacidad captante que las metástasis9. Las metástasis pulmonares captan I131 de forma más intensa que las óseas10,11.
Dosis de I131: como se ha citado previamente, la cantidad de I131 necesaria para hacer un rastreo es significativamente mayor que la que permite hacer una gammagrafía; y la dosis de I131 necesaria para realizar una ablación es distinta si el tejido captante es un remanente de tiroides tiroides sano12 o si es tejido tumoral.
Preparación del paciente: una dieta pobre en yodo y una concentración plasmática elevada de TSH favorecen la captación del isótopo. Varios estudios sugieren que la concentración óptima de I131 en el tejido captante se consigue con una TSH plasmática igual o superior a 30 mUI/L13.
Existen 2 formas igualmente eficaces14 de conseguir un aumento adecuado de la concentración de TSH: la suspensión del tratamiento con tiroxina (que provoca una elevación de la TSH endógena), y la administración de TSH recombinante (TSHhr). Aunque esta última tiene la ventaja de evitar la clínica asociada al hipotiroidismo, su uso no ha desplazado totalmente a la suspensión del tratamiento con tiroxina, por 2 motivos:
- 1.
Aunque varios estudios sugieren que la evolución a corto plazo de los pacientes es independiente de la técnica usada15,16 los estudios a largo plazo son escasos17. Por este motivo se aconseja la suspensión del tratamiento con tiroxina en la preparación para un rastreo-ablación en pacientes de alto riesgo (aquellos con tumor residual tras la tiroidectomía y los que tienen metástasis)1.
- 2.
El precio de la TSHhr: la dosis necesaria para que la TSH alcance una concentración adecuada cuesta 807,29 €
Recientemente, se ha producido una circunstancia temporal que probablemente aumentará el porcentaje de rastreos-ablación que se harán con la técnica de la suspensión del tratamiento con tiroxina: el fabricante de TSHhr ha comunicado que, por cuestiones de fabricación, habrá problemas de disponibilidad de la molécula durante los años 2011 y 2012. La Agencia Española de Medicamentos y Productos Sanitarios ha publicado una nota informativa en la que aconseja limitar el uso de TSHhr mientras dichos problemas de disponibilidad persistan18.
No existe unanimidad sobre el tiempo que es necesario prolongar la suspensión de tratamiento con tiroxina para alcanzar la concentración necesaria de TSH. Una cuestión relevante porque el hipotiroidismo resultante será tanto más intenso (analítica y clínicamente) cuanto más se prolongue esta situación. Lo habitual es mantener al paciente sin tratamiento durante 4 semanas19, aunque algunas publicaciones sugieren que suspensiones de tratamiento más cortas son igualmente efectivas20,21.
En el presente trabajo, analizamos la evolución de la concentración plasmática de TSH y T4L en 2 grupos de pacientes que se someterán a un rastreo-ablación. Uno de los grupos está formado por pacientes estudiados tras una tiroidectomía total, el otro por pacientes tiroidectomizados en tratamiento sustitutivo con tiroxina a los que se suspende el tratamiento con esta hormona como paso previo a la realización de la prueba citada. Nosotros postulamos que la concentración plasmática de TSH alcanzará la cifra de 30 mU/L antes de que transcurran 4 semanas desde el momento de la tiroidectomía o desde que se suspende el tratamiento con tiroxina.
Pacientes y métodosDurante 6 meses se realizó un muestreo consecutivo de todos los pacientes de nuestro hospital a los que se programó un rastreo-ablación. La muestra resultante estaba formada por 12 pacientes que recibieron el isótopo inmediatamente tras la cirugía (al que llamaremos grupo de tiroidectomía), y 20 pacientes tiroidectomizados cuyo tratamiento sustitutivo con tiroxina se suspendió antes de la prueba (grupo de suspensión de tratamiento). Todas las tiroidectomías fueron realizadas por el mismo cirujano con amplia experiencia en la cirugía de tiroides.
Se siguió el protocolo vigente en nuestro hospital, que establece que transcurran un mínimo de 28 días con una dieta pobre en yodo desde el momento de realización de una tiroidectomía total o desde la suspensión del tratamiento con tiroxina hasta la realización del rastreo-ablación.
Se realizó un análisis de la concentración plasmática de TSH y T4L en todos los pacientes a los 7, 14, 21 y 28 días desde el momento de la tiroidectomía o desde el momento en que se suspendió el tratamiento con tiroxina. La concentración plasmática de TSH se analizó utilizando el método inmunométrico quimioluminiscente Cobas 6000® (Roche diagnostics. Mannheim) con coeficientes de variación interensayo de 1,90; 2,33 y 2,69% a las concentraciones de 0,48; 6,08 y 34,91μUI/mL. La concentración de T4L se analizó utilizando el método de inmunoanálisis quimioluminiscente competitivo con análogos Cobas 6000® (Roche diagnostics. Mannheim) con coeficientes de variación interensayo de 1,82; 1,81 y 2,64% a las concentraciones de 1,06; 2,71 y 6,59 ng/dL.
Los datos se presentan como media±desviación estándar. Las comparaciones de las medidas de variables cuantitativas entre ambos grupos se realizaron utilizando el test de Mann Witney, y las comparaciones de variables nominales con el Chi-cuadrado.
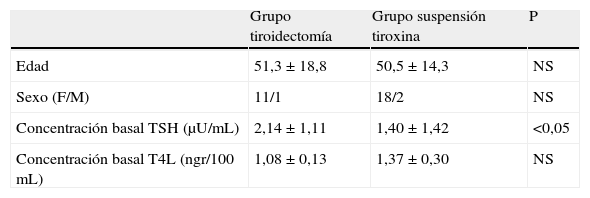
ResultadosLa tabla 1 muestra las características clínicas de los pacientes estudiados. Tres de los pacientes eran varones (uno en el grupo de tiroidectomía y 2 en el grupo de suspensión de tratamiento). La concentración plasmática de TSH en el momento de la inclusión en el estudio fue menor (p<0,05), y la de T4L mayor (no significativo) en el grupo de suspensión del tratamiento con tiroxina que en el grupo de tiroidectomía.
Características basales de los 2 grupos de pacientes sometidos a ablación con I131
| Grupo tiroidectomía | Grupo suspensión tiroxina | P | |
| Edad | 51,3±18,8 | 50,5±14,3 | NS |
| Sexo (F/M) | 11/1 | 18/2 | NS |
| Concentración basal TSH (μU/mL) | 2,14±1,11 | 1,40±1,42 | <0,05 |
| Concentración basal T4L (ngr/100 mL) | 1,08±0,13 | 1,37±0,30 | NS |
Las cifras representan valores absolutos en el caso del sexo. Media±desviación estándar en el resto de las variables.
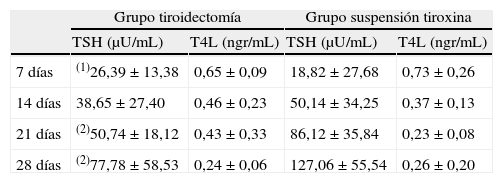
La concentración plasmática media de TSH a los 7, 14, 21 y 28 días sin aporte de tiroxina fue, respectivamente, de 20,78; 46,06; 75,23 y 112,28μUI/mL en el total de la muestra analizada. Su evolución en cada uno de los 2 grupos que forman nuestra muestra está detallada en la tabla 2. La concentración plasmática de TSH a los 7 días fue significativamente mayor (p<0,05) en el grupo de tiroidectomía que el en grupo de suspensión de tratamiento. A los 14, 21 y 28 días la concentración plasmática de TSH fue mayor en el grupo de suspensión de tratamiento (siendo significativas con p<0,01 las diferencias a los 21 y a los 28 días).
Evolución de la concentración plasmática de TSH y T4L (media±desviación estándar) en los dos grupos de pacientes sometidos a ablación con I131
| Grupo tiroidectomía | Grupo suspensión tiroxina | |||
| TSH (μU/mL) | T4L (ngr/mL) | TSH (μU/mL) | T4L (ngr/mL) | |
| 7 días | (1)26,39±13,38 | 0,65±0,09 | 18,82±27,68 | 0,73±0,26 |
| 14 días | 38,65±27,40 | 0,46±0,23 | 50,14±34,25 | 0,37±0,13 |
| 21 días | (2)50,74±18,12 | 0,43±0,33 | 86,12±35,84 | 0,23±0,08 |
| 28 días | (2)77,78±58,53 | 0,24±0,06 | 127,06±55,54 | 0,26±0,20 |
(1) p<0,05 vs grupo suspensión tiroxina; (2) p<0,01 vs grupo suspensión tiroxina.
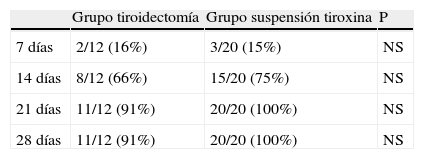
La tabla 3 muestra el número y porcentaje acumulativos de pacientes que alcanzaron una concentración plasmática de TSH igual superior a 30μUI/mL. A los 14 días de la ausencia de aporte de tiroxina, el 66% de los pacientes del grupo de tiroidectomía y el 75% de los del grupo de suspensión de tratamiento habían alcanzado dicha concentración. A los 21 días, esa condición la cumplía el 91% de los pacientes del grupo de tiroidectomía y el 100% de los del grupo de suspensión de tratamiento. Una de las pacientes del grupo de tiroidectomía no alcanzó la cifra de 30μUI/mL ni siquiera a los 28 días.
Número acumulativo (y porcentaje) de pacientes que alcanzaron una concentración de TSH superior a 30μU/mL a los 7, 14, 21 y 28 días en el grupo de pacientes de tiroidectomía y en el de suspensión de tratamiento con tiroxina
| Grupo tiroidectomía | Grupo suspensión tiroxina | P | |
| 7 días | 2/12 (16%) | 3/20 (15%) | NS |
| 14 días | 8/12 (66%) | 15/20 (75%) | NS |
| 21 días | 11/12 (91%) | 20/20 (100%) | NS |
| 28 días | 11/12 (91%) | 20/20 (100%) | NS |
NS: no significativo.
La concentración plasmática media de T4L a los 7, 14, 21 y 28 días sin aporte de tiroxina fue, respectivamente, de 0,71; 0,40; 0,29 y 0,25 ng/100mL en el total de la muestra analizada. La tabla 2 muestra la evolución de la concentración de esta molécula en cada uno de los 2 grupos de pacientes estudiados. Las diferencias en la concentración de T4L entre los 2 grupos no alcanzaron significación estadística.
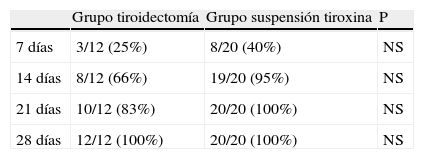
La tabla 4 muestra el número y porcentaje acumulativos de pacientes que alcanzaron una concentración plasmática de T4L igual o inferior a 0,7 ng/100mL (el límite inferior de la normalidad en nuestro laboratorio). A los 14 días, el 66% de los pacientes del grupo de tiroidectomía y el 95% de los del grupo de suspensión de tiroxina tenían una concentración de T4L de esos límites. A los 28 días todos los pacientes cumplían esta condición.
Numero acumulativo (y porcentaje) de pacientes que alcanzaron una concentración de T4L inferior a 0,7 ngr/100mL a los 7, 14, 21 y 28 días en el grupo de pacientes de tiroidectomía y en el de suspensión de tratamiento con tiroxina
| Grupo tiroidectomía | Grupo suspensión tiroxina | P | |
| 7 días | 3/12 (25%) | 8/20 (40%) | NS |
| 14 días | 8/12 (66%) | 19/20 (95%) | NS |
| 21 días | 10/12 (83%) | 20/20 (100%) | NS |
| 28 días | 12/12 (100%) | 20/20 (100%) | NS |
NS: no significativo.
La incidencia del carcinoma diferenciado de tiroides es mayor en las mujeres que en los varones en una proproción de 4:122. La relación en nuestra muestra es de aproximadamente 10:1. Significativamente distinta. Aunque esta desproporción podría sesgar los resultados obtenidos, entendemos que no es probable que así sea dado que no se han descrito grandes diferencias en el catabolismo de la tiroxina y en la respuesta de las células tirotropas al descenso en la concentración de T4L entre hombres y mujeres.
La concentración plasmática de TSH por debajo del límite inferior de lo normal mejora el pronóstico postiroidectomía de los pacientes con un carcinoma de tiroides de origen folicular23. Esto explica que la concentración de esta molécula sea menor, y la de T4L mayor en el grupo de pacientes en los que se suspendió el tratamiento con tiroxina. Achacamos la falta de significación estadística de la diferencia de T4L al tamaño muestral.
Nosotros esperábamos, de acuerdo con los datos de publicaciones previas24, que la concentración plasmática de TSH en los distintos análisis realizados fuese menor en el grupo de suspensión de tiroxina. Muy al contrario, en el día 14 las diferencias entre ambos grupos ya no fueron significativas, y en los días 21 y 28 la concentración de esta molécula fue significativamente mayor en el grupo de suspensión de tiroxina que en el grupo de tiroidectomía. Una evolución sorprendente para la que no tenemos explicación.
En conjunto, más del 71% de los pacientes tenían una concentración de TSH igual o superior a 30μUI/mL 14 días después de la cirugía o de la suspensión del tratamiento con tiroxina, y a los 21 días todos los pacientes excepto uno cumplían esa condición. Nuestros resultados sugieren que se puede reducir sustancialmente el tiempo sin administrar tiroxina de los 28 días habituales hasta 21 días. Y que en una mayoría notable de los pacientes podría hacerse el rastreo-ablación en 14 días. Sugerimos que así se haga.
Una de las pacientes no alcanzó la concentración de TSH de 30μUI/mL siquiera a los 28 días, a pesar de un descenso notable de la concentración de T4 (datos no publicados). La concentración plasmática de tiroglobulina de esta paciente el día de la gammagrafía del rastreo fue de 6,5mg/mL, los anticuerpos antitiroglobulina indetectables, y dicha gammagrafía mostró la presencia de un pequeño resto captante en el lecho tiroideo. El estudio de su función hipofisaria y la resonancia magnética de la silla turca no demostraron alteración funcional o anatómica alguna. Ni siquiera en pacientes así la prolongación del tiempo sin tratamiento hasta los 28 días parece lo óptimo.
La reducción del tiempo sin tratamiento no es una cuestión clínicamente menor: en el análisis realizado el día 14 un 84% de los pacientes tenía una concentración plasmática de T4L inferior al límite bajo de la normalidad; una situación que hace probable la existencia de síntomas de hipotiroidismo, que probablemente serán crecientes con el paso de los días.
Antaño era frecuente que la suspensión del tratamiento con tiroxina previa a un rastreo-ablación se prolongase durante 6 semanas25,26. Aunque actualmente el tiempo exigido sin tratamiento suele ser de 4 semanas, es habitual que los pacientes sufran un hipotiroidismo analítica y clínicamente notable. Los datos que publicamos en este texto sugieren que se puede conseguir una concentración óptima de TSH para la realización de un rastreo-ablación con un tiempo de espera sustancialmente menor del habitual: 14 días de espera es suficiente en la mayoría, y 21 días lo es en la práctica totalidad de los pacientes, tanto en aquellos recién tiroidectomizados como en los que se suspende el tratamiento con tiroxina. Es esperable la existencia de clínica de hipotiroidismo a partir de los 14 días en la mayoría de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.