Introducción
Los avances en el conocimiento del cáncer de mama han hecho que su diagnóstico sea cada vez más temprano y la proporción de tratamientos conservadores haya aumentado de tal forma que éstos sean la norma. La afección ganglionar de la axila en los pacientes con carcinoma de mama continúa siendo el indicador pronóstico más importante y un factor decisivo para establecer la indicación de un tratamiento adyuvante1. Por ello, frente a la linfadenectomía axilar radical (LAR), técnica universalmente utilizada para determinar la posible afectación ganglionar pero que conlleva una morbilidad importante2, se está imponiendo la biopsia selectiva del ganglio centinela (BSGC). Sin embargo, uno de los puntos críticos para introducir esta técnica es disponer de un servicio de medicina nuclear (SMN) que haya realizado un período de validación para que sus resultados sean fiables. En su defecto, una opción podría ser la utilización de un SMN externo al centro donde se realiza la cirugía, siempre y cuando éste disponga de especialistas en cirugía y patología mamarias con experiencia en linfadenectomía. El objetivo principal de este estudio es analizar la factibilidad de esta opción y de forma secundaria analizar el impacto de la implantación de esta técnica en una unidad de cirugía mamaria, observando el ahorro de LAR y de estancias postoperatorias en estos pacientes.
Pacientes y métodos
Criterios de inclusión y exclusión
Una vez establecidos los contactos adecuados con los servicios que debían intervenir, se definieron los protocolos de actuación, los criterios de inclusión y exclusión, las técnicas a utilizar y el circuito a completar. Desde abril de 2001, la Unidad de Patología Mamaria del Servicio de Cirugía General del Hospital Universitario del Mar de Barcelona incluyó, de forma consecutiva, en este estudio a todas las pacientes de cualquier edad que presentaran un carcinoma de mama de diámetro menor de 3 cm, de tipo infiltrante, o intraductal de alto grado por su posibilidad de ser microinfiltrante. Los criterios de exclusión fueron: tratamiento quirúrgico o radioterápico previos, multifocalidad, embarazo o lactancia, diseminación metastásica conocida y carcinoma inflamatorio.
Circuito
A todas las pacientes se les realizó una historia clínica completa, exploración física, mamografía bilateral, radiografía de tórax de frente y perfil, hemograma, función hepática y los estudios preoperatorios habituales protocolizados en nuestra institución. El diagnóstico de cáncer de mama se hizo mediante citología (que fue confirmada en todos los casos), core biopsia o biopsia escisional. A todos los pacientes con ganglios palpables o detectados por ecografía se les practicó una punción citológica con el fin de excluir los positivos para células malignas.
Método de marcaje
Todos los pacientes fueron programados en el SMN del Hospital del Mar, donde un equipo externo de médicos nucleares con amplia experiencia realizaba la administración del radiocoloide, la linfogammagrafía y la detección intraoperatoria del GC. La técnica consistió en inyectar por vía intratumoral y subdérmica 111 MBq de nanocoloide marcado con 99mTc, y realizar imágenes gammagráficas estáticas a los 30 min y a las 2 h postinyección. Se consideraba como GC el primer ganglio que aparecía en la linfogammagrafía o el primer ganglio que dependía de un canal linfático y se localizaba mediante lápiz de 57Co. El GC se marcaba externamente en la piel con tinta indeleble.
Método quirúrgico
La intervención se realizó la mañana siguiente, en su mayoría en el Hospital de la Esperanza de Barcelona y algunas en el propio Hospital del Mar. Previo marcaje radiológico con arpón mediante ecografía o mamografía cuando el tumor no era palpable, se realizó la tumorectomía. Se procedió a la biopsia peroperatoria del tumor y de los márgenes que se marcaban con la técnica MAS-1.2.3 (una grapa margen medial, 2 grapas margen anterior, 3 grapas margen superior), que servía tanto para el control radiológico peroperatorio de la pieza como para la orientación de la pieza para el patólogo. Si el margen estaba afectado o era menor de 1 mm, se procedía a su ampliación. Una nueva evaluación peroperatoria garantizaba la indemnidad del nuevo margen. En el caso de microcalcificaciones se hacía únicamente el estudio de los márgenes.
A continuación, se procedía a practicar la BSGC. Para ello se realizaba un rastreo con sonda en las regiones donde la linfogammagrafía mostraba la existencia de ganglios centinela, tanto en la zona axilar como en la zona de la mamaria interna. Se consideraban ganglios centinela todos aquellos cuya actividad superara el 10% de la actividad del ganglio con mayor número de cuentas por segundo. Una vez localizado/s y extirpado/s el/los GC de la axila, se realizaba un rastreo de comprobación, así como una inspección axilar para ver si existían otros ganglios que fueran sospechosos por su dureza y/o aspecto, en cuyo caso se procedía también a su exéresis. Se realizaba la biopsia peroperatoria mediante tinción con hematoxilina-eosina de los ganglios axilares extirpados; en caso de que alguno de ellos tuviera metástasis se procedía a LAR. A partir de abril de 2003, cuando el GC era negativo, el paciente era incluido en el programa de cirugía mayor ambulatoria.
Si existía migración del radiocoloide hacia los ganglios de la cadena mamaria interna, se localizaban y extirpaban mediante una incisión paraesternal homolateral y se estudiaban siempre en diferido.
En el caso de que la biopsia peroperatoria de los ganglios axilares centinela fuera negativa pero posteriormente el estudio histopatológico definitivo que incluía la realización de técnicas inmunohistoquímicas demostrase la presencia de micrometástasis, la indicación era siempre la LAR. A partir de abril de 2003, tras la puesta en marcha de un ensayo multicéntrico (AATM 048/13/2000) en el que se compara la LAR frente a la observación en pacientes con micrometástasis, sólo se indicó la LAR en las pacientes incluidas en el brazo terapéutico del ensayo o en aquellas que renunciaron a su inclusión en el estudio. El estudio de las adenopatías que se extraían en las LAR se realizaba por el procesamiento estándar y tinción con hematoxilina-eosina.
La decisión del tratamiento adyuvante posterior a la cirugía con hormonoterapia, radioterapia y quimioterapia se determinaba, individualizando cada caso, en el comité de patología mamaria del Hospital Universitario del Mar, que está formado por especialistas en cirugía mamaria, oncología, radiología, ginecología, patología y radioterapia.
Análisis estadístico
Los resultados se expresan en forma de valores absolutos, porcentajes y medias, según necesidades. El análisis estadístico se realizó mediante la prueba de la t de Student al comparar dos medias y el test de Anova para comparar más de dos medias.
Resultados
Se han tratado con esta técnica 196 pacientes con neoplasia de mama, 195 mujeres y un varón; la media de edad ha sido de 60,7 ± 9,8 años, con un rango de 27 a 85. La tumoración asentaba en 102 casos (52%) en la mama derecha, en 89 casos (45,5%) en la mama izquierda y en 5 casos (2,5%) de forma bilateral, resultando un total de 201 neoplasias de mama. En 146 casos (72,6%) las lesiones no fueron palpables.
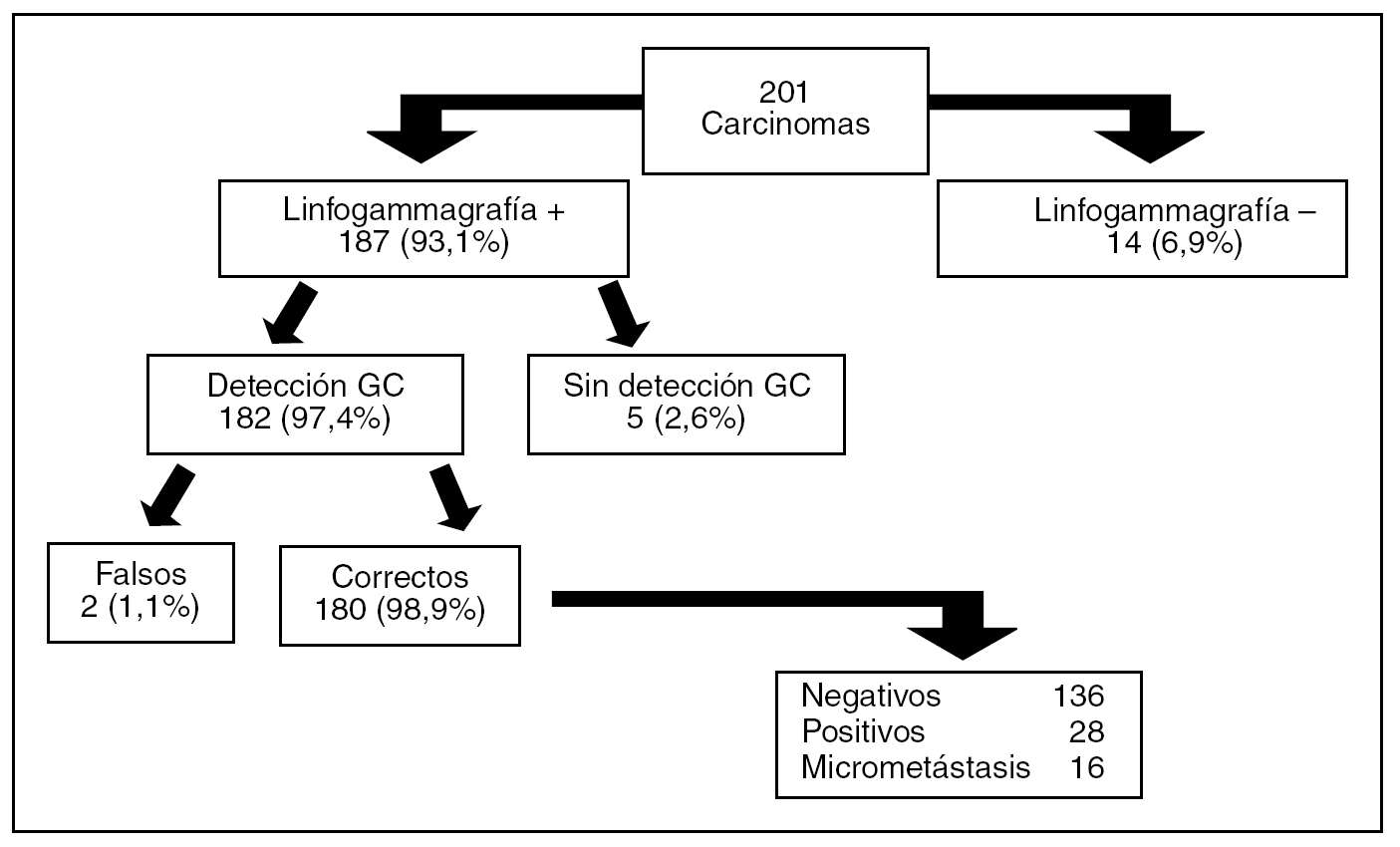
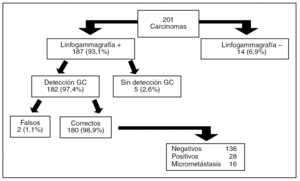
En todos los casos fue posible coordinar a los distintos grupos de profesionales, concentrando el grueso de la actividad un día fijo a la semana. Se señalizaron radiológicamente 148 (72,9%) de los casos. La visualización del GC axilar en la linfogammagrafía fue posible en el 93,1% de los casos y su detección con sonda portátil durante la intervención (en 1 caso con ayuda de azul de metileno) en el 97,4% de ellos (fig. 1). La migración a la mamaria interna se ha producido en 23 de los 201 casos (11,4 %) y se demostró la presencia de metástasis en un solo caso.
Fig. 1. Resultados obtenidos con la aplicación de la técnica de la biopsia selectiva de ganglio centinela (GC) axilar en 196 pacientes (5 bilateral).
El número promedio de GC encontrados en la axila ha sido de 1,9 (tabla 1). La media de la actividad presentada en el GC axilar de máxima actividad ha sido de 610 cps (± 681) y la media de actividad en el ganglio que presentaba la menor actividad en la axila era de 295 cps (± 422).
En consecuencia, y de acuerdo con el protocolo establecido, esta técnica ha permitido evitar la LAR en 131 (65%) de los casos incluidos. De los 5 pacientes con neoplasia bilateral, en 2 de ellos se pudo obviar la LAR en ambos lados y en otros 2 en un lado.
Los tipos de intervención, por orden de frecuencia, han sido la tumorectomía con BSGC en 124 (62 %) casos, y la tumorectomía con BSGC y LAR en 62 (31 %) casos.
El tipo anatomopatológico predominante de la serie fue el carcinoma ductal infiltrante con componente de intraductal en el 40% de los tumores. En cuanto al tamaño tumoral anatomopatológico, la media del diámetro máximo fue de 18,7 ± 15,7 mm, y el 85,5% de los tumores fueron inferiores a 25 mm. Se demostró una diferencia significativa de la media del tamaño tumoral según la estirpe (tabla 2). También hubo diferencia significativa entre los tamaños tumorales de los carcinomas con afectación ganglionar y los que no la tenían, con una media de 22,6 ± 13 mm y 17,4 ± 16 mm (p < 0,05), respectivamente.
La media de días de estancia postoperatoria fue de 1,9 días con una moda de 1 día, y un rango de 0 a 11 días. Un 57,4% fue intervenido en un régimen de cirugía de corta estancia (un día) o de cirugía mayor ambulatoria (CMA). La diferencia del promedio de días de ingreso para los pacientes con o sin LAR fue de 1,8 días (3,1 frente a 1,3; p < 0,001).
Discusión
La implementación de la técnica de la BSGC (inyección del radiotrazador, migración y detección del GC) necesita de un período de validación para asegurar que se biopsia el ganglio o ganglios que tienen las máximas probabilidades de estar afectados en caso de que el tumor haya desarrollado las metástasis regionales, evitando así falsos negativos.
Es por ello que en hospitales con un especial interés en la patología mamaria e importante casuística, pero que no dispongan de un SMN propio o que éste debiera pasar por un período de validación de la técnica, se abre la posibilidad de utilizar la experiencia de SMN de otros centros con la técnica ya validada, y beneficiar así a los pacientes sin aplicarles una LAR innecesaria. Además, en nuestro caso, se suma el hecho de tener un elevado porcentaje de casos susceptible de tratamiento conservador, debido a que nuestro centro asume el tratamiento del cáncer de mama procedente del cribado de 4 barrios de Barcelona.
La experiencia de los especialistas de medicina nuclear que han colaborado con nuestro centro es amplia y ha sido publicada con anterioridad3,4. La tasa de detección de este grupo es del 96%, superior al 90% exigible.
La idea de incorporar un SMN externo no solamente ha dado resultado en nuestro centro, sino que posteriormente se ha aplicado a otros centros de nuestra comunidad autónoma, que tampoco disponían de SMN propio. Esta innovación ha hecho posible la extensión de los beneficios que aporta la técnica de la BSGC a otros pacientes, que de otra forma no hubiera sido posible.
Respecto al marcaje, algunos grupos utilizan, además del radiocoloide, un colorante de forma sistemática, pero en la experiencia del SMN externo que nos asiste les ha aportado una mínima mejoría en el porcentaje de localización del GC cuando se utilizaron conjuntamente ambas técnicas con respecto al uso único del radiotrazador4. No obstante, algunos grupos utilizan el marcaje combinado con notable éxito, llegando en algún caso al 100% de identificación5. Sólo se ha realizado en algún caso como complemento cuando el trazador no ha migrado de forma clara. En nuestro caso, siempre se intenta la inyección de radiocoloide intra y peritumoral, aunque en caso de tumores muy pequeños con microcalcificaciones se realiza una inyección subareolar dada su menor dificultad y el hecho de que hay una alta concordancia entre el GC que marca una u otra técnica, superior al 90%6-11.
En lo que respecta a la técnica quirúrgica, nuestro grupo ha realizado un período de comprobación, en el que se ha constatado que el equipo quirúrgico, con amplia experiencia en la cirugía mamaria, fue capaz de encontrar el ganglio que el equipo de medicina nuclear previamente marcaba. Por ello se realizó la identificación y la exéresis del GC en 15 casos, a los que seguidamente se realizó la LAR, corroborando los hallazgos previos. La técnica de BSGC se realizó de forma sistemática a partir de abril de 2001, iniciándose el estudio.
La estrategia de nuestro grupo ha sido introducir la BSGC con unas indicaciones conservadoras12, aunque es posible que se puedan ampliar en el futuro, como sugieren recientes estudios sobre las indicaciones de esta técnica en tumores multicéntricos y multifocales1, ya que éstos se encuentran en una proporción que va del 13 al 65% según las series13. Sin embargo, es posible que ello contribuya a aumentar los falsos negativos de la técnica de BSGC, como han sugerido Veronesi et al14, que en su serie fueron la mitad de los falsos negativos que tuvieron (2 de 4). Por otra parte, también es posible que en un futuro se puedan incluir aquellos carcinomas en estadios II y III que hayan sido tratados con terapéutica adyuvante preoperatoria4, aunque hasta el momento suelen excluirse debido a un aumento de los falsos negativos4. En estos pacientes se sugiere que el efecto citotóxico podría no ser uniforme dando una desigual regresión tumoral entre las adenopatías afectadas15. Aunque otros autores argumentan un índice de falsos negativos inferior, 0-12%16,17, nuestra opinión es que dado que ello influiría negativamente en un déficit de tratamiento, sea no realizando exéresis de ganglios afectados o no realizando una nueva terapia adyuvante postoperatoria, es mejor no someter a los pacientes a este riesgo hasta contar con mayor evidencia.
Respecto a los 2 falsos negativos de la técnica en cuanto a migración, pero que se han podido diagnosticar correctamente por la palpación de un ganglio macroscópicamente afectado, es conocido que cuando el GC está saturado por la metástasis puede ser que no capte el trazador y vaya a un segundo ganglio que puede no estar todavía afectado18. En la mayoría de estos casos, una palpación cuidadosa de la región axilar reglada a través de la herida realizada, permite descubrir pequeños ganglios de consistencia aumentada que no se palpaban en la exploración clínica previa y que pueden extirparse, y de los que se puede realizar un estudio anatomopatológico peroperatorio. La importancia de este hecho ha sido recalcada por otros autores que han presentado similares hallazgos1. También se ha sugerido la utilidad de practicar un rastreo ecográfico sistemático prequirúrgico de la axila, que ayudaría a evitar estos falsos negativos19.
La BSGC tiene otras ventajas como son la detección de metástasis en adenopatías de la cadena mamaria interna, que en nuestros casos ha sido únicamente en una ocasión, y también la detección de metástasis en los ganglios intramamarios20, de los que no se ha detectado ninguno en nuestra serie. Por otra parte, es evidente el beneficio en cuanto a acortar las estancias hospitalarias, ya que al evitar una linfadenectomía radical, estas intervenciones se pueden realizar fácilmente dentro de un programa de CMA. En un futuro próximo, la mentalización de la población y las mejoras técnicas harán posible universalizar la cirugía del cáncer de mama en CMA, como algunos grupos que ya incluyen casos de tratamiento conservador con linfadenectomía de forma ambulatoria21.
Se puede concluir que es factible implantar la técnica de BSGC mediante la utilización de un SMN externo, y que ello ha posibilitado el ahorro del 65% de las LAR en los casos de neoplasia de mama en que se ha indicado. Además, ha supuesto otros beneficios añadidos que pueden objetivarse en una reducción significativa de las estancias hospitalarias y de la implementación de un programa de CMA en este tipo de pacientes.
Correspondencia: Dr. M. Segura.
Hospital Universitario del Mar.
Passeig Marítim, 25-29. 08003. Barcelona. España.
Correo electrónico: msegura@imas.imim.es
Manuscrito recibido el 19-11-2005 y aceptado el 4-4-2006.