A trombose é uma das principais causas de morte e o crescente conhecimento das alterações fisiopatológicas inerentes permitiu o desenvolvimento de terapêuticas eficazes (antiagregante, anticoagulante e fibrinolítico) para a prevenção e tratamentos da doença tromboembólica.
Contudo, uma compreensão melhor do processo subjacente é fundamental para o desenvolvimento de novos agentes terapêuticos mais seguros e eficazes.
O objetivo da presente revisão é sumarizar os tratamentos atuais disponíveis, e destacar os novos agentes e o seu papel comprovado ou eventual na cirurgia vascular.
Thrombosis is one of the major causes of death worldwide. Continous increase in the knowledge about the pathophysiological changes associated with thrombosis led to the development of effective therapies (anti‐platelet, anticoagulant and fibrinolytics) for the prevention and treatment of the thromboembolic disease.
However, better understanding of the underlying processes is still crucial for the development of more effective and safer antithrombotic drugs.
The aim of this review is summarize the current treatment, as well as the new agentes and to highlight their proven or possible role in Vascular Surgery.
O processo da hemóstase deriva de um delicado balanço entre a coagulação e a fibrinólise. O distúrbio deste equilíbrio, tanto por fatores genéticos como adquiridos, leva a complicações trombóticas e hemorrágicas.
A trombose corresponde à formação de trombo localizado na circulação arterial e/ou venosa. A natureza do trombo vai depender da sua localização: no sistema venoso é constituído maioritariamente por fibrina, eritrócitos e poucas plaquetas, e no sistema arterial tem um grande número de plaquetas. Isto vai ter implicação no tipo de agentes usados e os seus alvos celulares.
As plaquetas exercem um papel importante na hemóstase que, a nível arterial, pode ocorrer após rotura, fissura ou erosão da placa de ateroma1, com exposição e libertação de fatores trombogénicos, e adesão das plaquetas. Na veia, a trombose ocorre através da ativação da cascata de coagulação.
Os fármacos antiagregantes e anticoagulantes são fundamentais para o tratamento de muitas doenças a que estão associadas um incremento do risco trombótico, como a doença coronária, cerebrovascular e arterial periférica aguda e crónica, e prevenção e tratamento da trombose venosa. São ainda fundamentais após tratamentos de revascularização, sejam eles coronários ou periféricos percutâneos, ou cirúrgicos, para aumentar a permeabilidade dos procedimentos2.
Existem vários tipos de fármacos, que atuam em diferentes recetores e em pontos‐chave da ativação, adesão e agregação plaquetária e ainda na cascata de coagulação. O seu principal efeito adverso, que limita a sua aplicação universal, é o risco hemorrágico e que tem uma variação individual dependendo da reatividade plaquetária e a predisposição individual. Este facto vai complicar o desenvolvimento de doses e mecanismos de monitorização estandardizados3.
O objetivo desta revisão é o de fornecer uma visão geral sobre os mais recentes avanços do tratamento antiagregante e anticoagulante atualmente em uso, bem como o de novos agentes ainda em desenvolvimento. Também será discutida a indicação clínica destes fármacos, a sua farmacocinética e farmacodinâmica bem como o seu manuseio perioperatório.
Hemóstase primária e secundáriaPara uma melhor compreensão, é relevante abordar o sistema hemostático e os mecanismos envolvidos.
Na presença de uma lesão da parede do vaso, há uma exposição dos elementos do espaço subendotelial com adesão e ativação das plaquetas através de recetores como a glicoproteína (Gp) Ib‐IX‐V, que se liga ao fator de Von Willebrand (FvW) e ao colagénio (via Gp V)4, e a Gp VI que liga ao colagénio.
Quando ativadas, as plaquetas sofrem uma mudança morfológica e alteram a expressão de fosfolípidos na membrana que acelera a cascata de coagulação. Além disso, secretam agonistas como adenosina difosfato (ADP), tromboxano A2 (TxA2), trombina, adrenalina, serotonina, entre outros. O ADP promove a ativação através de 2 recetores (P2Y1 e P2Y12) e ativa a via da cicloxigenase (COX) com formação de TxA2 (após conversão do ácido araquidónico em prostaglandina H2 e desta em TxA2 pela tromboxano sintase).
Um dos ativadores com maior ação é a trombina que se liga aos recetores plaquetários: protease‐ativated receptor (PAR) ‐1 e PAR‐4.
Por fim, ocorre ativação da integrina plaquetária Gp IIb/IIIa que liga o fibrinogénio ou o FvW, e intervém na agregação plaquetária.
A cascata da coagulação inicia‐se simultaneamente através da via intrínseca (fator XII que converte o fator XI e este ativa o fator IX; o fator IX, por sua vez, vai ativar o fator X na presença do fator VIIIa) e extrínseca (o fator tecidual‐FT, liga‐se ao fator VII. O complexo VIIa‐FT ativa o fator X). Estas 2 vias terminam na via comum, onde o fator Xa converte a protrombina (IIa), na presença do cofator Va, em trombina. Esta última vai transformar o fibrinogénio em fibrina que estabiliza o trombo plaquetário5.
As novas direções no tratamento antiagregantePor mais do que uma década, a dupla antiagregação com o ácido acetilsalicilico (AAS) e clopidogrel, era considerado o tratamento standard para prevenir eventos isquémicos recorrentes, tanto na fase aguda como crónica, do tratamento da síndrome coronária aguda (SCA), bem como na doença arterial periférica (DAP). Contudo, os eventos isquémicos continuavam a ocorrer, o que levou à necessidade de desenvolvimento de novos agentes mais potentes, alguns já com aprovação e usados na prática clínica, e outros ainda em desenvolvimento.
Atualmente, as principais classes de agentes antiagregantes são as seguintes: 1) inibidor da COX‐1 – AAS; 2) antagonistas dos recetores da ADP P2Y12 – ticlopidina, clopidogrel, prasugrel, ticagrelor, cangrelor e elinogrel; 3) inibidores da Gp IIIb/IIa – abciximab, eptifibatide e tirofiban; 4) antagonistas do recetor da trombina – vorapaxar, atopaxar, e 5) inibidores do TxA2: picotamida, ridogrel, ramatroban.
Inibidores da cicloxigenase‐1O AAS bloqueia irreversivelmente a COX‐1, a enzima que catalisa a síntese do TxA2 a partir do ácido araquidónico. O TxA2 liga‐se ao recetor prostaglandina endoperóxido causando alterações na conformação da plaqueta, e aumenta o recrutamento e agregação das plaquetas.
O AAS tem claros benefícios na doença cardiovascular e existem numerosas publicações, como a Antithrombotic Trialist Collaboration, que mostrou, em doentes com doença aterosclerótica, uma redução de 25% nos eventos cardiovasculares, com o AAS6. Contudo, em estudos específicos para a DAP não mostrou redução significativa7. Esta eficácia limitada do AAS em monoterapia pode ser explicada pela sua resistência, que parece atingir com mais frequência os doentes com DAP comparativamente à doença coronária8.
Contudo, o AAS mantem‐se como fármaco de 1.ª linha em baixas doses (55‐325mg/dia), e deve ser substituído por outros agentes apenas em doentes com DAP e que tiveram um evento vascular estando sob tratamento com AAS, ou em casos de não tolerância8.
Antagonistas do recetor P2Y12O ADP exerce o seu efeito nas plaquetas através dos recetores P2Y1 e P2Y12. Apesar de serem necessários os 2 recetores para a agregação plaquetária, é o P2Y12 que exerce o principal papel, estabilizando o agregado plaquetário.
TiclopidinaInibidor irreversível do recetor do ADP. Está descrito o seu efeito na redução dos eventos cardiovasculares e trombóticos em doentes claudicantes10. Contudo, os seus efeitos adversos, como a púrpura trombocitopénica trombótica e a neutropenia, limitam o seu uso9.
Clopidogrel (Plavix®)Após a sua aprovação, depressa substituiu a ticlopidina, devido ao seu perfil de segurança mais favorável. Além disso, tem um início de ação mais rápido com a dose de carga10.
O clopidogrel é uma pró‐droga, que necessita de metabolização no fígado via citocromo P450 (CYP450). Devido à sua ação irreversível, tem efeito durante todo o tempo de vida da plaqueta (7‐10 dias).
Tal como o AAS, existem resistências a este fármaco e na sua causa estão alterações genéticas na atividade do CYP450, ou interações medicamentosas com fármacos que competem com o mesmo sistema metabólico, como os inibidores da bomba de protões e os bloqueadores dos canais de cálcio.
Tem indicação para o tratamento da DAP, especialmente em doentes alérgicos ou intolerantes ao AAS. O estudo Clopidogrel versus Aspirin in Patients at Risk of Ischaemic Events (CAPRIE) mostrou que o clopidogrel (75mg/dia) tem uma vantagem modesta, mas significativa, sobre o AAS (325mg/dia) para a prevenção de acidente vascular cerebral (AVC), enfarte agudo do miocárdio (EAM) e DAP em doentes com doença aterosclerótica sintomática11.
Relativamente ao papel do clopidogrel na dupla‐terapia, de acordo com as guidelines da European Society of Cardiology (ESC), Inter‐Society Consensus for the management of Peripheral Arterial Disease (TASC‐II), American College of Cardiology Foundation (ACCF)/American Heart Association (AHA) e American College of Chest Physicians (ACCP), o uso por rotina da dupla antiagregação em doentes com DAP estável não está recomendado, devido ao aumento do risco de hemorragia. O risco de complicações hemorrágicas duplica com a dupla terapêutica, comparando com o placebo ou a monoterapia com o clopidogrel12–15.
Contudo, pode ser importante em alguns subgrupos de doentes. O estudo Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance (CHARISMA) mostrou que, em doentes com EAM ou AVC prévios ou DAP sintomática, tiveram benefício com a dupla antiagregação com clopidogrel e AAS16. Assim, a dupla terapia deve ser considerada: a) em doentes com doença aterosclerótica difusa, b) naqueles com múltiplos eventos aterotrombóticos e com risco de eventos recorrentes, c) nos doentes cujos fatores de risco não estão controlados (intolerância à estatina, por exemplo). Após procedimentos de revascularização periféricos percutâneos, as recomendações na duração da dupla terapia são as seguintes: a) stent ilíaco: um mês17–18; b) stenting femoro‐poplíteo: 1‐3 meses, considerar>3 meses se stenting da artéria femoral superficial19–21; c) drug eluting baloons: 3 meses22–23; d) drug‐eluting stents: 2 meses; e e) DES nos vasos tibiais: um ano24.
Contudo, a duração da terapêutica dupla deve ser individualizada, tendo em conta a extensão da doença, qualidade do inflow e outflow, presença de isquemia crítica, extensão do stent e risco de fratura, bem como do risco hemorrágico.
Deve ser suspenso 3‐5 dias antes de procedimentos invasivos.
Prasugrel (Efient®)É uma tienopiridina de 3.ª geração, administrada oralmente sob a forma de pró‐droga, que necessita de metabolização hepática para se transformar no seu composto ativo.
Tem as seguintes vantagens sobre o clopidogrel: é mais eficazmente convertida no seu composto ativo, tem um início de ação mais rápido, e um maior grau de inibição plaquetária com menor variabilidade de resposta (pois não é afetada por polimorfismos do CYP450)25.
É mais eficiente que o clopidogrel na redução dos eventos cardiovasculares em doentes com SCA, contudo este benefício é contrabalançado pelo maior número de hemorragias intracranianas, estando então contraindicado em doentes com história de AVC ou acidente isquémico transitório (AIT) e deve ser usado com precaução em doentes com peso<60kg e idade>75 anos.
Não está aprovado para o uso na doença arterial periférica (DAP).
Deve ser suspenso 7 dias antes de procedimentos invasivos.
Ticagrelor (Brilinta®)É uma ciclo‐pentil‐triazolopirimidina que inibe diretamente e de forma reversível o recetor P2Y12. Tal como o prasugrel, tem um início de ação rápido e uma atividade mais consistente do que o clopidogrel. Devido à sua reversibilidade e tempo de meia vida de 8‐12h, é necessário uma administração bi‐diária. Cerca de 30‐40% do seu efeito é atribuído a metabolitos a partir do CYP3A e que também está envolvido na metabolização do próprio fármaco. Como tem excreção hepática, deve ser tida especial atenção em doentes com disfunção hepática.
Tem um perfil de segurança muito bom e há estudos, como o PLATelet inhibition and patient Outcomes (PLATO), que mostra menores taxas de mortalidade em relação com o clopidogrel (9,8 vs. 11,7%, p<0,001) em doentes com SCA, e superioridade na prevenção dos eventos cardiovasculares fatais e não‐fatais. Contudo, com maior probabilidade de hemorragia não‐fatal (16 vs. 14,6%, p=0,0084). No subgrupo de doentes com DAP, a redução dos eventos isquémicos com o ticagrelor foi consistente com os restantes resultados deste estudo26–27.
O Prevention of Cardiovascular events in patients with prior heart attack using Ticagrelor compared to placebo on a background of Aspirin‐Thrombolysis in Myocardial Infarction 54 (PEGASUS‐TIMI 54) mostrou que o ticagrelor reduz as taxas de morte cardiovascular, EAM ou AVC, comparativamente ao placebo28.
Não está atualmente aprovado na DAP, contudo está a decorrer de momento o estudo Design and Rationale for the effects of Ticagrelor and Clopidogrel in patients with Peripheral Arterial Disease (EUCLID), que pretende investigar se o tratamento com ticagrelor vs. clopidogrel, em monoterapia, permite a redução da incidência de eventos cardiovasculares e relacionados com o membro, em doentes com DAP sintomática29.
Deve ser suspenso 5 dias antes de intervenções.
CangrelorComposto semelhante do ticagrelor e é o primeiro inibidor reversível, de ação direta e endovenoso do recetor P2Y1230. Devido ao seu rápido início de ação, curta semivida e recuperação rápida da função plaquetária (30‐60min)31, torna este fármaco apelativo para o uso em situações clínicas agudas e em doentes sem via oral e em que pode vir a ser necessário a reversão rápida. Foi aprovado em junho de 2015, nos Estados Unidos da América e Inglaterra, para as intervenções coronárias percutâneas.
ElinogrelÉ um agente de ação direta, reversível, que se liga competitivamente aos recetores P2Y12 e tem um início de ação mais rápido que o clopidogrel. Como não tem metabolismo pelo sistema CYP, reduz as interações medicamentosas32. O seu desenvolvimento clínico parou após a fase II dos ensaios clínicos33.
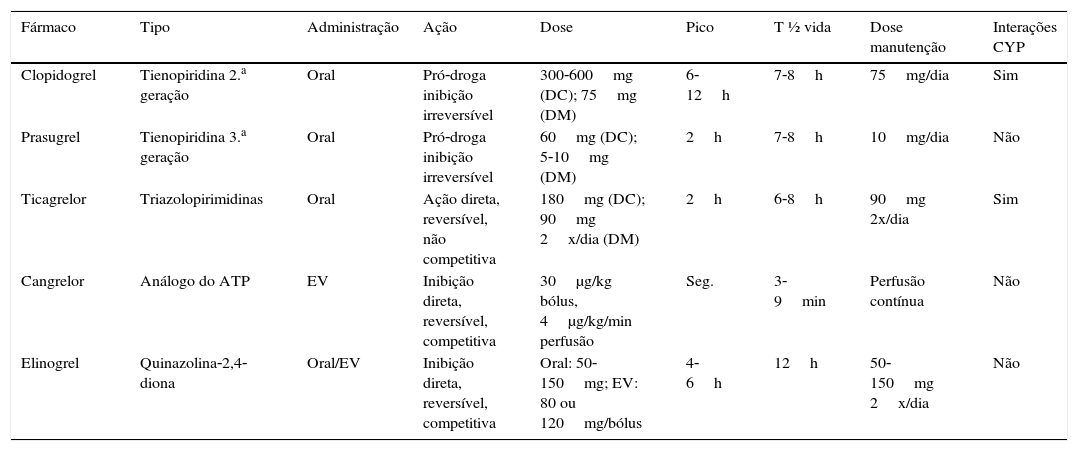
As características dos fármacos antagonistas do recetor P2Y12 estão resumidas na tabela 134–36.
Características dos antagonistas P2Y12
| Fármaco | Tipo | Administração | Ação | Dose | Pico | T ½ vida | Dose manutenção | Interações CYP |
|---|---|---|---|---|---|---|---|---|
| Clopidogrel | Tienopiridina 2.a geração | Oral | Pró‐droga inibição irreversível | 300‐600mg (DC); 75mg (DM) | 6‐12h | 7‐8h | 75mg/dia | Sim |
| Prasugrel | Tienopiridina 3.a geração | Oral | Pró‐droga inibição irreversível | 60mg (DC); 5‐10mg (DM) | 2h | 7‐8h | 10mg/dia | Não |
| Ticagrelor | Triazolopirimidinas | Oral | Ação direta, reversível, não competitiva | 180mg (DC); 90mg 2x/dia (DM) | 2h | 6‐8h | 90mg 2x/dia | Sim |
| Cangrelor | Análogo do ATP | EV | Inibição direta, reversível, competitiva | 30μg/kg bólus, 4μg/kg/min perfusão | Seg. | 3‐9min | Perfusão contínua | Não |
| Elinogrel | Quinazolina‐2,4‐diona | Oral/EV | Inibição direta, reversível, competitiva | Oral: 50‐150mg; EV: 80 ou 120mg/bólus | 4‐6h | 12h | 50‐150mg 2x/dia | Não |
CYP: citocromo P450; DC: dose de carga; DM: dose de manutenção; EV: endovenoso.
A ativação da Gp IIb/IIIa permite a ligação do fibrinogénio, adesão das plaquetas e endotélio. Existem 3 fármacos aprovados para uso clínico, contudo apenas com disponibilidade endovenosa e com um rápido início de ação, restringindo o seu uso à fase aguda do tratamento após o evento isquémico.
A sua aplicação está bem estabelecida para as intervenções coronárias, mas existem vários estudos preliminares para avaliar a sua administração nas intervenções arteriais periféricas, particularmente em conjunto com os trombolíticos. Existem muitos estudos que demostraram que os resultados da trombólise melhoram com a terapêutica conjunta do trombolítico com os inibidores da Gp e nenhum agente em particular demonstrou superioridade37.
Estes agentes também foram estudados no tratamento endovascular de lesões periféricas crónicas, com o objetivo de prevenir a trombose precoce das revascularizações e melhorar a permeabilidade. Os resultados, no que concerne à sua segurança e risco hemorrágico, são unânimes quanto ao seu benefício, contudo, quanto à permeabilidade, os resultados são diferentes: um estudo de Dörffler‐Melly et al. mostra que a permeabilidade e resultados clínicos são melhores com o abciximab vs. placebo38, e outro estudo de Ansel et al. não revelou diferenças aos 9 meses após a intervenção39. Estudos adicionais estão atualmente em curso para examinar o papel destes agentes no tratamento endovascular da isquemia crítica e para se identificar a dose ideal, a frequência e mecanismo de administração.
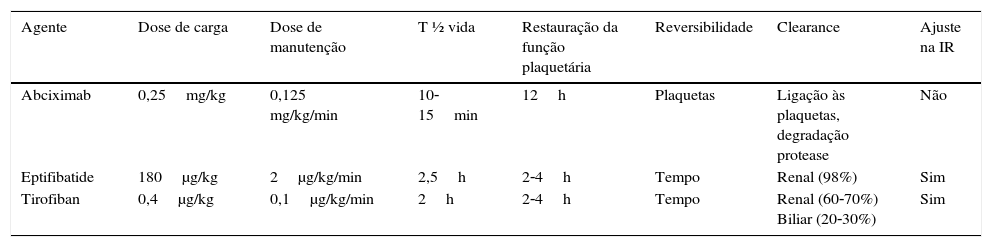
A farmacodinâmica dos antagonistas da Gp IIb/IIIa está sumarizada na tabela 235–36.
Farmacodinâmica dos antagonistas da Gp IIb/IIIa
| Agente | Dose de carga | Dose de manutenção | T ½ vida | Restauração da função plaquetária | Reversibilidade | Clearance | Ajuste na IR |
|---|---|---|---|---|---|---|---|
| Abciximab | 0,25mg/kg | 0,125 mg/kg/min | 10‐15min | 12h | Plaquetas | Ligação às plaquetas, degradação protease | Não |
| Eptifibatide | 180μg/kg | 2μg/kg/min | 2,5h | 2‐4h | Tempo | Renal (98%) | Sim |
| Tirofiban | 0,4μg/kg | 0,1μg/kg/min | 2h | 2‐4h | Tempo | Renal (60‐70%) Biliar (20‐30%) | Sim |
T ½ vida: tempo de meia vida; IR: insuficiência renal.
O AAS e os inibidores do recetor P2Y12 têm como alvo as vias de ativação plaquetária do ADP e TxA2, e pouco afetam vias alternativas, incluindo as que são mediadas pela trombina. Esta tem um papel fundamental na cascata de coagulação, sendo um indutor potente da agregação plaquetária.
A resposta das plaquetas à trombina é mediada pelos PAR. O subtipo PAR‐1 é o recetor principal e é seletivamente bloqueado por 2 fármacos: vorapaxar (aprovado pela Food and Drug Administration [FDA], em maio de 2014) e atopaxar.
Está indicado para redução dos eventos trombóticos cardiovasculares em doentes com história prévia de EAM ou DAP.
O estudo The Preventing Heart Attack and Stroke in Patients With Atherosclerosis (TRA 2OP‐TIMI 50) avaliou a eficácia e segurança do varopaxar na prevenção secundária dos doentes com EAM, AVC isquémico prévio ou DAP sintomática. Os resultados demonstraram uma redução global de 13% nos eventos cardiovasculares major com este fármaco (p>0,001)40.
Em doentes selecionados com DAP sintomática e sem fibrilhação auricular (FA), o vorapaxar reduziu a incidência de isquemia aguda do membro inferior41.
Inibidores da via do tromboxano A2A inibição do recetor do tromboxano (TP) vai bloquear o efeito do TxA2 nas plaquetas, bem como o de outros ligandos, como os eicosanoides e endoperóxidos, o que poderá trazer vantagens relativamente ao AAS. Além disso, os TP também são expressos nas células inflamatórias, parede vascular e placas de aterosclerose, o que também pode trazer efeito sobre estas estruturas42.
Esta classe inclui os seguintes agentes: picotamida (inibidor da sintase do TxA2 e do recetor do TP), ridogrel (inibidor da sintase do TxA2 e do recetor do TP), ramatroban (inibidor do recetor TP), entre outros em fase de investigação (NCX 4016, Si 8886/terutroban, EV‐077)43.
A picotamida foi usada num estudo (estudo Drug Evaluation in Atherosclerotic Vascular Disease in Diabetics [DAVID]) em doentes diabéticos e com DAP, em que mostrou reduzir a mortalidade global mas não os eventos cardiovasculares major, comparativamente ao AAS44.
Papel dos novos antiagregantes na doença arterial periféricaOs doentes com DAP tipicamente têm uma doença aterosclerótica avançada, e>50% têm concomitantemente doença coronária e/ou cerebrovascular. Os doentes que têm doença coronária e DAP têm níveis mais elevados de marcadores de inflamação e protrombóticos, comparativamente aos doentes com doença coronária apenas45. Isto coloca este subgrupo de doentes num risco mais elevado de eventos adversos e com piores resultados clínicos após revascularização46.
O AAS é o principal agente antiagregante usado na doença cardiovascular e DAP sintomática, apesar da pouca evidência para o uso desta medicação específica nestes doentes45. Assim, de forma a poder avaliar quais os melhores agentes usados na DAP, Katsanos et al. desenvolveram uma revisão dos principais estudos que comparam os diferentes antiagregantes (AAS, ticlopidina, clopidogrel, ticagrelor, cilostazol, picotamida e vorapaxar, em monoterapia ou em combinação com o AAS) para prevenção do Major Adverse Cardiac Events (MACE), bem como as amputações major em doentes com DAP. Os autores concluem que o AAS, cilostazol, vorapaxar e picotamida não são eficazes na prevenção de eventos cardiovasculares e/ou amputação na DAP. Apenas os antagonistas do ADP (ticlopidina, clopidogrel, clopidogrel+AAS e ticagrelor+AAS), tiveram uma redução significativa na mortalidade cardiovascular, comparativamente ao placebo.
A ticlopidina, apesar de associada a uma redução muito significativa da mortalidade cardiovascular, foi abandonada devido à elevada incidência de alterações hematológicas.
Em termos de segurança, as combinações vorapaxar com AAS e clopidogrel com AAS foram associadas a maior risco hemorrágico.
O estudo confirmou ainda que a dupla antiagregação, com clopidogrel e AAS, reduz a taxa de amputação major após revascularização47.
Novos anticoagulantes oraisOs anticoagulantes orais são amplamente usados na prevenção e tratamento do tromboembolismo arterial e venoso. Até muito recentemente, os antagonistas da vitamina K, como a varfarina, eram os únicos fármacos orais disponíveis. Apesar da sua eficácia, existe uma imprevisibilidade da farmacocinética e farmacodinâmica, um início lento de ação farmacológica, uma margem terapêutica estreita, metabolismo variável dependente do citocromo P450, e interações com fármacos e outros alimentos. Todos estes fatores levaram à necessidade de encontrar novos fármacos, como o dabigatrano, rivaroxibano, apixabano e edoxabano, os chamados novos anticoagulantes orais (NACO), que têm a grande vantagem de não exigirem uma monitorização da sua atividade48–49.
Em Portugal, o rivaroxibano (Xarelto®), o dabigatrano (Pradaxa®) e o apixabano (Eliquis®) estão aprovados para uso clínico.
Fármacos anticoagulantes oraisPertencem a 2 classes principais: 1) inibidores fator Xa e 2) inibidores diretos da trombina (IDT).
Inibidores do fator XaO fator Xa, que forma um complexo com o fator Va (protrombinase) e cliva a protrombina em trombina, é comum às vias intrínseca e extrínseca, logo, os fármacos inibidores deste fator vão ter um impacto em toda a cascata da coagulação.
Rivaroxibano (Xarelto®)É um inibidor direto do fator Xa aprovado para uso na FA não valvular (NV), profilaxia (na artoplastia da anca e joelho) e tratamento e prevenção da Trombose Venosa Profunda (TVP) e Tromboembolismo Pulmonar (TEP), e ainda prevenção de eventos aterotrombóticos em doentes adultos após SCA e com biomarcadores cardíacos elevados50.
Tem limitações na sua administração a doentes com Clearance de Creatinina (ClCr)<30mL/min, devendo ser tomado com precaução em doentes com ClCr entre 15‐29mL/min, e não está recomendado para doentes com ClCr<15mL/min.
Para a sua aplicação na DAP, está atualmente em curso o estudo Efficacy and safety of rivaroxiban in reducing the risk of major thrombotic vascular events in subjects with peripheral artery disease undergoing peripheral revascularization procedures of the lower extremities (VOYAGER‐PAD), na fase 3 de investigação clínica, que tem como objetivo comprovar se o rivaroxibano, quando adicionado ao tratamento habitual e comparando com o placebo, tem o potencial em reduzir a incidência de complicações cardíacas, cerebrais ou dos membros inferiores, em doentes que foram submetidos recentemente a procedimentos de revascularização dos membros inferiores51.
Apixabano (Eliquis®)Tal como o rivaroxibano, é um inibidor direto do factor Xa e está aprovado em Portugal para a prevenção do AVC e embolismo sistémico em doentes adultos com FA NV, com um ou mais fatores de risco, e tratamento da TVP e TEP e prevenção de TVP recorrente e TEP em adultos.
O seu perfil farmacocinético faz com que a sua posologia habitual seja a de um comprimido, 2 vezes por dia. Esta diferença, comparativamente aos outros agentes, pode ter implicações na compliance e na manutenção de níveis eficazes de hipocoagulação.
Deve ser tomado com precaução em doentes com insuficiência renal grave (clearance de creatinina 15‐29ml/min) e na doença hepática (contraindicado na doença hepática associada e coagulopatia e no compromisso hepático grave não está recomendado)52.
Edoxabano (Lixiana®)No edoxabano, a ligação às proteínas plasmáticas é 55%, inferior ao do apixabano (87%) e rivaroxibano (∼90%). Esta característica é importante para os doentes em hemodiálise, pois esta não vai afetar a clearance do edoxabano53.
Teve aprovação de comercialização na Europa em junho de 2015, para tratamento do TVP e TEP em doentes que foram tratados inicialmente com anticoagulação parentérica nos primeiros 5‐10 dias e na prevenção do AVC, e embolismo sistémico na FA NV.
Inibidores diretos da trombinaOs IDT bloqueiam a atividade da trombina impedindo a conversão de fibrinogénio em fibrina.
Dabigatrano (Pradaxa®)IDT aprovado para a prevenção do AVC na FA NV. Schulman et al. (2013) demonstraram ser também eficaz no tratamento do TEV54.
As principais características farmacodinâmicas e farmacocinéticas dos NACO e indicações clínicas; as recomendações para suspensão antes de procedimentos invasivos e a sua reintrodução pós‐operatória estão sumarizadas nas tabelas 3–540,55–59, respetivamente.
Características farmacocinéticas, indicações e dosagem dos novos anticoagulantes orais comparativamente à varfarina
| Características | Varfarina | Dabigatrano | Apixabano | Rivaroxibano | Edoxabano |
|---|---|---|---|---|---|
| Biodisponibilidade (%) | 98 | 6‐7 | 66 | 63‐79 | 50 |
| Tmax (h) | 71‐100 | 2‐3 | 1‐3 | 2‐4 | 1‐3 |
| t ½ (h) | 20‐60 | 12‐17 | 7‐8 | 5‐9 | 9‐11 |
| Ligação proteínas (%) | 99 | 35 | 87 | 7‐13 | 9‐11 |
| Efeitos alimentos | Sim | Atraso absorção | Não | Atraso absorção | Não |
| Posologia (vezes dia) | 1 | 2 | 2 | 1 | 1 |
| Metabolismo/eliminação | 100% hepática | 80% renal 20% hepática | 25% renal 75% intestinal | 1/3 renal 2/3 hepática | 35% renal 65% hepática |
| Substrato CYP | 2C9, 3A4 | Não | 3A4 | 3A4, 2J2 | 3A4 |
| Monitorização | Sim | Não | Não | Não | Não |
| Alvo | II, VII, IX, X, P‐S, P‐C | II | Xa | Xa | Xa |
| Antídoto | Sim | Não | Não | Não | Não |
| Indicações e dose | |||||
| Prevenção primária do TEV na prótese total da anca | Guiada INR | 220mg 1x/dia ou 110mg 2x/dia | 2,5mg 2x/dia | 10mg 1x/dia (ClCr>15mL/min) | |
| Prevenção primária do TEV na prótese total do joelho | 150mg 1x/diaa | ||||
| Tratamento e prevenção secundária do TEV | 1‐21 dias: 150mg 2x/dia (Tratamento com HNF ou HBPM durante≥5 dias) | 1ª semana: 10mg 2x/dia (ClCr>15mL/min) | 1‐21 dias; 15mg 2x/dia | Após tratamento com HNF ou HBPM durante 5‐10 dias: >60 Kg: 60mg 1x/dia ≤ 60 Kg: 30mg 1x/diad | |
| >21 dias 150mg 2x/dia 110mg 2x/diab | >1ª semana a 6 meses: 5mg 2x/dia >6 meses: 2,5‐5mg 2x/dia (ClCr>15mL/min) | >21 dias: 20mg 1x/dia 15mg 1x/dua se ClCr 15‐49mL/min | |||
| Prevenção do AVC nos doentes com FANV | 150mg 2x/dia 110mg 2xdiab | 5mg 2x/dia 2,5mg 2x/diac | 20mg 1x/dia 15mg 1x/dia se ClCr 15‐40mL/min | 60mg 1x/diac | |
| Prevenção de eventos aterotrombóticos após SCA com biomarcadores cardíacos elevados | 2,5mg 2x/dia | ||||
a Nos doentes com IR moderada com ClCr 30‐50mL/min, idade>75 anos ou a receber amiodarona.
b Doentes≥80 anos; a tomar concomitantemente verapamilo; compromisso renal moderado; gastrite, esofagite ou refluxo gastro‐esofágico; doentes a realizar antiagregantes; doentes com risco aumentado de hemorragia.
c Se 2 das 3 condições seguintes: idade≥80 anos, peso<60kg; creatinina≥1,5mg/dL (133 micromol/L).
d Não usar de ClCr>95mL/min pois aumenta o risco de acidente vascular cerebral isquémicos comparativamente com a varfarina. Ajustar dose para 30mg 1x/dia se ClCr 15‐50ml/min. Sem aprovação em Portugal.
FA NV: Fibrilação auricular não‐valvular; CYP: citocromo P450; TEV: tromboembolismo venoso; T ½ vida: tempo de meia vida; T max: tempo para alcançar a concentração plasmática máxima; INR: International Normalized Ratio; HNF: heparina não‐fracionada; HBPM: heparina de baixo peso molecular; SCA: síndrome coronária aguda.
Recomendações para a descontinuação dos NACO, antes de cirurgias com risco de hemorragia baixo (12‐25% de efeito anticoagulante residual na altura da cirurgia) ou elevado (<10% de efeito anticoagulante residual na altura da cirurgia)
| Função renal (ClCr) | Dabigatrano (150mg 2x/dia) | Rivaroxibano (20mg 1x/dia) | Apixabano (5mg 2x/dia) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| T ½ vida | Risco baixo | Risco elevado | T ½ vida | Risco baixo | Risco elevado | T ½ vida | Risco baixo | Risco elevado | |
| >50mL/min | 12‐17h | ≥48h | 2‐4 dias | 5‐9h | ≥24h | ≥2 dias | 7‐8h | 24‐36h | 3 dias |
| 30‐50mL/min | 13‐23h | ≥60h | ≥4 dias | 9‐13h | ≥36h | ≥3 dias | 17‐18h | 48h | 4 dias |
T ½ vida: tempo de meia vida; Cl Cr: clearance de creatinina.
Reintrodução pós‐operatória dos NACO: abordagem sugerida
Os NACO foram testados no tratamento de TEV e comparados com a terapêutica convencional (heparina de baixo peso molecular e/ou varfarina). Alguns destes estudos, como o RE‐COVER I e II, EINSTEIN, AMPLIFY e HOKUSAY, são resumidos de seguida:
- a)
RE‐COVER I e II (Efficacy and safety of dabigatran compared to warfarin for 6 months of acute symptomatic VTE): o estudo compara o dabigatrano com a varfarina após um período inicial de anticoagulação parentérica. O outcome primário, que correspondia à incidência de tromboembolismo venoso recorrente sintomático, ou morte relacionada, ocorreu em 2,4% dos doentes no grupo dabigatrano e 2,1% no grupo varfarina. A incidência de episódio hemorrágico major foi semelhante nos 2 grupos; 1,6% no grupo dabigatrano e 1,9% no grupo varfarina, enquanto o aparecimento de qualquer hemorragia foi ligeiramente superior no grupo da varfarina (21,9 vs. 16,9%). Os autores concluíram que no tratamento do TEV agudo, o dabigatrano é tão eficaz quanto a varfarina, apresentando um perfil de segurança semelhante45,60.
- b)
EINSTEIN (Evaluating Oral, Direct Factor Xa Inhibitor Rivaroxiban in patients with acute symptomatic DVT or PE): o rivaroxibano foi comparado com a terapêutica standard (enoxaparina seguida de varfarina ou acenocumarol ajustada a um INR‐alvo de 2,0‐3,0). O outcome primário, que consistiu na recorrência do TEV, ocorreu em 2,1% dos doentes no grupo do rivaroxibano e 3% no grupo da terapêutica standard, o que traduz uma eficácia semelhante para os 2 esquema anticoagulantes. A ocorrência de hemorragia major ou clinicamente relevante foi idêntica nos 2 grupos, 8,1%. Os autores concluíram que, na dose utilizada, o rivaroxibano em monoterapia tem a mesma eficácia e segurança que o esquema anticoagulante standard61.
- c)
AMPLIFY (The Apixaban for the Initial Management of Pulmonary Embolism and Deep‐Vein Thrombosis as First‐Line Therapy): mostrou que o apixabano teve resultados não inferiores à terapêutica convencional (enoxaparina/varfarina) em relação ao outcome primário que foi o TEV sintomático recorrente ou morte relacionada com o TEV (2,3 vs. 2,7%) e esteve associada a menos eventos hemorrágicos major (0,6 vs. 1,8%, p<0,001)62.
- d)
HOKUSAY (Edoxabano versus warfarin fot the treatment of symptomatic venous thromboembolism): concluiu que o edoxabano, iniciado após o tratamento inicial com heparina, teve resultados não inferiores à terapia standard e causou menos eventos hemorrágicos63.
A dupla antigregação, com AAS e clopidogrel, tem sido o tratamento standard na prevenção secundária de eventos trombóticos em doentes com doença cardiovascular. Contudo, apesar do benefício desta conjugação, os eventos aterotrombóticos continuavam a ocorrer. A juntar a este facto, estão os efeitos variáveis de doses fixas do clopidogrel que levaram à necessidade de desenvolvimento novos agentes.
As novas tienopiridinas, como o prasugrel, produzem uma inibição da agregação plaquetária, induzida pelo ADP, mais potente e consistente. Os inibidores diretos do P2Y12, como o ticagrelor, não só ultrapassam o início e término de ação mais lentos das tienopiridinas, mas também oferecem uma maior potência no bloqueio do recetor ADP. Contudo, o grande desafio destes agentes é a segurança pois, quando adicionadas ao AAS, estão associados a mais eventos hemorrágicos do que o clopidogrel.
Quanto ao papel destes novos fármacos, na DAP, tem sido extensamente investigado e apenas os inibidores dos recetores de ADP demostraram prevenir significativamente os eventos major cardiovasculares nestes doentes. O clopidogrel é o fármaco com o perfil risco/benefício mais favorável e a dupla anti agregação, com a combinação da AAS e clopidogrel, permite reduzir a taxa de amputações major após revascularização, apesar do risco acrescido de hemorragia major.
A anticoagulação oral é uma terapêutica muito eficaz para a prevenção e tratamento dos fenómenos tromboembólicos. Durante muitos anos, os antagonistas da vitamina K eram a única opção terapêutica, contudo com limitações, como a imprevisibilidade do seu metabolismo, farmacocinética e farmacodinâmicas especiais, e necessidade de monitorização laboratorial da sua atividade antitrombótica. Estas limitações levantaram o interesse no desenvolvimento de novos fármacos.
Assim, surgiram o dabigatrano, rivaroxibano e apixabano, atualmente comercializados em Portugal e que apresentam vantagens relativamente aos antagonista da vitamina K, nomeadamente, a sua farmacocinética, com tempos de vida plasmáticos mais curtos, que permitem uma suspensão segura, num tempo mais curto previamente à cirurgia, e o seu metabolismo previsível dispensando a monitorização da sua ação. Contudo, também têm desvantagens como a ausência de antídoto disponível e o seu preço mais elevado.
Apesar de todos os desenvolvimentos atuais e o constante aparecimento de novos fármacos, a busca pelo agente ideal continua: administração oral apenas uma vez por dia, elevada eficácia na redução dos eventos tromboembólicos; cinética e resposta à dose previsíveis; baixa taxa de eventos hemorrágicos; sem necessidade de monitorização da sua ação farmacológica; janela terapêutica alargada; sem necessidade de ajuste de dose; pouca interação com alimentos ou outros fármacos; baixa ligação não‐específica às proteínas plasmáticas; inibição concomitante dos fatores de coagulação livre e ligados ao coágulo. Contudo, com os NACO esta busca já foi iniciada.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.