El síndrome del ligamento arcuato medio (SLAM), o síndrome de compresión del tronco celiaco, es causado por la compresión extrínseca del ligamento arcuato medio, bandas fibrosas prominentes y tejido ganglionar periaórtico. En muchas ocasiones es asintomático, pero puede presentar síntomas como dolor abdominal posprandial o durante el ejercicio náuseas, vómitos y pérdida de peso. Presentamos tres pacientes, uno de ellos asintomático. Los otros dos casos precisaron tratamiento quirúrgico, en uno de ellos mediante liberación laparoscópica y en el otro mediante cirugía abierta. En ambos casos se obtuvo mejoría clínica y seguimiento mediante ecografía doppler-color satisfactorio. El SLAM representa una entidad poco frecuente de dolor abdominal. Las técnicas diagnósticas menos invasivas, como la ecografía doppler-color para el screening y la angioTC preoperatoria, obtienen buenos resultados en comparación con la arteriografía. El tratamiento quirúrgico mediante abordaje laparoscópico, con o sin asociación de tratamiento revascularizador endovascular, constituye una técnica terapéutica segura y eficaz.
Median arcuate ligament syndrome (MALS) or celiac artery compression syndrome is caused by extrinsic compression of the median arcuate ligament, prominent fibrous bands and ganglionic periaortic tissue. It is asymptomatic on many occasions, but can present with symptoms such as, abdominal pain after eating or during exercise, nausea, vomiting, and loss of weight. We present three patients, one of whom was asymptomatic. The other two required surgical treatment, using laparoscopic release in one, and open surgery on the other. A clinical improvement was achieved in both cases and the follow-up by colour Doppler ultrasound was satisfactory. MALS is a rare abdominal pain condition. The less invasive diagnostic techniques, such as colour Doppler ultrasound and pre-operative angioCT, obtain good results compared to angioplasty. Surgical treatment using a laparoscopic approach, whether or not it is associated with endovascular revascularisation treatment, is a safe and effective therapeutic technique.
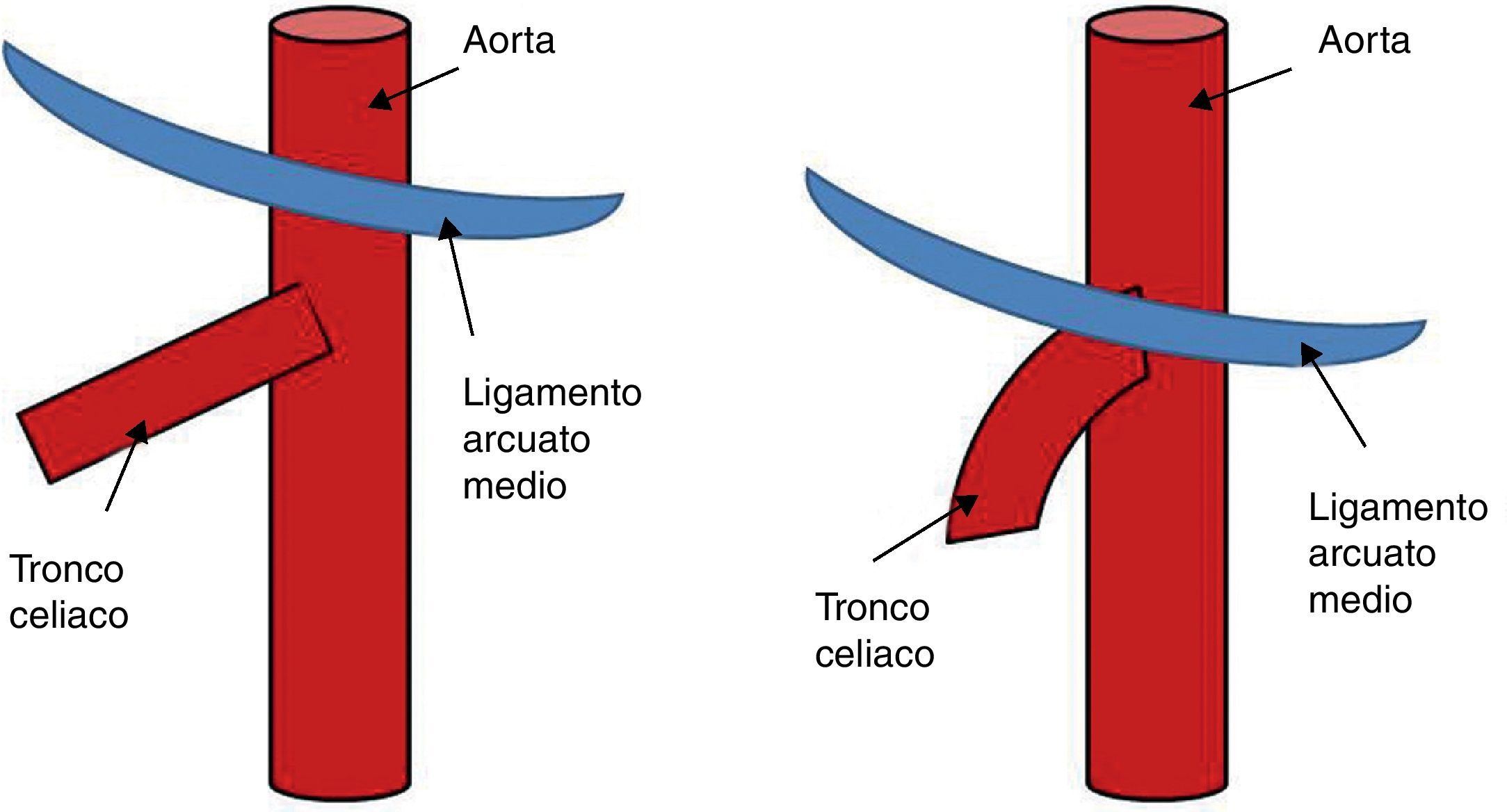
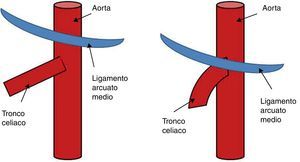
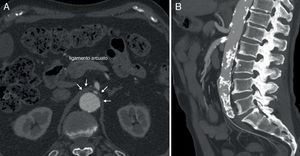
El ligamento arcuato es un arco fibroso que une ambos pilares del diafragma a sendos lados del hiato aórtico. Este ligamento discurre habitualmente por encima del origen del tronco celiaco. Entre el 10 y el 24% de los casos dicho ligamento posee una inserción baja, cruzando la porción proximal del tronco celiaco angulándolo (fig. 1), representando una variante anatómica que por sí misma no es obstructiva. El síndrome del ligamento arcuato o del ligamento arcuato medio (SLAM) es una entidad anatómica y clínica caracterizada por la compresión extrínseca del tronco celiaco. También se denomina síndrome de compresión del tronco celiaco o síndrome de Dunbar. Se cree que la compresión es originada por una inserción anormalmente baja del diafragma o un origen excesivamente alto del tronco celiaco en la aorta. También pueden contribuir a la compresión fibras del ganglio celiaco1. Su incidencia es de 2 por cada 100.000 pacientes con dolor abdominal superior, recurrente e inespecífico2. Stein et al.3, en 2011, han publicado la compresión concomitante de la arteria mesentérica superior y del tronco celiaco por el ligamento arcuato, representando una variante inusual.
Según Ilica et al.4 pueden existir factores congénitos que puedan contribuir a la aparición del SLAM. Se ha descrito su aparición en gemelos monocigóticos5 y con agregación familiar6,7.Ciertos factores congénitos pueden contribuir a una posición relativa variable del tronco celiaco y del ligamento arcuato, lo que es responsable de la compresión, los cuales pueden ser genéticamente heredados. No obstante, Thony et al.8, han sugerido que dichas compresiones no son congénitas y que se ven favorecidas por cambios entre la aorta y las estructuras musculoesqueléticas a lo largo del tiempo.
El presente manuscrito presenta los casos clínicos de tres pacientes con estenosis del tronco celiaco por SLAM. Uno de ellos permaneció asintomático, y otros dos requirieron división del ligamento arcuato, en uno mediante técnica laparoscópica y en otro realizando cirugía abierta de manera simultánea a la resección e injerto de un aneurisma de aorta abdominal concomitante.
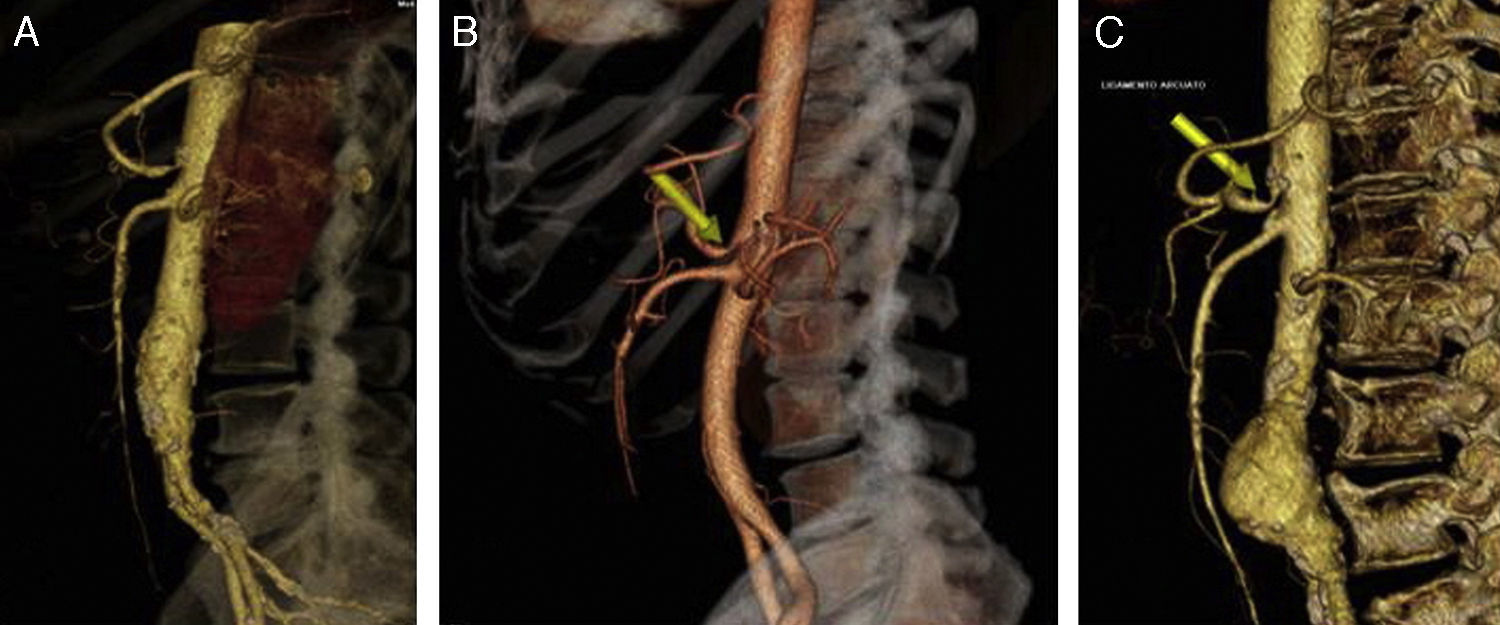
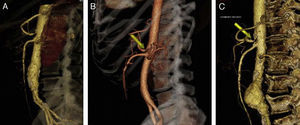
Casos clínicosCaso 1Paciente varón de 70 años con antecedentes de extabaquismo, hipertensión arterial, hipertrofia benigna de próstata, cardiopatía isquémica crónica (infarto agudo de miocardio revascularizado mediante tres stents coronarios convencionales) y hemorragia digestiva secundaria a angiodisplasia de colon. Acude por claudicación intermitente invalidante. Durante el estudio de imagen con angioTC (angiografía mediante tomografía axial computarizada con contraste intravenoso) (fig. 2A) se objetiva la presencia de estenosis del tronco celiaco por la presencia de ligamento arcuato, no presentando dolor abdominal, pérdida de peso o ninguna clínica relacionada con el síndrome del ligamento arcuato. Diagnosticado de hallazgo casual asintomático del SLAM, se decide seguimiento con revisiones anuales mediante ecografía-doppler.
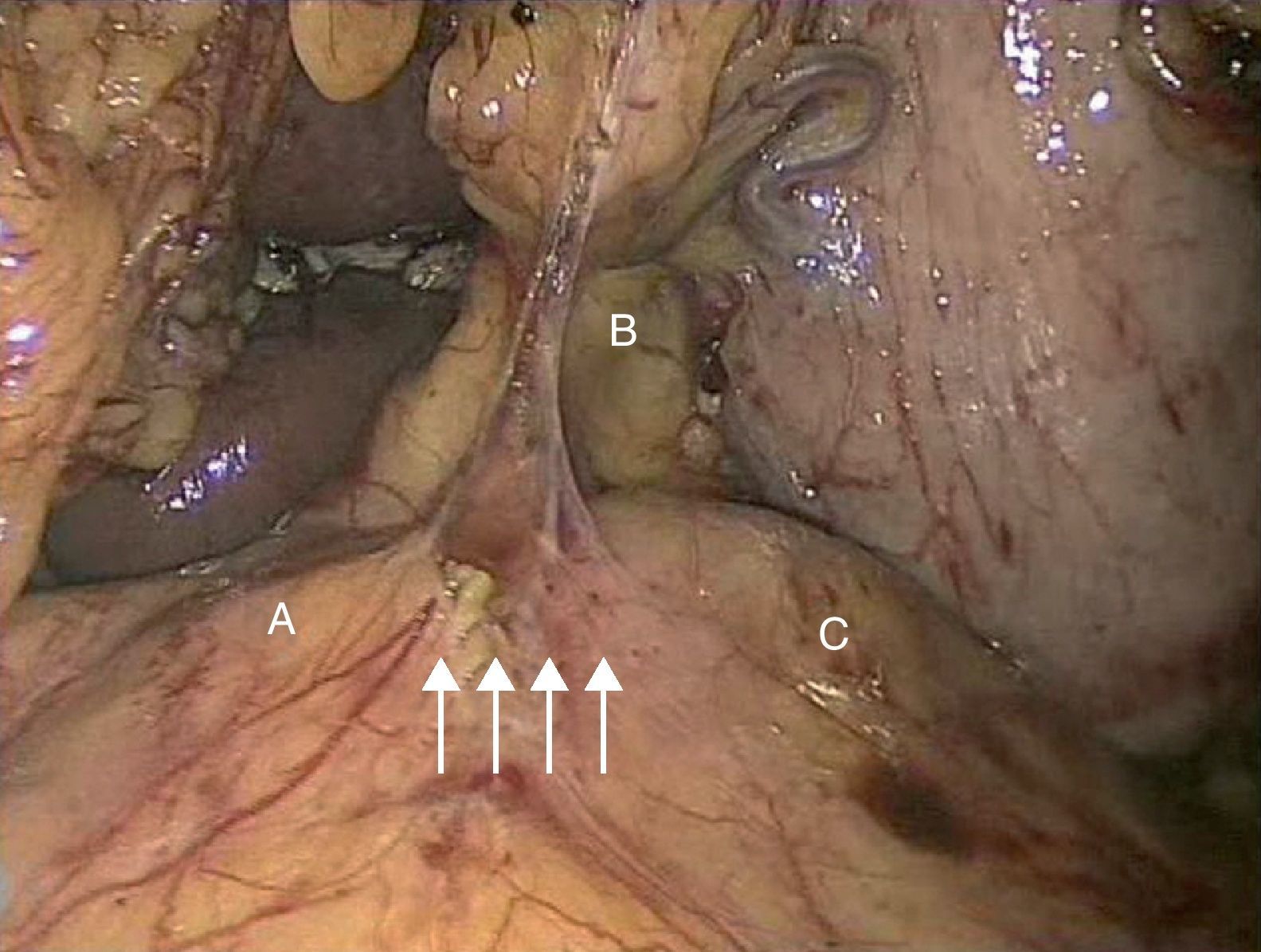
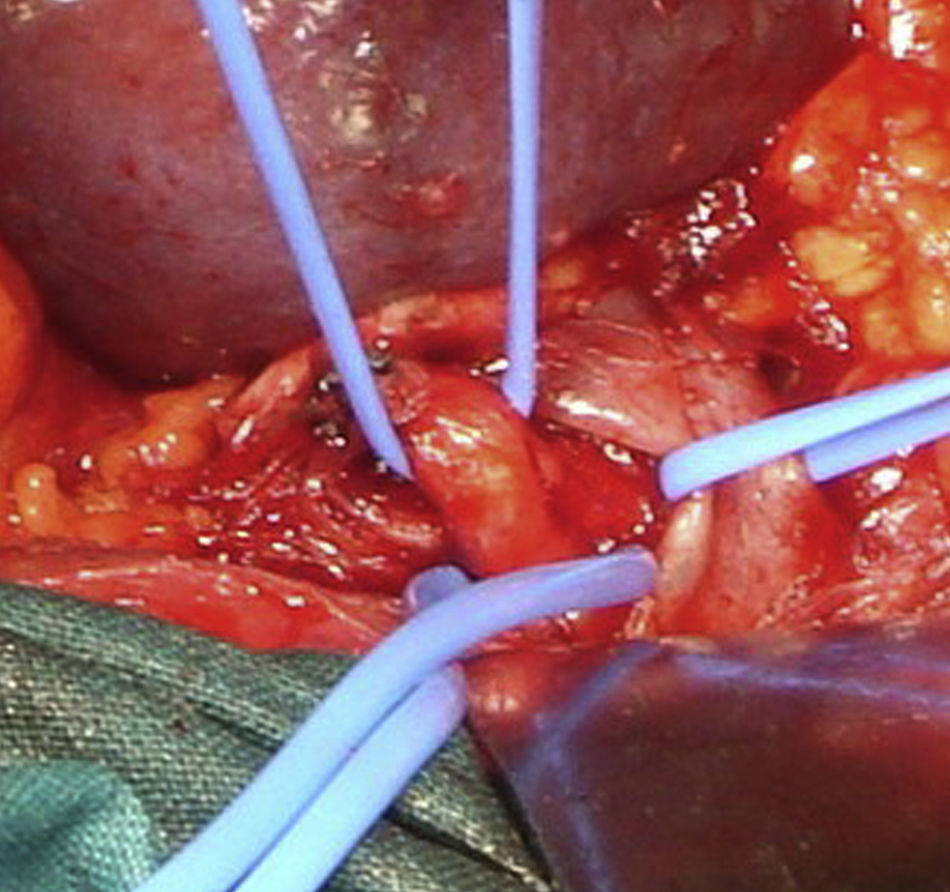
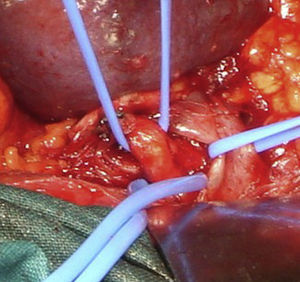
Caso 2Paciente varón de 52 años que ingresa por dolor abdominal posprandial acompañado de síndrome constitucional y pérdida de peso de más de 10 kilos en los últimos 6 meses. Como antecedentes personales presenta hepatitis C, episodios de fiebre de Malta y herpes zoster, y ha sido intervenido de herniorrafia inguinal izquierda. A la exploración física presenta pulsos a todos los niveles y un soplo a nivel epigástrico. La palpación abdominal es normal, sin alteraciones en el hemograma ni en la bioquímica. En el examen mediante angioTC (fig. 2B) se objetiva estenosis del tronco celiaco originada por compresión extrínseca a nivel de los pilares del diafragma. Con el diagnóstico de SLAM se realiza la liberación mediante laparoscopia del tronco celiaco (fig. 3). Al tercer día postoperatorio el paciente es dado de alta, remitiendo los síntomas al mes de la intervención. En el estudio mediante eco-doppler del tronco celiaco no se obtienen estenosis hemodinámicamente significativas, por lo que no se realiza ningún tipo de tratamiento revascularizador.
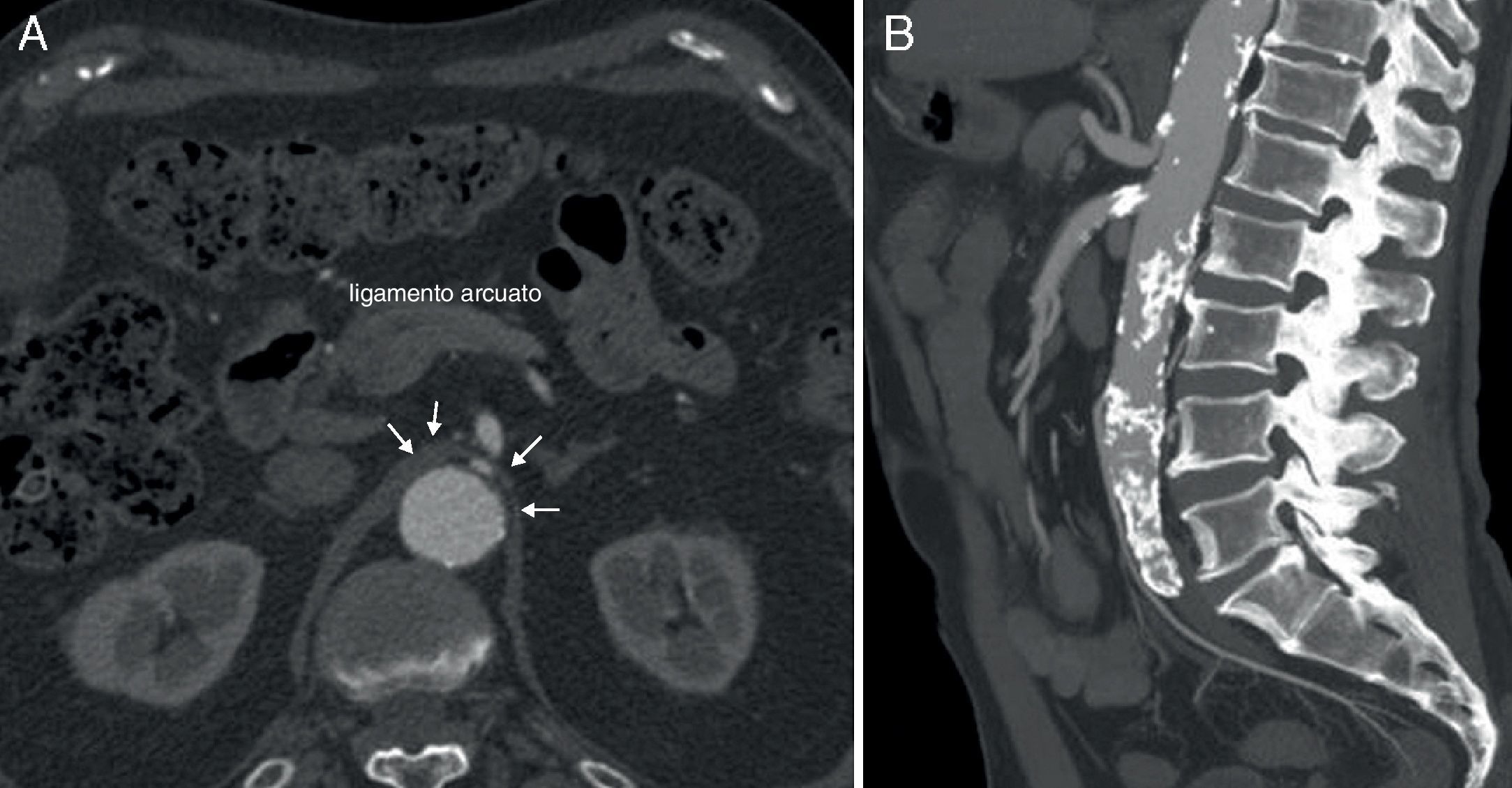
Caso 3Mujer de 63 años que es remitida al Servicio de Angiología y Cirugía Vascular por aneurisma de aorta abdominal de 51mm. de diámetro máximo y crecimiento de 11mm durante el último año. Como antecedentes personales solamente destacan hábito tabáquico e hipertensión arterial. Durante el estudio preoperatorio mediante angioTC (fig. 2C), además de confirmarse el diagnóstico de AAA, se halla la existencia de un SLAM, además de placas de ateromatosis a nivel del ostium de la arteria mesentérica superior que originan una estenosis aproximada del 80% (fig. 4). La paciente fue sometida a resección del AAA e injerto término-terminal de dacron mediante laparotomía media. Durante el mismo acto quirúrgico se procedió a la descompresión del tronco celiaco (fig. 5), comprobándose mediante arteriografía intraoperatoria la no necesidad de realización de ningún procedimiento revascularizador concomitante. Tras dos años de la cirugía la paciente se encuentra asintomática y el estudio mediante eco-doppler es normal.
DiscusiónAspectos anatómicos e histológicosEl diafragma en el SLAM forma bandas fibrosas que conectan ambos pilares y rodean al hiato aórtico anteriormente. Su forma, consistencia y localización varía en las diferentes personas, el cual, en ocasiones, comprime el extremo superior del tronco celiaco. Estudios in vivo han demostrado variaciones en el grado de compresión con los movimientos respiratorios, relacionado con un desplazamiento inferior de la aorta y un desplazamiento anterior del ligamento arcuato durante la inspiración9. Por lo tanto, el origen del tronco celiaco y el ligamento arcuato se acercan durante la espiración y se alejan durante la inspiración.
La localización final del origen del tronco celiaco puede variar durante la embriogénesis, lo que se piensa que es la etiología de este síndrome. Histológicamente, la compresión extrínseca sobre el tronco celiaco produce una serie de cambios en la pared arterial, incluyendo hiperplasia intimal, proliferación de fibras elásticas en la capa media y desorganización de la adventicia5. Estos hechos justifican que la simple liberación quirúrgica del tronco celiaco no sea suficiente para eliminar los síntomas en todos los casos y haya que realizar ulteriores intervenciones de revascularización.
No obstante, en presencia de un flujo arterial excelente a través de la arteria mesentérica superior, la intensidad de los síntomas asociados con SLAM apunta a una etiología multifactorial, no relacionada en exclusiva con la circulación mesentérica, sino también con otras funciones, como neurogénicas y/o endocrinas10.
ClínicaLa presentación clínica del SLAM es muy variable y su diagnóstico se realiza habitualmente por exclusión. Entre el 76 y 90% de las ocasiones se demuestra su existencia sin el desarrollo de síntomas11. Los síntomas derivados del SLAM son raros de encontrar, principalmente gracias al desarrollo de vasos colaterales. El tipo más común de colaterales son las arcadas pancreaticoduodenales, las cuales son formadas por la persistencia de la arteria longitudinal anterior durante el desarrollo embrionario. Estas arcadas se desarrollan en el caso de compresión del tronco celiaco, y en la mayoría de los casos compensan los síntomas isquémicos mediante revascularización reversa6.
No obstante, la mayoría de los pacientes son mujeres jóvenes, con una complexión delgada, aquejadas de dolor. El dolor se localiza en el epigastrio y empeora tras las comidas, el ejercicio o al inclinarse. La desaparición del mismo puede obtenerse adoptando una posición con las rodillas pegadas al pecho. El mecanismo no está completamente explicado. Existen diferentes teorías, pero la más aceptada es que el incremento de la demanda de sangre a través del tronco celiaco comprimido origina cierto grado de isquemia intestinal y el subsecuente dolor. Otra teoría se basa en una isquemia de intestino delgado motivado por un fenómeno de robo; sangre del territorio de la arteria mesentérica superior es derivada a través de colaterales para compensar la deficiencia originada por un tronco celiaco estenosado. La teoría menos aceptada sugiere que el dolor es causado directamente por irritación crónica del plexo celiaco, o indirectamente por sobrestimulación del plexo celiaco con una consecuente vasoconstricción esplácnica e isquemia10,12.
Además de dolor, los pacientes pueden experimentar náuseas, vómitos y diarrea. La pérdida de peso es también común y se ha relacionado con miedo a la comida o miedo al dolor originado al comer. El examen físico puede detectar un soplo o thrill a nivel del epigastrio.
DiagnósticoEl amplio empleo de la ecografía hace a esta modalidad el método diagnóstico de elección. Debe incluir una valoración mediante ecografía doppler-color con medidas de las velocidades sanguíneas en el tronco celiaco al final de la inspiración y al final de la espiración. Velocidades pico mayores a 200cm/s sugieren una estenosis significativa13. También se puede observar flujo reverso en la arteria hepática común. Una velocidad de flujo aumentada durante la espiración profunda se conoce como «la señal dúplex del síndrome de compresión de la arteria celiaca». Esta técnica puede emplearse como un método de screening, pero sus resultados deben ser confirmados con otras modalidades diagnósticas. Además la experiencia del examinador es un factor crucial en sus resultados.
La arteriografía aórtica lateral continúa siendo el gold standard para el diagnóstico del SLAM. Los principales signos angiográficos son la compresión del tronco celiaco en las fases espiratoria e inspiratoria finales. Otros hallazgos típicos incluyen el estrechamiento focal del tronco celiaco proximal y la dilatación postestenótica. Dicho afilamiento es variable durante el ciclo respiratorio, acentuándose durante la espiración y disminuyendo durante la inspiración, secundario al desplazamiento fisiológico de la aorta hacia delante y abajo durante la inspiración. Las proyecciones anteroposteriores pueden mostrar el incremento de la red colateral en el territorio de distribución del tronco celiaco.
La angioRM (angiografía mediante resonancia magnética nuclear) ha sido descrita como de gran utilidad en niños y adolescentes en del diagnóstico del SLAM. En comparación con el eco-doppler no se afecta por el aire intestinal, y además permite la valoración de la totalidad de la vasculatura entérica y la anatomía abdominal, permitiendo el diagnóstico diferencial de otras causas de isquemia mesentérica. La angioTC se trata de una exploración más rápida, incluyendo la opción en los equipos de última generación de angioTC en 4 dimensiones, añadiendo una valiosa información hemodinámica adicional13. Desafortunadamente, la necesidad de contrastes yodados y la exposición a la radiación son aspectos contraproducentes a tener en cuenta. Adicionalmente, la angioTC permite información sobre la anatomía local y la presencia de calcificaciones arteriales concomitantes. Un aspecto técnico a tener en cuenta es el hecho de que habitualmente la angioTC se realiza durante inspiración máxima (momento de menor compresión del tronco celiaco por parte del ligamento arcuato) y para un mejor estudio debería realizarse al final de la espiración. Se ha propuesto el empleo de angioTC sincronizada con electrocardiograma (ECG) para la mejora de adquisición de las imágenes diagnósticas14. Los criterios para distinguir esta identidad de estenosis ateroscleróticas del tronco celiaco son la observación del aspecto ganchudo debido al pliegue (especialmente en la porción proximal del tronco celiaco) y a la indentación del borde aórtico adyacente15. La evaluación ideal se realiza mediante reconstrucciones en 3D en plano sagital, para la valoración del tronco celiaco proximal.
La tonometría gástrica durante ejercicio ha sido recientemente descrita como la prueba clave en los pacientes con sospecha de SLAM al poder detectar isquemia gastrointestinal, seleccionando aquellos pacientes que se pueden beneficiar del tratamiento16. Esta técnica consiste en la medida de pCO2 gástrico durante ejercicio en bicicleta durante 10 minutos. En todos los casos de isquemia originados por SLAM diagnosticados mediante esta técnica desaparecieron los síntomas tras la liberación del tronco celiaco16.
TratamientoEl tratamiento del SLAM se basa en la restauración del flujo sanguíneo normal en el tronco celiaco y en la eliminación de la irritación neuronal producida por las fibras del ganglio celiaco.
La técnica quirúrgica clásica se fundamenta en la división del ligamento arcuato y la exéresis de las fibras constrictivas del plexo celiaco mediante la realización de una laparotomía media. Desde 1985 Reilly et al.17 describieron los criterios que se correlacionaban con el éxito de la intervención, que son: presencia de dolor posprandial, edad entre 40 y 60 años, sexo femenino, pérdida de peso mayor a 20 libras y un angiograma en el que se observara una dilatación postestenótica del tronco celiaco o un incremento del flujo colateral. Sin embargo, en más del 15% de los pacientes esta intervención no mejora la estenosis arterial o los síntomas de los pacientes18. No obstante, la mayor serie publicada hasta la actualidad de pacientes sometidos a tratamiento quirúrgico abierto es la de Reilly17, con 51 pacientes, describiendo los dos pilares del tratamiento: la descompresión celiaca y el aseguramiento de su permeabilidad. Sus resultados en cuanto a morbilidad y mortalidad hacen de esta técnica quirúrgica un procedimiento seguro17,19. La liberación del ligamento arcuato mejora los síntomas en el 53% de los pacientes, mientras que la adición de un procedimiento revascularizador incrementa el éxito hasta el 76% de los pacientes17.
En dichas ocasiones, debido a la lesión en la pared arterial concomitante, se debe añadir una reconstrucción vascular, cuyas técnicas descritas en este territorio incluyen el parche de angioplastia en el tronco celiaco, el bypass aortoceliaco con vena safena o protésico y la reimplantación del tronco celiaco en la aorta. Una sencilla indicación para la realización de la reconstrucción vascular es si en el momento de la laparotomía se encuentra un tronco celiaco estenosado o con thrill a la palpación1. También se puede valorar el gradiente de presión entre la aorta y el tronco celiaco, de manera invasiva o mediante ecografía doppler, considerándose un gradiente de presión de 10mm Hg significativo. También se ha descrito la sustitución de estas técnicas de reconstrucción por procedimientos endoluminales, como la angioplastia con o sin colocación de stent en el tronco celiaco.
El tratamiento endovascular exclusivo mediante angioplastia/stent ha obtenido malos resultados debido al origen de este síndrome con la compresión extrínseca de las fibras diafragmáticas10, además de los cambios permanentes en la pared del vaso1. Debe estar limitado al tratamiento de la enfermedad estenótica residual tras la descompresión extrínseca mediante laparoscopia o cirugía abierta. Sin embargo, la revascularización abierta puede ser preferible en situaciones con síntomas recurrentes tras la realización de tratamiento endovascular20.
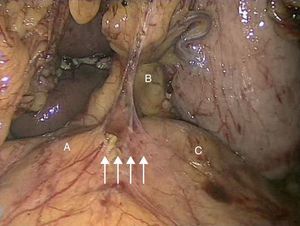
La laparoscopia para el tratamiento del SLAM fue descrita por primera vez por Roayaie et al. en 200021. Durante la intervención se pueden dividir las bandas fibrosas del ligamento arcuato, incluidas las fibras del ganglio celiaco que rodeen al tronco celiaco, dejando a la arteria completamente libre en toda su circunferencia, permitiendo la esqueletización de la misma22. La exposición adecuada se realiza mediante la división del ligamento gastrohepático y la identificación de las ramas del tronco celiaco. El peritoneo posterior es abierto y los dos pilares del diafragma expuestos23. Las bandas fibrosas del ligamento arcuato son divididas longitudinalmente, permitiendo la visualización de la superficie anterior de la aorta y la exposición del tronco celiaco. La disección del vaso suele realizarse con la pinza de cauterio y una manipulación cuidadosa, debido a que se trata de vasos muy friables24. Tras la realización de la técnica laparoscópica, si persisten los cambios degenerativos en la pared arterial, debe realizarse una técnica de revascularización quirúrgica, tanto abierta como endovascular. Las ventajas de dicha técnica incluyen la rápida recuperación, la temprana movilización, la corta duración de la hospitalización y el escaso dolor postoperatorio25. En el 2007 se ha descrito el abordaje robótico laparoscópico del SLAM empleando el sistema quirúrgico da Vinci26. Roseborough24 presentó en 2009 una serie de 15 pacientes tratados mediante descompresión laparoscópica del ligamento arcuato. El éxito en cuanto a mejoría de los síntomas alcanzó al 93,3% de los pacientes; no obstante, tuvo que reconvertirse la técnica a cirugía abierta en 4 ocasiones debido a sangrado intraoperatorio, además de añadir procedimientos revascularizadores en el 40%. Van Petersen et al.27, en 2009, presentaron 46 pacientes tratados mediante liberación endoscópica retroperitoneal del SLAM, con una única reconversión a cirugía abierta y la aparición de neumotórax en tres casos.
ConclusionesA pesar de que la angiografía sigue siendo la prueba diagnóstica de referencia, la angioTC es capaz de confirmar los típicos hallazgos de imagen del SLAM, demostrando el estrechamiento focal característico del tronco celiaco por las fibras musculares. Tras el screening inicial mediante ecografía doppler-color, esta prueba puede ser definitoria. La liberación laparoscópica del ligamento arcuato en el SLAM es técnicamente factible y segura, siendo una opción mínimamente invasiva respecto a la cirugía abierta. El papel del tratamiento endovascular mediante angioplastia/stent debería limitarse al tratamiento de estenosis residuales tras la descompresión extrínseca.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.