Las infecciones de endoprótesis aórticas son infrecuentes pero devastadoras. El tratamiento no está estandarizado, resultando una decisión compleja y en muchos casos urgente.
ObjetivosDescribir el diagnóstico, el tratamiento y la evolución de los casos de infección de endoprótesis aórtica abdominal (EVAR) y torácica (TEVAR) tratados en un único centro.
MétodosEstudio observacional, retrospectivo, descriptivo que incluyó pacientes con infección endoprotésica tratados entre 1998 y 2015. Se recogió la indicación del implante inicial, intervenciones posteriores, tiempo hasta la infección, clínica, pruebas complementarias, tratamiento y evolución.
ResultadosRegistramos 9 infecciones: 5 EVAR (1,2%) y 4 TEVAR (4,2%). La mediana de edad fue de 77años (rango, 62-85). Detectamos 5 infecciones tras implantes urgentes (5 de 9) y 3 tras intervenciones secundarias (3 de 9). La mediana de tiempo hasta la infección fue de 3,5meses (rango, 0-109,5). Realizamos 7 explantes de endoprótesis (5 EVAR y 2 TEVAR), con reparación in situ con prótesis de dacrón-plata (n=5) o bypass axilobifemoral (n=2). En 2 TEVAR el tratamiento fue conservador por elevado riesgo quirúrgico dadas sus comorbilidades. La mortalidad a 30días fue del 44,4% (4 de 9 pacientes), todos tras tratamiento quirúrgico. La mortalidad global fue del 66,6% (6 de 9 pacientes). Solo falleció un paciente con tratamiento conservador tras 2años de seguimiento debido a una fístula aortoesofágica. Tres pacientes están en seguimiento (2 explantes y uno conservador) tras 121, 74 y 51meses, respectivamente.
ConclusionesLa mortalidad de los pacientes con infección endoprotésica es elevada, independientemente del tratamiento. El tratamiento conservador es una buena opción en nuestra experiencia, y la cirugía, una alternativa que debería emplearse en función de las características del paciente.
Aortic endograft infections are uncommon. However, they are usually life-threatening. Treatment is not standardised, making this disease complex, and in most cases, an urgent situation.
ObjectivesTo describe the diagnosis, treatment, and follow-up of all cases diagnosed with infected aortic endograft (abdominal-EVAR, and thoracic-TEVAR) in our Hospital.
MethodsAn observational and retrospective study was conducted using data collected between 1998 and 2015. A descriptive analysis is presented on the primary indication for treatment, secondary procedures, the time-lapse between the diagnosis and primary treatment, type of repair, follow-up, and mortality.
ResultsOf the 9 patients with infected aortic endografts, 5 were with EVAR (1.2%) and 4 with TEVAR (4.2%). The median age was 77years (range, 62-85). Five patients received a primary urgent endograft (5 of 9). Three patients had secondary procedures before the infection diagnosis (3 of 9). The median time between primary repair and diagnosis was 3.5 months (range, 0-109.5). Explantation was performed on 7 patients. Two patients received medical treatment due to their increased surgical risk. The 30 day mortality was 44.4% (4 of 9 patients), and the overall mortality was 66.6% (6 of 9 patients). One patient with medical treatment died due to an aortic-oesophageal fistula after 2years of follow-up. Three patients are still alive (2 explantations, and 1 with medical treatment) after 121, 74, and 51 months, respectively.
ConclusionsEndograft infections mortality is high, despite the treatment used. Medical treatment is a good choice in our experience. Surgical treatment is an alternative depending on the fitness and comorbidities of the patient.
Las infecciones de endoprótesis aórticas suponen un reto considerable para cualquier cirujano vascular. Su incidencia varía entre el 0,2 y el 5%1-3 en los casos de reparación con endoprótesis abdominales (EVAR) y entre el 1,5% y el 4,8%4,5 en la reparación con endoprótesis torácicas (TEVAR).
La causa más frecuente de infección es la contaminación perioperatoria, aunque también se encuentra asociada a diseminación hematógena, inmunodeficiencia, reintervenciones y al desarrollo de fístulas aortobronquiales (FAB), aortoesofágicas (FAE) o aortoentéricas (FAEN)6,7. Su presentación clínica es inespecífica, por lo que requiere un alto nivel de sospecha.
Elegir el mejor tratamiento resulta complejo. Se han propuesto diferentes tratamientos4-6: explante y realización de bypass in situ o el bypass extraanatómico con ligadura de muñón aórtico; semiconservadores, en los que se realiza drenaje de abscesos más lavado intrasaco con antibióticos sin realizar explante, y el tratamiento conservador con antibioterapia a largo plazo.
En este estudio examinamos la clínica, el diagnóstico, el tratamiento y la evolución de todos los pacientes tratados en nuestro centro con infección de endoprótesis aórtica.
Material y métodosDiseñoRealizamos un estudio observacional, retrospectivo, incluyendo los pacientes intervenidos de EVAR y TEVAR entre enero de 1998 y diciembre de 2015 en nuestro hospital. Se incluyeron los pacientes tratados de urgencia (rotura de aneurismas aórticos, roturas traumáticas, aneurismas sintomáticos, disección tipo B de Stanford complicada, úlcera aórtica) o tratados de manera programada (patología aneurismática aortoiliaca, aneurismas de aorta torácica descendente, disección crónica tipo B de Stanford, endofugas). Identificamos y describimos los casos de infección de endoprótesis.
Variables de estudioSe recogieron las variables edad, sexo y comorbilidades: diabetes, hipertensión arterial, tabaquismo, dislipemia, patología cardiológica o pulmonar, antecedentes quirúrgicos, insuficiencia renal crónica (tasa de filtración glomerular <60l/min), accidentes cerebrovasculares y cáncer).
Se describió la indicación del implante endoprotésico inicial e intervenciones posteriores previas por cualquier causa (vascular u otro tipo) previas a la infección. Se revisó la etiología de la infección y el tratamiento empleado.
El diagnóstico de infección se estableció mediante una prueba de imagen positiva. En todos los casos se realizó angio-TC, que se consideró positiva si presentaba evidencias de gas intraaórtico o periprotésico, colecciones periaórticas y fístulas. La trombosis del dispositivo se consideró diagnóstica de infección en presencia de otro criterio de infección, como la clínica (fiebre >38°C, sepsis), datos analíticos (proteínaC reactiva [PCR] >5mg/l y leucocitosis [11.000 leucocitos/μl]), y cultivos positivos. No hubo ningún paciente que fuera diagnosticado de infección de endoprótesis con angio-TC negativa inicialmente. Se recogió el tiempo transcurrido hasta la infección (en meses). En pacientes con diagnóstico inicial de aneurisma micótico se consideró infectada la endoprótesis desde el implante.
Describimos la mortalidad, indicando la causa y el tiempo transcurrido desde la colocación de la prótesis.
Tratamiento quirúrgico de la aorta abdominalSe realizó el abordaje mediante laparotomía media de la aorta abdominal infrarrenal, pinzamiento suprarrenal o inserción de balón de oclusión aórtica. Posteriormente se realizó explante de la endoprótesis, lavado del lecho quirúrgico con rifampicina e implante de bypass in situ con prótesis de dacrón-plata (Maquet-Rastatt, Alemania).
Como alternativa, realizamos un bypass axilobifemoral de PTFEe (W.L. Gore & Associates Inc., Flagstaff, Arizona, EE.UU.), explante de la endoprótesis y ligadura de muñón aórtico.
Tratamiento quirúrgico de la aorta torácicaSe realizó en primer lugar un bypass axilofemoral8 para mantener la perfusión visceral durante el pinzamiento de la aorta torácica. Posteriormente se practicó una toracotomía izquierda a través del quinto espacio intercostal, explante de la endoprótesis y reparación in situ mediante bypass de aorta torácica con prótesis de dacrón-plata y retirada del bypass axilofemoral. Como alternativa realizamos explante y bypass axilobifemoral.
Tratamiento médicoEl tratamiento conservador fue consensuado entre el equipo quirúrgico y el servicio de enfermedades infecciosas para aquellos pacientes que, estables clínicamente, presentasen un elevado riesgo quirúrgico dadas sus comorbilidades. Se empleó antibioterapia de amplio espectro, con ajuste posterior según antibiograma y mantenimiento a largo plazo tras el alta. Estos pacientes precisaron un ingreso hospitalario mínimo de 4semanas.
Análisis estadísticoSe realizó un análisis descriptivo. Los datos se presentan como porcentajes y proporciones o mediana y rango intercuartílico. Se describe la incidencia de infección. Se empleó el paquete estadístico STATA12 (StataCorp LP, 4905 Lakeway Drive College Station, Texas, EE.UU.).
ResultadosDurante el período de estudio se realizaron 411 EVAR, identificando 5 infecciones (1,2%), y 96 TEVAR, identificando 4 casos de infección (4,2%). Se realizaron 36 EVAR (36 de 411; 8,7%) y 26 TEVAR (26 de 96; 27%) urgentes. Solo hubo una mujer. La mediana de edad fue de 77años (rango, 62-85). Las características basales y la indicación de tratamiento inicial se recogen en la tabla 1. El 55,5% de los casos (5 de 9 pacientes) fueron implantes urgentes. En un paciente con rotura de aneurisma micótico torácico roto y en otros 2 con sospecha no confirmada de infección se decidió tratamiento endovascular dadas sus comorbilidades. En todos los casos se emplearon endoprótesis de la casa comercial Medtronic (Santa Rosa, California, EE.UU,), 4 Valiant Captivia, una Talent y 4 Endurant. La profilaxis antibiótica empleada en todos los casos (incluidos los implantes urgentes) consistió en la administración de 2g de cefazolina intravenosa previo a la inducción anestésica o 1g de vancomicina intravenosa en pacientes alérgicos.
Características basales, detalles de implante e intervenciones secundarias
| Caso | Comorbilidades | Indicación del implante inicial | Prótesis inicial | Intervenciones posteriores |
|---|---|---|---|---|
| 1 | HTA, DM, DL, fumador, cáncer renal | Aneurisma de arteria iliaca primitiva bilateral de 5cm | EAUI+BPFF | Nefroureterectomía laparoscópica |
| 2 | HTA, DL, FA, ACVA | AAA de 7cm e hipogástrica izquierda de 4cm | EABI + embolización hipogástrica | - |
| 3 | HTA, exfumador, FA, MCD, ICC, EPOC, TEP | AAA de 7cm | EABI +, embolización hipogástrica | BPFF de PTFEe por trombosis de extensión iliaca derecha. Sustitución de bypass de PTFE por vena safena (infección). Trombectomía bypass. Drenaje absceso inguinal. Drenaje absceso retroperitoneal |
| 4 | HTA, DL, Exfumador, ACVA, cáncer próstata | AAA de 6,3cm | EABI | EAUI+BPFF por endofuga tipo IB. Implante de extensión iliaca por crecimiento de aneurisma iliaco y endofuga tipo IB |
| 5 | Exfumador | Úlcera aórtica. Rotura de aorta torácica descendente | TEVAR | - |
| 6 | HTA, Exfumador, CI, ACVA, nódulo pulmonar, síndrome de Leriche | Úlcera aórtica. Rotura de aorta torácica descendente | TEVAR | - |
| 7 | HTA, fumadora, IRC | Disección de aorta tipo B | TEVAR | Bypass axilobifemoral por progresión de luz falsa, con oclusión aorta diafragmática e isquemia de miembros inferiores |
| 8 | DM, DL, trasplante cardiaco, EPOC, IRC, AAA | Rotura de aneurisma micótico de aorta torácica descendente | TEVAR | TEVAR proximal por nueva rotura 48 h tras el primer implante |
| 9 | HTA, DM, CI, IRC, cáncer vesical | Rotura de AAA de 6cm | EAUI+BPFF | - |
AAA: aneurisma de aorta abdominal; ACVA: accidente cerebrovascular; BPFF: bypass femorofemoral; CI: cardiopatía isquémica; DL: dislipemia; DM: diabetes mellitus; EABI: endoprótesis aortobiiliaca; EAUI: endoprótesis aortouniiliaca; EPOC: enfermedad pulmonar obstructiva crónica; EVAR: reparación con endoprótesis abdominales; FA: fibrilación auricular; HTA: hipertensión arterial; ICC: insuficiencia cardiaca congestiva; IRC: insuficiencia renal crónica; MCD: miocardiopatia dilatada; PTFE: Politetrafluoroetileno; PTFEe: Politetrafluoroetileno expandido; TEP: Tromboembolia pulmonar; TEVAR: reparación con endoprótesis torácicas.
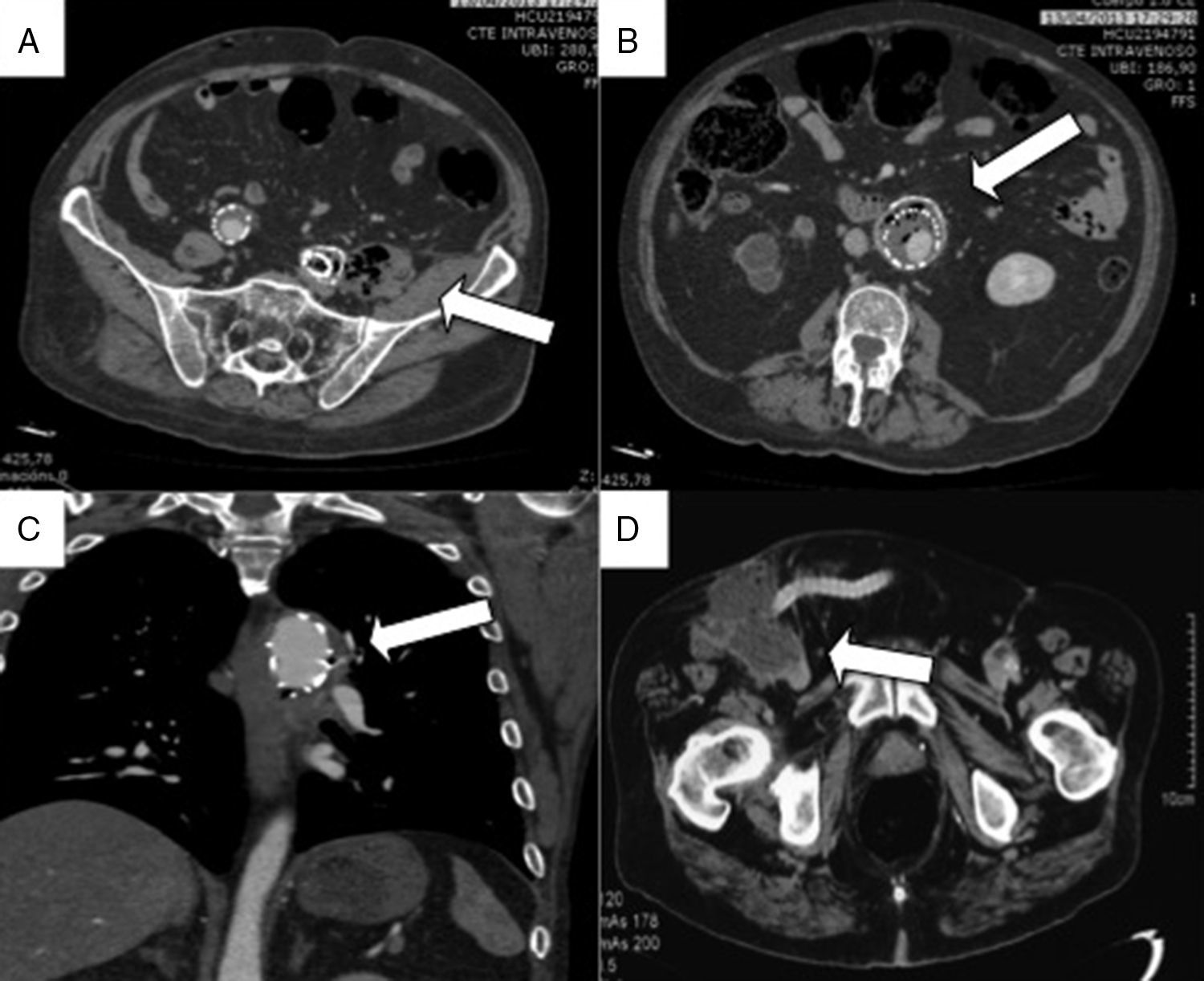
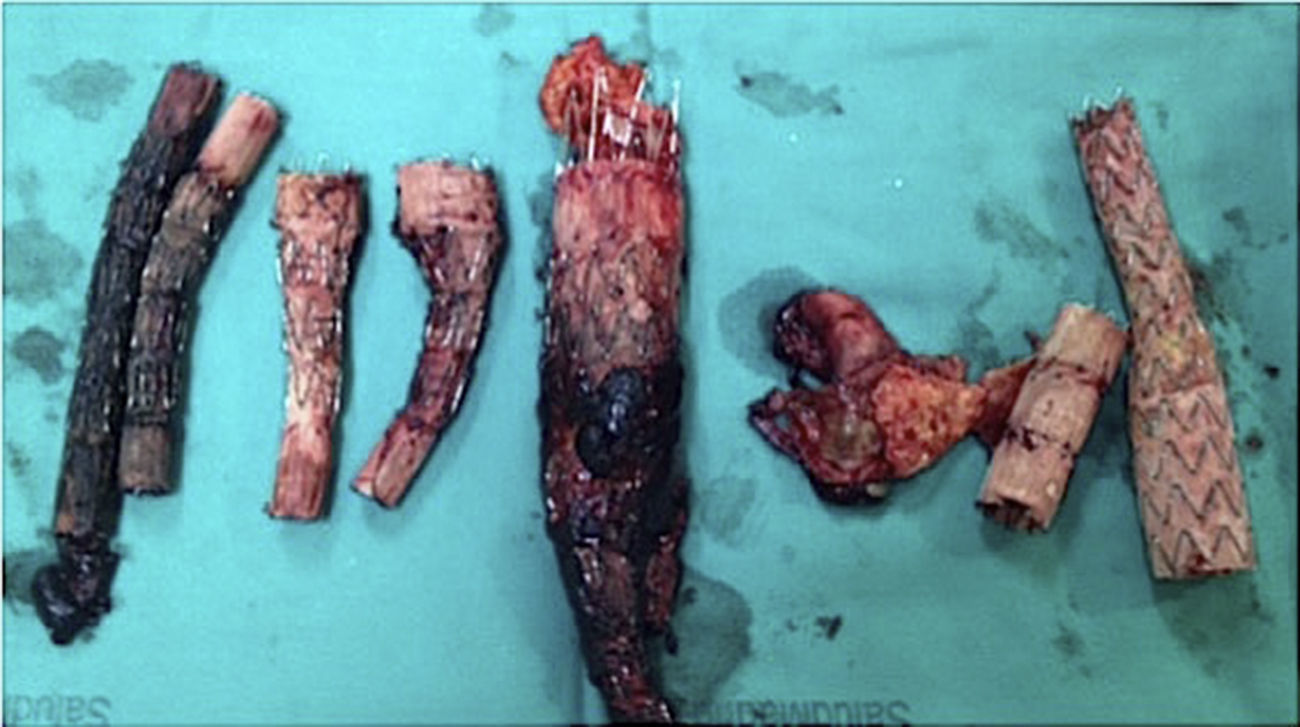
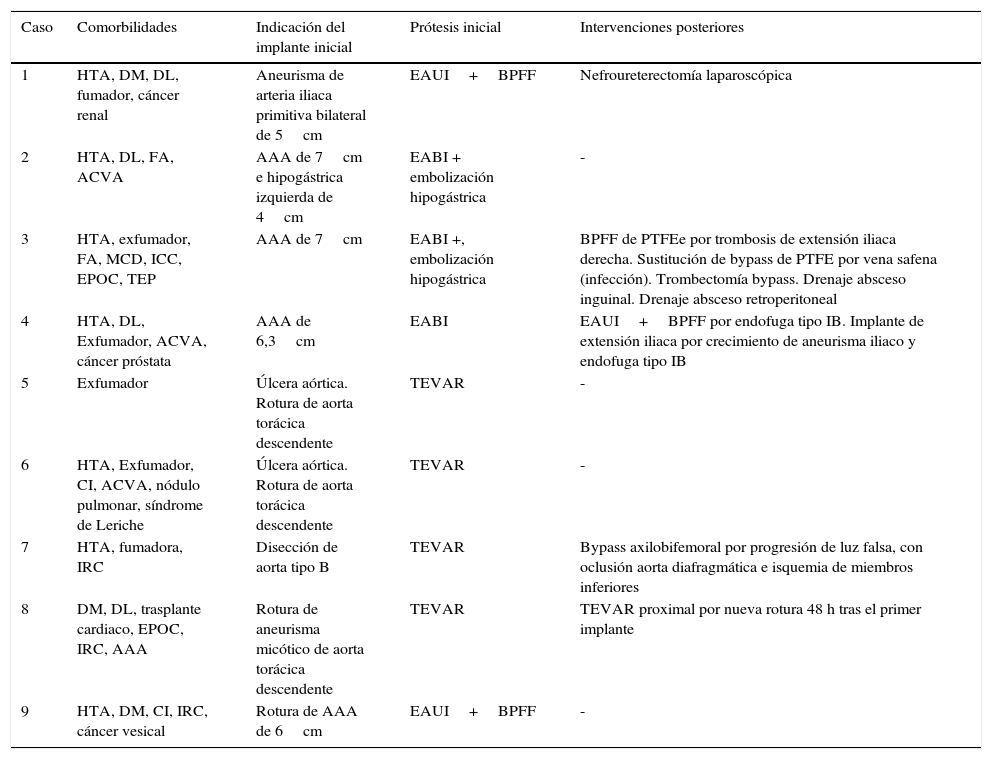
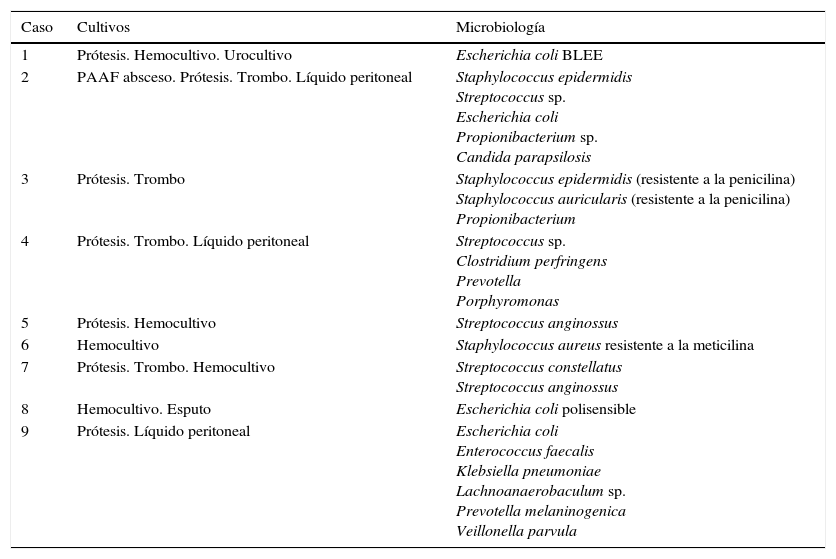
La mediana de tiempo hasta el diagnóstico de infección fue de 3,5meses (rango, 0-109,5). En la tabla 2 se recogen la clínica, las pruebas complementarias y la etiopatogenia de la infección. En 3 pacientes la infección se relacionó con una intervención posterior al implante, y en 4, con fístulas (3 FAEN y una FAE). En la angio-TC se hallaron evidencias de infección en todos los casos (fig. 1), siendo el hallazgo más frecuente la presencia de gas periprotésico o intraaórtico (7 de 9 pacientes). El cultivo de la prótesis fue positivo en 7 casos. En la tabla 3 se recogen los microorganismos aislados en cada paciente.
Signos y síntomas de infección, hallazgos analíticos, angio-TC y etiología de la infección
| Caso | Días hasta el diagnóstico | Síntomas | PCR (mg/l) | Hemograma | Etiología | Angio-TC |
|---|---|---|---|---|---|---|
| 1 | 104 | Fiebre (39°C). Taquicardia. Hematuria. Piuria. Isquemia MMII | 81 | 20.100 leucocitos/μl. 86% neutrófilos | Absceso intraabdominal posnefrectomía | Absceso. Trombosis endoprótesis |
| 2 | 123 | Fiebre (38,5°C). Sudoración nocturna. Síndrome constitucional. Dolor MII | 217,3 | 11.700 leucocitos/μl. 82% neutrófilos | FAEN | Gas en saco aneurismático. Absceso en psoas. Fístula aortoduodenal |
| 3 | 101 | Absceso inguinal e intraabdominal. Afebril | - | - | Absceso inguinal, infección BPFF | Absceso periprotésico en rama iliaca. Gas en saco aneurismático |
| 4 | 2.293 | Síndrome constitucional. Dolor MII. Hipotensión | 408 | 22.500 leucocitos/μl. 92,6% neutrófilos | Absceso psoas. FAEN | Gas en saco aneurismático y endoprótesis. Gas intramuscular psoas izquierdo |
| 5 | 59 | Fiebre (39°C). Hematemesis. Dolor lumbar | 122 | 12.800 leucocitos/μl. 73% neutrófilos | Úlcera esofágica | Gas periprotésico |
| 6 | 0 | Dolor pleurítico. Taquicardia | 311 | 14.900 leucocitos/μl. 80% neutrófilos | Úlcera esofágica | Gas periprotésico |
| 7 | 3285 | Hematemesis. Shock séptico | - | 21.200 leucocitos/μl. 91,7% neutrófilos | FAE | Gas intraaórtico |
| 8 | 0 | Fiebre 38°C. Hemoptisis. Dolor abdominal | 162 | 9.200 leucocitos/μl. 79,9% neutrófilos | Bacteriemia por patología abdominal | Aneurisma sacular con cambios inflamatorios y gas periaórtico |
| 9 | 61 | Shock séptico. Isquemia MID | 150,6 | 30.500 leucocitos/μl. 83,3% neutrófilos | FAEN | Gas en saco aneurismático |
BPFF: bypass femorofemoral; FAE: fístula aortoesofágica; FAEN: fístula aortoentérica; MID: miembro inferior derecho; MII: miembro inferior izquierdo; MMII: miembros inferiores.
Cultivos y microorganismos detectados
| Caso | Cultivos | Microbiología |
|---|---|---|
| 1 | Prótesis. Hemocultivo. Urocultivo | Escherichia coli BLEE |
| 2 | PAAF absceso. Prótesis. Trombo. Líquido peritoneal | Staphylococcus epidermidis Streptococcus sp. Escherichia coli Propionibacterium sp. Candida parapsilosis |
| 3 | Prótesis. Trombo | Staphylococcus epidermidis (resistente a la penicilina) Staphylococcus auricularis (resistente a la penicilina) Propionibacterium |
| 4 | Prótesis. Trombo. Líquido peritoneal | Streptococcus sp. Clostridium perfringens Prevotella Porphyromonas |
| 5 | Prótesis. Hemocultivo | Streptococcus anginossus |
| 6 | Hemocultivo | Staphylococcus aureus resistente a la meticilina |
| 7 | Prótesis. Trombo. Hemocultivo | Streptococcus constellatus Streptococcus anginossus |
| 8 | Hemocultivo. Esputo | Escherichia coli polisensible |
| 9 | Prótesis. Líquido peritoneal | Escherichia coli Enterococcus faecalis Klebsiella pneumoniae Lachnoanaerobaculum sp. Prevotella melaninogenica Veillonella parvula |
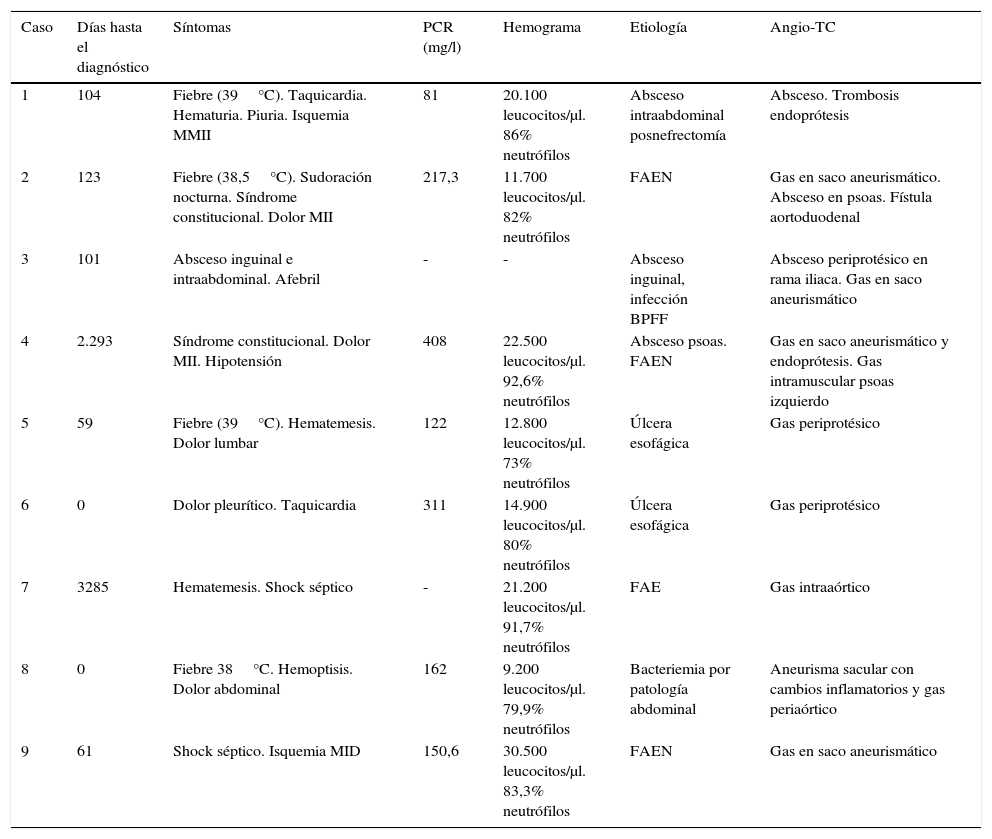
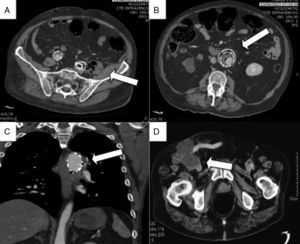
La tabla 4 describe el tratamiento y la evolución de cada paciente. La mortalidad a 30días fue del 44,4% (4 de 9 pacientes), todos tras tratamiento quirúrgico, y la mortalidad global fue del 66,6% (6 de 9 pacientes) durante el seguimiento. En 7 de los 9 pacientes se realizó explante de la endoprótesis (fig. 2), 5 EVAR y 2 TEVAR. De los pacientes EVAR, 2 fallecieron durante las primeras 24h debido a fallo multiorgánico, 2 durante el primer mes tras la intervención debido a rotura aórtica visceral y perforación de colon respectivamente, y uno el día 45 tras la intervención. Dos pacientes continúan en seguimiento: un EVAR y un TEVAR. En 2 pacientes TEVAR (pacientes número 6 y 8) se realizó tratamiento conservador. Ambos fueron clasificados como riesgo anestésico ASAIV. En el paciente número6 su edad (85años), el antecedente de cardiopatía isquémica y la presencia de un nódulo pulmonar en estudio fueron las características que nos hicieron optar por tratamiento médico, al considerarlo un paciente con un pronóstico vital reducido y que toleraría mal la cirugía; en el paciente número 8 su edad (80años) y los antecedentes de EPOC y trasplante cardiaco podrían haber dificultado el abordaje quirúrgico. El paciente número 6 falleció tras 2años de seguimiento por hematemesis debido a una FAE. Dada la estabilidad clínica del paciente número 8 tras el inicio del tratamiento antibiótico, 3meses tras el diagnóstico se realizó una gammagrafía con leucocitos marcados que fue negativa; sin embargo, sí se registró actividad inflamatoria en PET-TAC. Seis meses tras el diagnóstico no presenta signos de infección en angio-TC. Cincuenta y un meses tras el diagnóstico el paciente sigue con tratamiento antibiótico y sin síntomas de infección, aunque no disponemos de una nueva prueba de imagen.
Tratamiento y evolución
| Caso | Riesgo anestésico | Tratamiento de la infección | Seguimiento |
|---|---|---|---|
| 1 | ASA III | Explante+BP in situ con prótesis de plata | Vivo: 121 meses de seguimiento |
| 2 | ASA IV | Explante+BP AxBiF Reparación de fístula 2.° tiempo | Fallecido: día 23 postoperatorio |
| 3 | ASA IV | Explante+BP in situ con prótesis de plata | Fallecido: día 45 postoperatorio |
| 4 | ASA IV | Explante+BP in situ con prótesis de plata | Fallecido: 14 h postoperatorio |
| 5 | ASA III | Explante+BP in situ con prótesis de plata. BP axiloiliaco temporal | Vivo: 74 meses de seguimiento |
| 6 | ASA IV | Conservador. Antibioterapia | Fallece 24 meses tras la intervención por FAE |
| 7 | ASA IV | Explante+ligadura aórtica y reparación de fístula | Fallecido: día 24 postoperatorio |
| 8 | ASA IV | Conservador. Antibioterapia | Vivo: 51 meses de seguimiento |
| 9 | ASA IV | Explante+BP in situ con prótesis de plata | Fallecido. 5 h postoperatorio |
AxBiF: axilobifemoral; BP: bypass; FAE: fístula aortoesofágica.
En nuestra serie, la incidencia de infección de endoprótesis tras EVAR es del 1,2%. En el caso de la aorta torácica nuestra incidencia es del 4,2%; sin embargo, si excluimos a los 3 pacientes con sospecha de aneurisma micótico en el implante inicial, sería de 1,04%. Estos datos son semejantes a lo descrito en la literatura1-5.
El implante urgente de endoprótesis se ha relacionado con mayor riesgo de infección6,9. En nuestra serie se realizaron 5 implantes urgentes. Cernohorsky et al.1 describen una serie de 11 pacientes en los que 5 implantes fueron urgentes. Capoccia et al.9 describen 8 casos urgentes de un total de 26 infecciones en EVAR. Las intervenciones posteriores al implante de una endoprótesis también se asocian a infección10,11. En nuestra serie hemos registrado intervenciones tras el implante en 3 pacientes (una intervención urológica y 2 vasculares). La presencia de FAE o FAB tiene especial relevancia en el desarrollo de infecciones en TEVAR12-14. Moulakakis et al.12 refieren un 51% de FAE y un 15,6% de FAB como causa de infección en TEVAR. Podemos distinguir entre fistulas primarias, ocasionadas por la propia acción del aneurisma sobre estructuras vecinas, o secundarias, relacionadas con la erosión de la pared aórtica y esofágica/bronquial en la zona de fijación proximal por la endoprótesis (dada la rigidez del dispositivo y la angulación), la necrosis isquémica de la pared esofágica por la cobertura de colaterales o el exceso de sobredimensionamiento de la endoprótesis14.
La mediana de tiempo hasta la infección fue de 3,5meses, lo que indica una estrecha relación entre el implante y la infección endoprotésica. No obstante, también registramos 2 casos en que la infección apareció de manera tardía, en los pacientes 4 y 7, tras 6 y 9años, respectivamente, por lo que el riesgo de infección persiste en el tiempo.
La sintomatología es habitualmente inespecífica, y exceptuando los casos de hematemesis, hemoptisis o rectorragia, que sugieren la presencia de una fístula, se requiere un alto nivel de sospecha clínica. Los síntomas más frecuentes son el dolor inespecífico (abdominal, lumbar, torácico), descrito entre el 44 y el 75% de los casos, y la fiebre, entre el 33 y el 81%15-17 de los casos. Otras manifestaciones son un síndrome constitucional, fenómenos isquémicos por embolismos sépticos o sepsis. En nuestra serie, la fiebre y el dolor (4 de 9 pacientes) fueron los síntomas más frecuentes. En 2 pacientes el diagnóstico inicial fue la isquemia de miembros inferiores, en uno de ellos por trombosis de la endoprótesis y en el otro por trombosis de un bypass femorofemoral. Esta forma de presentación puede demorar el tratamiento definitivo del paciente debido a la confusión en el diagnóstico.
Todos los pacientes en nuestra serie presentaron evidencia de infección en angio-TC, detectando gas periprotésico o intraaórtico en 8 de 9 pacientes, y la presencia de un absceso en el restante. La presencia de fístulas tampoco resultó inusual. Ante estos datos parece que la angio-TC parece ser el método inicial más adecuado para establecer el diagnóstico de infección endoprotésica. La angio-TC es la prueba de imagen inicial que se realiza con mayor frecuencia, aunque puede presentar cambios relacionados con la cirugía durante los 3 primeros meses. Otras pruebas de imagen empleadas son la resonancia nuclear magnética, que detecta mejor signos inflamatorios periaórticos, la gammagrafía con leucocitos marcados o la PET-TAC, aunque puede dar falsos positivos las primeras 6-8semanas18.
Los patógenos más frecuentes fueron Staphylococcus spp. (3 de 9 casos) y Streptococcus spp. y Escherichia coli (4 de 9 casos), respectivamente. Hubo 4 casos de infección polimicrobiana, incluyendo también patógenos anaerobios además de los ya citados. Todos los pacientes con infecciones polimicrobianas fallecieron en el postoperatorio, 2 de ellos en menos de 24h, lo que indica la gravedad de este tipo de infecciones. En todos los pacientes se obtuvo algún cultivo positivo, resultando de especial utilidad el cultivo de la endoprótesis (7 de 9 casos).
Se realizaron 7 explantes de endoprótesis (5 EVAR y 2 TEVAR), de los cuales, con excepción de 2 pacientes (un EVAR y un TEVAR), el resto fallecieron en el postoperatorio. Al menos 3 de los pacientes intervenidos (2 EVAR y un TEVAR) acudieron en estado de shock séptico, lo que ensombrece el pronóstico, independientemente del tratamiento empleado. Esta razón podría justificar la elevada mortalidad en el grupo de pacientes quirúrgicos. En cuanto a los pacientes con tratamiento antibiótico, uno falleció tras 2 años de seguimiento debido a una FAE. Pese al tratamiento, la mortalidad asociada a este tipo de infecciones es muy elevada. En EVAR, Davila et al.15 refieren una mortalidad perioperatoria del 8%, que asciende al 25% durante el seguimiento. Así mismo, describen una alta morbilidad en el perioperatorio, con un 33% de pacientes que precisaron diálisis por fallo renal agudo. Capoccia et al.9, en el registro multicéntrico R.I.EVAR sobre infecciones en EVAR refieren una mortalidad de hasta el 50%. Para el tratamiento se han descrito diferentes técnicas quirúrgicas: explante y bypass in situ con injerto criopreservado, con vena femoral o vena safena interna en espiral, prótesis de dacrón impregnada en rifampicina o plata, o la realización de bypass axilobifemoral5,19-24. Se ha descrito en la literatura la inferioridad del bypass extraanatómico respecto a la reparación in situ24. Smeds et al.25 recogen en un estudio multicéntrico la que es la serie más extensa publicada hasta la fecha, con 206 infecciones de endoprótesis (180 EVAR y 26 TEVAR). Según sus resultados, el tratamiento quirúrgico conlleva una mortalidad a 30días del 11%, y hasta del 49% tras 5años de seguimiento, con peor pronóstico en caso de emplear prótesis sin antibiótico. El tratamiento conservador en infecciones de EVAR tiene resultados similares al explante, con una mortalidad hasta del 45-50%9,26.
En TEVAR, Moulakakis et al.12, en un metaanálisis en que comparan tratamiento conservador frente a explante, observan mayor supervivencia con el tratamiento quirúrgico, con una mortalidad del 46% en explante frente al 81,8% en el grupo de tratamiento médico. Además, indican que la asociación de tratamiento semiconservador realizando drenaje de las colecciones purulentas más antibioterapia intrasaco al tratamiento médico con antibioterapia puede mejorar la supervivencia de estos pacientes. Por otro lado, Lyons et al.17 recogen una mortalidad de 100% pese a drenaje del absceso y antibioterapia prolongada en pacientes con TEVAR por complicaciones aórticas.
Basándonos en nuestra experiencia, el tratamiento conservador es una buena opción que permite una supervivencia prolongada aunque no elimine la aparición de complicaciones a largo plazo. La cirugía se debería emplear en aquellos casos en que la condición clínica del paciente lo permita. En pacientes inestables, con presencia de fístulas concomitantes e infecciones polimicrobianas, la mortalidad con tratamiento quirúrgico y sin él es muy elevada, resultando la experiencia del equipo quirúrgico crucial a la hora de plantear el mejor tratamiento a ofrecer al paciente.
Este estudio presenta numerosas limitaciones. Se trata de un estudio retrospectivo con un grupo pequeño y heterogéneo de pacientes. Tampoco se realiza un análisis estadístico que permita identificar factores de riesgo. La realización de registros de ámbito nacional permitiría conocer la variabilidad clínica y terapéutica en nuestro territorio. Conociendo los resultados de nuestra experiencia global podríamos homogeneizar y optimizar el tratamiento de este tipo de pacientes.
ConclusiónEl implante urgente de endoprótesis, así como la realización de nuevas intervenciones tras el implante, se relacionan con un mayor riesgo de infección. Pese al tratamiento, la mortalidad es alta, especialmente en pacientes inestables, con fistulas o infecciones polimicrobianas. En nuestra experiencia, el tratamiento conservador tiene unos resultados aceptables, reservando la cirugía para pacientes con características más favorables.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de la información contenida en este artículo se presentó durante el 40th VEITH Symposium, en Nueva York, Estados Unidos, en noviembre de 2014.