INTRODUCCION
El Anisakis simplex (AS) es un nematodo de distribución mundial que parasita en su forma adulta reproductora a los mamíferos marinos y en los diferentes estadios larvarios a peces y cefalópodos.
Su localización geográfica es prácticamente universal y la infestación frecuente. En el área mediterránea se han descrito numerosas especies de peces parasitados, entre las que se encuentran: escombriformes (melva, pez sable, caballa, jurel), gadiformes (merluza, bacaladilla) y perciformes (pargo y boga de mar). En el Atlántico Norte se encuentra principalmente en clupeiformes (arenque), gadiformes (merluza, bacalao, bacaladilla, merlán y eglefino), escombriformes (caballa, gallineta nórdica), pleuronectiformes (fletán y rodaballo) y escorpeniformes (charrasco)1. Ocasionalmente se han hallado larvas de AS en peces de agua dulce2, si bien se ha atribuido al hecho de haber sido alimentados con deshechos marinos infestados y no tratados. El salmón, al tener parte de su ciclo en el mar, puede estar parasitado2.
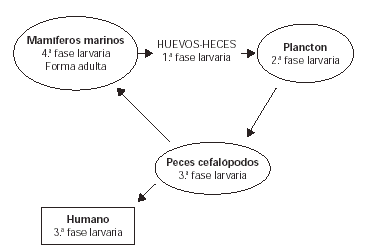
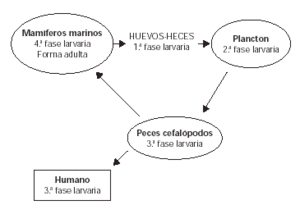
La forma adulta parasita mamíferos marinos (ballenas, focas, etc.). Los huevos son expulsados con las heces del animal, desarrollándose en el agua la primera fase larvaria. Estas larvas son ingeridas por pequeños crustáceos tipo plancton (segunda fase larvaria) que a su vez son ingeridas por peces y cefalópodos. En ellos la larva atraviesa la barrera digestiva y migra a los tejidos, donde desarrolla la tercera fase larvaria, que es la que parasita al humano, en el caso de que ingiera estos peces o cefalópodos.
El hombre es un hospedador ocasional y en él la larva no puede completar su ciclo vital. En el caso de que los peces parasitados sean ingeridos por un mamífero marino, la larva progresa al cuarto estadio y posteriormente al estadio adulto completándose el ciclo (fig. 1).
Figura 1.--Ciclo biológico del Anisakis simplex.
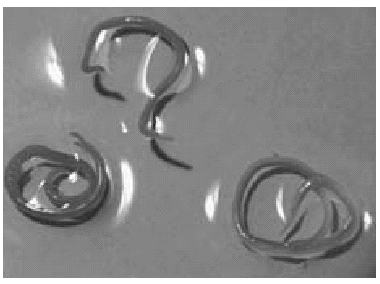
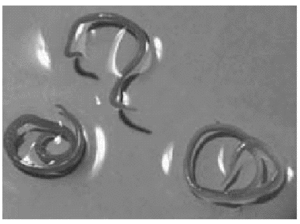
Las larvas en estadio III pueden observarse enrolladas en espiral plano en el músculo o vísceras de los peces o cefalópodos. Morfológicamente el cuerpo del AS es cilíndrico, blanquecino y de unos 30 mm de longitud; sin embargo, cuando lo observamos encapsulado en la musculatura de los peces varía su aspecto, adaptando en ocasiones un color pardo3 (fig. 2).
Figura 2.--Larvas de Anisakis simplex.
PREVALENCIA
El estudio más amplio sobre prevalencia se ha realizado en Japón. Analizando 34.400 pacientes con urticaria o alergia alimentaria, se detectó IgE específica frente a AS en 29,8 % de los individuos analizados4.
En ese mismo país, con un alto consumo de pescado crudo, otro estudio detecta IgE específica frente a AS en el 33 % de pacientes con dermatitis atópica, 75 % de pacientes con urticaria y en el 10 % de los controles sanos5. También se ha descrito IgG frente a AS, alcanzando tasas del 33 %, en pacientes con Anisakiosis6.
La incidencia de las reacciones alérgicas frente a AS es muy desigual en el conjunto de la geografía española: se encuentra una alta incidencia en el centro y noreste de la península, mientras son poco frecuentes los casos en la zona sur y sureste de España7. Además de la distinta procedencia del pescado consumido, dependiente de los distintos caladeros donde faenan las flotas pesqueras y que pueden presentar una mayor o menor infestación del pescado consumido, también pueden influir las costumbres locales en hábitos alimentarios. La forma de cocinar el pescado puede variar de una plancha de calor moderado en el interior del pescado en Norte y Centro a una fritura a alta temperatura y más prolongada, en el Sur8.
En adultos la prevalencia de sensibilización a AS en España varía, según los distintos estudios, entre un 6 y un 56 %9-11. Según estudio de Del Pozo, en el País Vasco, la sensibilización frente a AS era del 22 % en los pacientes con urticaria/angioedema12.
Un estudio de prevalencia entre todos los pacientes que acudían a una consulta hospitalaria de alergología realizado en Madrid muestra una sensibilización del 16 y del 21,8 % mediante prueba cutánea e IgE específica respectivamente13. También se ha demostrado IgE específica frente a AS en población general, con una frecuencia entre el 10 y el 15 %5,14.
Las sensibilizaciones asintomáticas se puede explicar por el elevado consumo de pescado y la alta frecuencia de parasitación del pescado por AS o por la existencia de reactividad cruzada con otros nematodos o artrópodos.
La posibilidad de existencia de sensibilización a AS aumenta con la edad, en sujetos con elevada IgE total10 y en aquellos que consumen frecuentemente pescado fresco15.
FORMAS CLINICAS
En contraste con otras infestaciones por nematodos, la enfermedad puede ser causada por un solo parásito, aunque se han descrito infestaciones masivas16-17.
Al ingerir pescado crudo o poco cocinado (ahumados, en vinagre, ceviche, marinado, salazón, escabechado, etc), parasitado por AS, el ser humano puede presentar distintas manifestaciones clínicas1,18.
Los síntomas se desarrollan como resultado de una reacción inflamatoria, cuando la cabeza de la larva se adhiere o penetra en la mucosa del tubo digestivo. Las manifestaciones clínicas dependerán de la zona del tubo digestivo donde se localice la larva y del tipo de reacción a la que de lugar.
La localización más frecuente es el estómago19,20 o el intestino21-23. La anisakiosis gástrica se caracteriza por dolor abdominal localizado en epigastrio, de tipo cólico, que puede acompañarse de náuseas, vómitos o incluso alteraciones del ritmo intestinal, si afecta al intestino delgado. En este caso, el diagnóstico puede confirmarse mediante endoscopia, con visualización del parásito; su extracción hará desaparecer los síntomas. Cuando el proceso presenta un curso crónico, la formación de abcesos o granulomas gástricos24 o intestinales puede simular cuadros de pseudoobstrucción intestinal, apendicitis aguda o episodios de enfermedad inflamatoria intestinal25-30. Se han descrito cuadros extradigestivos en relación con la penetración de la larva en la pared del tubo digestivo y su migración a pulmón, hígado u otros órganos31.
La larva de AS también puede producir una reacción alérgica de tipo inmediato, dando lugar a manifestaciones sistémicas que van desde la urticaria o angioedema hasta el shock anafiláctico32-34. Se han descrito casos de enfermedad ocupacional (asma y conjuntivitis) por sensibilización a AS35-38, así como dermatitis de contacto39 y artralgias tras la exposición al parásito40,41.
La historia clínica de estos pacientes es la presencia de síntomas a los pocos minutos o varias horas después de haber ingerido pescado fresco o poco cocinado. Asimismo, refieren buena tolerancia al pescado implicado en varias ocasiones. Al realizar el estudio alergológico presentan pruebas cutáneas e IgE específica positivas frente a AS con una importante elevación de la IgE sérica total42,43.
Algunos pacientes presentan un cuadro mixto de urticaria y/o angioedema (síntomas alérgicos) acompañado de clínica abdominal (epigastralgia, vómitos, etc.), que se ha descrito como "anisakiosis gastroalérgica"44. En esta situación los síntomas digestivos suelen preceder a los síntomas alérgicos, con una latencia media respecto a la ingesta del pescado parasitado de 3 h y 5 h, respectivamente.
El hemograma suele permanecer dentro de los parámetros establecidos como normales, aunque la fórmula leucocitaria puede mostrar leucocitosis con neutrofilia y eosinofilia no muy intensa, observándose en algunos casos aumento posterior de la cifra de eosinófilos a partir de las 24 h del inicio del cuadro clínico. Las determinaciones bioquímicas no suelen verse alteradas, salvo que sean secundarias a complicaciones del tipo pseudo-obstrucción (vómitos de repetición). Los niveles séricos de proteína catiónica del eosinófilo pueden estar muy elevados, aunque no es una técnica de uso habitual45.
Las pruebas de diagnóstico por imagen no suelen ser necesarias. En los cuadros intestinales sería de elección la ecografía, aunque los signos observados son inespecíficos: engrosamiento de la pared intestinal, líquido libre, estrechamiento de la luz y disminución del peristaltismo45.
ANTIGENOS DEL ANISAKIS SIMPLEX
Se conocen tres grupos de moléculas antigénicas del AS46:
1. Antígenos somático. Son los antígenos más abundantes con un peso molecular entre 13-150 kDa. Entre ellos se incluyen proteínas de la vía de la neoglucogénesis y de la síntesis de ácidos grasos. Algunas de estas proteínas, las biotinizadas, presentan reactividad cruzada con otros ascáridos. Estos antígenos se obtienen por homogenización de las larvas enteras y contienen todas las proteínas solubles del parásito47.
2. Antígeno secretor-excretor. Se sintetiza en dos estructuras, la glándula esofágica dorsal o las células secretoras del tracto digestivo que son la mayor fuente de enzimas histolíticas (con actividad proteolítica e hialuronidasa). Estas moléculas ayudan al parásito a penetrar en la mucosa gástrica y pueden degranular mastocitos en ratones sensibilizados. Los anticuerpos frente a estos antígenos son los primeros en aparecer48. Este complejo antigénico puede obtenerse mediante incubación de las larvas vivas en un medio de cultivo apropiado durante largos periodos de tiempo y en el que es liberado por las larvas47,49-50. Los pesos moleculares de las proteínas de este antígeno son varios, pero se ha demostrado que las proteínas de bajo peso molecular (14, 17 y 18 kDa) sólo son reconocidas por los sueros de los ratones infectados con la larva viva del As. Una posible explicación es que los antígenos con bajo peso molecular son producidos únicamente cuando la larva esta viva51. En recientes estudios se ha demostrado que las larvas del estadio III de AS incubadas en un medio ácido diluido liberan una cantidad considerable de proteínas al medio. Las variables temperatura y concentración del medio más óptimas fueron de 37 °C y una concentración de ácido clorhídrico entre 50 y 100 mmol/l, similar a la del jugo gástrico52.
3. Antígeno de superficie. Corresponde a moléculas expresadas en la cutícula del parásito, que también se encuentran en otros nematodos. Este antígeno se expresa cuando la larva evoluciona del estadio III al IV. Aunque se ha sugerido que son menos antigénicas y específicas que los antígeno secretor-excretor y somático, se ha demostrado en recientes estudios que son fuente de muchas proteínas reconocidas por los anticuerpos del ratón infestado. Posiblemente estas moléculas juegan un papel importante en el desarrollo de un estímulo crónico, como en el caso de los granulomas53.
Tanto en SDS-PAGE como en técnicas de inmunotransferencia, los antígenos de superficie y secretor-excretor se comportan de forma muy distinta, según se encuentren en el tercero o en el cuarto estadio de la fase larvaria, sugiriendo una alta especificidad de estadio. Por el contrario, el antígeno somático mantiene un patrón de bandas similar en ambos estadios, lo que indica su conservación durante el desarrollo del parásito54.
REACTIVIDAD CRUZADA
Se ha relacionado a la tropomiosina existente en el AS con la reactividad cruzada que presenta esta parásito con otros artrópodos como la Blatella germanica y el Chironomus spp. larvae mediante estudios de inhibición de CAP e inhibición de inmunotransferencia55. También estaría relacionada con los ácaros, en mayor medida Acarus siro y Tyrophagus putrescientae, la cucaracha y la gamba56,57.
En diversos estudios, basados en técnicas de ELISA y de inmunotransferencia, se ha considerado al antígeno somático como responsable de la existencia de reactividad cruzada entre el AS y otros nematodos, como el Ascaris suum, Toxocara canis, Hysterothylacium aduncum, Trichinella spiralis y Trichuris muris58,59. También están presentes en otros nematodos las enzimas con grupo biotina contenidas en los extractos del antígeno somático del AS60.
Los carbohidratos del extracto de AS utilizado para el diagnóstico pueden ser los responsables de los falsos positivos de las pruebas diagnósticas. La reactividad cruzada existente entre el antígeno de cuerpo entero del AS con otros alergenos, hace que sea necesaria la utilización de otros antígenos para la realización de las pruebas cutáneas y la determinación de IgE específica, con el objetivo de disminuir la elevada tasa de falsos positivos. El tratamiento previo con periodato (sustancia que destruye las estructuras carbohidratadas) hace desaparecer una banda de peso molecular medio reconocida en inmunotransferencia por sujetos asintomáticos61. Otros autores, usando anticuerpos monoclonales han obtenido los mismos resultados. Al eliminar los epítopos o-glicanos del anticuerpo monoclonal UA3, anticuerpo que reconoce dos proteínas de peso molecular de 139 y 154 kDa del Anisakis simplex, el problema de la reactividad cruzada desaparece en gran medida62.
Moneo et al han aislado el alergeno mayor de AS, dándole el nombre de Ani s 1. Esta proteína no es reconocida por el suero de los pacientes asintomáticos con prueba cutánea e IgE específica positivas frente al antígeno de cuerpo entero de AS63. Mediante estudios inmunohistoquímicos se ha demostrado que esta proteína sólo se encuentra en la glándula excretora del parásito.
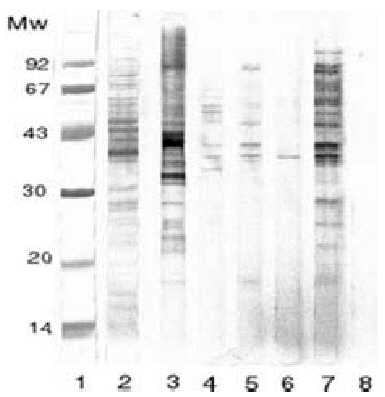
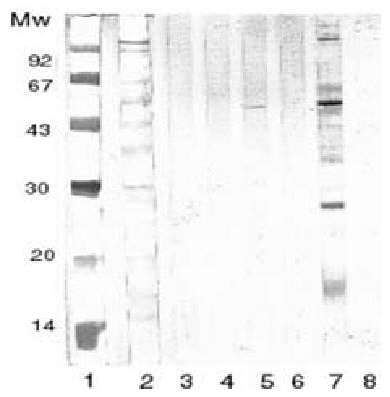
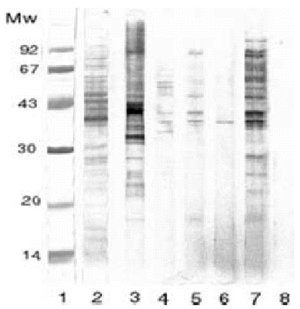
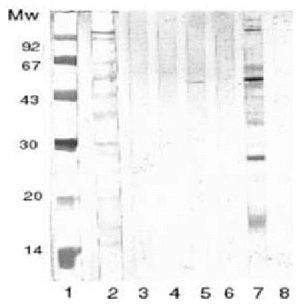
Pascual et al han realizado un estudio comparando la utilidad diagnóstica del alergeno de cuerpo entero del AS frente al alergeno secretorexcretor. Se realizó SDS-PAGE de los dos antígenos (figs. 3 y 4) en cinco grupos de sueros: a) sueros de alérgicos a pescado y marisco; b) alérgicos a pescado; c) urticaria y angioedema; d) asma con IgE elevada, y e) anisakiosis gastroalérgica diagnosticada mediante endoscopia. Todos ellos presentaban prueba cutánea e IgE específica positivas para el alergeno de cuerpo entero de AS. El grupo control estaba compuesto por una mezcla de sueros de niños atópicos menores de un año de edad con IgE normal. Los cinco grupos citados reconocían mediante inmunotransferencia varias bandas proteicas alrededor de 40 kDa. Además, los grupos A, C y E también reconocían bandas de 20 kDa al enfrentarlas al antígeno de cuerpo entero. Sin embargo, frente al antígeno secretor-excretor, sólo los pacientes diagnosticados de anisakiosis gastroalérgica reconocieron bandas proteicas (figs. 3 y 4)64.
Figura 3.--La banda 1 y 2 corresponden al SDS-PAGE realizado sobre el antígeno de cuerpo entero del As, estando la banda 2 teñida con Amido-black. La banda 3, 4, 5, 6, y 7 corresponden al inmunoblot realizado con sueros de pacientes alérgicos a pescados y mariscos, pacientes alérgicos a pescados, pacientes con urticaria-angioedema, pacientes asmáticos con Ig E elevada y pacientes con anisakiosis gastroalérgica diagnosticada por endoscopia, respectivamente. La banda 8 representa al grupo control.
Figura 4.--La banda 1 y 2 corresponden al SDS-PAGE realizado sobre el antigeno secretor-excretor del As, estando la banda 2 teñida con Amido-black. La banda 3, 4, 5, 6, y 7 corresponden al inmunoblot realizado con sueros de pacientes alérgicos a pescados y mariscos, pacientes alérgicos a pescados, pacientes con urticaria-angioedema, pacientes asmáticos con Ig E elevada y pacientes con anisakiosis gastroalérgica diagnosticada por endoscopia, respectivamente. La banda 8 representa al grupo control.
Estos datos indican la idoneidad del antígeno secretor-excretor para su utilización en el diagnóstico de la alergia a AS, aumentándose la especificidad de la técnica diagnóstica.
La determinación seriada de IgE total y de IgE específica frente a AS puede ser útil en el diagnóstico de la parasitación aguda. Daschner et al determinaron ambos parámetros a las 24 h y un mes después de la reacción, objetivando un incremento de la IgE total en un 85,36 % (35/41) de pacientes y de la IgE específica en el 90,24 % (37/41). En el 89 % de los pacientes con gastroscopia positiva se produjo un aumento de IgE total y específica (p = 0,02), siendo éste mayor que el de los pacientes de gastroscopia sin parásito65.
PREVENCION
Los extractos de AS sometidos al calor ven reducida su alergenicidad, pero incluso tratados a 100 °C son capaces de mostrar cierta capacidad para unir IgE. Son los alergenos de peso molecular bajo los que mejor resisten las altas temperaturas66. Al someter al pescado a congelación se consigue la muerte de la larva de AS. Basándose en estas premisas, varios los autores han realizado pruebas de provocación con pescado congelado en pacientes alérgicos a AS, obteniendo una buena tolerancia, sin la aparición de síntomas tras su ingesta67-69.
Sin embargo, otros autores refieren que hasta un 10 % de los pacientes desarrollan síntomas tras la ingesta de pescado congelado. Baeza et al estudian la evolución durante 10 meses en 58 pacientes con alergia a AS, divididos en tres grupos: uno con dieta totalmente exenta de pescado, otro tomando únicamente pescado congelado y un tercer grupo con ingesta libre de pescado fresco. Desarrollaron síntomas de urticaria el 16 y el 5 % de los pacientes que estaban realizando la dieta con pescado fresco y con pescado congelado, respectivamente, aunque en el grupo de pacientes con dieta estricta de pescado congelado la diferencia no fue estadísticamente significativa, en relación al grupo con dieta exenta de pescado. Los niveles de IgE total, durante ese periodo, no variaron en el grupo que consumía pescado fresco, disminuyendo en un 57 y un 45 % en los pacientes cuya dieta incluía pescado congelado y dieta exenta en pescado, respectivamente15.
El tipo de dieta que debe realizar el paciente alérgico a AS es un aspecto muy importante, ya que la dieta exenta en pescado puede ser problemática en aquellos pacientes que presenten otras patologías asociadas, especialmente aquellos con dislipemias.
Las recomendaciones dietéticas se podrían resumir en los siguientes puntos:
1. Evitar la ingesta de pescado crudo o poco cocinado.
2. Someter el pescado a congelación 20 °C un mínimo de 48 h.
3. Se recomienda el pescado congelado en alta mar o ultracongelado, donde se eviscera precozmente y la posibilidad de parasitación del músculo es menor.
La legislación aplicable a los productos de la pesca es variable.
Las autoridades sanitarias holandesas impusieron la congelación previa de los productos de la pesca destinados al consumo humano sin tratamiento térmico previo, obteniendo una disminución radical en el número de casos al año70.
Esta norma es vigente en la actualidad en el resto de la CEE, aunque en muchos casos no se aplica71.
En España, antes de su despacho al consumo humano, los pescados y productos de pescado deberán ser sometidos a un control visual para detectar y retirar los parásitos visibles, no debiendo ser puestos en el mercado los que estén parasitados71,72.
ANISAKIOSIS EN LA INFANCIA
Como se apuntaba con anterioridad, la edad es un factor de riesgo para la sensibilización a AS. Pocos son los estudios sobre la implicación del AS en los primeros años de vida.
Bernardini et al realizan un estudio entre la población infantil remitida a una consulta de alergia hospitalaria, encontrando una sensibilización del 6,1 %. La existencia de una prueba cutánea positiva no parece ser un indicador de sintomatología tras la ingesta de pescado parasitado. Después de ajustar para otras variantes, encuentran que la sensibilización a AS se asocia significativamente a pruebas cutáneas positivas frente A. Tennis, soja, marisco y ácaros73.
En otro estudio, en el que se encuentra una prevalencia del 11 %74, se concluye que la sensibilización a AS en niños es generalmente asintomática, aunque hay una elevada asociación con episodios de urticaria aguda en aquellos que tienen prueba cutánea positiva frente al parásito. Los resultados de este estudio indican la posibilidad de reactividad cruzada con otros nematodos como el Ascaris lumbricoides, ya que en siete de los pacientes con prueba cutánea positiva frente a AS se encontró IgE específica frente a ese parásito.
En un estudio sobre la prevalencia de sensibilización a alergenos nematodos en pacientes pediátricos se detectaron cifras sorprendentemente elevadas. Cuarenta y uno de los 73 (56 %) pacientes estudiados presentaban IgE específica frente a AS y un 65 % frente a A. Lumbricoides. Las tasas más altas de sensibilización a AS ocurrieron en pacientes con hipersensibilidad inmediata a crustáceos, pudiendo deberse a su contenido en tropomiosina10,75.
CONCLUSIONES
La patología producida por AS afecta a gran parte de la población mundial, debido a su amplia distribución geográfica y a que se refiere a un alimento de primer orden como es el pescado.
En la infancia la prevalencia de Anisakiosis es menor, debiéndose posiblemente a que la ingesta de pescado crudo en niños es muy poco frecuente.
Los cuadros clínicos que produce muestran un gran abanico de síntomas que pueden ser leves o llevar al paciente a una situación de extremada gravedad.
El antígeno secretor-excretor se ha demostrado como el mejor antígeno para el diagnóstico, ya que no presenta reactividad cruzada con otros alergenos.
A pesar de los diferentes criterios que siguen existiendo entre los distintos grupos dedicados a estudiar esta patología, la congelación del pescado parece ser la mejor alternativa para prevenir la aparición de los síntomas.
Finalmente, es imprescindible destacar la importancia de poner en marcha las medidas necesarias para el cumplimiento de la legislación ya existente sobre el consumo de pescado crudo.